Что такое репликация и репарация днк
Что такое репликация и репарация днк
Репликация митохондриальной и ядерной ДНК происходит в разные фазы клеточного цикла. Несмотря на то что общая последовательность стадий при репликации ядерной ДНК у высших существ (эукариот) и у бактерий (прокариот) одинакова, сам процесс имеет незначительные отличия. Так, у эукариот во время репликации ДНК (ядерная) остаётся в нуклеосомной конфигурации.
Фрагменты ДНК, богатые парами оснований Г—Ц (R-полосы эухроматина в уплотнённом хроматине), экспрессируют гены «домашнего хозяйства», которые функционируют во всех клетках организма. Данные фрагменты реплицируются на ранней стадии S-фазы. Участки гетерохроматина, богатые парами оснований А—Т (G-полосы), экспрессируют небольшое количество генов и реплицируются на поздней стадии S-фазы.
Гены с большим содержанием пар А—Т, кодирующие различные свойства и функционирующие лишь в определённых клетках, входят в состав факультативного гетерохроматина. Их репликация происходит на ранней стадии S-фазы только в тех клетках, в которых они экспрессируются, и на поздних стадиях — в клетках, где экспрессии не происходит.
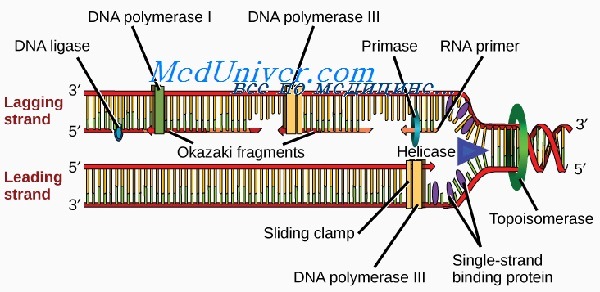
Область спирали ДНК, которая в начале репликации раскручивается в первую очередь, называют участком начала репликации (репликоном). В этом месте двойную нить расплетает фермент хеликаза, раскрывающий последовательность оснований. Процесс репликации происходит вдоль одной цепи со скоростью примерно 40-50 нуклеотидов в секунду одновременно в обоих направлениях. У высших существ имеется множество репликонов, расположенных на расстоянии 50 000—300 000 п.н. В месте разделения нити ДНК возникают репликационные вздутия, на каждом конце которого формируется репликационная вилка.
Новая ДНК синтезируется при участии ферментов, называемых ДНК-полимеразами, из дезоксирибонуклеотидтрифосфатов (АТФ, ГТФ и др.), которые превращаются в монофосфатные нуклеотиды (АМФ, ГМФ и др.). Отщепление и гидролиз пирофосфатов из трифосфатов обеспечивают процесс энергией и обусловливают его полную необратимость, делая молекулу ДНК достаточно устойчивой.
Все ДНК-полимеразы могут выстраивать новую ДНК только в направлении от 5′- к 3′-концу. Это означает, что ферменты должны двигаться вдоль матричной цепи от 3′- к 5′-концу. В связи с этим репликация может непрерывно происходить от репликона только по одной цепи, называемой опережающей. Из-за расположения Сахаров репликация по второй, отстающей цепи происходит только на коротких отрезках, известных как фрагменты Оказаки.
Длина новых фрагментов ДНК, образующихся вдоль отстающей цепи, в среднем составляет 100—200 пар нуклеотидов. Во время синтеза фрагменты Оказаки сшивает между собой фермент ДНК-лигаза. В ожидании репликации стабильность первичной одноцепочечной нуклеотидной последовательности отстающей цепи поддерживается белком, связывающим одноцепочечную ДНК (или спиральдестабилизирующим белком).
Для синтеза опережающей цепи необходим фермент ДНК-полимераза S, а для синтеза отстающей — ДНК-полимераза а. Последняя имеет субъединицу, называемую ДНКпраймазой, которая синтезирует короткую РНК-затравку, играющую роль праймера. Репликация мито-хондриальной ДНК происходит независимо от процессов в ядре. При этом используется ряд других ферментов, один из которых — ДНК-полимераза у.
В геноме присутствует большое количество копий пяти гистонных генов, благодаря чему происходит синтез множества гистонов (особенно во время S-фазы), которые сразу после репликации связываются с новой цепью ДНК.
Следует отметить, что процесс репликации носит название полуконсервативного, так как в состав дочерних молекул ДНК входит одна первичная цепь и одна синтезированная.
Репликация теломер ДНК
Основной проблемой синтеза ДНК на конце отстающей цепи служит то, что ДНК-полимеразе а необходимо прикрепиться выше конца последовательности, которая реплицирована, и работать проксимально в направлении от 5′- к 3′-концу. Для решения этой проблемы нужен ДНК-синтетический фермент теломераза, который продлевает отстающую цепь.
Теломераза — рибонуклеопротеин, содержащий матричную РНК с последовательностью 3′-ААУЦЦЦААУ-5′, которая комплементарна полутора повторам шестиосновной теломерной ДНК (5′-ГГГТТА-3′). Фрагмент последовательности 3′-ААУ РНК-теломеразы связывается с терминальным концом ТТА-5′ матричной отстающей цепи, при этом остальная часть РНК остаётся свободной. Затем к этой матричной РНК присоединяются дезоксирибонуклеотиды, тем самым продлевая повторяющуюся последовательность в ДНК на один сегмент.
После этого теломераза отщепляется и направляется к другому терминальному концу с последовательностью ТТА-5′, и процесс повторяется. Как только возникает достаточно длинный терминальный повтор, ДНК-полимераза а прикрепляется к полученному одноцепочечному фрагменту и достраивает вторую цепь по методу комплементарности в проксимальном 5’—3′-направлении, двигаясь к уже существующему двухцепочечному участку, последующее слияние с которым происходит благодаря действию ДНК-лигазы.
Репаративные механизмы ДНК
Иногда в растущую цепь случайно вклинивается неправильное основание, однако, к счастью, у здоровых клеток присутствуют пострепликационные репаративные ферменты и система коррекции ошибочного спаривания оснований, которые исправляют подобные ошибки. В основе механизма действия данных систем лежат удаление и замена ошибочно вставленных оснований в соответствии с последовательностью матричной цепи. Для их функционирования необходимы ДНК-полимеразы b и е.
Значение ДНК для медицины. Патология пострепликационных механизмов репарации иногда обусловливает предрасположенность пациентов к некоторым онкологическим заболеваниям. К ним относят синдром множественной ломкости хромосом (синдром Блума), наследственную предрасположенность к раку молочной железы, вызванную мутациями генов BRCA1 и BRCA2, и аутосомно-доминантную форму рака кишечника (наследственный неполипозный рак толстой кишки).
Существует теория, утверждающая, что после каждого клеточного цикла теломеры укорачиваются на один повтор, а следовательно, количество делений клетки ограничено числом повторов в теломерной цепи. Согласно этому бесконечный рост и деление опухолевых клеток происходят из-за присутствия активных мутантных теломераз, которые препятствуют разрушению теломер.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в содержание раздела «генетика» на нашем сайте
РЕПАРАЦИОННЫЕ МЕХАНИЗМЫ ДНК
Цель: понять, как нарушается целостность генетического материала клетки и какие существуют восстановительные механизмы ДНК и как они работают.
1. Изучить, что такое репарация.
2. Разобрать, как происходит повреждение ДНК и по каким причинам
3. Выяснить, как работают репарационные механизмы ДНК
3. «Световое восстановление»………………………………………. …. 5
4. «Темновое восстановление»………………………………………. …….6
6. Классификация репарации………………………………………………..8
8. Интересные факты о репарации………………………………….………11
Репарация (от лат. reparatio — восстановление) — особая функция клеток, заключающаяся в способности исправлять химические повреждения и разрывы в молекулах ДНК, повреждённых при нормальном биосинтезе ДНК в клетке или в результате воздействия физических или химических реагентов. Осуществляется специальными ферментными системами клетки. Ряд наследственных болезней (напр., пигментная ксеродерма) связан с нарушениями систем репарации. В окружающем мире существует множество факторов, способных вызвать необратимые изменения в живом организме. Чтобы сохранить свою целостность, избежать патологических и несовместимых с жизнью мутаций, должна существовать система самостоятельного восстановления.
Молекула дезоксирибонуклеиновой кислоты может быть разорвана как в ходе биосинтеза, так и под влиянием вредных веществ.
Источники повреждения ДНК:
— Ошибки репликации ДНК
— Апуринизация — отщепление азотистых оснований от сахарофосфатного остова
— Дезаминирование — отщепление аминогруппы от азотистого основания
К негативным факторам, в частности, относят температуру или физические силы различного происхождения. Если разрушение произошло, клетка запускает процесс репарации. Так начинается восстановление исходной структуры молекулы ДНК. За репарацию отвечают особые ферментные комплексы, присутствующие внутри клеток. С невозможностью отдельных клеток осуществлять восстановление связаны некоторые заболевания.
Впоследствии исследования Кельнера получили свое логическое продолжение в работах американских биологов Сетлоу, Руперта и некоторых других. Благодаря труду этой группы ученых было достоверно установлено, что фотореактивация является процессом, который запускается благодаря особому веществу – ферменту, катализирующему расщепление димеров тимина. Именно они, как выяснилось, образовывались в ходе экспериментов под воздействием ультрафиолета. При этом яркий видимый свет запускал действие фермента, который способствовал расщеплению димеров и восстановлению первоначального состояния поврежденных тканей. В данном случае речь идет о световой разновидности восстановления ДНК. Определим это более четко. Можно сказать, что световая репарация – это восстановление под воздействием света первоначальной структуры ДНК после повреждений. Однако данный процесс не является единственным, способствующим устранению повреждений.
Спустя некоторое время после открытия световой была обнаружена темновая репарация. Это явление происходит без какого-либо воздействия световых лучей видимого спектра. Данная способность к восстановлению обнаружилась во время исследования чувствительности некоторых бактерий к ультрафиолетовым лучам и ионизирующему излучению. Темновая репарация ДНК – это способность клеток убирать любые патогенные изменения дезоксирибонуклеиновой кислоты. Но следует сказать, что это уже не фотохимический процесс, в отличие от светового восстановления.
Механизм «темнового» устранения повреждений Наблюдения за бактериями показали, что спустя некоторое время после того, как одноклеточный организм получил порцию ультрафиолета, вследствие чего некоторые участки ДНК оказались поврежденными, клетка регулирует свои внутренние процессы определенным образом. В результате измененный кусочек ДНК просто отрезается от общей цепочки. Получившиеся же промежутки заново заполняются необходимым материалом из аминокислот. Иными словами, осуществляется ресинтез участков ДНК. Открытие учеными такого явления, как темновая репарация тканей, – это еще один шаг в изучении удивительных защитных способностей организма животного и человека.
На данный момент ученые выделяют следующие разновидности систем репарации. Они активируются в зависимости от разных факторов. К ним относятся: реактивация, рекомбинационное восстановление, репарация гетеродуплексов, эксцизионная репарация, воссоединение негомологичных концов молекул ДНК. Все одноклеточные организмы обладают как минимум тремя ферментными системами. Каждая из них обладает способностью осуществлять процесс восстановления. К этим системам относят: прямую, эксцизионную и пострепликативную. Этими тремя видами восстановления ДНК обладают прокариоты. Что касается эукариот, то в их распоряжении находятся дополнительные механизмы, которые называются Miss-mathe и Sos-репарация. Биология подробно изучила все эти виды самовосстановления генетического материала клеток.
1. Прямая репарация — наиболее простой путь устранения повреждений в ДНК, в котором обычно задействованы специфические ферменты, способные быстро (как правило, в одну стадию) устранять соответствующее повреждение, восстанавливая исходную структуру нуклеотидов. Так действует, например, O6-метилгуанин-ДНК-метилтрансфераза, которая снимает метильную группу с азотистого основания на один из собственных остатков цистеина.
3. Пострепликативная репарация Tип репарации, имеющей место в тех случаях, когда процесс эксцизионной репарации недостаточен для полного исправления повреждения: после репликации с образованием ДНК, содержащей поврежденные участки, образуются одноцепочечные бреши, заполняемые в процессе гомологичной рекомбинации при помощи белка. Пострепликативная репарация была открыта в клетках E.Coli, не способных выщеплять тиминовые димеры. Это единственный тип репарации, не имеющий этапа узнавания повреждения.
Интересные факты о репарации
1. Полагают, что от 80 % до 90 % всех раковых заболеваний связаны с отсутствием репарации ДНК[4].
2. Повреждение ДНК под воздействием факторов окружающей среды, а также нормальных метаболических процессов, происходящих в клетке, происходит с частотой от нескольких сотен до 1000 случаев в каждой клетке, каждый час.
3. По сути ошибки в репарации происходят так же часто как и в репликации, а при некоторых условиях даже чаще.
4. В половых клетках сложная репарация, связанная с гомологичной рекомбинацией не происходит из-за гаплоидности генома этих клеток.
Репарация – это обязательное условие нормального функционирования организма. Подвергаясь ежедневно и ежечасно угрозам повреждений и мутаций ДНК, многоклеточная структура приспосабливается и выживает. Это происходит в том числе и за счет налаженной системы репарации. Отсутствие нормальной восстановительной способности вызывает болезни, мутации и другие отклонения. К ним относятся различные патологии развития, онкология и даже само старение. Наследственные болезни вследствие нарушений репарации могут приводить к тяжелым злокачественным опухолям и другим аномалиям организма. Сейчас определены некоторые заболевания, вызываемые именно сбоями систем репарации ДНК. Это такие, например, патологии, как синдром Кокейна, ксеродерма, неполипозный рак толстой кишки, трихотиодистрофия и некоторые раковые опухоли.
1. Кирпичев А.С., Севастьянова Г.А. Молекулярная биология М. AKADEMA. 2005г.
2. С.Коничев, Г.А.Севастьянова Молекулярная биология. — Москва: Академия, 2003г.
3. С.Г. Инге-Вечтомов. Генетика с основами селекции. — Москва: Высшая школа, 1989г.
4. Кирилл Стасевич Как клетка чинит свою ДНК. Наука и жизнь. — 2015г.
Материалы конгрессов и конференций
IX РОССИЙСКИЙ ОНКОЛОГИЧЕСКИЙ КОНГРЕСС
РЕПАРАЦИЯ ДНК И ЕЕ РОЛЬ В КАНЦЕРОГЕНЕЗЕ
Н.В. Томилин
Институт цитологии РАН, Санкт-Петербург
Много лет назад Джеймс Кливер и Дирк Бутсма показали, что фибробласты больных пигментной ксеродермой (ПК) имеют дефект по эксцизионной репарации (ЭР) ДНК после УФ облучения. Поскольку у большинства больных ПК образуется рак кожи, эти данные указывали, что у нормальных людей, редко болеющих раком кожи, репарация ДНК является важным фактором подавления канцерогенеза. По определению, репарация уменьшает число повреждений в ДНК, в том числе и вступающих в репликацию, тем самым, снижая вероятность образования мутаций и хромосомных перестроек, а, следовательно, инициацию рака и прогрессию опухолей. Эта простая концепция была впоследствии подтверждена на некоторых других моделях и стала весьма популярной, однако соотношения между репарацией ДНК и канцерогенезом оказались значительно более сложными, чем это представлялось ранее. Выяснилось, в частности, что до самой репарации работают сложные сигнальные каскады идентификации повреждений в геноме и выбора между репарацией и апоптозом, а также выбора адекватной системы репарации для данного типа повреждений. В последние годы значительный прогресс достигнут в понимании механизмов так называемой пострепликативной репарации или механизмов обхода повреждений ДНК во время и после репликации без их элиминации из генома, а также механизмов эпигеномных модификаций хроматина. Данный доклад будет посвящен краткому описанию известных к настоящему времени систем репарации ДНК в клетках высших эукариот и их роли в поддержании стабильности генома, обеспечивающей в нормальных клетках низкие темпы канцерогенеза.
Основной функцией ДНК, как известно, является сохранение наследственной информации путем полуконсервативной репликации. Матричный синтез, происходящий при репликации и транскрипции, следует правилам комплементарности азотистых оснований (А-Т и Г-Ц), основанным на их особой химической структуре, позволяющей ферментам этих синтезов, ДНК- и РНК-полимеразам, точно копировать последовательность нуклеотидов. Большинство этих ферментов строго различают нормальные звенья в матричных молекулах, поэтому, как правило, химические модификации нуклеотидов в ДНК приводят к блоку нормальной транскрипции и репликации, то есть являются некодирующими повреждениями. К таковым относятся внутритяжевые сшивки пиримидиновых нуклеотидов (циклобутановые димеры и 6-4 фотопродукты), образующиеся после УФ облучения, межтяжевые сшивки по пуриновым нуклеотидам, разнообразные ковалентные аддукты оснований, образуемые некоторыми химическими канцерогенами, тиминовые гликоли, апуриновые и апиримидиновые сайты и т.п. В редких случаях химические модификации нуклеотидов сохраняют способность к комплементарному спариванию во время репликации и транскрипции, однако это спаривание происходит неоднозначно. Например, окисленный гуанин, 8-оксогуанин (8-oxoG), спаривается не только с цитозином, но и с аденином, приводя к заменам в дочерних нитях ДНК при репликации. Можно отметить, что спонтанное окисление гуанина – это довольно частое событие, поскольку реакционно-способные соединения кислорода постоянно производятся митохондриями. И, наконец, к повреждениям можно отнести некоторые типы разрывов нитей ДНК, особенно при действии ионизирующих излучений, которые сопровождаются химическими модификациями оснований на концах.
Наиболее изученной системой репарации является эксцизионная репарация нуклеотидов (ЭРН), частично дефектная у большинства больных пигментной ксеродермой. При ЭРН модифицированные нуклеотиды (например, пиримидиновые димеры) удаляются из поврежденной нити благодаря действию нуклеаз XPG и ERCC1/XPF, а образующийся при этом однотяжевый пробел заполняется ДНК-полимеразами d или e с помощью PCNA и зашивается ДНК-лигазой. В ЭРН работают также геликазы XPD и XPB, входящие в состав комплекса TFIIH, и комплекс XPA/RPA, стабилизирующий расплетенный участок и, по-видимому, определяющий, в какой нити будут сделаны разрезы. Узнавание димеров в неактивной ДНК (так называемая глобальная репарация) обеспечивают комплексы XPC/HR23B и DDB2/DDB1, экспрессия которых контролируется хорошо известным опухолевым супрессором и транскрипционным фактором р53. Транскрипция гена DDB2 является индуцибельной, однако ген XPC экспрессируется постоянно.
При ЭРН повреждения ДНК могут распознаваться и без участия комплексов XPC/HR23B и DDB2/DDB1 при так называемой транскрипционной репарации, когда транскрипционный комплекс, содержащий РНК полимеразу II, блокируется на некодирующем повреждении, а репарация запускается белками CSA и CSB, дефектными при синдроме Кокейна. В отличие от больных с пигментной ксеродермой, у больных с синдромом Кокейна (рано стареющие кахектичные карлики) не наблюдается повышения частоты рака кожи, хотя фибробласты УФ-чувствительны. В одной из гипотез предполагается, что в клетках больных с синдромом Кокейна блок транскрипции быстро индуцирует апоптоз, поэтому раковые клоны образоваться не успевают.
Очень важной для клетки (и для канцерогенеза) является ее способность воссоединять случайные двойные разрывы (ДР) ДНК, что осуществляется двумя различными репарационными механизмами – негомогическим воссоединением концов (НГВК) ДНК и путем гомологической рекомбинации (ГР) при наличии по соседству второй копии неповрежденного идентичного по нуклеотидной последовательности сегмента ДНК, например сестринской хроматиды. Поскольку в диплоидных ядрах гомологичные хромосомы пространственно разделены (хромосомные территории), репарация путем ГР преимущественно происходит в S- и G2 фазах клеточного цикла, а НГВК осуществляется во время любой фазы цикла. В геномах высших эукариот имеется много повторов, по которым, в принципе, возможна репарация путем ГР, однако такая репарация ДР приводит к хромосомным транслокациям, и она практически полностью подавлена. Главным механизмом подавления потенциально кластогенной ГР между повторами и вообще неправильных (эктопических) воссоединений концов ДНК при репарации ДР является, по-видимому, локальная специфическая модификация хроматина по гистону Н2АХ – фосфорилирование лизина-139 (или образование γ-H2AX). Эта модификация, происходящая в мегабазных доменах хроматина рядом с ДР, способствует удержанию долгоживущих концов ДНК благодаря привлечению в эти домены специального белка когезинa (SMC1), а также белка hRad50, который может одномоментно связываться с двумя концами ДНК.
В клетках человека репарация путем НГВК непосредственно осуществляется продуктами генов DNA-PK, Ku70/80, XRCC4, LIG4, Artemis, hRAD50, hMRE11 и NBS1, а репарация путем ГР происходит с помощью белков RAD51 (paralogs XRCC2, XRCC3), RAD52, RAD54, BRCA1, BRCA2 (FANCD1), FANCD2, а также комплексов XPF/ERCC1 и hRAD50/hMRE11/NBS1. Узнавание случайных ДР осуществляется либо самим комплексом hRAD50/hMRE11/NBS1, который быстро связывается с концами ДНК, либо протеинкиназой АТМ (дефективной при наследственном синдроме атаксия-телеангиэктазия), которая выявляет какие-то не идентифицированные локальные изменения хроматина, вызванные ДР, и при этом активируется. АТМ-киназа быстро фосфорилирует гистон Н2АХ, белки NBS1, FANCD2 и Artemis, а также киназу Chk2 (RAD53), останавливающую клеточный цикл. Фосфорилирование белка Artemis необходимо для репарации примерно 10% случайных ДР. Образование γ-H2AX возможно и за счет активности других киназ (ATR и DNA-PK), но киназа ATR включается только при блоке репликации ДНК, когда в вилках репликации образуются достаточно протяженные однотяжевые бреши, связывающие белок RPA. Заметим, что репарация путем НГВК является неточной, и при ней всегда образуются микроделеции, тогда как ГР точно восстанавливает исходную последовательность нуклеотидов.
Важной для канцерогенеза является пострепликативная репарация (ПРР) или обход повреждений (lesion bypass or DNA damage tolerance) во время или после репликации. Этот путь был открыт у бактерий почти 40 лет назад, когда было показано, что напротив не вырезанных пиримидиновых димеров во время репликации образуются однотяжевые пробелы в дочерних нитях, которые затем устраняются гомологической рекомбинацией между сестринскими дуплексами ДНК, контролируемой белком RecA. ПРР рассматривается как главный источник индуцируемых мутаций.
Главным событием при TLS является замена блокированной репликативной ДНК полимеразы (ДПδ или ДПε) на другую ДНК полимеразу, способную вставлять нормальные нуклеотиды напротив поврежденных звеньев. В клетках человека такой TLS-полимеразой является продукт гена, дефектного при вариантной пигментной ксеродерме, ДНК полимераза η (ДПη) (у дрожжей ген RAD30), которая связывается с репликативным белком PCNA (POL30), причем связывание усиливается при моно-убихитинилировании PCNA также по лизину-164. Эта модификация зависит от белка RAD18 и происходит при торможении репликации, однако остается неясным, каким образом при этом активируется RAD18. По нашим данным, при торможении репликации hRAD18, как и ДПη, накапливается в заблокированных вилках (фокусах репликации) и при этом перестает экстрагироваться из ядра буфером, содержащим Тритон-Х100. Эти изменения подавляются ингибиторами протеинкиназ стауроспорином и вортманнином, то есть могут быть связаны с фосфорилированием либо самого RAD18, либо какого-то взаимодействующего с ним белка. Есть основания предполагать, что это фосфорилирование осуществляется каскадом ATR/Chk1 в ответ на накопление однотяжевой ДНК в вилках репликации.
В дрожжах параллельно с моно-убихитинилированием PCNA происходит его поли-убихитинилирование по тому же лизину-164, зависисимое от продуктов генов RAD5, MMS2 и UBC13, которое направляет репарацию по второму механизму (смена матрицы, TMS). В клетках человека ПРР по механизму смены матрицы зависит от гомолога дрожжевого гена MMS2, однако поли-убихитинилирования PCNA пока не обнаружено. Необходимо отметить, что ПРР путем смены матрицы (TMS) является точной, а при смене полимеразы (TLS) специальные ДНК-полимеразы могут делать ошибки. Эти ошибки и являются, по-видимому, основным источником индуцированных точковых мутаций в геноме человека. Необходимо, однако, иметь ввиду, что только 5% генома кодирует белки и требует точного воспроизведения во время репликации, поэтому мутации в 95% генома (в некодирующей ДНК), особенно в дифференцированных соматических клетках, редко приводят к заметным фенотипическим эффектам. Что касается половых и стволовых клеток, то в них повреждения ДНК должны легче индуцировать апоптоз, а не репарацию.