Что такое ресинтез атф
Основные закономерности метаболических процессов в организме человека. Часть 2.
Рассматривая обмен веществ в условиях нормального функционирования организма, следует остановиться на безусловно взаимосвязанных, но в то же время достаточно специфичных составляющих метаболизма, а именно на углеводном, белковом, липидном и водно-электролитном обмене.
Очевидно, что основная роль углеводов в метаболизме определяется их энергетической функцией. Именно глюкоза крови вследствие наличия простого и быстрого пути гликолитической диссимиляции и последующего окисления в цикле трикарбоновых кислот, а также возможности максимально быстрого извлечения ее из депо гликогена, обеспечивающей экстренную мобилизацию энергетических ресурсов, является наиболее востребованным источником энергии в организме. Использование циркулирующей в плазме глюкозы разными органами неодинаково: мозг задерживает 12% глюкозы, кишечник— 9%, мышцы — 7%, почки — 5%. При этом уровень глюкозы плазмы крови является одной из важнейших гомеостатических констант организма, составляя 3, 3—5, 5 ммоль/л. Как известно снижение уровня глюкозы ниже допустимого передела имеет своим незамедлительным следствием дискоординацию деятельности ЦНС, проявляющуюся соответствующей клинической симптоматикой: головной мозг содержит небольшие резервы углеводов и нуждается в постоянном поступлении глюкозы, поскольку энергетические расходы мозга покрываются исключительно за счет углеводов. Глюкоза в тканях мозга преимущественно окисляется, а небольшая часть ее превращается в молочную кислоту.
При полном отсутствии углеводов в пище они образуются в организме из продуктов трансформации жиров и белков. В печени возможно новообразование углеводов как из собственных продуктов их распада (пировиноградной или молочной кислоты), так и из продуктов диссимиляции жиров и белков (кетокислот и аминокислот), что обозначается как глюконеогенез. В результате трансформации аминокислот образуется пировиноградная кислота, при окислении жирных кислот — ацетилкоэнзим А, который может превращаться в пировиноградную кислоту — предшественник глюкозы. Это наиболее важный общий путь биосинтеза углеводов. Между двумя основными источниками энергии — углеводами и жирами — существует тесная физиологическая взаимосвязь. Повышение содержания глюкозы в крови увеличивает биосинтез триглицеридов и уменьшает распад жиров в жировой ткани. Поступление в кровь свободных жирных кислот уменьшается. В случае возникновения гипогликемии процесс синтеза триглицеридов тормозится, ускоряется распад жиров и в кровь в большом количестве поступают свободные жирные кислоты. Гликогенез, гликогенолиз и глюконеогенез являются тесно взаимосвязанными процессами, обеспечивающими оптимальный уровень глюкозы крови сообразно степени функционального напряжения организма.
Центральным звеном регуляции углеводного и других видов обмена и местом формирования сигналов, управляющих уровнем глюкозы, является гипоталамус. Отсюда регулирующие влияния реализуются вегетативными нервами и гуморальным путем, включающим эндокринные железы. Единственным гормоном, снижающим уровень гликемии, является инсулин — гормон, вырабатываемый β-клетками островков Ланхгерганса. Снижение гликемии происходит за счет усиления инсулином синтеза гликогена в печени и мышцах и повышения потребления глюкозы тканями организма. Увеличение уровня глюкозы в крови возникает при действии нескольких гормонов. Это глюкагон, продуцируемый α-клетками островков Ланхгерганса, адреналин — гормон мозгового слоя надпочечников, глюкокортикоиды — гормоны коркового слоя надпочечников, соматотропный гормон гипофиза, тироксин и трийодтиронин — гормоны щитовидной железы. Данные гормоны в связи с однонаправленностью их влияния на углеводный обмен и функциональным антагонизмом по отношению к эффектам инсулина часто объединяют понятием «контринсулярные гормоны».
Таким образом биологическая роль углеводов для организма человека определяется прежде всего их энергетической функцией. Обладая энергетической ценностью в 16, 7 кДж (4, 0 ккал) на 1 грамм вещества, углеводы являются основным источником энергии для всех клеток организма, при этом выполняя еще пластическую и опорную функции. Суточная потребность взрослого человека в углеводах составляет около 500 г.
— пластическая (структурная) функция заключается в том, что белки являются главной составной частью всех клеточных и межклеточных структур тканей;
— ферментная (каталитическая, энзимная) функция состоит в обеспечении всех химических реакций, протекающих в ходе обмена веществ в организме (дыхание, пищеварение, выделение), деятельностью ферментов, являющихся по своей структуре белками;
— транспортная функция белков заключается в их способности к соединению с целым рядом метаболитов и переносе последних в связанном состоянии в межтканевой жидкости и плазме крови к области их утилизации;
— защитная функция белков проявляется реализацией иммунного ответа образованием иммуноглобулинов (антител) и системы комплемента при поступлении в организм чужеродного белка, а также способностью к непосредственному связыванию экзогенных токсинов; белки системы гемостаза обеспечивают свертывание крови и остановку кровотечения при повреждении кровеносных сосудов;
— регуляторная функция, направленная на сохранение гомеостаза с поддержанием биологических констатнт организма, реализуется буферными свойствами молекулы протеинов, белковой структурой клеточных рецепторов, активируемых в свою очередь регуляторными полипептидами и гормонами, также имеющими белковую структуру;
— двигательная функция, обеспечивается взаимодействием сократительных белков мышечной ткани актина и миозина;
— энергетическая роль белков состоит в обеспечении организма энергией, образующейся при диссимиляции белковых молекул; при окислении 1 г белка в среднем освобождается энергия, равная 16, 7 кДж (4, 0 ккал).
При катаболизме почти все природные аминокислоты сначала передают аминогруппу на а-кетоглутарат в реакции трансаминирования с образованием глутамата и соответствующей кетокислоты. Затем глутамат подвергается прямому окислительному дезаминированию под действием глутаматдегидрогеназы, в результате чего получаются а-кетоглутарат и аммиак. При необходимости синтеза аминокислот и наличии необходимых а-кетокислот обе стадии непрямого дезаминирования протекают в обратном направлении. В результате восстановительного аминирования а-кетоглутарата образуется глутамат, который вступает в трансаминирование с соответствующей а-кетокислотой, что приводит к синтезу новой аминокислоты. В случае использования белков в качестве источника энергии большинство аминокислот окисляются в конечном счёте через цикл лимонной кислоты до углекислого газа и воды. Прежде, чем эти вещества вовлекаются в заключительный этап катаболизма, их углеродный скелет превращается в двухуглеродный фрагмент в форме ацетил-КоА. Именно в этой форме большая часть молекул аминокислот включается в цикл лимонной кислоты.
Таблица 1. 1. Аминокислоты, входящие в состав белков человека.
1. Незаменимые
2. Частично заменимые
3. Условно заменимые
4. Заменимые
Таблица 1. 2. Классификация липидов организма человека.
1. Гликолипиды.
Содержат углеводный компонент.
2. Жиры.
3. Минорные липиды.
4. Стероиды.
А. Стерины (спирты).
Наиболее важен холестерин.
В. Стериды.
Эфиры стеринов и высших жирных кислот. Наиболее распространены эфиры холестерина.
5. Фосфолипипы.
Одним из продуктов катаболизма жиров, имеющем важное значения для метаболизма в целом являются кетоновые тела. Кетоновые тела — группа органических соединений, являющихся промежуточными продуктами жирового, углеводного и белкового обменов. К кетоновым телам относят β-оксимасляную и ацетоуксусную кислоты и ацетон, имеющие сходное строение и способные к взаимопревращениям. Главным путем синтеза кетоновых тел, происходящего в основном в печени, считается реакция конденсации между двумя молекулами ацетил-КоА, образовавшегося при β-окислении жирных кислот или при окислительном декарбоксилировании пирувата (пировиноградной кислоты) в процессе обмена глюкозы и ряда аминокислот. Данный путь синтеза кетоновых тел более других зависит от характера питания и в большей степени страдает при патологических нарушениях обмена веществ. Из печени кетоновые тела поступают в кровь и с нею во все остальные органы и ткани, где они включаются в универсальный энергообразующий цикл — цикл трикарбоновых кислот, в котором окисляются до углекислоты и воды. Кетоновые тела используются также для синтеза холестерина, высших жирных кислот, фосфолипидов и заменимых аминокислот. При голодании, однообразном безуглеводистом питании и при недостаточной секреции инсулина использование ацетил-КоА в цикле трикарбоновых кислот подавляется, так как все метаболически доступные ресурсы организма превращаются в глюкозу крови. В этих условиях увеличивается синтез кетоновых тел. Следует подчеркнуть важную роль кетоновых тел в поддержании энергетического баланса. Кетоновые тела – поставщики «топлива» для мышц, почек и действуют, возможно, как часть регуляторного механизма с обратной связью, предотвращая чрезвычайную мобилизацию жирных кислот из жировых депо. Печень в этом смысле является исключением, она не использует кетоновые тела в качестве энергетического материала.
Процесс образования, отложения и мобилизации из депо жира регулируется нервной и эндокринной системами, а также тканевыми механизмами и тесно связаны с углеводным обменом. Так, повышение концентрации глюкозы в крови уменьшает распад триглицеридов и активизирует их синтез. Понижение концентрации глюкозы в крови, наоборот, тормозит синтез триглицеридов и усиливает их расщепление. Таким образом, взаимосвязь жирового и углеводного обменов направлена на обеспечение энергетических потребностей организма. При избытке углеводов в пище триглицериды депонируются в жировой ткани, при нехватке углеводов происходит расщепление триглицеридов с образованием неэтерифицнрованных жирных кислот, служащих источником энергии. В обмене жиров одна из важнейших ролей принадлежит печени. Печень — основной орган, в котором происходит образование кетоновых тел (бета-оксимасляная, ацетоуксусная кислоты, ацетон), используемых как альтернативный глюкозе источник энергии.
Как указывалось выше метаболизм жиров контролируется нервной и эндокринной системами. Мобилизация жиров из депо происходит под влиянием гормонов мозгового слоя надпочечников — адреналина и норадреналина. Соматотропный гормон гипофиза также обладает жиромобилизирующим действием. Аналогично действует тироксин — гормон щитовидной железы. Тормозят мобилизацию жира глюкокортикоиды — гормоны коркового слоя надпочечника, вероятно, вследствие того, что они несколько повышают уровень глюкозы в крови. Действие инсулина связано с повышением активности внутриклеточной фосфодиэстеразы, что приводит к снижению концентрации цАМФ и угнетению липолиза. Таким образом, инсулин усиливает синтез жира и уменьшает скорость его мобилизации. Имеются данные, свидетельствующие о возможности прямых нервных влияний на обмен жиров. Симпатические влияния тормозят синтез триглицеридов и усиливают их распад. Парасимпатические влияния, напротив, способствуют отложению жира в депо.
Статья добавлена 31 мая 2016 г.
Ресинтез АТФ в мышечных волокнах
Дано определение ресинтеза АТФ. Описаны основные пути ресинтеза АТФ в мышечных волокнах: креатинфосфатный, гликолитический, миокиназный и тканевое дыхание. Описаны количественные критерии путей ресинтеза АТФ, соотношение между различными путями ресинтеза АТФ при мышечной работе, а также между путями ресинтеза АТФ и зонами относительной мощности.
Ресинтез АТФ в мышечных волокнах
Определение
Ресинтез АТФ – синтез АТФ из различных энергетических субстратов во время физической работы в мышечных волокнах.
Формула ресинтеза АТФ выглядит следующим образом:
Пути ресинтеза АТФ
Ресинтез АТФ может осуществляться двумя путями:
Аэробный путь (тканевое дыхание, аэробное или окислительное фосфорилирование) – основной способ образования АТФ в мышечных волокнах. Он протекает в митохондриях мышечных волокон. В результате тканевого дыхания выделяется 39 молекул АТФ. Окисляемое вещество распадается до углекислого газа и воды.
Анаэробный ресинтез АТФ
Анаэробные пути ресинтеза АТФ являются дополнительными способами образования АТФ в мышечных волокнах в тех случаях, когда основной путь получения АТФ – тканевое дыхание не может обеспечить мышечную деятельность необходимым количество кислорода. Эти механизмы ресинтеза АТФ активно функционируют в начале выполнения физических упражнений, когда тканевое дыхание не полностью «развернулось», а также при физических нагрузках высокой мощности.
Анаэробный ресинтез АТФ в мышечных волокнах возможен посредством нескольких механизмов:
Количественные критерии путей ресинтеза АТФ
Существуют количественные критерии путей ресинтеза АТФ. К ним можно отнести: максимальную мощность, время развертывания, время сохранения или поддержания максимальной мощности, метаболическую ёмкость (табл. 1).
Таблица 1. Количественные критерии основных путей ресинтеза АТФ (С.С. Михайлов, 2009)
| Пути ресинтеза АТФ | Критерии | |||
| Максимальная мощность, кал/мин кг | Время развертывания | Время сохранения максимальной мощности | Метаболическая ёмкость | |
| Креатинфосфатный | 900-1100 | 1-2 с | 8-10 с | |
| Гликолитический | 750-850 | 20-30 с | 2-3 мин. | При анаэробном окислении гликогена образуются 3 молекулы АТФ в расчете на одну молекулу глюкозы |
| Аэробный | 350-450 | 3-4 мин. | Десятки минут | При аэробном окислении гликогена образуются 39 молекул АТФ в расчете на одну молекулу глюкозы (самый экономичный) |
Соотношение между различными путями ресинтеза АТФ
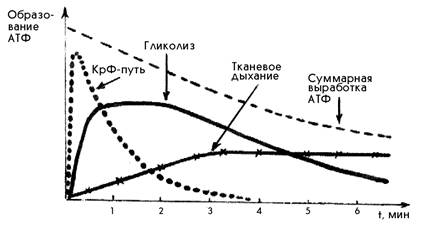
При любой мышечной работе функционируют все три основных механизма ресинтеза АТФ, но включаются они последовательно. В первые секунды ресинтез АТФ осуществляется за счет креатинфосфатной реакции, затем включается гликолиз. По мере продолжения работы на смену гликолизу приходит тканевое дыхание (рис.1). Эта смена механизмов ресинтеза АТФ приводит к уменьшению суммарной выработки АТФ.
Рис.1. Включение путей ресинтеза АТФ при выполнении физической работы (С.С. Михайлов, 2009)
Пути ресинтеза АТФ и зоны относительной мощности
В.С. Фарфель приводит следующее соотношение мощности работы и основной системы энергообеспечения (табл.2)
Таблица 2. Зоны мощности работы и основная система энергообеспечения (В.С. Фарфель)
АТФ мышц
Дано определение АТФ, описана история открытия АТФ, содержание АТФ в мышечных волокнах, приведена структура АТФ, описаны реакции гидролиза и ресинтеза АТФ в мышечных волокнах
АТФ мышц
Что такое АТФ?
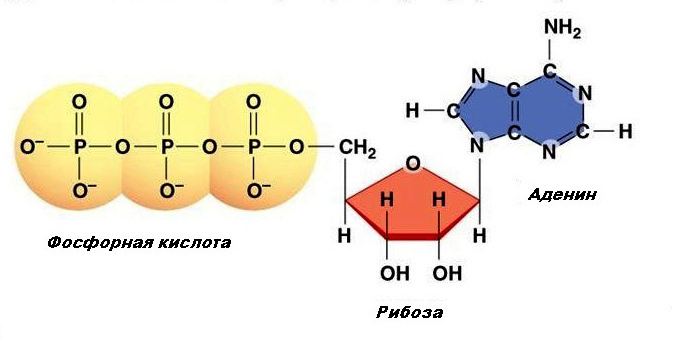
АТФ (аденозинтрифосфат, аденозинтрифосфорная кислота) – основное макроэргическое соединение организма[1]. Состоит из аденина (азотистого основания), рибозы (углевод) и трех последовательно расположенных фосфатных остатков, причем второй и третий фосфатные остатки присоединяются макроэргической связью. Структура АТФ выглядит следующим образом (рис.1).
Рис. 1. Структура АТФ
История открытия АТФ
АТФ был открыт(а) в 1929 году немецким биохимиком Карлом Ломаном (Karl Lohmann) и, независимо Сайрусом Фиске (Cyrus Fiske) и Йеллапрагада Субба Рао (Yellapragada Subba Rao) из Гарвардской медицинской школы. Однако структура АТФ была установлена только спустя несколько лет. Владимир Александрович Энгельгардт в 1935 году показал, что для сокращения мышц необходимо присутствие АТФ. В 1939 году В. А. Энгельгардт совместно со своей женой М. Н. Любимовой предъявили доказательства, что миозин проявляет ферментную активность при этом расщепляется АТФ и высвобождается энергия. Фриц Альберт Липманн (Fritz Albert Lipmann) в 1941 году показал, что АТФ является основным переносчиком энергии в клетке. Ему принадлежит фраза «богатые энергией фосфатные связи». В 1948 году Александр Тодд (Alexander Todd) (Великобритания) синтезировал АТФ. В 1997 году Пол Д. Бойер (Paul D. Boyer) и Джон Э. Уокер (John E. Walker) получили Нобелевскую премию по химии за разъяснение ферментативного механизма, лежащего в основе синтеза АТФ.
Содержание АТФ в мышечных волокнах
Количество АТФ в тканях организма человека относительно невелико, поскольку он (она) в тканях не запасается. В мышечных волокнах содержится 5 ммоль на кг сырой ткани или 25 ммоль на кг сухой мышечной ткани.
Гидролиз АТФ
Непосредственным источником энергии при мышечной деятельности является АТФ, который (ая) находится в саркоплазме мышечных волокон. Освобождение энергии происходит в результате реакции гидролиза АТФ.
Гидролиз АТФ – реакция, протекающая в мышечных волокнах, при которой АТФ, взаимодействуя с водой распадается на АДФ и фосфорную кислоту (Н3РО4). При этом выделяется энергия. Гидролиз АТФ ускоряется ферментом АТФ-азой. Этот фермент находится на каждой миозиновой головке толстого филамента.
Реакция гидролиза АТФ имеет следующий вид:
В результате гидролиза 1 моль АТФ выделяется энергия, равная 42-50 кДж (10-12 ккал). Скорость протекания реакции гидролиза повышают ионы кальция. Следует отметить, что АДФ (аденозиндифосфат) в мышечных волокнах выполняет роль универсального акцептора (приёмника) высокоэнергетического фосфата и используется для образования АТФ.
Фосфорная кислота (Н3РО4) в саркоплазме мышечных волокон достаточно быстро диссоциирует на ионы водорода и остаток фосфорной кислоты. В настоящее время доказано, что именно реакция гидролиза АТФ приводит к ацидозу, то есть закислению мышцы, а не гликолиз АТФ, в результате которого образуется молочная кислота (или более точно — лактат).
Фермент АТФ-аза
Фермент АТФ-аза расположен на миозиновых головках, что играет существенную роль в сокращении мышечных волокон. Активность фермента АТФ-азы лежит в основе классификации мышечных волокон на медленные (I тип), промежуточные (IIA тип) и быстрые (IIB тип).
Химическая энергия, выделяемая в результате гидролиза в мышечных волокнах, расходуется на: сокращение мышечных волокон (взаимодействие белков актина и миозина) и на их расслабление (работу кальциевого и натрий-калиевого насосов). При взаимодействии с актином одна молекула миозина за одну секунду гидролизует 10 молекул АТФ.
Запасы АТФ в мышечных волокнах невелики и могут обеспечить выполнение интенсивной работы в течение 1-2 с. Дальнейшая мышечная деятельность осуществляется благодаря быстрому восстановлению (ресинтезу) АТФ, поэтому при сокращении мышечных волокон в них одновременно протекают два процесса: гидролиз АТФ, дающий необходимую энергию и ресинтез АТФ, восполняющий запасы АТФ в мышечных волокнах.
Ресинтез АТФ
Ресинтез АТФ – синтез АТФ в мышечных волокнах из различных энергетических субстратов во время физической работы. Его формула выглядит следующим образом:
Ресинтез АТФ может осуществляться двумя путями:
Если в саркоплазме мышечных волокон недостаточно АТФ, то затрудняется процесс их расслабления. Возникают судороги.
Литература
[1] Макроэргические соединения – химические соединения, содержащие связи, при гидролизе которых происходит освобождение значительного количества энергии.
Энергетические процессы в мышце
Содержание
Энергетические процессы в мышце [ править | править код ]
Естественно, что для совершения мышечного движения требуется энергия. В организме человека существуют разные источники энергии, которые последовательно включаются один за другим. Рассмотрим каждый из них.
АТФ [ править | править код ]
Универсальным источником энергии в живом организме является молекула АТФ, которая образуется в цитратном цикле Кребса. Под действием фермента АТФазы молекула АТФ гидролизуется, отсоединяя фосфатную группу в виде ортофосфорной кислоты (Н3РО4), и превращается в АДФ, при этом высвобождается энергия.
Головка миозинового мостика при контакте с актином обладает АТФазной активностью и соответственно возможностью расщеплять АТФ и получать энергию, необходимую для движения.

Креатинфосфат [ править | править код ]
Запас молекул АТФ в мышце ограничен, поэтому расход энергии при работе мышцы требует постоянного его восполнения, это происходит за счет креатинфосфата. Креатинфосфат обладает способностью отсоединять фосфатную группу и превращаться в креатин, присоединяя фосфатную группу к АДФ, которая превращается в АТФ.
АДФ + креатинфосфат = АТФ + креатин.
Эта реакция получила название – реакции Ломана. Именно поэтому креатин имеет большое значение в бодибилдинге.
Надо заметить, что креатин эффективен только при выполнении анаэробных (силовых) упражнений, так как креатинфосфата достаточно примерно на 2 минуты интенсивной работы, затем подключаются другие источники энергии. Соответственно, в лёгкой атлетике приём креатина как добавки для увеличения атлетических показателей малоэффективен.
Запасы креатинфосфата в волокне не велики, поэтому он используется в качестве источника энергии только на начальном этапе работы мышцы, до момента активизации других более мощных источников – анаэробного и затем аэробного гликолиза. По окончании работы мышцы реакция Ломана идет в обратном направлении, и запасы креатинфосфата в течение нескольких минут восстанавливаются.
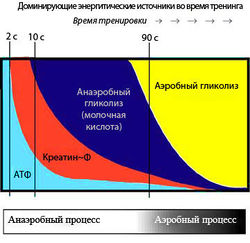
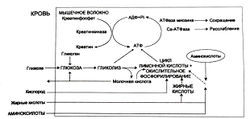
Энергетический метаболизм скелетных мышц [ править | править код ]
Алактатные механизмы [ править | править код ]
КФ обеспечивает запас энергии фосфата для ресинтеза АТФ из АДФ при наступлении сократительной деятельности (рис. 3):
КФ + АДФ Креатинкиназа К + АТФ (1)
В состоянии покоя мышечные волокна наращивают концентрацию КФ до пяти раз больше, чем АТФ. В начале сокращения, когда концентрация АТФ начинает падать, а АДФ повышаться вследствие ускорения разложения АТФ, массовая активность способствует образованию АТФ из КФ.
Хотя образование АТФ из КФ происходит быстро, требуя одной единственной ферментативной реакции (1), количество АТФ, которое может быть получено в результате этого процесса, ограничено начальной концентрацией КФ. Мышечные волокна также содержат миокиназу, которая катализирует образование одной молекулы АТФ и одной молекулы АМФ из двух молекул АДФ. АТФ и КФ, вместе взятые, могут обеспечить максимальную силу в течение 8—10 с. Таким образом, энергия, полученная от фосфагенной системы, используется для коротких всплесков максимальной мышечной активности, необходимых в легкой и тяжелой атлетике (забег на 100 м, толкание ядра или поднятие тяжестей).
Гликолиз [ править | править код ]
Хотя метаболизм по гликолитическому пути производит лишь небольшое количество АТФ из каждой усвоенной единицы глюкозы, он может обеспечить быстрый синтез большого количества АТФ при наличии достаточного количества ферментов и субстрата. Этот процесс может также происходить в отсутствие кислорода:
Глюкоза анаэробный быстрый гликолиз 2 АТФ + 2 лактата (2)
Глюкоза для гликолиза поступает либо из крови, либо из запасов гликогена. Когда исходным материалом выступает гликоген, из одной единицы потребленной глюкозы в результате фосфоролитического гликогенолиза образуется три молекулы АТФ. По мере того, как мышечная активность становится интенсивнее, для анаэробного расщепления гликогена мышц требуется все больше и больше АТФ, и, соответственно, увеличивается производство молочной кислоты. Анаэробный гликолиз может обеспечить энергию на 1,3-1,6 мин максимальной мышечной активности.
Образование молочной кислоты понижает уровень pH в мышечных волокнах. Это препятствует действию ферментов и вызывает боль, если удаление молочной кислоты происходит слишком медленно по сравнению с ее образованием.
Окислительное фосфорилирование [ править | править код ]
При умеренном уровне физической нагрузки, например, при беге на 5000 м или марафоне, большая часть АТФ, используемого для сокращения мышц, образуется путем окислительного фосфорилирования. Окислительное фосфорилирование позволяет высвободить из глюкозы гораздо больше энергии по сравнению с отдельно взятым анаэробным гликолизом:
Жиры катаболизируются только с помощью окислительных механизмов, при этом выделяется много энергии. Аминокислоты тоже могут быть метаболизированы подобным образом. Три метаболических пути образования АТФ для сокращения и расслабления мышц показаны на рис. 3.
В течение первых 5
10 мин умеренной физической нагрузки главным потребляемым «топливом» является собственный гликоген мышц. В течение следующих 30 мин доминирующими становятся переносимые кровью вещества; глюкоза крови и жирные кислоты вносят примерно одинаковый вклад в потребление мышцами кислорода. По истечении этого периода все более важную роль приобретают жирные кислоты. Важно подчеркнуть взаимодействие между анаэробными и аэробными механизмами в образовании АТФ во время физической нагрузки. Вклад анаэробного образования АТФ больше при краткосрочной нагрузке высокой интенсивности, в то время как при более продолжительных нагрузках низкой интенсивности преобладает аэробный метаболизм.
Восстановление и кислородная задолженность [ править | править код ]
После того как физическая нагрузка закончилась, поглощение кислорода все еще остается выше нормы (табл.). С недавнего времени для обозначения кислородной задолженности используется также термин «избыточное потребление кислорода после физической нагрузки». Сначала его уровень очень высок, пока тело восстанавливает запасы КФ и АТФ, возвращая тканям запасенный кислород, а затем в течение еще одного часа потребление идет на более низком уровне, пока удаляется молочная кислота. Поэтому ранние и последние фазы кислородной задолженности называют соответственно алактатной и лактатной кислородной задолженностью. Повышение температуры тела также говорит о более высокой скорости метаболизма и росте потребления кислорода.
Чем продолжительнее и интенсивнее физическая нагрузка, тем больше времени занимает восстановление. Например, на восстановление после полного истощения гликогена мышц зачастую требуется несколько дней, а не секунд, минут или часов, необходимых для восстановления запасов КФ и АТФ и удаления молочной кислоты. Физическая нагрузка большой интенсивности, вероятно, приводит к микротравмам мышечных волокон, и их восстановление занимает некоторое время.
Компоненты кислородной задолженности. После длительной, тяжелой физической нагрузки дыхание остается выше нормы для удовлетворения повышенной потребности в кислороде
Восстановление запасов кислорода в тканях(около 1 л)
Восстановление уровней креатинфосфата и других богатых энергией фосфатов (около 1-1,5 л)
Удаление молочной кислоты путем глюконеогенеза и другими путями (до 12 л)
Стимуляция метаболизма вследствие повышения уровня адреналина (около 1 л)
Дополнительное потребление кислорода в дыхательных мышцах и сердце (около 0,5 л)
Общее усиление метаболизма вследствие более высокой температуры тела*