Что такое риф в микробиологии
Иммунофлюоресцентный метод
Смотреть что такое «Иммунофлюоресцентный метод» в других словарях:
Бактериоскопический (микроскопический) метод — совокупность способов обнаружения и изучения морфологических и тинкториальных св в бактерий (микробов) в лабораторной к ре, патологическом материале или в пробах из внешней среды с помощью микроскопии. Применяют для установления д за инфекц.… … Словарь микробиологии
Обследование больного — I Обследование больного Обследование больного комплекс исследований, направленных на выявление индивидуальных особенностей больного, установление диагноза болезни, обоснование рационального лечения, определение прогноза. Объем исследований при О … Медицинская энциклопедия
Лёгкие — I Легкие (pulmones) парный орган, расположенный в грудной полости, осуществляющий газообмен между вдыхаемым воздухом и кровью. Основной функцией Л. является дыхательная (см. Дыхание). Необходимыми компонентами для ее реализации служат вентиляция… … Медицинская энциклопедия
ПНЕВМОНИЯ ПНЕВМОЦИСТНАЯ — мед. Пневмоцистная пневмония (ПП) воспаление нижних отделов дыхательных путей, вызываемое Pneumocystis carinii. При попадании в организм здорового человека (пути передачи воздушно капельный и вертикальный) заболевания не возникает. На фоне… … Справочник по болезням
Коклюш — I Коклюш (pertussis; франц. coqueluche) острая инфекционная болезнь, характерным признаком которой является приступообразный спазматический кашель. Этиология и эпидемиология. Возбудитель болезни грамотрицательная палочка Bordetella pertussis.… … Медицинская энциклопедия
Эпидемический паротит — Эту статью следует викифицировать. Пожалуйста, оформите её согласно правилам оформления статей. Эпид … Википедия
Паротит эпидемический — Эпидемический паротит, свинка, заушница 5 летний мальчик с типичным припуханием околоушных слюнных желёз МКБ 10 B26. МКБ 9 … Википедия
РИФ — см. Иммунофлюоресцентный метод (Источник: «Словарь терминов микробиологии») … Словарь микробиологии
Реакция иммунофлюоресценции — см. Иммунофлюоресцентный метод (Источник: «Словарь терминов микробиологии») … Словарь микробиологии
Микроскопия люминесцентная — М. первично или вторично флюоресцирующих объектов в специальном люминесцентном микроскопе (напр., МЛ 2) или в люминесцентной приставке к световому микроскопу (напр., ОИ 28, ОИ 30). В микробиол. исследовании в качестве объектов М. л. обычно… … Словарь микробиологии
Трепонемные тесты
Реакция иммобилизации бледных трепонем (РИБТ). Обязательным условием является исключение перед обследованием приема больным антибиотиков, которые оказывают токсическое действие на бледные трепонемы, вызывая их неспецифическое обездвижение.
Положительные результаты РИБТ обнаруживаются примерно с середины вторичного свежего периода сифилиса, и могут длительно сохраняться после проведенного лечения. При необходимости метод используют для выявления АТ в СМЖ, это исследование отличает высокая специфичность, но низкая чувствительность (около 40 %).
РИБТ мало пригодна для диагностики ранних форм сифилиса ввиду позднего (не ранее 8–9 недель от момента заражения) появления АТ-иммобилизинов; метод может давать ложноположительные результаты, в особенности у больных с аутоиммунной патологией, злокачественными заболеваниями, диабетом. Кроме того, РИБТ – достаточно сложный, трудоемкий и дорогостоящий анализ, требующий высокой квалификации персонала и наличия вивария, в связи с чем в последние годы он используется лишь в отдельных лабораториях. В диагностике РИБТ применяется как реакция-арбитр при расхождении результатов других серологических исследований, для дифференцирования ложноположительных результатов и при установлении диагноза поздних форм сифилиса.
Реакция связывания комплемента с трепонемным антигеном (РСК с ТА).Чувствительность метода – около 80 %, специфичность – 98 %. Метод входил в состав комплекса стандартных серологических реакций на сифилис, регламентированного приказом Минздрава СССР № 1161 от 02.09.1985 «О совершенствовании серологической диагностики сифилиса». В настоящее время использование этой реакции, как и РСК с кардиолипиновым антигеном, ограничено отдельными лабораториями.
Реакция иммунофлуоресценции (РИФ). Для диагностики сифилиса используют несколько модификаций РИФ: РИФ-ц – для выявления АТ в СМЖ, РИФ-200 (тестируемую сыворотку перед реакцией разводят в 200 раз); РИФ-абс (РИФ с абсорбцией), IgM-РИФ-абс (для определения АТ IgM). По чувствительности и специфичности РИФ-абс не уступает РИБТ, но выполнение этого метода намного проще. Результаты РИФ-абс становятся положительными с 3–й недели после заражения (до появления твердого шанкра или одновременно с ним), это метод ранней диагностики сифилиса. Нередки положительные результаты исследования спустя много лет после полноценного лечения раннего сифилиса, а у больных с поздним сифилисом – на протяжении десятилетий.
Показания для выполнения РИФ-абс:
IgM–РИФ–абс применяют для раздельного выявления АТ классов Ig, что представляет особый интерес при диагностике врожденного сифилиса, когда АТ к трепонеме, синтезированные в организме ребенка, представлены IgM, а АТ IgG имеют материнское происхождение. Показаниями к проведению этого исследования являются: диагностика врожденного сифилиса; оценка результатов лечения раннего сифилиса.
РИФ обладает высокой чувствительностью (98,5%) и специфичностью (99,6%) практически при всех формах сифилиса. Недостатками РИФ являются: невозможность автоматизации исследования и учета результатов; трудности приготовления качественного антигена из взвеси бледных трепонем, полученных из яичка зараженного кролика; субъективизм в оценке результатов.
Реакция пассивной гемагглютинации (РПГА). Сопоставление результатов, полученных при использовании РПГА и РИБТ, РИФ–абс, КСР, МРП показало высокую чувствительность и специфичность РПГА при диагностике сифилиса, совпадающую с результатами РИФ–абс.
РПГА может быть выполнена в качественном и количественном вариантах, существуют их макро- и микромодификации. Количественный метод РПГА позволяет оценить концентрацию специфических трепонемных АТ в крови. Титры от 1 : 640 и ниже характерны для пациентов, леченных по поводу сифилиса в прошлом. Более высокие титры – обычно для активной нелеченной инфекции.
Положительные результаты РПГА, как правило, отмечают спустя 3 недели после появления твердого шанкра и далее у пациентов, перенесших сифилис, в течение многих лет, нередко пожизненно.
Чувствительность РПГА составляет 76% при первичном сифилисе; 100% при вторичном сифилисе; 97% при скрытом сифилисе; 94% при позднем сифилисе. Специфичность РПГА выше, чем специфичность РИФ–абс, составляет 99%.
Благодаря соотношению высокой специфичности, чувствительности, простоты выполнения, стандартизации реагентов среди трепонемных тестов для серодиагностики сифилиса РПГА стабильно занимает лидирующее место в клинической практике в мире.
Особые преимущества ИФА заключаются: в высокой чувствительности и специфичности метода; автоматизации постановки реакции; высокой степени стандартизации; возможности исследования большого количества образцов сывороток; в количественном учете и объективной документации полученных результатов; возможности одновременного определения титра противотрепонемных АТ разных классов (IgG и IgM) в одном образце; пригодности для ранней диагностики сифилиса и диагностики врожденного сифилиса; в удобстве применения для тестирования крови в службе переливания крови; применимости в качестве подтверждающего специфического трепонемного теста. Чувствительность ИФА 98–100%, специфичность 96–100%.
К недостаткам ИФА можно отнести: непригодность для исследования единичных образцов; более длительный срок до получения результата, и меньший срок годности ИФА-наборов, например, по сравнению с РПГА.
Иммунный блот (ИБ). Одним из современных методов диагностики сифилиса является ИБ для определения АТ IgG либо IgM к определенным АГ бледной трепонемы.
Метод обладает высокой чувствительностью (до 100%,), специфичностью (98%) и воспроизводимостью (100%). Исследование дает возможность изучения спектра АТ сразу к нескольким АГ T.pallidum, применения высокоочищенных рекомбинантных и пептидных АГ, снижающих до минимума неспецифическую реактивность сывороток.
Все это определяет возможность предпочтения применения метода ИБ перед другими трепонемными тестами для верификации диагноза сифилиса в сложных случаях, в частности, для диагностики сифилиса во второй половине инкубационного периода, скрытого врожденного сифилиса в первые дни жизни ребенка, для выявления скрытого сифилиса у лиц со слабым гуморальным ответом, а также для дифференцирования ложноположительных результатов других тестов.
Механизм, цели применения реакции иммунофлюоресценции (РИФ), виды РИФ, ингредиенты
Реакция иммунофлюоресценции (РИФ, метод Кунса) является методом экспресс-диагностики для выявления антигенов микробов или определения антител. РИФ основана на использовании флюоресцеинизотиоцианата – ФИТЦ или других флюорохромов, химически связанных, конъюгированных с АТ. При этом меченые АТ сохраняют иммунологическую специфичность и вступают во взаимодействие со строго определенными корпускулярными АГ.
Различают две основные разновидности метода: прямой и непрямой.
Прямой метод РИФоснован на том, что антигены тканей или микробы, обработанные специфичными сыворотками с антителами, меченными флюорохромами, способны светиться в УФ-лучах люминесцентного микроскопа. Бактерии в мазке, обработанные такой люминесцирующей сывороткой, светятся по периферии клетки в виде каймы зеленого или желтого цвета.
Непрямой метод РНИФзаключается в выявлении комплекса антиген-антитело с помощью антиглобулиновой (против антитела) сыворотки, меченной флюорохромом. Для этого мазки из исследуемых микробов обрабатывают антителами антимикробной кроличьей диагностической сыворотки. Затем антитела, не связавшиеся антигенами микробов, отмывают, а оставшиеся на микробах антитела выявляют, обрабатывая мазок антиглобулиновой (антикроличьей) сывороткой, меченной флюорохромами. В результате образуется комплекс микроб + антимикробные кроличьи антитела + антикроличьи антитела, меченные флюорохромом. Этот комплекс наблюдают в люминесцентном микроскопе, как и при прямом методе.
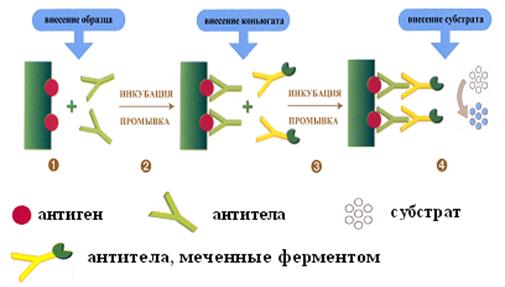
Механизм, цели применения иммуноферментного анализа (ИФА), ингредиенты
Твердофазный ИФАявляется наиболее распространенным вариантом ИФА, когда один из компонентов иммунной реакции (антигены или антитела) сорбирован на твердом носителе, например в лунках микропланшетов из полистирола (рис. 25). При определении антител в лунки микропланшетов с сорбированными антигенами последовательно добавляют сыворотку крови больного, антиглобулиновую сыворотку, меченную ферментом, субстрат для фермента (Н2О2 или фосфатид) и хромоген (индикатор, окрашивающий продукт ферментации). Каждый раз после добавления очередного компонента из лунок удаляют несвязавшиеся реагенты путем тщательного промывания. При положительном результате изменяется цвет раствора хромогена. Твердофазный носитель можно сенсибилизировать не только антигеном, но и антителами. Тогда в лунки с сорбированными антителами вносят искомый антиген, добавляют иммунную сыворотку против антигена, меченную ферментом, а затем субстрат для фермента и хромоген.
Рис. 25. Принцип постановки ИФА для обнаружения антимикробных антител
Механизм, ингредиенты радиоиммунного анализа (РИА)
МЕТОДЫ СЕРОЛОГИЧЕСКИХ РЕАКЦИЙ В ДИАГНОСТИКЕ ВИРУСНЫХ БОЛЕЗНЕЙ
Вирус – антиген, так как их белковая оболочка вызывает выработку специфических антител, которые накапливаются в сыворотке крови. Они способны соединятся в комплекс антиген + антитело только со своим антигеном. Если антиген – инфекционный агент (вирус), антитела его нейтрализуют: в этом состоит биологическая роль антитела.
Взаимодействие антител с антигенами возможно в пробирке, что является основой серологических реакций. Если взятая пара АГ (антиген) и АТ (антитело) гомологичны и соответствуют друг другу, то они образуют комплекс АГ + АТ. Это позволяет обнаружить по известному антителу неизвестный антиген [1].
1. Реакция нейтрализации (PH)
Это универсальная реакция служит эталоном при оценке других серологических реакций.
Принцип ее состоит в том, что при взаимодействии антигена (вируса) с гомологичными антителами образуется комплекс антиген + антитело, в результате нейтрализуется инфекционность вируса. Индикатором свободного (не связавшегося с антителами) вируса является чувствительная к вирусу живая система: животные, куриные эмбрионы или культура клеток.
При постановке реакции в пробирке смешивают равные объемы вируса и сыворотки, смесь выдерживают при соответствующей температуре (4, 22 или 37 °С) в течение одного часа или 16—18 ч (зависит от вируса и условий опыта). Затем этой смесью заражают чувствительную к вирусу живую систему, наблюдают за состоянием живых объектов и через соответствующий срок учитывают результат нейтрализации вируса по отсутствию:
1) гибели, развития клинической картины болезни и патологических изменений в органах и тканях лабораторных животных;
2) гибели, патологических изменений в оболочках, тканях зародыша и отсутствию гемагглютининов в жидкостях полостей куриных эмбрионах;
3) цитопатического действия (ЦПД) или бляшкообразования в культуре клеток. [2]
Так как для нейтрализации определенного количества вируса требуется определенное количество антител, а один из этих компонентов все еще неизвестен, то PH можно ставить в двух вариантах:
1) к разным дозам (разведениям) сыворотки (обычно в виде последовательных 2-кратных разведений) добавляют одинаковые дозы вируса (обычно 100—1000 ЕД50). В этом варианте определяют титр вируснейтрализующих антител в сыворотке, показателем которого служит разведение сыворотки, защищающее от действия вируса 50 % зараженных биологических систем;
2) к разным дозам (разведениям) вируса (обычно в виде последовательных 10-кратных разведений) добавляют одинаковые дозы сыворотки (обычно в разведениях 1 : 10 или 1 : 20). При постановке данного варианта PH кроме исследуемой (или специфической) сыворотки используют и нормальную (отрицательную) сыворотку. В этом случае определяют индекс нейтрализации (IN), который показывает, во сколько раз иммунная (специфическая) или исследуемая сыворотка снижает титр вируса по сравнению е нормальной сывороткой.
Достоинствами PH являются ее универсальность и высокая специфичность; недостатки — большая трудоемкость; необходимость строго соблюдать стерильность материалов, посуды и инструментов; высокая стоимость живых биологических систем; относительная длительность биопробы и необходимость проведения математических расчетов. [3]
2.Реакция торможения гемагглютинации (РТГА)
Широко используется при исследовании гемагглютинирующих вирусов.
Основана на том, что антитела при встрече с гомологичным вирусом (антигеном) нейтрализуют не только его инфекционную, но и гемагглютинирующую активность, так как блокируют рецепторы вирионов, ответственные за гемагглютинацию, образуя с ними комплекс антиген + антитело.
Принцип РТГА состоит в том, что в пробирке (лунке) смешивают равные объемы сыворотки крови и вируса и после экспозиции (30—40 мин) добавляют эритроциты соответствующего вида животного.
Эритроциты являются индикатором наличия вируса в смеси. Агглютинация эритроцитов указывает на наличие вируса в смеси, а отсутствие гемагглютинации — на его отсутствие, так как антитела полностью нейтрализовали гемагглютинирующую активность вируса. [4]
РТГА можно ставить в двух вариантах:
1) к разным разведениям сыворотки (обычно 2-кратным) добавляют одинаковые дозы вируса (4—8 ГАЕ);
2) к разным разведениям вируса (обычно 2-кратным) добавляют одинаковые дозы сыворотки.
Постановку РТГА по первому варианту проводят по следующим этапам:
• титруют вирус в РГА и определяют его гемагглютинирующий титр;
• приготовляют и контролируют рабочую дозу вируса (4 или 8 ГАЕ);
• ставят главный опыт РТГА;
Оценивают гемагглютинацию в каждой смеси в крестах и определяют титр антител. За титр антител в сыворотке принимается наивысшее разведение сыворотки, которое еще полностью тормозит гемагглютинацию. [5]
РГТА позволяет решить следующие диагностические задачи:
• обнаружить и определить титр антител в сыворотке крови с помощью известного вируса;
• идентифицировать неизвестный вирус путем исследования его с различными заведомо известными сыворотками (антителами).
Достоинства РТГА — простота техники постановки и быстрый результат. Однако эту реакцию можно использовать только для гемагглютинирующих вирусов. [4]
3.Реакция непрямой гемагглютинации (РНГА)
Основана на том, что эритроциты, на которых предварительно адсорбированы антигены, приобретают способность агглютинироваться в присутствии гомологичных сывороток (антител).
Эритроциты при этом выполняют роль носителей со специфическими детерминантами, агглютинация которых происходит в результате реакции антиген + антитело.
Эритроциты, к поверхности которых прочно присоединены антигены, называют эритроцитарным антигенным диагностикумом, или эритроцитами, сенсибилизированными антигеном.
Другой тип РНГА — на поверхности эритроцитов адсорбированы антитела и последующая их агглютинация происходит в присутствии гомологичного антигена. В этом случае такие эритроциты называют эритроцитарным антительным диагностикумом, или эритроцитами, сенсибилизированными антителами.
Приготовление эритроцитарных диагностикумов включает следующие этапы:
• фиксация эритроцитов формальдегидом или глютаровым, или акриловым альдегидами. Такие обработанные эритроциты длительно сохраняются. Чаще для этой цели используют эритроциты барана, человека, кур и др.;
• обработка фиксированных эритроцитов раствором танина. В результате эритроциты приобретают свойство необратимо адсорбировать на своей поверхности белки (вирусы и антитела);
• сенсибилизация танизированных эритроцитов вирусами или антителами.
Методика постановки РНГА для обнаружения и определения титра антител заключается в следующем:
• к последовательным 2-кратным разведениям сыворотки добавляют равные дозы эритроцитов, сенсибилизированных антигеном;
• смесь оставляют на 2—3 ч при комнатной температуре или на 16—18 ч при 4 °С;
• учитывают результаты. Если в сыворотке содержатся антитела к вирусу, которым были сенсибилизированы эритроциты, наблюдают гемагглютинацию, которую оценивают в крестах.
РНГА позволяет решать следующие диагностические задачи:
• обнаружить антитела и определить их титр в сыворотке крови с помощью известного эритроцитарного антигенного диагностикума;
• обнаружить и идентифицировать неизвестный вирус с помощью известного эритроцитарного антительного диагностикума.
Достоинства РНГА: высокая чувствительность, простота техники постановки и быстрота ответа. Однако важно отметить, что возникают большие трудности в приготовлении стабильных эритроцитарных диагностикумов (большая зависимость от чистоты используемых компонентов, необходимость подбора режима фиксации, танизации и сенсибилизации эритроцитов для каждого вида вируса). [6]
4.Реакция связывания комплемента (РСК)
Это — одна из традиционных серологических реакций, применяемых для диагностики многих вирусных болезней.
Само название в значительной мере отражает суть метода, состоящего из двух отдельных этапов. На первом этапе участвуют антиген и антитело (один из этих ингредиентов заранее известен), а также определенное количество предварительно оттитрованного комплемента. При соответствии антигена и антитела их комплекс связывает комплемент, что выявляют на втором этапе с помощью индикаторной системы (смесь бараньих эритроцитов и антисыворотки к ним — гемолизина). Если комплемент связался при взаимодействии антигена и антитела, то лизиса эритроцитов не происходит (положительная РСК). При отрицательной РСК несвязанный комплемент способствует гемолизу эритроцитов. РСК часто используют в диагностической практике для обнаружения и идентификации вирусов, обнаружения и титрования антител в сыворотках крови.
Основными компонентами РСК служат антигены (известные или выявляемые), антитела (известные антисыворотки или исследуемые сыворотки), комплемент (сыворотка крови морской свинки), гемолитическая сыворотка и эритроциты барана; в качестве разбавителя используют изотонический раствор натрия хлорида (pH 7,2—7,4) или различные буферные растворы. [2]
5.Реакция диффузионной преципитации в геле (РДП)
Основана на способности к диффузии в гелях антител и растворимых антигенов.
Для создания условий диффузии в слое агара делают лунки, в которые заливают компоненты. Количество и взаимное расположение лунок зависит от решаемой задачи.
РДП позволяет решить следующие диагностические задачи:
обнаружить и идентифицировать неизвестный выделенный вирус путем исследования его с различными заведомо известными сыворотками (антителами);
обнаружить и определить титр антител в сыворотках с помощью известного антигена.
РДП может быть поставлена в чашках Петри (макрометод) и на предметных стеклах (микрометод).
Методика постановки макрометода по технике принципиально не отличается от постановки микрометода, только в этом случае в чашку Петри наливают 20—25 мл расплавленного агара и в застывшем геле делают лунки диаметром 5—6 мм по специальной схеме (расстояние между лунками 4—5 мм ) и вносят соответствующие компоненты.
При постановке РДП на предметных стеклах препарат можно через 48—72 ч высушить и окрасить раствором амидного черного, что позволит его сохранить и сфотографировать.
Достоинства РДП: простота техники постановки; быстрота получения ответа; не требует стерильной работы, особой чистоты компонентов; возможность документирования результата путем фотографирования. Недостаток РДП — низкая чувствительность. [7]
6.Реакция торможения гемадсорбции (РТГАд)
Эту реакцию используют в том случае, если вирус обладает гемадсорбирующими свойствами. Гемадсорбцией называется адсорбция (прилипание) эритроцитов к поверхности клеток, зараженных вирусом.
Чтобы наблюдать гемадсорбцию, из пробирки с зараженной вирусом культурой клеток удаляют культуральную жидкость и вносят 0,5%-ную взвесь эритроцитов, оставляют на 5—10 мин, затем слой клеток споласкивают физиологическим раствором (чтобы смыть эритроциты). Если в зараженной культуре клеток идет репродукция вируса, то на таких клетках под малым увеличением микроскопа можно видеть адсорбировавшие эритроциты, в контрольных (незараженных) культурах клеток таковые отсутствуют.
РТГАд основана на торможении гемадсорбции, если зараженную вирусом культуру клеток предварительно обработать специфической сывороткой (содержащей антитела к этому вирусу).
Методика постановки РТГАд заключается в следующем: на 3—7-й день после заражения культур клеток из них удаляют питательную среду, промывают клетки раствором Хенкса и вносят в каждые 4 пробирки по 0,5 мл специфической к вирусу ПГ-3 сыворотки в разведении 1:10;
пробирки в наклонном положении оставляют при комнатной температуре на 30 мин (для контакта клеток с антителами);
во все пробирки вносят по 1 мл 0,5%-ной взвеси эритроцитов морской свинки;
через 30 мин — учет результатов. Отсутствие гемадсорбции в пробирках со специфической сывороткой и проявление ее в пробирках с зараженной культурой клеток, но не обработанной специфической сывороткой, свидетельствует о наличии вируса ПГ-3 в культуре клеток.
Чаще всего РТГАд применяют для идентификации вируса и редко для обнаружения и титрования антител. [4]
7.Реакция иммунофлуоресценции (РИФ)
При данном методе используют явление люминесценции.
В РИФ люминесценция проявляется в виде флуоресценции — это свечение, возникающее в момент облучения возбуждающим светом и прекращающееся сразу после его окончания.
Для возбуждения флуоресценции при люминесцентной микроскопии чаще всего используют ультрафиолетовую или сине-фиолетовую часть спектра (длина волны 300—460 нм).
Метод РИФ заключается в том, что антитела, соединенные с флуорохромом, сохраняют способность вступать в специфическую связь с гомологичным антигеном. Образующийся комплекс антиген + антитело в связи с присутствием в нем флуорохрома обнаруживают под люминесцентным микроскопом по характерному свечению.
Для получения антител используют высокоактивные гипериммунные сыворотки, из которых выделяют антитела и метят их флуорохромом. В качестве флуорохрома наиболее часто используют ФИТЦ-флуоресцеин изотиоционат (зеленое свечение) и РСХ-родамин сульфохлорид (красное свечение). Антитела, меченные флуорохромом, называют конъюгатом. [3]
Методика приготовления и окрашивания препаратов заключается в следующем:
• готовят на предметных стеклах мазки, отпечатки из органов или на покровных стеклах — инфицированную культуру клеток; можно использовать и гистосрезы;
• препараты подсушивают на воздухе и фиксируют в охлажденном ацетоне при комнатной температуре или при минус 15 °С (от 15 мин до 4—16 ч);
• окрашивают по прямому или непрямому методу; ведут учет под люминесцентным микроскопом по интенсивности свечения, оцениваемому в крестах.
Параллельно готовят и окрашивают препараты от здорового животного — контроль.
Различают два основных метода применения флуоресцирующих антител: прямой и непрямой.
Прямой метод (одноступенчатый). На фиксированный препарат наносят конъюгат (флуоресцирующую сыворотку к предполагаемому вирусу), выдерживают 30 мин при температуре 37 °С во влажной камере. Затем препарат отмывают от несвязанного конъюгата физиологическим раствором (pH 7,2 — 7,5), подсушивают на воздухе, наносят нефлуоресцирующее масло и исследуют под микроскопом.
Прямой метод позволяет обнаружить и идентифицировать антиген. Для этого нужно иметь на каждый вирус флуоресцирующую сыворотку.
Непрямой метод (двухступенчатый). На фиксированный препарат наносят немеченую сыворотку, содержащую антитела к предполагаемому вирусу, выдерживают 30 мин при 37 °С, отмывают несвязанные антитела. На препарат наносят флуоресцирующую антивидовую сыворотку, соответствующую виду животного — продуцента гомологичных противовирусных антител, выдерживают 30 мин при 37 °С. Затем препарат отмывают от несвязанных меченых антител, подсушивают на воздухе, наносят нефлуоресцирующее масло и исследуют под люминесцентным микроскопом.
Непрямой метод позволяет не только обнаружить и идентифицировать антиген, но и выявить и определить титр антител. Кроме того, этим методом можно обнаруживать одной меченой сывороткой антигены различных вирусов.
Разработаны несколько модификаций непрямого метода. Наибольшего внимания заслуживает метод с использованием комплемента. Метод заключается в том, что на фиксированный препарат наносят инактивированную нефлуоресцирующую специфическую сыворотку и комплемент морской свинки, выдерживают 30 мин при 37 °С, промывают, и для выявления комплекса антиген + антитело + комплемент наносят флуоресцирующую антикомплементарную сыворотку, выдерживают 30 мин при 37 °С, промывают, подсушивают на воздухе и исследуют под люминесцентным микроскопом.
Достоинства РИФ: высокая специфичность и чувствительность; простота техники постановки; требуется минимальное количество компонентов. Это экспресс-метод диагностики, так как в течение нескольких часов можно получить ответ. К недостаткам можно отнести субъективизм в оценке интенсивности свечения и, к сожалению, иногда флуоресцирующие сыворотки бывают плохого качества. В настоящее время РИФ широко применяют в диагностике вирусных болезней животных. [5]
Библиографический список
2. Широбоков В. П. Медицинская микробиология, вирусология и иммунология [Текст] : учебник для студ. высш. мед. учеб. заведений. – М. : Винница Нова Книга, 2015. – 262 с.
4. В. А. Подколзина, А. А. Седов Медицинская микробиология[Текст]: конспект лекций для вузов. – М.: Приор-издат, 2007. – 14с.
5. Павлович С. А. Микробиология с вирусологией и иммунологией [Текст] : учеб. пособие / Павлович С. А. – 3-е изд., испр. – Минск: Выш. шк., 2013. – 388 с.
6. Донецкая Э.Г.-А. Клиническая микробиология [Текст] : Руководство для специалистов клинической лабораторной диагностики. — М. : ГЭОТАРМедиа, 2011. — 57 с.
7. Кишкун А. А. Клиническая лабораторная диагностика [Текст]: учеб. пособие. – М.: ГЭОТАР-Медиа, 2010. – 807 с.