Что такое система ti rads
Обновлённые критерии TI-RADS — диагностика узловых поражений щитовидной железы
Узловые поражения щитовидной железы широко распространены: у примерно 1/3 взрослого населения на УЗИ обнаруживаются узловые поражения щитовидной железы. Однако менее 10% из них являются злокачественными. УЗИ высокого разрешения является методом первой линии для выявления и оценки узловых поражений щитовидной железы. Всё возрастающее число проводимых УЗИ-исследований и важность их результатов в дальнейшей тактике ведения больного обусловили потребность в наличии единой терминологии, которая позволила бы УЗИ-специалистам и клиницистам лучше понимать друг друга, а также единой системы классификации найденных узловых поражений, на основе которой можно было бы оценить вероятность злокачественности находок и тактику их дальнейшего ведения.
В 2009 году Eleonora Horvath с соавторами опубликовали результаты 8-летнего проспективного трехэтапного исследования, целью которого было создание такой единой УЗИ-классификации. Авторы проанализировали УЗИ-картины в общей сложности 1959 пациентов с узловыми поражениями щитовидной железы. Всем пациентам была проведена тонкоигольная аспирационная биопсия, а затем проанализирована корреляция результатов цитологического и гистологического исследования и найденных УЗИ-критериев.
На основе этих данных была создана классификация TI-RADS (Thyroid Imaging Reporting and Data System). В 2011 году Jin Young Kwak с соавторами предложили более простую в использовании модель, основанную на подсчете количества подозрительных ультразвуковых признаков. Эта модель была названа К-TIRADS (Korean Thyroid Imaging Reporting and Data System).В настоящий момент в клинической практике применяются несколько модификаций TI-RADS: чилийская, украинская, корейская и французская. Эти модификации не имеют принципиальных отличий.
По результатам проведенного Xi Wei (Head Neck, июнь 2016) метаанализа TI-RADS, чувствительность и специфичность этого диагностического инструмента составили 0,79 и 0,71 соответственно; это указывает на то, что категории TI-RADS являются перспективным инструментом для оценки доброкачественных и злокачественных узлов щитовидной железы и для принятия решения о дальнейшей биопсии. Стоит заметить, что TI-RADS не является единственной классификацией узловых поражений ЩЖ. Специалисты УЗИ используют также шкалы, разработанные Американской (American Thyroid Association (АTA), Statement on Preoperative Imaging for Thyroid Cancer Surgery, 2014) и Британской (British Thyroid Association (BTA), Ultrasound assessment of thyroid nodules, 2014) Тиреоидными Ассоциациями. Однако, на сегодняшний день TI-RADS и её различные модификации являются самыми популярными.
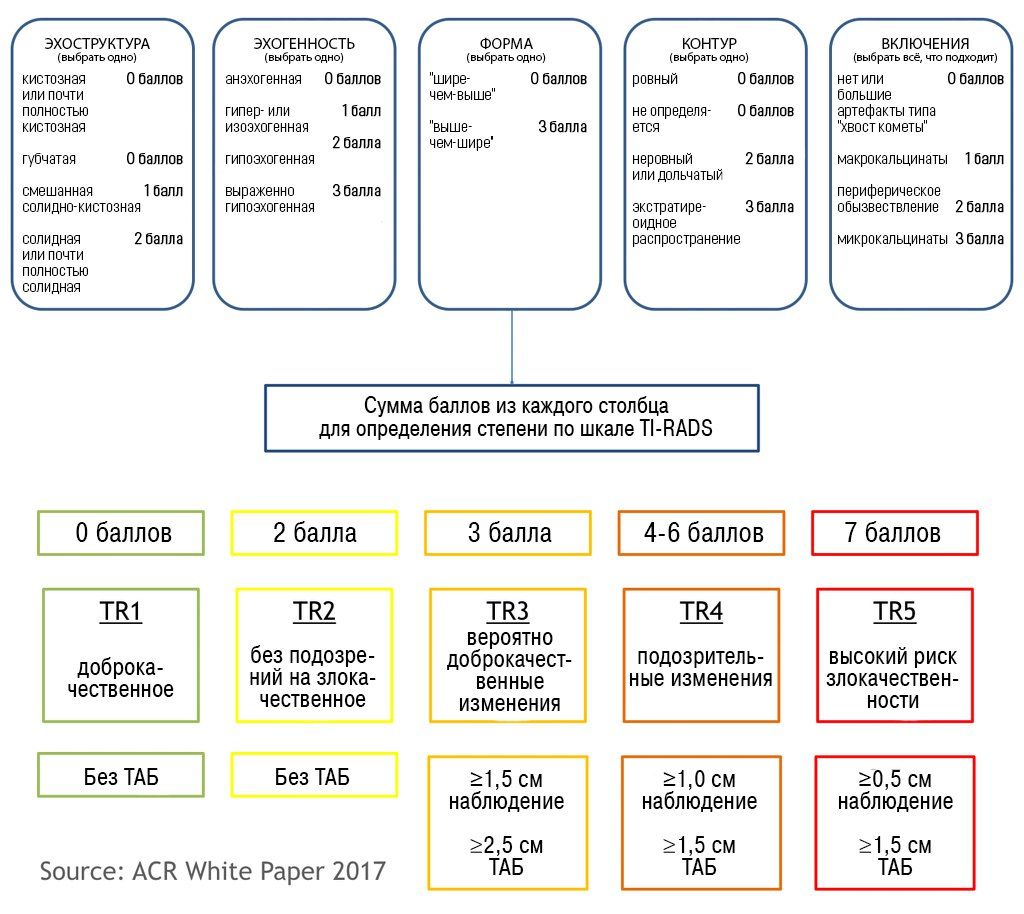
В марте 2017 года Journal of American College of Radiology опубликовал новую версию TI-RADS (ACR TI-RADS) и рекомендации к ее использованию. Еще более упрощенная, новая схема подразумевает, что каждому приведенному признаку будет присвоено определенное количество баллов, а затем по результатам подсчета найденное образование можно будет отнести к одной из существующих категорий. Для разработки новых рекомендаций были использованы данные литературы, результаты программы SEER (Surveillance, Epidemiology, and End Results) Национального Института Рака США и оценка существующих классификационных систем.
По заявлению Комитета TI-RADS, новые критерии должны:
снизить количество проводимых биопсий узловых образований ЩЖ с низким риском злокачественности;
давать возможность оценить все возможные узловые образования;
базироваться на уже разработанном лексиконе;
быть простыми в применении специалистами УЗИ-диагностики.
ACR TI-RADS согласуется с большинством других рекомендаций, предписывающих биопсию для образований высокого риска размером 1 см и более. Однако, порог для образований среднего и умеренного риска (2,5 и 1,5 см соответственно) выше, чем рекомендованые ATA и Korean Society of Thyroid Radiology. Последние ссылаются на исследование Machens с соавт., которое показало, что совокупный риск отдаленных метастазов от сосочкового и фолликулярного рака щитовидной железы существенно возрастал при размере образования 2 и более см. По утверждению авторов TI-RADS, они опирались на собственную интерпретацию данных этого исследования и отметили постепенное нарастание рисков, которое начиналось с большего размера узла. Немаловажно также и то, что Machens и др. основывали свой анализ на размере опухоли при патологоанатомическом исследовании, а не на параметрах, измеренных при УЗИ — а эти данные могут значительно отличаться. Исключение может быть сделано для узловых образований категории TR5 размерами 5‒9 мм.
Авторы рекомендуют определять эхоструктуру образования как губчатую только в том случае, если оно более чем на 50% состоит из небольших кистозных включений. В новой классификации понятия преимущественно солидного и преимущественно кистозного образования объединены в графу смешанного образования, так как само появление солидного компонента оказалось более прогностически важным, чем соотношение. Кроме того, хотя определение кровотока во включении с помощью доплеровского картирования не вошло в критерии новой классификации, авторы рекомендуют использовать его, чтобы отличить истинно солидный компонент от включений и кровоизлияния.
Наличие или отсутствие гидрофильной границы (HALO) также было опущено в новой версии TI-RADS. Зато появился термин «границы плохо определяются». Это нововведение позволит классифицировать большее количество образований. Термин «неровный дольчатый край» включает в себя зубчатые края, с или без протрузии в окружающую паренхиму. Могут возникнуть трудности с распознанием данного критерия, если контур не определяется, если эхогенность окружающей узел ткани ЩЖ гетерогенна или если узловых образований много и они «упираются» краями друг в друга. Выход контура образования за пределы железы обычно классифицируют при описании как обширный или минимальный. Обширное экстратиреоидное расширение, которое характеризуется выраженным прорастанием в смежные мягкие ткани и/или сосудистые структуры, является очень надёжным признаком злокачественности и неблагоприятным прогностическим фактором. Минимальное экстратиреоидное распространение может быть заподозрено по выпучиванию контура железы или снижению его эхогенности в месте образования, однако прогностическая ценность этого критерия дискутабельна. Авторы рекомендуют с осторожностью определять минимальное экстратиреоидное распространение, особенно если образование доброкачественно по другим критериям.
В случае если не удаётся оценить внутреннюю структуру образования из-за кальцификатов, дающих сильные акустические тени, авторы рекомендуют считать их солидными. Примечательно, что небольшие эхогенные включения, обнаруживаемые в губчатых узлах, чаще всего представляют собой задние стенки мелких кист. Такие включения не должны учитываться при подсчете баллов. В протоколе исследования следует особо указывать на локализацию образования в критических местах — если узел расположен близко к трахее или к борозде возвратного нерва. Важной частью протокола УЗИ является сонографическая оценка шейных лимфоузлов. Если пациенту ранее проводились оперативные вмешательства и/или биопсии ЩЖ, это также должно быть указано в протоколе.
Что касается сроков наблюдения, комитет TI-RADS рекомендует для категории TR5 обследования каждый год последующие 5 лет. Для TR4 сканирование должно проводиться через 1, 2, 3 и 5 лет. Для TR3 последующая визуализация может быть выполнена на 1-й, 3-й, и 5-й год. Наблюдение можно прекращать через 5 лет, если УЗИ-картина остается без изменений. Следует помнить, что данные критерии носят рекомендательный характер, и решение о дальнейшей биопсии и/или оперативном вмешательстве выносит клиницист после обсуждения тактики с пациентом, при этом учитывая многие другие факторы риска для каждого конкретного пациента, включая его семейный анамнез, возраст, пол, сопутствующую патологию и т.д.
Источники
Xu T. et al. Thyroid nodule sizes influence the diagnostic performance of TIRADS and ultrasound patterns of 2015 ATA guidelines: a multicenter retrospective study //Scientific reports. – 2017. – Т. 7. – С. 43183.
Tessler F. N. et al. ACR thyroid imaging, reporting and data system (TI-RADS): white paper of the ACR TI-RADS committee //Journal of the American College of Radiology. – 2017. – Т. 14. – №. 5. – С. 587-595.
Быть или не быть TI-RADS: полемические заметки с Евразийского форума по раку щитовидной железы.
Полный текст:
Аннотация
Приведены тезисы обсуждения экспертами проблемы УЗ-диагностики рака щитовидной железы в формате TI-RADS и цитологических заключений по классификации Bethesda на Евразийском форуме по раку щитовидной железы.
Ключевые слова
Для цитирования:
Борсуков А.В. Быть или не быть TI-RADS: полемические заметки с Евразийского форума по раку щитовидной железы. Эндокринная хирургия. 2016;10(3):33-36. https://doi.org/10.14341/serg2016333-36
For citation:
Borsukov A.V. TI-RADS: to be or not to be. Polemic notes from the Eurasian Forum on thyroid cancer. Endocrine Surgery. 2016;10(3):33-36. (In Russ.) https://doi.org/10.14341/serg2016333-36
Начало октября 2016 г. выдалось очень насыщенным для хирургической эндокринологии. 1–3 октября в Новой Москве на базе санатория “Красная Пахра” проходил российский этап IV Всемирного турне ведущих специалистов Международной федерации обществ по онкологии головы и шеи в рамках Глобальной программы повышения квалификации врачей. Приехали гранды мировой величины, такие как Jatrin P. Shah, Ashok R. Shaha, Claudio R. Cernea, Carol Bradford, Nancy Lee, Lisa Lisitra. Представительной выглядела и делегация из России: академик РАН Поляков В.Г., член-корр. РАН Решетов И.В., профессора и д.м.н.: Шевченко С.П., Кондратьева Т.Т., Ванушко В.Э., Абросимов А.Д., Сельчук В.Д., Александров Ю.К., Бржезовский В.Ж., Фисенко Е.П., Иванов Р.В., Крылов В.В., Паршин В.С., Романчишин А.Р., Шолохов В.Н. и многие другие.
Главным организатором мероприятия был основатель и директор Евразийской федерации онкологии Субраманиан Сомасундаран, за что ему огромное спасибо!
В рамках глобального турне специалистов по онкологическим заболеваниям головы и шеи проходил Евразийский форум по раку щитовидной железы. Среди большого количества крайне интересных научных секций для меня, как специалиста по лучевой диагностике, наиболее важна была панельная дискуссия экспертов по вопросам онковизуализации заболеваний щитовидной железы. Публикуя краткие заметки о мультидисциплинарной дискуссии между хирургами, эндокринологами, патоморфологами/цитологами и врачами-диагностами, я хотел бы перенести эту дискуссию на страницы журнала “Эндокринная хирургия”. Затрагивалось много проблем, но хотелось бы заострить внимание на одной: быть или не быть ультразвуковой стандартизированной классификации TI-RADS. Чтобы было понятнее, от чего эксперты отталкивались, приведу наиболее распространенную систему TI-RADS в удобном табличном формате (табл. 1).
Подозрительные признаки оценивают только в солидных очагах:
Мы сделали попытку систематизировать доводы “за” и “против” применения системы TI-RADS (табл. 2).
Таблица 2. TI-RADS: pro et contra
Однако дискуссия быстро вышла за рамки только этих вопросов. Вначале для всех экспертов профессором Ю.К. Александровым (Медицинский университет, Ярославль) была продемонстрирована короткая презентация о диагностических возможностях систем TI-RADS и Bethesda. Юрий Константинович наглядно показал их взаимосвязь с более ранним выявлением рака щитовидной железы. Им был высказан тезис о том, что система TI-RADS нужна и создана в первую очередь для эндокринологов. Это позволит сократить время обследования врачом пациента и даст возможность эндокринологу провести анализ не только клинических, но и инструментальных данных. Интерес экспертов вызвала серия слайдов, где Ю.К. Александров продемонстрировал результаты психологического опроса эндокринологов, указав на резкий дефицит времени для осмысления результатов визуализирующих методик обследования щитовидной железы.
Оппонентом Ю.К. Александрова выступила профессор Елена Полиектовна Фисенко (РНЦХ, Москва). Она заявила, что система TI-RADS в первую очередь ориентирована на врачей ультразвуковой диагностики для возможности улучшения кооперации среди специалистов различных ЛПУ. Она сообщила, что создана рабочая группа по адаптации системы TI-RADS для России с разработкой градаций ультразвуковых признаков, позволяющих уточнить показания к биопсии и сроки мониторинга не только узлового зоба и рака щитовидной железы, но и очагов <10 мм в щитовидной железе без клинических проявлений.
Ведущий специалист по патоморфологии/цитологии Татьяна Тихоновна Кондратьева (ОНЦ, Москва) выступила с тезисом о необходимости мультидисциплинарного взаимодействия на платформе TI-RADS – Bethesda. Кооперация различных специалистов требует стандартизации как диагностических, так и морфологических подходов. Татьяна Тихоновна указала на недостатки системы цитологических заключений Bethesda в виде нечетких формулировок по тактике при категориях 3–4, однако, как эксперт она утверждает: необходима единая система подготовки к описанию цитологического предоперационного материала.
Представитель Медицинского радиологического научно-исследовательского центра им. А.Ф. Цыба Петр Иванович Гарбузов указал на значимость новых технологий в визуализации заболеваний щитовидной железы, особенно с учетом патоморфологических изменений патологических зон на фоне лечения радионуклидами.
Яркой страницей дискуссии стало выступление профессора Владимира Эдуардовича Ванушко (Эндокринологический научный центр, Москва). Его главный постулат: все диагностические средства в дифференциальной диагностике заболеваний щитовидной железы, включая рак щитовидной железы, должны стать понятной всем технологией. Эта технология должна предусматривать четкую преемственность в этапах диагностики (от первичной до уточняющей); в сроках мониторинга (до- и постоперативных этапах, единых правилах оценки цитологических данных). Владимиром Эдуардовичем была высказана мысль о низкой воспроизводимости УЗИ и достаточно большом количестве ложноположительных и ложноотрицательных результатов. Вопросов к В.Э. Ванушко было много, так как он представлял авторскую группу Общероссийских рекомендаций по узловому зобу у взрослых (редакция 2015–2016 гг.). На вопрос, почему система BI-RADS не включена в рекомендации, В.Э. Ванушко ответил, что все ультразвуковые признаки, представленные в этой системе, приведены в рекомендациях, однако пока отсутствует единый подход среди врачей лучевой диагностики и эндокринологов о формате самой системы TI-RADS в России. Поэтому включать систему TI-RADS в общероссийский документ, регламентирующий работу врачей всех специальностей по узловому зобу, преждевременно.
Своеобразной второй дискуссионной площадкой по TI-RADS стал семинар по онковизуализации в рамках того же форума по раку щитовидной железы с привлечением большого количества экспертов по ультразвуковой и лучевой диагностике.
Профессор Алексей Васильевич Борсуков (СГМУ, Смоленск) привел основные требования к протоколу УЗИ щитовидной железы и регионарных лимфоузлов, предъявляемые к врачам в Общероссийских рекомендациях по узловому зобу 2015–2016 гг. Докладчиком было указано, что новые методы УЗИ – эластография, эхоконтраст еще не находят должного отклика у радиологов. Ответственность за это лежит и на нас – врачах лучевой диагностики, так как площадок, где встречаются эндокринологи и специалисты по визуализации, недостаточно.
Профессор Владимир Николаевич Шолохов (ОНЦ, Москва) остановился на статистике рака щитовидной железы, диапазоне диагностических возможностей новых ультразвуковых методик. Он подчеркнул, что проблема воспроизводимости УЗИ важна не только для врачей-клиницистов, но и для самих специалистов лучевой диагностики. У нас мало общепризнанных консенсусных критериев оценки изображения. Точнее, даже не столько общепризнанных, сколько общеприменимых критериев с унификацией заключений.
Доктор Екатерина Николаевна Лебедева (Медицинский центр “Медика Менте”, Московская область) и Иван Александрович Тимашков (СГМУ, Смоленск) на клинических примерах ознакомили аудиторию с трудностями УЗИ и новыми возможностями метода ультразвуковой диагностики в оценке эффективности малоинвазивного лечения узлового зоба.
Таким образом, вырисовывается общая картина крайней необходимости единого мультидисциплинарного информационного поля, где приводятся доводы pro и contra относительно диагностических подходов к патологии щитовидной железы. Важна аргументированная критика точек зрения с поиском компромиссного решения, которое направлено на одно – совершенствование диагностики и лечения пациентов. Первым шагом Евразийского форума по раку щитовидной железы стало создание рабочей группы по совершенствованию системы TI-RADS и ее валидации к российским реалиям. Координатором рабочей группы является профессор Е.П. Фисенко (РНЦХ, Москва). Надеемся, что работа консультативной группы будет продуктивной и в 2017 г. начнется общественное обсуждение рабочей версии RU TI-RADS.
О необходимости внедрения классификации TI-RADS в России
Полный текст:
Аннотация
В мировых профессиональных медицинских сообществах продолжается активное обсуждение модификаций системы стратификации признаков злокачественности узлов щитовидной железы TI-RADS (англ. Thyroid Imaging Reporting And Diagnostic System). Система предназначена в первую очередь для отбора узлов для выполнения пункционной биопсии. Классификация должна быть единой для всех медицинских учреждений нашей страны, простой в использовании и понятной для врачей различных специальностей. В статье представлена модификация TI-RADS, подготовленная для обсуждения в профессиональных сообществах России. Выделены “большие” эхопризнаки (специфичность ≥95%), наиболее характерные для рака щитовидной железы, и “малые” признаки (специфичность ≥90%), дополнительные, позволяющие перевести узел из категории TI-RADS 3 в категорию TI-RADS 4 для выполнения пункции. При сравнении показателей диагностической информативности данного варианта TI-RADS с европейским (EU-TIRADS) отмечено, что оба варианта имели одинаковую специфичность – 93%. Отечественный вариант несколько превышал европейский по показателям чувствительности, соответственно 94,2 и 91,0%, что можно объяснить учетом дополнительных “малых” признаков злокачественности, что позволяет рекомендовать к обсуждению в России предложенный отечественными экспертами вариант TI-RADS.
Ключевые слова
Для цитирования:
Фисенко Е.П., Сенча А.Н., Катрич А.Н., Сыч Ю.П., Цветкова Н.В., Борсуков А.В., Костромина Е.В. О необходимости внедрения классификации TI-RADS в России. Клиническая и экспериментальная тиреоидология. 2019;15(2):55-63. https://doi.org/10.14341/ket10115
For citation:
Fisenko E.P., Sencha A.N., Katrich A.N., Sych Yu.P., Tsvetkova N.V., Borsukov A.V., Kostromina E.V. Оn the need to introduce the TI-RADS classification in Russia. Clinical and experimental thyroidology. 2019;15(2):55-63. (In Russ.) https://doi.org/10.14341/ket10115
Система стратификации признаков злокачественности узлов ЩЖ TI-RADS должна быть проста в применении и понятна не только специалистам, выполняющим пункционную биопсию узлов ЩЖ, но и тем врачам первичного звена (в первую очередь специалистам ультразвуковой диагностики), которые чаще первыми дифференцируют очаговые изменения ЩЖ и должны решить вопрос о передаче пациента в службы (специалистам-клиницистам), непосредственно занимающиеся морфологической оценкой и определением дальнейшей тактики ведения пациента. На это в очередной раз обращено внимание в последних предложенных вариантах TI-RADS американскими и европейскими коллегами [1, 2].
Система TI-RADS также предполагает стандартизацию обмена медицинской информацией между врачами-клиницистами (эндокринологами, хирургами) и специалистами ультразвуковой диагностики, что требует более быстрой валидации данной системы в РФ с закреплением этого в клинических рекомендациях для двух специальностей: эндокринологии и ультразвуковой диагностики.
Дифференцировка узлов ЩЖ часто проводится не столько по наличию основных признаков злокачественности (раки), сколько по их отсутствию (доброкачественные образования) [3, 4]. Однако хорошо известно, что рак щитовидной железы (РЩЖ) имеет много “масок” (клинических, ультразвуковых, цитологических) и часто имитирует доброкачественную природу узла.
Набор эхопризнаков, наиболее часто встречающихся при РЩЖ при мультипараметрическом УЗИ, практически совпадает в большинстве литературных источников [5–10], что представлено и в Российских клинических рекомендациях по диагностике и лечению высокодифференцированного РЩЖ у взрослых (2017) [11]:
– снижение эхогенности узла;
– вертикальная пространственная (или непараллельная) ориентация узла или “размеры выше больше, чем шире”;
– наличие микрокальцинатов в узле;
– неровные (мелкодольчатые, звездчатые, лучистые) и нечеткие контуры.
Эти признаки являются высокоспецифичными (таблица), что подтверждается многочисленными исследованиями, в том числе метаанализом [5, 9, 10, 12–20].
Таблица. Показатели специфичности эхографических признаков злокачественности в узлах щитовидной железы по данным различных авторов
Автор
УЗ-признак
Неровный контур
Вертикальная ориентация
Снижение эхогенности
Микрокальцинаты
В работах последних лет обращено внимание, что признак “понижение эхогенности” узлов ЩЖ следует подразделять на “умеренное” и “значительно сниженное” [1, 2]. При этом специфичность признака “выраженное снижение эхогенности” значительно превышает “умеренное снижение эхогенности” узла в диагностике РЩЖ [19, 20].
Наибольшие разногласия возникают при обсуждении термина “нечеткие границы” узла, что связано с субъективной оценкой врача-оператора. Известно, что доброкачественные гиперпластические процессы, представленные узловыми образованиями, часто не имеют капсулы, в связи с чем четкость их контуров тем хуже определяется, чем меньше размер очага [14, 20, 21], что приводит к гипердиагностике инвазивных процессов. Использование высокочастотных датчиков (12–18 МГц) позволяет определить микродольчатость, лучистость/игольчатость/звездчатость инфильтрирующих краев опухоли, что более важно для проведения дифференциально-диагностического процесса [1, 20].
Основные противоречия представленных в литературе модификаций TI-RADS сводятся к распределению узлов в категориях Т3 и Т4, Т5. В первой группе более ранних вариантов TI-RADS в категорию Т3 предложено определять узлы без перечисленных выше признаков злокачественности, соответственно начиная с Т4 – с признаками злокачественности [5–9]. Пункцию предложено выполнять и в категории Т3 (однако не представлены критерии отбора узлов для пункции в данной категории), и в категориях Т4, Т5. Распределение узлов в Т4 и Т5 определяется количеством выявленных признаков злокачественности. При этом Т4 подразделяется на подкатегории (2 или 3).
Во второй группе вариантов TI-RADS предложено отказаться от подразделения Т4 на подкатегории, что значительно облегчает работу. Разделение на категории преимущественно идет по характеру их эхогенности [1, 2].
В нашей стране также продолжается обсуждение классификации TI-RADS. Выделены ультразвуковые признаки, по которым происходит отбор узлов из категории Т3 (изо- или гиперэхогенных) в Т4 для пункции (согласно логике системы BI-RADS, а именно она взята в основу TI-RADS [22], узел, требующий выполнения биопсии, из Т3 (категория для динамического наблюдения узлов) должен быть перенесен в категорию Т4). Основными критериями в этом случае для узлов ЩЖ являются следующие “малые” ультразвуковые признаки злокачественности, полученные в В-режиме [19, 23, 24]:
– умеренное снижение эхогенности или неравномерная эхогенность узла (наличие гипоэхогенных включений);
– округлая форма узла;
– неравномерной толщины хало вокруг узла;
– наличие макрокальцинатов в узле.
Таким образом, появление этих признаков в гипер- или изоэхогенных узлах указывает на необходимость их морфологической оценки, т.е. перевода в категорию Т4 для выполнения пункционной биопсии.
К “малым” признакам отнесены также патологический интранодулярный сосудистый рисунок (по результатам применения цветокодированных режимов) и высокая жесткость узла (по результатам применения количественных и качественных параметров ультразвуковой эластографии). Эти методики широко внедряются в мировой ультразвуковой диагностике, однако на настоящий момент для оценки узлов ЩЖ являются дополнительными [23, 25]. При наличии соответствующей аппаратуры эти признаки могут быть определены как на этапе первичного диагностического поиска, так и на этапе непосредственного решения вопроса о выполнении биопсии при использовании оборудования высокого или экспертного класса.
Суммируя вышесказанное, мы предлагаем на страницах журнала обсудить возможный вариант TI-RADS, приемлемый для всех служб в нашей стране, и, возможно, сформировать общие рекомендации.
Проект TI-RADS
TI-RADS 1. Нет очаговых изменений в паренхиме ЩЖ.
TI-RADS 2. Очаговые образования, не требующие морфологической оценки (макрофолликулы; губчатые или кистозные узлы), представленные на рис. 1.
TI-RADS 3. Очаговые структуры, требующие динамического наблюдения без выполнения биопсии (гипер- или изоэхогенные образования с ровными контурами, в том числе на фоне аутоиммунного тиреоидита; кальцинированные узлы по типу “яичной скорлупы”) (рис. 2).
Пункция в категории TI-RADS 3 возможна по настоянию пациента или при наличии клинической необходимости по рекомендации лечащего врача.
При отрицательной динамике в процессе выполнения динамического мониторинга предполагается перевод в категорию TI-RADS 4 узлов, которые за 6–12 мес наблюдения значительно изменили свои характеристики в В-режиме:
– увеличились размеры узла (объем увеличился более чем на 30%);
– узлы приобрели шаровидную форму, появились кальцинаты, деформация капсулы узла (и/или капсулы ЩЖ);
– появились патологически измененные лимфатические узлы шеи, не выявляемые ранее.
Все гипоэхогенные узлы предлагается отнести в категории 4 и 5.
Рис. 1. Категория TI-RADS 2: а – кистозно расширенный или макрофолликул; б – губчатый узел (стрелки).
Рис. 2. Категория TI-RADS 3: а – изоэхогенный очаг (стрелки), окруженный тонким хало (узловой зоб); б – гиперэхогенный очаг округлой формы, с четкими контурами, тонким гипоэхогенным ободком на фоне аутоиммунного тиреоидита; в – кальцинированный узел по типу “яичной скорлупы”.
TI-RADS 4. Узлы более 1,0 см в диаметре с “малыми” признаками злокачественности для выполнения ПУНКЦИИ (рис. 3):
– неравномерно утолщенное хало;
Рис. 3. TI-RADS 4: а – узел шаровидной формы, с ровными и четкими контурами, умеренно пониженной эхогенности, с участками более низкого эхо, с макрокальцинатом. Узел окружен тонким хало (фолликулярная неоплазия); б, в, г (поперечное и продольное сканирование левой доли ЩЖ) – изоэхогенные узлы с гипоэхогенными включениями, с четкими контурами, с тонким хало (фолликулярная аденома); д – изоэхогенный узел с гипоэхогенными включениями, с неравномерно утолщенным хало (фолликулярный рак).
TI-RADS 5. Солидные узлы с “большими” признаками злокачественности для выполнения ПУНКЦИИ:
– значительно сниженная эхогенность;
– вертикальная пространственная ориентация образования;
– неровный контур образования: бугристый, микродольчатый, лучистый;
– наличие в опухоли микрокальцинатов;
Рис. 4. TI-RADS 5. Узлы ЩЖ размером >1,0 см (папиллярные раки): а, б – узлы значительно пониженной эхогенности с микрокальцинатами, с неровными микродольчатыми контурами; в – узел вертикальной пространственной ориентации, с нечеткими, неровными контурами, значительно сниженной эхогенности, с множественными микрокальцинатами; г – узел с микродольчатыми нечеткими контурами, неравномерно пониженной эхогенности, с микрокальцинатами; д – узел значительно пониженной эхогенности, вертикальной пространственной ориентации, с нечеткими, неровными (лучистыми) контурами; е – узел с нечеткими контурами, с множественными микрокальцинатами.
При наличии измененных лимфатических узлов (шаровидная форма, исчезновение дифференцировки внутренних структур, кистозные изменения, кальцинаты) к указанию категории ТI-RADS целесообразно в заключении добавлять “ЛИМФАДЕНОПАТИЯ”. На основании заключения ультразвукового исследования и клинико-лабораторных данных врач-эндокринолог принимает окончательное решение о необходимости выполнения пункционной биопсии узла ЩЖ и измененных лимфатических узлов шеи.
Представленный вариант модификации TI-RADS наиболее близок к европейскому варианту [1]. Для работы в условиях нашей страны менее приемлемыми представляются варианты TI-RADS, предлагающие присвоение баллов каждому ультразвуковому признаку, с дальнейшим распределением узлов по категориям TI-RADS в зависимости от суммы баллов [2, 9].
Группой авторов проведено пилотное исследование по оценке воспроизводимости европейского варианта системы ТI-RADS и варианта, предложенного группой отечественных авторов, при помощи критерия Кохрейна [26]. Доля совпадений результатов (когда разные исследователи относили один и тот же узел к одинаковой категории) составила 79%, коэффициент Кохрейна составил 03–05 (p < 0,001), что свидетельствует о хорошей воспроизводимости данного метода оценки злокачественного потенциала узлов ЩЖ разными операторами.
Оба варианта TI-RADS имели одинаковую специфичность – 93%. Отечественный вариант несколько превышал европейский по показателям чувствительности: 94,2 против 91,0% соответственно, что можно объяснить учетом большего количества “малых” признаков злокачественности. Нам представляется важным обратить внимание на эти признаки. В ряде работ показано, что в 13,4% случаев в раковых узлах ЩЖ не удается выявить ни одного “большого” признака злокачественности; в 10,1% случаев выявляется только один “большой” признак рака; в 25,6% случаев определяется сочетание одного “большого” признака с несколькими “малыми”; в 13% случаев удается дифференцировать только “малые” признаки злокачественности [21, 27].
“Малые” признаки чаще возникают в узлах, приближающихся к 2,0 см в диаметре [21]. В настоящее время мы оперируем размерами узлов до 1,0 см и свыше 1,0 см, согласно ряду российских клинических рекомендаций [11, 28]. В последних западных вариантах TI-RADS размеры узлов разделяют от 0,5; 1,0; 1,5; 2,0 см и более [1, 2]. Возможно, нам также следует рассмотреть данные модификации.
Заключение
Мы предлагаем провести широкое обсуждение предложенного варианта классификации TI-RADS для его дальнейшей оптимизации и приемлемой стандартизации в обозримом будущем. Наш подход обусловлен желанием сблизить позиции отечественных специалистов ультразвуковой диагностики и российских эндокринологов. Переход на единую информационную диагностическую площадку этих двух специальностей, надеемся, будет положительно влиять на конечные показатели результатов ведения пациентов с узловыми новообразованиями ЩЖ.
Дополнительная информация
Источник финансирования. Работа выполнена без привлечения внешних источников финансирования на личные средства авторов.
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с публикацией настоящей статьи.
Участие авторов: Фисенко Е.П. – концепция и инициатива создания публикации, анализ материалов, написание текста; Сыч Ю.П. – сбор и обработка материалов, анализ материалов, написание текста; Сенча А.Н. – сбор и анализ материалов, редактирование текста; Катрич А.Н. – сбор и анализ материалов, редактирование текста; Цветкова Н.В. – сбор и анализ материалов, редактирование текста; Борсуков А.В. – сбор и анализ материалов, редактирование текста; Костромина Е.В. – сбор и анализ материалов, редактирование текста. Все авторы внесли существенный вклад в проведение поисково-аналитической работы и подготовку статьи, прочли и одобрили итоговую версию до публикации.
Благодарности. Коллектив авторов выражает искреннюю благодарность коллегам, принявшим активное участие в обсуждении и подготовке материалов статьи: профессору кафедры ультразвуковой диагностики ФГБОУ ДПО РМАНПО Заболоцкой Наталье Владленовне, заведующей отделением ультразвуковой диагностики ФГБУ “НМИЦ эндокринологии” Минздрава России Солдатовой Татьяне Васильевне, заведующей отделением ультразвуковой диагностики НИИ клинической и экспериментальной радиологии ФГБУ “НМИЦ онкологии им. Н.Н. Блохина” Минздрава России, профессору Синюковой Галине Тимофеевне, старшему научному сотруднику НИИ клинической и экспериментальной радиологии ФГБУ “НМИЦ онкологии им. Н.Н. Блохина” Минздрава России Данзановой Татьяне Юрьевне, врачу отделения лучевой диагностики ФБУ здравоохранения “Центральная медико-санитарная часть № 141” ФМБА России, г. Удомля Тверской области, Пищугиной Алене Владимировне.