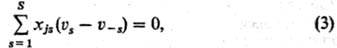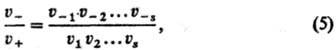Что такое сложная реакция
Сложные реакции
Полезное
Смотреть что такое «Сложные реакции» в других словарях:
СЛОЖНЫЕ РЕАКЦИИ — химические реакции, в которых конечные продукты получаются из исходных через промежуточные вещества. Образование каждого из промежуточных веществ называется элементарной стадией сложной реакции. К сложным реакциям относятся, напр., цепные реакции … Большой Энциклопедический словарь
сложные реакции — – реакции, представляющие собой совокупность простых реакций. Общая химия : учебник / А. В. Жолнин [1] … Химические термины
сложные реакции — химические реакции, в которых конечные продукты получаются из исходных через промежуточные вещества. Образование каждого из промежуточных веществ называется элементарной стадией сложных реакций. К сложным реакциям относятся, например, цепные… … Энциклопедический словарь
сложные реакции — sudėtingosios reakcijos statusas T sritis chemija apibrėžtis Bendras grįžtamųjų, daugiapakopių, lygiagrečiųjų, grandininių reakcijų pavadinimas. atitikmenys: angl. complex reactions; composite reactions rus. сложные реакции … Chemijos terminų aiškinamasis žodynas
СЛОЖНЫЕ РЕАКЦИИ — Хим. р ция реализуется как совокупность множества дискретных актов хим. превращения, в каждом из к рых участвует лишь одна или небольшое число частиц (молекул, атомов, ионов). Если среди актов р ции имеются химически различающиеся, то р ция наз.… … Химическая энциклопедия
СЛОЖНЫЕ РЕАКЦИИ — хим. реакции, в к рых конечные продукты получаются из исходных через промежуточные в ва. Образование каждого из промежуточных в в наз. элементарной стадией С. р. К С. р. относятся, напр., цепные реакции, большинство органич. реакций … Естествознание. Энциклопедический словарь
Реакции химические — превращения одних веществ в другие, отличные от исходных по химическому составу или строению. Общее число атомов каждого данного элемента, а также сами химические элементы, составляющие вещества, остаются в Р. х. неизмененными; этим Р. х … Большая советская энциклопедия
РЕАКЦИИ ХИМИЧЕСКИЕ — (от лат. re приставка, означающая обратное действие, и actio действие), превращения одних в в (исходных соед.) в другие (продукты р ции) при неизменяемости ядер атомов (в отличие от ядерных реакций). Исходные соединения в Р. х. иногда наз.… … Химическая энциклопедия
РЕАКЦИИ — (1) связей силы воздействия тел на точки механической системы, в которых стесняется свобода её движения. Р. связей возникают (согласно закону Ньютона) как пассивные силы противодействия при наличии активных сил, действующих на механические связи… … Большая политехническая энциклопедия
СЛОЖНЫЕ УДОБРЕНИЯ — содержат два или три основных элемента пищи растений (азот, фосфор, калий). С.у. получают смешением удобрений или в результате химической реакции; в последнем случае возможно получение удобрений высококонцентрированных или вовсе не содержащих… … Прудовое рыбоводство
Сложные реакции. Кинетическое изучение сложных реакций



Сложными называют химические реакции, протекающие более чем в одну стадию. Рассмотрим в качестве примера одну из сложных реакций, кинетика и механизм которой хорошо изучены:
Данная реакция является реакцией второго порядка; её кинетическое уравнение имеет следующий вид:
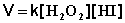
Изучение механизма реакции показало, что она является двухстадийной (протекает в две стадии):
Скорость первой стадии V1 много больше скорости второй стадии V2 и общая скорость реакции определяется скоростью более медленной стадии, называемой поэтому скоростьопределяющей или лимитирующей.
Сделать вывод о том, является реакция элементарной или сложной, можно на основании результатов изучения её кинетики. Реакция является сложной, если экспериментально определенные частные порядки реакции не совпадают с коэффициентами при исходных веществах в стехиометрическом уравнении реакции; частные порядки сложной реакции могут быть дробными либо отрицательными, в кинетическое уравнение сложной реакции могут входить концентрации не только исходных веществ, но и продуктов реакции.
2.1.8 Классификация сложных реакций
Последовательными называются сложные реакции, протекающие таким образом, что вещества, образующиеся в результате одной стадии (т.е. продукты этой стадии), являются исходными веществами для другой стадии. Схематически последовательную реакцию можно изобразить следующим образом:
Число стадий и веществ, принимающих участие в каждой из стадий, может быть различным.
Параллельными называют химические реакции, в которых одни и те же исходные вещества одновременно могут образовывать различные продукты реакции, например, два или более изомера:
Сопряжёнными принято называть сложные реакции, протекающие следующим образом:
причём одна из реакций может протекать самостоятельно, а вторая возможна только при наличии первой. Вещество А, общее для обеих реакций, носит название актор, вещество В –индуктор, вещество D, взаимодействующее с А только при наличии первой реакции –акцептор. Например, бензол в водном растворе не окисляется пероксидом водорода, но при добавлении солей Fe(II) происходит превращение его в фенол и дифенил. Механизм реакции следующий. На первой стадии образуются свободные радикалы:
которые реагируют с ионами Fe 2+ и бензолом:
Fe 2+ + OH• ––> Fe 3+ + OH –
Происходит также рекомбинация радикалов:
Т.о., обе реакции протекают с участием общего промежуточного свободного радикала OH•.
Цепными называют реакции, состоящие из ряда взаимосвязанных стадий, когда частицы, образующиеся в результате каждой стадии, генерируют последующие стадии. Как правило, цепные реакции протекают с участием свободных радикалов. Для всех цепных реакций характерны три типичные стадии, которые мы рассмотрим на примере фотохимической реакции образования хлороводорода.
1. Зарождение цепи (инициация):
Стадия развития цепи характеризуется числом молекул продукта реакции, приходящихся на одну активную частицу – длиной цепи.
3. Обрыв цепи (рекомбинация):
Обрыв цепи возможен также при взаимодействии активных частиц с материалом стенки сосуда, в котором проводится реакция, поэтому скорость цепных реакций может зависеть от материала и даже от формы реакционного сосуда.
Реакция образования хлороводорода является примером неразветвленной цепной реакции – реакции, в которой на одну прореагировавшую активную частицу приходится не более одной вновь возникающей. Разветвленными называют цепные реакции, в которых на каждую прореагировавшую активную частицу приходится более одной вновь возникающей, т.е. число активных частиц в ходе реакции постоянно возрастает. Примером разветвленной цепной реакции является реакция взаимодействия водорода с кислородом:
СЛОЖНЫЕ РЕАКЦИИ
Найдено 7 изображений:
СЛОЖНЫЕ РЕАКЦИИ, такие реакции химические, элементарные акты к-рых различны. В противоположность С. р. элементарные акты простых реакций не отличаются один от другого природой участвующих в них веществ, а лишь, возможно,- направлением превращения, если реакция обратима (в последнем случае нек-рые авторы реакцию также называют сложной). С. р. можно рассматривать как совокупность простых реакций, к-рые в этом случае наз. стадиями сложной реакции. Иногда все образующиеся в ходе С. р. вещества являются её продуктами в том смысле, что они могут быть получены в количествах, сравнимых с затраченными количествами исходных веществ. Таковы, в частности, последовательные реакции и параллельные реакции. Более распространён, однако, тип химических реакций, иллюстрируемый примером гомогенного распада закиси азота N2O. Эта реакция происходит в две стадии:
Под чертой приведено итоговое ур-ние реакции, выражающее её конечный результат, устанавливаемый с помощью хим. анализа или каким-либо иным сравнительно грубым методом, напр. по изменению давления, если реакцию проводят в замкнутой системе. Чтобы получить итоговое ур-ние суммированием хим. уравнений стадий 1 и 2, эти ур-ния надо предварительно умножить на числа, написанные справа от них. Такие числа наз. стехиометрическими числами. Вещества, образующиеся и расходующиеся на разных стадиях, но не входящие в итоговые ур-ния, наз. промежуточными веществами (атомный кислород, напр.,- промежуточное вещество распада N2O).
Если С. р. происходит в открытой системе, при непрерывной подаче с постоянной скоростью исходных веществ и с непрерывным удалением продуктов реакции, то реакция может происходить стационарно. Каждое промежуточное вещество тогда образуется и расходуется с одинаковой скоростью, так что его кол-во в системе не изменяется со временем. Реакция в замкнутой системе может происходить квазистационарно, если среднее время жизни промежуточных веществ мало по сравнению со временем, за к-рое происходит существенное изменение состава реагирующей смеси. При этом течение реакции в каждый момент практически не отличается от стационарного.
Важнейшим случаем нестационарных реакций являются реакции с разветвляющимися цепями, теория к-рых была создана Н. Н. Семёновым. Скорость отдельных стадий С. р. определяется действующих масс законом, на основе к-рого можно получить ур-ния, описывающие течение С. р. Задача значительно упрощается, если реакция стационарна или квазистационарна.
Лит.: Эмануэль Н. М., К н о р р е Д. Г., Курс химической кинетики, 3 изд., М., 1974; Механизм и кинетика сложных каталитических реакций, М., 1970.
Что такое сложная реакция
ФИЗИЧЕСКАЯ И КОЛЛОИДНАЯ ХИМИЯ
Конспект лекций для студентов биофака ЮФУ (РГУ)
2.1 СКОРОСТЬ ХИМИЧЕСКОЙ РЕАКЦИИ
2.1.7 Сложные реакции
Сложными называют химические реакции, протекающие более чем в одну стадию. Рассмотрим в качестве примера одну из сложных реакций, кинетика и механизм которой хорошо изучены:
Данная реакция является реакцией второго порядка; её кинетическое уравнение имеет следующий вид:
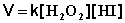
Изучение механизма реакции показало, что она является двухстадийной (протекает в две стадии):
Сделать вывод о том, является реакция элементарной или сложной, можно на основании результатов изучения её кинетики. Реакция является сложной, если экспериментально определенные частные порядки реакции не совпадают с коэффициентами при исходных веществах в стехиометрическом уравнении реакции; частные порядки сложной реакции могут быть дробными либо отрицательными, в кинетическое уравнение сложной реакции могут входить концентрации не только исходных веществ, но и продуктов реакции.
2.1.8 Классификация сложных реакций
Последовательными называются сложные реакции, протекающие таким образом, что вещества, образующиеся в результате одной стадии (т.е. продукты этой стадии), являются исходными веществами для другой стадии. Схематически последовательную реакцию можно изобразить следующим образом:
Число стадий и веществ, принимающих участие в каждой из стадий, может быть различным.
Параллельными называют химические реакции, в которых одни и те же исходные вещества одновременно могут образовывать различные продукты реакции, например, два или более изомера:
Сопряжёнными принято называть сложные реакции, протекающие следующим образом:
которые реагируют с ионами Fe 2+ и бензолом:
Fe 2+ + OH• ––> Fe 3+ + OH –
Происходит также рекомбинация радикалов:
Т.о., обе реакции протекают с участием общего промежуточного свободного радикала OH•.
Цепными называют реакции, состоящие из ряда взаимосвязанных стадий, когда частицы, образующиеся в результате каждой стадии, генерируют последующие стадии. Как правило, цепные реакции протекают с участием свободных радикалов. Для всех цепных реакций характерны три типичные стадии, которые мы рассмотрим на примере фотохимической реакции образования хлороводорода.
1. Зарождение цепи (инициация):
Стадия развития цепи характеризуется числом молекул продукта реакции, приходящихся на одну активную частицу – длиной цепи.
3. Обрыв цепи (рекомбинация):
Обрыв цепи возможен также при взаимодействии активных частиц с материалом стенки сосуда, в котором проводится реакция, поэтому скорость цепных реакций может зависеть от материала и даже от формы реакционного сосуда.
Реакция образования хлороводорода является примером неразветвленной цепной реакции – реакции, в которой на одну прореагировавшую активную частицу приходится не более одной вновь возникающей. Разветвленными называют цепные реакции, в которых на каждую прореагировавшую активную частицу приходится более одной вновь возникающей, т.е. число активных частиц в ходе реакции постоянно возрастает. Примером разветвленной цепной реакции является реакция взаимодействия водорода с кислородом:
сложные реакции
СЛОЖНЫЕ РЕАКЦИИ
Хим. реакция реализуется как совокупность множества дискретных актов хим. превращения, в каждом из которых участвует лишь одна или небольшое число частиц (молекул, атомов, ионов). Если среди актов реакции имеются химически различающиеся, то реакция наз. сложной. К С. р. относят наиболее распространенные классы реакций-каталитические ( см. катализ) и цепные реакции.
Из множества актов С. р. можно выделить химически одинаковые; они составляют элементарную реакцию. С. р. представляет собой совокупность элементарных реакций, природа и последовательность которых составляют механизм реакции.
Согласно детального равновесия принципу, состояние хим. равновесия при С. р. осуществляется таким образом, что каждая стадия строго равновесна. При удалении реагирующей системы от равновесия стадии С. р. одна за другой становятся вначале неравновесными, а затем и необратимыми.
Итог С. р. передается одним или неск. линейно независимыми хим. уравнениями (стехиометрич. уравнениями). Вещества, фигурирующие лишь в хим. уравнениях стадий С. р., но не в итоговом уравнении, наз. промежуточными. Итоговое хим. уравнение С. р. может быть получено сложением хим. уравнений стадий, умноженных на рациональные числа (положит., отрицат. или равные нулю). Эти числа наз. стехиометрич. числами С.р. Набор стехиометрич. чисел, обеспечивающий получение итогового уравнения ( т. е. приводящий к исключению промежут. веществ), задает маршрут реакции. М.б. образован базис маршрутов, т. е. такая совокупность маршрутов, что они линейно независимы, т. е. любой иной маршрут данной реакции является линейной комбинацией ее базисных маршрутов. При каждом механизме реакции число базисных маршрутов определенно, но выбор их в известной мере произволен. Число базисных маршрутов P больше или равно числу Q независимых итоговых уравнений. Если P > Q, всегда можно выбрать базис маршрутов таким образом, что итоговым уравнением (Р — Q) базисных маршрутов С. р. будет 0 = 0; такие маршруты наз. пустыми, а базис, состоящий из Q непустых маршрутов и (Р — Q) пустых,-стехиометрическим.
Чтобы определить кинетику С.р., т. е. представить скорости ее по итоговым уравнениям в виде функции концентраций исходных веществ и продуктов, нужно из системы уравнений, получаемой применением действующих масс закона к элементарным реакциям, исключить неизвестные концентрации промежут. веществ. Эта задача упрощается, если реакция строго стационарна или если ее с достаточным приближением можно считать квазистационарной: вместо системы дифференц. уравнений имеем тогда систему алгебраич. уравнений, все производные концентрации промежут. веществ по времени равны нулю ( см. квазистационарности приближение). С др. стороны, исследуя нестационарную кинетику, можно получить больше информации о механизме С. р., чем если ограничиться лишь стационарной кинетикой.
Условие стационарности С. р. записывается в виде:
Система уравнений, которые получаем, выразив в (1) us и u—s по закону действующих масс, определяет все неизвестные.
Уравнение (2) позволяет легко определить число базисных маршрутов данной реакции. Если к.-л. стадия С. р. равновесна, уравнение (1) в применении к этой стадии заменяется уравнением, выражающим закон действующих масс для соответствующего равновесия. Для С. р., описываемой неск. итоговыми уравнениями, достаточно записать кинетич. уравнения, выражающие скорости по непустым маршрутам стехиометрич. базиса (скорости по пустым маршрутам не требуются, хотя они и не равны нулю).
Альтернативное выражение условий стационарности С. р. имеет вид:
где xjs—стехиометрич. коэф. промежут. вещества номеру в хим. уравнении 5-й стадии (положит. число, если вещество образуется, и отрицательное, если вещество расходуется). Условия (1) и (3) эквивалентны, иногда удобнее пользоваться одним, иногда-другим.
В случае одномаршрутной С. р. (реакции с одним базисным маршрутом) ее стационарная скорость u м. б. выражена через скорости в прямом направлении u+ и в обратном направлении u_: