Что такое смывы в больнице
Что такое смывы в больнице
Проводимый целенаправленный санитарно-бактериологический контроль пищевых продуктов, смывов с объектов окружающей среды, воды позволяет эффективно осуществлять текущий санитарный и эпидемиологический надзор, дает объективную оценку соблюдения режима. Помогает в выяснении путей передачи инфекционного начала. Ошибки при отборе проб могут привести к неправильной гигиенической оценке исследуемых образцов при самых чувствительных и точных методах исследования, и как следствие к неадекватной оценке самого объекта.
Поэтому одним из основных принципов микробиологических исследований является правильное взятие проб, строго придерживаясь, правил отбора проб и их количественного соотношения.
Основными документами по отбору проб пищевых продуктов для микробиологических исследований являются:
Особенности отбора проб пищевых продуктов по ГОСТ Р 54004-2010 :
1.Перед отбором проб на основании визуального осмотра упаковочные единицы или продукты подразделяются на 3 группы, при этом отбор проб проводится по каждой группе отдельно:
— нормальные по внешнему виду (без признаков микробной порчи)
— подозрительные (с признаками отклонений, которые могут возникать как вследствие микробной порчи, так и вследствие химических или биохимических реакций в продукте)
— испорченные продукты при осмотре которых обнаружены явные дефекты продукта (бомбаж, плесневение, ослизнение, и т.п.). Продукты с просроченным сроком хранения для исследований не отбираются.
2. Пробы отбирают с помощью стерильных инструментов в стерильную посуду, горло которой обжигают в пламени горелки (стерильные банки или стерильные пакеты, стерильные пластиковые емкости).
Если осуществляется плановый отбор проб и формируется одна проба, тогда взятие проб для микробиологического анализа должно предшествовать отбору образцов для органолептического и физико-химического исследования, соблюдая правила асептики, исключающие загрязнение в момент отбора образца.
3. Объем (масса) пробы определяют в соответствии с НТД на данный вид продукции. Количество единиц упаковки устанавливается действующими стандартами, ОСТ, ТУ и т.п. на соответствующие продукты.
4. Если масса пробы равна массе продукта в потребительской таре, то используют всю упаковку. Если масса пробы больше единицы упаковки, то отбирают несколько упаковок, в противном случае (отсутствии упаковки), пробу отбирают путем взятия точечных проб из разных мест.
5. Если масса (объем) продукта не установлена НТД, отбирают не менее 1 штуки образца от продукции в потребительской таре и до 1000 г (см3) от продукции в транспортной таре (кусковой, жидкой, пастообразной, сыпучей и смешанной консистенции). При отборе проб от кусковой продукции массой более 1000 г используют один из следующих методов:
6. Пробы замороженных продуктов укладывают в изотермическую тару или с хладагентами. Температура таких образцов в процессе транспортировки не должна превышать минус 150С. Пробы скоропортящихся продуктов транспортируют при 50С в сумках-холодильниках с хладагентами не более 6 часов. В остальных случаях руководствуются НТД на каждый вид продукции.
9. Мясной продукции по ГОСТ Р 51447-99 «Мясо и мясные продукты»
10.Мясо птицы, субпродукты и полуфабрикаты птичьи согласно ГОСТ Р 50396.0-92 «Мясо птицы, субпродукты и полуфабрикаты птичьи».
9.При отборе проб продукции на предприятиях общественного питания следует руководствовоться МУ № 2657 «По санитарно-бактериологическому контролю на предприятиях общественного питания и торговли пищевыми продуктами».
При отборе пробы продукта сложной консистенции, в нее должны входить все компоненты в таком же соотношении как в исходном продукте. При необходимости каждый компонент отбирают отдельно.
Сыпучие продукты перед взятием проб тщательно перемешивают, либо пробу составляют из точечных проб.
10. Все пробы снабжаются этикетками, на которых кроме номера пробы, наименования продукции, обязательно указывают дату и час взятия пробы, а также дату и час выработки, срок годности продукта. Образцы пломбируют или опечатывают.
11. В процессе отбора проб составляется протокол взятия проб и направление на исследование с указанием причины отбора проб (плановое, внеплановое, по эпид.ситуации исследование и тд.) и указывается цель испытания на соответствие:
— Единые санитарно-эпидемические и гигиенические требования к товарам утв. 28.05.2010 за № 299
— ТР ТС 02\2011 «о безопасности пищевой продукции»
-СанПиН 2.3.2.1078-01 «Гигиенические требования безопасности и пищевой ценности пищевых продуктов»
— Федеральный закон Технический регламент на молоко и молочную продукцию №88-ФЗ от 12 июня 2008 г
— Федеральный закон Технический регламент на масложировую продукцию
— Федеральный закон Технический регламент на соковую продукцию из фруктов и овощей №178-ФЗ от 27 октября 2008 г
-Инструкция о порядке расследования, учета и проведения лабораторных исследований в учреждениях санитарно-эпидемиологической службы при пищевых отравлениях № 1135-73 г
— Единые санитарно-эпидемиологические и гигиенические требования к товарам, подлежащим санитарно-эпидемиологическому надзору (контролю), разработаны в целях реализации положений Соглашения таможенного союза по санитарным мерам от 11 декабря 2009 года.
Смывы.
Согласно МУ № 2657 от 31.12.82 «По санитарно-бактериологическому контролю на предприятиях общественного питания и торговли пищевыми продуктами».
В практике текущего санитарного надзора за пищеблоками детских, дошкольных и подростковых учреждений, а также буфетами-раздаточными широко используется метод смывов с целью контроля эффективности санитарной обработки инвентаря, оборудования, посуды, санитарной одежды и рук персонала. Метод смывов дает возможность объективно оценить санитарное содержание обследуемых учреждений.
Особое внимание при проведении смывов уделяют контролю оборудования и аппаратуры, которые используются по ходу технологического процесса приготовления продуктов, не подвергающихся в дальнейшем тепловой обработке (холодный цех).
Бактериологический контроль методом смывов с поверхностей инвентаря, оборудования, рук и санитарной одежды персонала может преследовать две цели:
а) установить эффективность санитарной обработки, для этого смывы с инвентаря, оборудования, рук и санитарной одежды персонала производят перед началом работы, или, если это невозможно, в перерывах, после того, как руки и оборудование подверглись санитарной обработке, т.е. смывы производят с чистых объектов.
б) определить роль оборудования и рук персонала в бактериальном обсеменении продукта или готового блюда по ходу технологического процесса производства, обращая особое внимание на производство продуктов и готовых блюд, прошедших термическую обработку или употребляемых в пищу без предварительной обработки (некоторые овощи, гастрономические продукты, салаты, винегреты и др.). Для решения поставленной задачи одновременно с взятием смывов отбирают повторные пробы пищевых продуктов (смывы берутся с необработанных рук и поверхностей).
Смыв осуществляется с поверхности увлажненным стерильным ватным тампоном, укрепленным на стеклянном или металлическом держателе, вмонтированном в ватно-марлевую пробку пробирки. В пробирке находится стерильная среда. Непосредственно перед взятием смыва тампон увлажняют опусканием тампона в жидкость. При взятии смывов необходимо учитывать следующие рекомендации:
При взятии смывов с мелких предметов смывается вся поверхность. Смывы берут:
При взятии смывов записывают номер образца по порядку, место взятия смыва. Составляется акт взятия смывов в 2 экземплярах.
Отбор проб воды для микробиологического исследования
Отбор, консервацию, хранение и транспортирование проб воды проводят:
— по ГОСТ Р 53415-2009 «Вода. Отбор проб для микробиологического анализа»;
— по ГОСТ 31942-2012 «Вода. Отбор проб для микробиологического анализа»;
— по ГОСТ Р 51593-2000 «Вода питьевая. Отбор проб», распространяется только на воду водопроводную централизованных систем водоснабжения;
— в соответствии с требованиями стандартов и других НД на методы определения;
— конкретных показателей и предназначенных для определенных типов вод.
Например, отбор проб воды централизованных систем питьевого водоснабжения проводят по трем нормативным документам:
— ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб»,
— ГОСТ Р 51593-2000 «Вода питьевая. Отбор проб»,
— МУК 4.2.1018-01 «Санитарно-микробиологический анализ питьевой воды».
Условия, при которых проводится отбор проб воды для микробиологические исследования, должны быть приближены к асептическим, т.е. не надо забывать обжигать кран, сливать в течение 10 минут воду из этого крана и только потом набирать воду в стерильную емкость. Емкость открывают непосредственно перед отбором удаляя пробку вместе со стерильным колпачком. Во время отбора пробка и края емкости не должны чего–либо касаться. В настоящее время используются одноразовые пакеты для отбора проб воды с таблеткой тиосульфата натрия и без. Ополаскивать посуду запрещается. Пробу отбирают непосредственно из крана без резиновых шлангов, водораспределительных сеток и других насадок. Если через пробоотборный кран происходит постоянный излив воды, отбор производят без предварительного обжига, не изменяя напора воды и существующей конструкции ( при наличии силиконовых или резиновых шлангов).
Пробы воды из источников централизованного и нецентрализованного водоснабжения отбираются по ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб».
Вода из чаши плавательного бассейна отбираются по следующим документам:
— ГОСТ Р 51592-2000 «Вода. Общие требования к отбору проб»,
— СанПиН 2.1.2.1188-03 «Плавательные бассейны. Гигиенические требования к устройству, эксплуатации и качеству воды. Контроль качества».
Отбор проб воды на анализ производится не менее чем в 2 точках: поверхностный слой толщиной 0,5 – 1,0 см и на глубине 25 – 30 см от поверхности зеркала воды. Контроль качества воды в ванне плавательного бассейна по основным микробиологическим показателям должен проводится 2 раза в месяц.
Анализ проб в лаборатории необходимо провести как можно быстрее от момента отбора. При отсутствии охлаждения анализ выполняют не позднее 2 часов после отбора пробы, а при охлаждении до 4-10˚ С срок хранения пробы увеличивается до 6 часов. Поэтому транспортировать пробы в лабораторию необходимо в термоконтейнерах (не допускать замораживания, т.к. при замораживании пробы погибает более 99% бактерий).
Так как количество микроорганизмов в пробе может уменьшиться наполовину менее чем через 20 минут вследствие действия остаточных количеств дезинфектантов (хлор – за считанные секунды), используются в емкости с тиосульфатом натрия (из расчета 10 мг на 500 мл воды) для нейтрализации хлорированной и бромированной воды.
Объем пробы устанавливают в зависимости от числа определяемых показателей и вида анализа в соответствии с НД на метод определения показателей. Например, объем пробы при анализе водопроводной воды и воды из скважины на индикаторные микроорганизмы достаточно 350 мл воды, а на индикаторные микроорганизмы и патогенную флору – 1350 мл, объем проб воды плавательных бассейнов – 500 мл и 1500 мл соответственно.
СанПиН 2.1.4.1116-02 «Питьевая вода. Гигиенические требования к качеству воды, расфасованной в емкости. Контроль качества», МУ 2.1.4.1184-03 «Методические указания по внедрению и применению санитарно-эпидемиологических правил и нормативов СанПиН 2.1.4.1116-02 «Питьевая вода. Гигиенические требования к качеству воды, расфасованной в емкости. Контроль качества»
Питьевая вода, расфасованная в емкости, отбирается в объеме 2,5 л, т.к. только на определение синегнойной палочки и колифагов требуется по 1,0 л воды.
МУК 4.2.1884-04 «Санитарно-микробиологический и санитарно-паразитологический анализ воды поверхностных водных объектов» (взамен МУ 2285-81, введены в действие 3 марта 2004 г.)
ОТБОР ПРОБ ПОЧВЫ ДЛЯ МИКРОБИОЛОГИЧЕСКОГО ИССЛЕДОВАНИЯ.
Отбор проб почвы осуществляется согласно ГОСТ 17.4.3.01-83 «Общие требования к отбору проб почвы», ГОСТ 17.4.4.02-84 «Методы отбора и подготовки проб для химического, бактериологического, гельмитологического анализа».
Пробная площадка – часть исследуемой территории, характеризующаяся сходными условиями (рельефом, однородностью структуры почвы и растительного покрова, характером хозяйственного использования).
Пробная площадка должна располагаться на типичном для изучаемой территории месте. На площади 100 м2 закладывается одна пробная площадка размером 25 м.
Точечная проба – материал, взятый из одного места горизонта или одного слоя почвенного профиля, типичный для данного горизонта или слоя.
Точечные пробы отбирают на пробной площадке из одного или нескольких слоев или горизонтов методом конверта. Выкапывают шурф 0,3м х 0,3м и глубиной 0,2м. Поверхность одной из стенок шурфа очищают стерильным ножом. Затем из этой стенки вырезают почвенный образец, размер которого обусловлен заданной навеской, так, если необходимо отобрать 200 г почвы, размер образца 20см х 3см х 3см, 500г – 20см х 5см х 3см.
Точечные пробы отбирают ножом, шпателем или почвенным буром.
Объединенную пробу составляют путем смешивания точечных проб, отобранных на одной пробной площадке.
Для бактериологического анализа с одной пробной площадки составляют 10 объединенных проб. Каждую объединенную пробу составляют из трех точечных проб массой от 200 до 250 г каждая, отобранных послойно с глубины от 0 до 5 см, от 5 до 20 см.
Пробы почвы, предназначенные для бактериологического анализа, в целях предотвращения их вторичного загрязнения следует отбирать с соблюдением правил асептики: стерильными инструментами, перемешивать на стерильной поверхности, помещать в стерильную тару. Время от отбора проб до начала их исследования не должно превышать 1 суток.
При контроле санитарного состояния почв территорий детских учреждений и игровых площадок отбор проб проводится отдельно из песочниц и с общей территории с глубины 0 – 10 см.
С каждой песочницы отбирается одна объединенная проба, составленная из 5 точечных проб. При необходимости возможен отбор одной объединенной пробы из всех песочниц каждой возрастной группы, составленной из 8-10 точечных проб.
Пробы почвы отбирают либо с игровых территорий каждой группы (одна объединенная из не менее пяти точечных), либо одна объединенная проба с общей территории из 10 точечных, при этом следует учитывать наиболее вероятные места загрязнения почв.
При контроле почв в районе точечных источников загрязнения (выгреба, мусоросборники и т.д.) пробные площадки размером не более 5 х 5 м закладывают на разном расстоянии от источника и в относительно чистом месте (контроль).
При изучении загрязнения почв транспортными магистралями пробные площадки закладываются на придорожных полосах с учетом рельефа местности, растительного покрова, метео- и гидрологических условий.
Пробы почвы отбирают с узких полос длинной 200 – 500 м на расстоянии 0-10, 10-50, 50-100 м от полотна дороги. Одна смешанная проба составляется из 20-25 точечных проб, отобранных с глубины 0-10 см.
При оценке почв сельскохозяйственных территорий пробы почвы отбирают 2 раза в год (весна, осень) с глубины 0-25см. На каждые 0-15 га закладывается не менее 1 площадки размером 100-200 м2 в зависимости от рельефа местности и условий землепользования.
Для приготовления среднего образца объемом 0,5 кг почву всех образцов одного участка высыпают на стерильный, плотный лист бумаги, тщательно перемешивают стерильным шпателем, отбрасывают камни и прочие твердые предметы. Затем почву распределяют на листе ровным тонким слоем в форме квадрата.
Диагоналями почву делят на 4 треугольника, Почву из двух противоположных треугольников отбрасывают, а оставшуюся вновь перемешивают, опять распределяют тонким слоем и делят диагоналями до тех пор, пока не останется примерно 0,5 кг почвы.
Затем проба доставляется в лабораторию с направлением и актом отбора пробы.
Микробиологические смывы
Обратившись в санэпидемслужбу, вы можете не только заказать такие распространенные услуги, как дезинфекция, дезинсекция или дератизация, но также обратиться в лабораторию при СЭС, которая проводит самые разные анализы. Одними из наиболее востребованных являются микробиологические смывы – на золотистый стафилококк, легионеллы, сальмонеллы и т.п.
Для чего нужно микробиологическое исследование смывов
Изучение микрофлоры смывов необходимо:
При проверке организаций общественного питания микробиологический анализ смывов позволяет определить общий уровень загрязненности предприятия, наличие или отсутствие нарушений в технологиях приготовления продуктов питания, сделать выводы о соблюдении санитарно-гигиенических норм. Также с помощью анализа смывов можно определить правильность хранения продуктов и готовых блюд. Главная же цель микробиологического анализа смывов – это снижение рисков отравлений, острых кишечных отравлений и других заболеваний, связанных с приемом некачественной пищи. Анализ результатов исследования и принятие соответствующих мер по повышению санитарно-гигиенического уровня на предприятии – залог высокого качества и безопасности продукции.
Что проверяется при лабораторном анализе смывов
Каждое предприятие общественного питания обязано регулярно осуществлять санитарно-бактериологический контроль, который связан с исследованием предметов и объектов, соприкасающихся с пищей или используемых при её приготовлении, обработке и хранении. Обычно исследуются:
Физические лица также могут заказать исследование микробиологических смывов:
Виды исследований микробиологических смывов
Методика сбора и изучения смывов широко используется во всем мире, поскольку дает очень точные и объективные результаты, а также помогает определить присутствие тех или иных патогенных микроорганизмов.
В нашей лаборатории при санэпидемслужбе можно заказать следующие виды исследований:
Особенности забора проб и проведения микробиологического анализа смывов
Наших заказчиков часто интересует, как происходит забор материалов для исследования. Смывы собирают стерильными салфетками или ватными тампонами, которые предварительно смачивают стерильным изотоническим раствором.
Существуют некоторые правила забора материала для анализов:
Заказав анализ микробиологических смывов в частном порядке до проверки контролирующего органа, любое предприятие общепита сможет заранее выявить имеющиеся проблемы, устранить их и тем самым благополучно избежать санкций и штрафов.
Микробиологические смывы
Компания “Единая Санитарная Служба” оказывает услуги по проведению лабораторных анализов, выявляющих различные негативные факторы, оказывающие пагубное влияние на здоровье человека и состояние окружающей среды. Для этих целей осуществляется санитарно-микробиологическое исследование. Смыв – это анализ жидкости, которая взята с твердой поверхности и растворена в специальном составе. Исследование позволяет оценить санитарные условия на предприятии, в заведении общепита, жилом помещении, а также загрязненность техники и оборудования. Микробиологические смывы – объективный метод исследования, который отличается повышенной точностью.
Цели микробиологических исследований
Взятие смывов рекомендуется проводить для:
Микробиологические смывы позволяют повысить безопасность выпускаемой продукции, свести к минимуму риски отравления, предотвратить негативные для покупателя последствия приобретения товаров ненадлежащего качества.
Предмет изучения микробиологических исследований
Предметом изучения данного метода исследования может выступать вода, которая используется в производства, применяется для наполнения бассейна. Также микробиологические смывы анализируют состояние почвы, что актуально при покупке земельного участка, строительстве дома, бурении скважин. Другим предметом изучения является воздух, лабораторные анализы позволяют определить наличие в нем:
Предприятия и заведения общественного питания часто заказывают исследование инвентаря, бытовых предметов, приборов, а также рабочих поверхностей, продуктов и готовых блюд. Также проводится взятие смывов с оборудования, чтобы проверить степень его загрязненности.
Виды исследований микробиологических смывов
Мы предлагаем проведение различных видов высокоточных микробиологических исследований-смывов:
Процедура взятия смывов для микробиологических исследований
При проведении микробиологических смывов “Единая Санитарная Служба” ориентируется на правила, приведенные в принятом Роспотребнадзором указе МУК 4.2.3591-19. Согласно данному правовому акту, забор материала выполняется с применением стерильных и специально обработанных тампонов. Смыв с оборудования необходимо брать до начала смены или после санобработки, для рабочих поверхностей применяется специальный трафарет. При больших размерах исследуемого объекта необходимо брать пробы из нескольких точек.
При взятии смыва с рук сотрудника нужно не менее 5 раз провести тампоном по ладоням, пальцам рук, ногтям, межпальцевой области. Для исследования санитарной одежды выбираются участки на рукавах, передней и верхней части изделия. Объем и количество смывов зависят от поставленных целей, особенностей деятельности предприятия, предмета исследования.
После проведения лабораторного изучения взятого материала клиенту выдается протокол с результатами. К итогам анализа прилагаются рекомендации по улучшению эпидемиологической и санитарно-гигиенической обстановки на изучаемом объекте. Советуем заказать микробиологическое исследование с целью выявления и исправления имеющихся нарушений на производстве. Такое решение позволит избежать проблем с контролирующими органами, гарантировать безопасность и качество выпускаемой продукции.
Смыв – это точное и информативное лабораторное исследование, которое используется для санитарно-бактериологического контроля на производстве, в общеобразовательных учреждениях, организациях общественного питания. Также анализ могут заказать физические лица с целью проверки своего жилья на соответствие эпидемиологическим нормам, для выявления причин плохого самочувствия, частых аллергий, простудных и других заболеваний.
Организация санитарно-противоэпидемического и дезинфекционно-стерилизационного режимов в ЛПУ
Департамент охраны здоровья населения Кемеровской области
ГУЗ «Кемеровская областная клиническая больница»
ГОУ ВПО «Кемеровская государственная медицинская академия» РОСЗДРАВА
Кемеровская региональная общественная организация
«ПРОФЕССИОНАЛЬНАЯ АССОЦИАЦИЯ МЕДИЦИНСКИХ СЕСТЕР КУЗБАССА»
Организация санитарно-противоэпидемического и
дезинфекционно-стерилизационного режимов в ЛПУ
Методическое пособие
Областной главный специалист по
сестринскому делу ДОЗН КО
Начальник Департамента охраны здоровья населения Кемеровской области
Одобрено и рекомендовано к изданию:
МС НМКЦ ГОУ СПО «КОМК»
Протокол №__4__от_15 января_2008__г
__________________И.Н.Санникова
(председатель методического совета)
Организация санитарно-противоэпидемического и дезинфекционно-стерилизационного режимов в ЛПУ: Методическое пособие/ Е.Б.Брусина, О.М.Дроздова, Н.Б.Карпушкина.- Кемерово: ГУЗ КОКБ, ГОУ ВПО КемГМА МЗ РФ,2007.-54 стр.
Инструктивно-методическое пособие подготовлено организации санитарно-противоэпидемического и дезинфекционно-стерилизационного режимов в ЛПУ. Предназначено для практикующих медицинских сестер студентов медицинских училищ и колледжей базового и повышенного уровня образования, студентов медицинской академии.
Подлежат ежегодному пересмотру.
Все права защищены. При перепечатке ссылка на источник обязательна.
© ГУЗ Кемеровская областная клиническая больница,2007г.
© ГОУ ВПО КемГМА МЗ РФ,2007г.
Раздел 1. Противомикробные мероприятия. Общая характеристика
Раздел 2. Категория предметов ухода за больными
Раздел 3. Камерная дезинфекция
Раздел 4. Методы контроля качества дезинфекции
Раздел 5. Предстерилизационная очистка
Раздел 6. Методы контроля и показатели качества предстерилизационной очистки
Раздел 7. Стерилизация. Методы стерилизации
Раздел 8. Сроки сохранения стерильности материалов
Раздел 9. Методы контроля качества стерилизации
Раздел 10. Безопасность медицинского персонала
Раздел 11. Обработка рук
Раздел 12. Регистрация аварийных ситуаций
Раздел 13. 7 правил универсальных мер безопасности медицинского персонала от инфекции
Раздел 14. Санитарно-противоэпидемический режим
Раздел 15. Санитарно-гигиенический режим отделений
Раздел 16. Санитарное содержание помещений, оборудования, инвентаря
Раздел 17. Бельевой режим
Раздел 18. Уборка помещений по типу текущей дезинфекции
Раздел 19. Уборка по типу заключительной дезинфекции
Раздел 20. Гигиенические требования при организации питания больных в отделении
Раздел 21. Классификация медицинских отходов
Раздел 22. Изоляционно-ограничительные мероприятия
Раздел 23. Общие сведения по госпитальным инфекциям
Раздел 24. Вирусные гепатиты. Общие сведения
Раздел 25. ВИЧ-инфекция
Раздел 26 Тестовый контроль знаний санитарно-противоэпидемическому режиму:
Нормативная документация, список использованной литературы
Организация санитарно-противоэпидемического и дезинфекционно-стерилизационного режимов в лечебно-профилактических учреждениях является отражением качества оказания медицинской помощи. Соблюдение принципов организации позволяет снизить частоту внутрибольничных инфекций в стационарах различного профиля, длительность пребывания пациентов в стационаре и экономические расходы, связанные с госпитализацией.
В настоящем инструктивно-методическом пособии представлены основные методы дезинфекции, предстерилизационной очистки и стерилизации, методы контроля их качества. Особое внимание уделяется методике мытья рук, безопасности медицинского персонала при работе с биологическими жидкостями. Рассматриваются вопросы, связанные с организацией санитарно-противоэпидемического режима в стационарах различного профиля, бельевого режима, питания больных, проведения текущей и заключительной дезинфекции, утилизацией отходов.
Для обеспечения инфекционной безопасности как пациентов, так и персонала, в инструктивно-методическом пособии представлены основные изоляционно-ограничительные мероприятия и алгоритм действия медицинского персонала при поступлении инфицированных пациентов. Дана характеристика госпитальных инфекций, гемоконтактных гепатитов, ВИЧ-инфекции – теоретические аспекты и меры профилактики их распространения.
Инструктивно-методическое пособие составлено в соответствии с действующими нормативными документами Министерства здравоохранения и социального развития Российской Федерации и предназначено для медицинского персонала лечебно-профилактических учреждений.
Противомикробные мероприятия. Общая характеристика
Противомикробные мероприятия – совокупность способов и методов уничтожения, подавления жизнедеятельности, снижения численности популяции и ограничения распространения возбудителей инфекций в целях лечения, предупреждения развития и распространения инфекционных заболеваний (рис.1) [2].
Рис.1. Противомикробные мероприятия
Стерилизация – совокупность физических и химических способов полного освобождения объектов внешней среды от вегетативных и споровых форм микроорганизмов.
Антисептика – Совокупность способов удаления, уничтожения или подавления жизнедеятельности микроорганизмов в ранах, на коже, слизистых оболочках, полостях в целях лечения и предупреждения развития инфекционного процесса.
Химиотерапия – меры, направленные на прямое уничтожение или подавление возбудителей во внутренней среде организма в целях лечения или профилактики инфекционных и паразитарных болезней.
Дезинфекция – частичное, селективное уничтожение потенциальных возбудителей инфекционных болезней на объектах внешней среды с целью разрыва путей передачи возбудителей инфекционных заболеваний от источников инфекций к восприимчивым людям.
Различают следующие виды и методы дезинфекции (рис.2):
Текущая дезинфекция – проводится в действующем эпидемическом очаге в присутствии источника инфекции с целью снижения массивности микробной контаминации окружающей больного внешней среды.
Заключительная дезинфекция – предполагает полное уничтожение возбудителей болезни в очаге после удаления из него источника инфекции (госпитализации в инфекционный стационар, выздоровления, выезда, смерти).
Рис.2. Виды и методы дезинфекции
Профилактическая дезинфекция – проводится в отсутствие источника инфекции с целью предотвращения накопления во внешней среде возбудителей инфекционных болезней.
Различают физические, химические и биологические методы дезинфекции.
Физические методы дезинфекции:
Механические – чистка, влажная уборка, стирка, выколачивание, вытряхивание, проветривание, фильтрация.
Термические – воздействие сухого горячего воздуха, водяного пара, горячей воды, обжигание, прокаливание, сжигание, пастеризация, тиндализация, холод, высушивание.
Лучистые – солнечный свет, ультрафиолетовые лучи.
Химические методы дезинфекции – основаны на применении различных химических веществ, обладающих антимикробным действием.
Категория предметов ухода за больными (Spaulding)
По степени риска инфицирования все предметы, контактирующие с пациентами подразделяются на:
«Критические» предметы – предметы, проникающие через покровы в ткани организма, которые в случае их контаминации любыми микроорганизмами, в том числе спорами бактерий, обусловливают высокую степень риска заражения больных.
«Полукритические» предметы – предметы, контактирующие с неповрежденными слизистыми оболочками и кожей, которые не должны содержать на своей поверхности никаких микроорганизмов, не считая спор бактерий.
«Некритические» предметы – предметы, контактирующие с неповрежденной кожей, но не со слизистыми.
Такое разделение предметов связано с обеспечением необходимого уровня и особенностей технологий обеззараживания (таблица 1,2) [7].
Необходимый уровень обеззараживания и средства
инструменты, сосудистые катетеры, имплантаты, стерильные жидкости, иглы и т.д.
Стерилизация (стерилянты, спороцидные дезинфицирующие средства при длительном времени контакта)
оборудование для ингаляций и анестезии, желудочно-кишечные эндоскопы и термометры; ларингоскопы и т.д.
Дезинфекция высокого уровня (стерилянты, спороцидные дезинфицирующие средства при кратковременном контакте)
подкладные судна, манжеты аппаратов для измерения давления крови, посуда, больничная мебель, посуда и т.д.).
Дезинфекция промежуточного (туберкулоцидные дезинфицирующие средства) или низкого уровня
Особенности различных технологий обеззараживания.
Обеззараживающие средства и режимы
Уничтожение всех вегетативных микроорганизмов и спор.
Высокая температура (пар или сухой жар).
Газо- или парообразные стерилизующие средства (окись этилена, формальдегид и т.д.).
Радиационный метод (Гамма- или бета-излучение).
Жидкие спороцидные стериллянты при длительной экспозиции (6-12 часов):
альдегиды перекись водорода (6%)
надуксусная кислота (Дезоксон-1)
Дезинфекция высокого уровня
Уничтожение всех вегетативных микроорганизмов и части спор. Возможно сохранение части спор.
Жидкие спороцидные дезинфектанты при кратковременной экспозиции (10-60 мин):
перекись водорода (6%)
Дезинфекция промежуточного (среднего) уровня
Уничтожение микобактерий туберкулеза и всех других вегетативных бактерий; всех грибов и большинства вирусов
Дезинфекция низкого уровня
Уничтожение большинства вегетативных бактерий, некоторых вирусов (гепатиты В, С, ВИЧ, герпес, грипп и др.) и некоторых грибов (кроме микобактерий туберкулеза).
Четвертичные аммониевые соединения (ЧАС)
Камерная дезинфекция является одним из существенных звеньев противомикробных мероприятий. Используется после выписки каждого больного из отделения или является обязательным мероприятием в очаге инфекции для обеззараживания хлопчатобумажных, шерстяных, суконных, кожаных и меховых вещей, матрацев, одеял, подушек, утиля, документов и книг [2].
В зависимости от действующего агента дезинфекционные камеры делятся на 4 группы:
Паровые, в которых обеззараживание производится насыщенным текучим водяным паром в условиях повышенного давления.
Горячевоздушные – сухим нагретым воздухом.
Пароформалиновые – пароформальдегидная смесь и увлажненный нагретый воздух.
Газовые – химические газовые вещества (сернистый ангидрид, окись этилена, метилбромид, хлорпикрин др.).
Методы контроля качества дезинфекции
Для оценки качества проведения дезинфекции проводятся следующие методы:
2. Химический – химические экспресс-пробы на остаточное количество дезинфицирующих веществ.
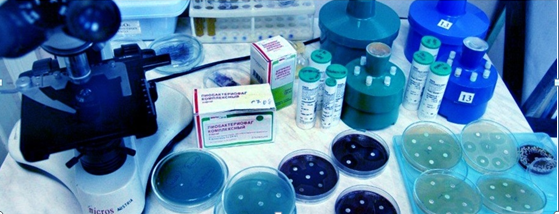
3. Бактериологический – исследуют смывы с объектов внешней среды на микробную обсемененность и бактериологический тестовый контроль дезкамер.
Показатели удовлетворительного качества дезинфекции:
Высев не патогенной микрофлоры с объектов контроля не более чем в 2% отобранных бактериологических смывов;
Определение заниженных концентраций дезрастворов не более чем в 5% отобранных проб;
Выявление неудовлетворительных экспресс-проб на остаточное количество дезрастворов не более чем в 2% от числа поставленных проб каждого вида;
Соответствие тестового бактериологического контроля режимам камерной дезинфекции.
Предстерилизационной очистке должны подвергаться все изделия перед их стерилизацией с целью удаления белковых, жировых и механических загрязнений, а также лекарственных препаратов.
Разъемные изделия должны подвергаться предстерилизационной очистке в разобранном виде.
Предстерилизационная очистка должна осуществляться ручным или механизированным (с помощью специального оборудования) способом.
Методика проведения механизированной очистки должна соответствовать инструкции по эксплуатации, прилагаемой к оборудованию.
Ершевание резиновых изделий не допускается.
Предстерилизационная очистка ручным способом должна осуществляться в последовательности в соответствии с табл. 3.
По окончании рабочей смены оборудование должно быть очищено механическим способом путем мытья с применением моющих средств.
Моющий раствор должен включать компоненты в соответствии с табл. 4.
Если инструмент, загрязненный кровью, может быть промыт под проточной водой тотчас же после использования при операции или манипуляции, его не погружают в раствор ингибитора коррозии (бензоат натрия).
В случае необходимости (продолжительность операций) инструмент можно оставить погруженным в моющий раствор с ингибитором коррозии до 7 часов.
Моющий раствор допускается применять до загрязнения (до появления розовой окраски, что свидетельствует о загрязнении раствора кровью, снижающем эффективности очистки). Моющий комплекс перекиси водорода с синтетическими моющими средствами можно использовать в течение двух суток с момента изготовления, если цвет раствора не изменился. Неизмененный раствор можно подогревать до 6 раз, в процессе подогрева концентрация перекиси водорода не изменяется.
Режим сушки эндоскопов и изделий из натурального латекса, а также требования к погружению эндоскопов в растворы должны быть изложены в инструкциях по эксплуатации этих изделий.
Температура раствора в процессе мойки не поддерживается.
ПРИГОТОВЛЕНИЕ МОЮЩЕГО РАСТВОРА
Для предстерилизационной очистки допускается применение медицинской перекиси водорода, а также перекиси водорода технической марок А и Б.
Организации, разрабатывающие и изготовляющие изделия медицинского назначения при проверке устойчивости изделий к средствам предстерилизационной очистки, должны использовать растворы перекиси водорода с моющими препаратами.
Методы контроля и показатели качества предстерилизационной очистки
1. Контроль качества предстерилизационной очистки проводят центры Роспотребназора и дезинфекционные станции не реже 1 раза в квартал.
3. Качество предстерилизационной очистки изделий оценивают путем постановки азопирамовой или амидопириновой пробы на наличие остаточных количеств крови, а также путем постановки фенолфталеиновой пробы на наличие остаточных количеств щелочных компонентов моющих средств.
4. Методика приготовления реактивов для постановки проб.
4.1. Азопирамовая проба.
4.1.1. Приготовление исходного раствора.
Для приготовления 1 л (куб. дм) исходного раствора азопирама отвешивают 100 г амидопирина и 1,0-1,5 г солянокислого анилина, смешивают их в сухой мерной посуде и доводят до объема 1 л (куб. дм) 95% этиловым спиртом. Смесь тщательно перемешивают до полного растворения ингредиентов.
4.1.2. Приготовление реактива азопирам.
Перед постановкой пробы готовят реактив азопирам, смешивая равные объемные количества исходного раствора азопирама и 3% раствора перекиси водорода. Реактив азопирам можно хранить не более 2 часов. При более длительном стоянии может появиться розовое спонтанное окрашивание реактива. При температуре выше +25 град. С раствор розовеет быстрее, поэтому его необходимо использовать в течение 30-40 мин. Не следует подвергать проверке горячие инструменты, а также хранить реактив азопирам на ярком свету и вблизи нагревательных приборов.
В случае необходимости пригодность реактива азопирам проверяют следующим образом: 2-3 капли реактива наносят на пятно крови. Если не позже чем через 1 мин появляется фиолетовое окрашивание, переходящее затем в сиреневый цвет, реактив пригоден к употреблению; если окрашивание в течение 1 мин не появляется, реактивом пользоваться не следует.
4.2. Амидопириновая проба.
Готовят 30% раствор уксусной кислоты и 3% раствор перекиси водорода на дистиллированной воде.
Смешивают равные количества 5% спиртового раствора амидопирина, 30% раствора уксусной кислоты и 3% раствора перекиси водорода. Реактив готовят перед применением.
4.3. Фенолфталеиновая проба.
Готовят 1% спиртовой раствор фенолфталеина на 95% этиловом спирте; раствор хранят во флаконе с притертой пробкой в холодильнике в течение месяца.
5. Методика постановки проб.
Контролируемое изделие протирают марлевой салфеткой, смоченной реактивом, или наносят 2-3 капли реактива на изделие с помощью пипетки.
В шприцы вносят 3-4 капли рабочего раствора реактива и несколько раз продвигают поршнем для того, чтобы смочить реактивом внутреннюю поверхность шприца, особенно места соединения стекла с металлом, где чаще всего остается кровь; реактив оставляют в шприце на 1 мин, а затем вытесняют на марлевую салфетку. При проверке качества очистки игл реактив набирают в чистый, не имеющий следов коррозии шприц. Последовательно меняя иглы, через них пропускают реактив, вытесняя 3-4 капли на марлевую салфетку.
Качество очистки катетеров и других полых изделий оценивают путем введения реактива внутрь изделия с помощью чистого шприца или пипетки. Реактив оставляют внутри изделий на 1 мин, после чего сливают на марлевую салфетку. Количество реактива, вносимого внутрь изделия, зависит от величины изделия.
6. Учет результатов постановки проб.
При постановке азопирамовой и амидопириновой проб окрашивание реактивов, наступившее позже чем через 1 мин после постановки пробы, не учитывается.
При положительной фенолфталеиновой пробе о наличии на изделиях остаточных количеств щелочных компонентов моющего средства свидетельствует появление розового окрашивания реактива.
В случае положительной пробы на кровь или на остаточные количества щелочных компонентов моющих средств, всю группу контролируемых изделий, от которой отбирали контроль, подвергают повторной очистке до получения отрицательных результатов.
Результаты контроля отражают в журнале по форме N 366/у (таблица 5).
Таблица 5
Код формы по ОКУД
Код учреждения по ОКПО
Министерство здравоохранения РФ
Наименование учреждения
Медицинская документация. Форма N 366/у.
Утверждена Минздравом СССР 04.10.80. пр. N 1030
ЖУРНАЛ
УЧЕТА КАЧЕСТВА ПРЕДСТЕРИЛИЗАЦИОННОЙ ОБРАБОТКИ
Начат «___» ____________ 199 г. Окончен «___» _____________ 199 г.
Результаты выборочного химического контроля
обработанных изделий
Фамилия лица,
проводившего
контроль
Из них загрязненных
Показатели удовлетворительного качества предстерилизационной очистки:
Отсутствие положительных проб на скрытую кровь
Отсутствие положительных проб на остаточное количество моющего комплекса
Стерилизация. Методы стерилизации
Стерилизация – совокупность физических и химических способов полного освобождения объектов внешней среды от вегетативных и споровых форм микроорганизмов [3].
Различают следующие методы стерилизации:
Паровой метод стерилизации стерилизующим агентом является водяной насыщенный пар. Метод используется для стерилизации инструментов, перчаток, шовного и перевязочного материалов, белья, питательных сред и лекарственных растворов, резиновых и силиконовых изделий. Стерилизация проводится в автоклаве:
режим для термостабильных материалов (белье, мягкий материал, инструменты):
t = 132 0 C (2,0 кгс/см 3 ) – 20 минут;
для стерилизаторов нового поколения: t = 134 0 C (2,1 кгс/см 3 )– 5 минут
режим для термолабильных материалов (резиновые или силиконовые дренажи, перчатки и др.):
t = 120 0 C (1,1 кгс/см 3 ) – 45 минут
110 0 С (0,5 кгс/см 3 ) – 180 минут.
Воздушный метод стерилизации стерилизующим агентом является сухой горячий воздух. Метод предназначен для стерилизации инструментов, лабораторной и аптечной посуды, а также изделий, которые не могут стерилизоваться паром (тальк, масло). Инструменты в воздушном стерилизаторе размещают в один слой открыто на лотках или упаковывают в бумагу (крафт-пакеты). Хранение стерильных изделий в воздушных стерилизаторах недопустимо. Стерилизация проводится в воздушных стерилизаторах:
t = 200 0 C – 10 минут (для стерилизаторов нового поколения)
t = 180 0 C – 60 минут
t = 180 0 C – 45 минут(для стерилизаторов нового поколения)
t = 160 0 C – 150 минут
Химический метод стерилизации стерилизующим агентом является жидкое или газообразное химическое вещество:
2. 1% (по надуксусной кислоте) раствор Дезоксона-1 – 45 минут;
3. 2% раствор глутарового альдегида – 10 часов.
При химическом методе стерилизации жидкими стерилянтами необходимо обязательное отмывание простерилизованного объекта от остатков стерилизующего вещества стерильной водой (не менее двух раз). После отмывания стерильные изделия выкладывают на стерильный стол или заворачивают в стерильную простынь и помещают в простерилизованный бикс, в котором простерилизованные изделия могут храниться до 3-х суток. К персоналу, проводящему стерилизацию, предъявляются высокие требования – он должен готовиться к стерилизации также как к работе в операционной: работа проводится в стерильном халате, бахилах, маске, стерильных перчатках.
Радиационный метод: стерилизующим агентом являются гамма- и бета-излучение. Данный способ стерилизации проводится только в заводских условиях, требует создания сложных и дорогостоящих систем защиты обслуживающего персонала от радиации.
Механические способы стерилизации предусматривают фильтрование жидкостей через мелкопористые фильтры, пропускание воздуха через бактерицидные фильтры, «промывание» какого-либо помещения (например, бокса) ламинарным потоком стерильного воздуха.
Сроки сохранения стерильности материалов
Сроки сохранения стерильности материалов зависит от метода стерилизации и материала упаковки. Срок хранения материалов, простерилизованных в стерилизационных коробках без фильтров, в двойной упаковке из бязи, пергаменте, бумаге (мешочной непропитанной и мешочной влагопрочной), в стерилизационной коробке, выложенной стерильной простыней (для изделий, стерилизованных растворами химических препаратов) равен 3 суткам, в стерилизационных коробках с фильтром – 20 суткам. Изделия, стерилизованные без упаковки, должны быть использованы непосредственно после стерилизации. Для изделий, стерилизованных в полиэтиленовой упаковке, срок хранения материалов до 5 лет, в крафт-пакетах – до 20 суток, в комбинированных полимерных пакетах – от 6 месяцев до 1 года.
Одним из методов хранения простеризованных изделий медицинского назначения является использование ультрафиолетовых камер («Панмед» и др.), которые обеспечивают длительный срок хранения – от 3-х до 7 суток).
Внимание! Следует учитывать, что ультрафиолетовые лучи стерилизующим действием не обладают!
Методы контроля качества стерилизации
Методы и средства контроля работы паровых и воздушных стерилизаторов представлены в таблице 6.
Проверку температурного режима осуществляют с помощью максимальных термометров, которые помещают в контрольные точки стерилизаторов в соответствии с таблицей 7 (паровые стерилизаторы) и таблицей 8 (воздушные стерилизаторы). Предельные отклонения температуры в различных точках стерилизационной камеры от номинальных значений температур стерилизации должны соответствовать нормативным показателям. Для контроля температуры используют также химические индикаторы (индикаторы типа ИС, химические тесты), которые помещают в контрольные точки, указанные выше.
Индикаторы типа ИС представляют собой полоску бумаги с нанесенным на нее индикаторным слоем и предназначены для оперативного визуального контроля совокупности параметров (температура, время) режимов работы паровых и воздушных стерилизаторов.
Химические тесты представляют собой стеклянные трубки, содержащие химические соединения или их смеси с красителями и предназначены для контроля достижения заданной температуры по вменению агрегатного состояния и/или цвета химических соединений, наблюдаемому после окончания стерилизации.
Медицинский персонал, использующий средства физического и химического контроля, регистрирует результаты контроля в журнале по форме N 257/у (табл. 9).
Контроль работы паровых и воздушных стерилизаторов
Контролируе-
мый показа-
тель
Средство контроля работы стерилизаторов
паровых при режиме стерилизации
воздушных при режиме
стерилизации
110+/-1
град.С
180 мин
120+/-2
град. С
45 мин
121+/-1
град. С
20 мин
126+/-1
град. С
10 мин
132+/-2
град. С
20 мин
160+/-3
град. С
150 мин
180+/-3
град. С
60 мин
Хими-
ческий
тест с
антипи-
рином
или ре-
зорци-
ном
Химический тест
с кислотой бен-
зойной
Хими-
ческий
тест с
бенза-
мидом
или
сукцин-
имидом
Химический тест
с никотинамидом
или мочевиной,
или Д(+)-манно-
зой
Химический тест
с левомицетином
Химический тест
с кислотой вин-
ной или гидро-
хиноном, или
тиомочевиной
Термометр ртутный стеклянный максимальный
с диапазоном измерения от 0 до 150 град. С
(ТП-7)
Давление в
стерилизаци-
онной камере
Мановакуумметр с диапазоном измерения
от 0,1 до 0,5 МПа
Бактерио-
логичес-
кий
Примечания: Изменение цвета химических индикаторов после цикла стерилизации не является свидетельством достижения стерильности изделий.
Знак обозначает, что данный показатель не контролируется или данное средство контроля не используется для этого режима.
Расположение контрольных точек в паровых стерилизаторах
Объем
стерили-
зацион-
ной
каме-
ры,
куб. дм
Число
конт-
роль-
ных
точек
Расположение контрольных точек
До 100
включи-
тельно
Свыше
100
до 750
включи-
тельно
Схемы не приводятся.
Примечание: контрольные точки 1 и 2 находятся в стерилизационной камере вне стерилизуемых изделий
Расположение контрольных точек в воздушных стерилизаторах
Объем
стерили-
зацион-
ной
каме-
ры,
куб. дм
Число
конт-
роль-
ных
точек
Расположение контрольных точек
До 80
включи-
тельно
Свыше 80
однока-
мерные
Свыше 80
двука-
мерные
Аналогичным образом (как в
однокамерных стерилизаторах) для
каждой стерилизационной камеры
См. схему
для однока-
мерных сте-
рилизаторов
с объемом
стерилиза-
ционной ка-
меры свыше
80 куб. дм
Схемы не приводятся.
Примечание: контрольные тесты помещают на расстоянии не менее 5 см от стенок стерилизационной камеры.
Код формы по ОКУД
Код учреждения по ОКПО
Министерство здравоохранения РФ
Медицинская документация. Форма N 257/у.
Утверждена Минздравом СССР 04.10.80. пр. N 1030
ЖУРНАЛ
РАБОТЫ СТЕРИЛИЗАТОРОВ ВОЗДУШНОГО, ПАРОВОГО (АВТОКЛАВА)
Начат «___» __________ 200_ г. Окончен «___» __________ 200_ г.
Марка, N
стерилиза-
тора воз-
душного,
парового
Время стери-
лизации
(мин.)
Показатели удовлетворительного качества стерилизации:
Отсутствие роста микроорганизмов при посевах всех биологических тестов в питательные среды;
Изменение исходного состояния (цвет, агрегатное состояние) химического индикатора;
Отсутствие высева микрофлоры со стерильных изделий.
Безопасность медицинского персонала
* Хлопчатобумажная сорочка или костюм: рубашка и брюки;
* шапочка или косынка;
* резиновые или латексные перчатки;
* обувь, подлежащая мытью и дезинфекции.
* пластиковые очки или лицевая маска «Барьер»;
При малейшей возможности контакта с кровью или жидкими выделениями организма, слизистыми оболочками или поврежденной кожей любого пациента, а также при наличии порезов или других повреждений собственной кожи необходимо использование перчаток.
Перчатки следует менять перед каждым пациентом и перед работой с биологическими жидкостями. Использованные перчатки подлежат утилизации. Стерильные перчатки надеваются лишь для выполнения асептических процедур.
Последовательность действий при использовании стерильных перчаток
1. Развернуть упаковку с перчатками.
2. Взять перчатку за отворот левой рукой так, чтобы пальцы не касались внутренней поверхности перчатки.
3. Сомкнуть пальцы правой руки и ввести их в перчатку.
4. Разомкнуть пальцы правой руки и натянуть на» них перчатку, не нарушая ее отворота.
5. Завести под отворот левой перчатки 2, 3- и 4-й пальцы правой руки, уже одетой в перчатку так, чтобы 1-й палец правой руки был направлен в сторону 1-го пальца на левой перчатке.
6. Держать левую перчатку 2, 3- и 4-м пальцами правой руки вертикально.
7. Сомкнуть пальцы левой руки и ввести ее в перчатку.
8. Расправить отворот левой перчатки, натянув ее на рукав, затем на правой с помощью 2- и 3-го пальцев, подводя их под подвернутый край перчатки.
1. Пальцами правой руки в перчатке сделать отворот на левой перчатке, касаясь ее только с наружной стороны.
2. Пальцами левой руки сделать отворот на правой перчатке, также касаясь ее только с наружной стороны.
3. Снять перчатку с левой руки, выворачивая ее наизнанку и держа за отворот.
4. Держать снятую с левой руки перчатку в правой руке.
5. Левой рукой взять перчатку на правой руке за отворот с внутренней стороны и снять перчатку с правой руки, выворачивая ее наизнанку.
6. Обе перчатки (левая оказалась внутри правой) поместить в емкость с дезинфицирующим средством
7. После дезинфекции выбросить в емкость «Отходы класса Б»
Необходимы для избежания воздушно-капельного переноса микроорганизмов, а также при наличии вероятности попадания в рот и нос биологических жидкостей пациентов при работе.
Маски следует заменять, когда они станут влажными. Нельзя опускать их на шею, использовать повторно. Все маски должны полностью закрывать рот и нос.
Высококачественные одноразовые маски намного эффективнее, чем обычные марлевые или бумажные.
Порядок снятия маски:
* снять маску, прикасаясь только к завязкам;
* поместить маску в емкость с крышкой для последующей дезинфекции;
* 4-х-слойную марлевую маску меняют каждые 4 часа.
Защитные барьеры (щитки, очки) для глаз и лица необходимы, чтобы предохранить глаза от брызг крови или жидких выделений организма. Защитные очки и лицевую маску тщательно моют теплой водой с мылом в конце рабочего дня и протирают насухо стерильной салфеткой. Хранят в шкафу на полке вместе с аптечкой первой помощи.
Основная цель халатов и полиэтиленовых фартуков — исключить попадание биологических жидкостей пациентов на одежду и кожу персонала. Смена халата производится ежедневно или чаще, если это необходимо. Запрещается производить стирку халатов на дому.
Порядок снятия халата.
* снять халат вначале с одной руки, касаясь только нижней части рукавов
* снять халат со второй руки, прикасаясь к нему изнутри и выворачивая его наизнанку;
* поместить халат в емкость с маркировкой «Грязное белье»;
Снять кольца, перстни и другие украшения, так как они затрудняют эффективное удаление микроорганизмов; открыть кран;
с помощью дозатора налить в ладонь жидкое мыло;
под умеренной струей комфортно теплой воды энергично намылить руки жидким мылом из разового дозатора;
тереть ладонью о ладонь;
тереть правой ладонью по тыльной стороне левой руки;
тереть левой ладонью по тыльной стороне правой руки;
сложив ладони, тереть внутренние поверхности пальцев движениями вверх и вниз;
тереть тыльной стороной пальцев по ладони другой руки;
тереть пальцы круговыми движениями;
поочередно круговыми движениями тереть ладони сжатыми пальцами;
Каждое движение следует повторять 5 раз!
* высушить руки двумя бумажными салфетками;
* салфетку сбросить в пакет «Отходы класса А»
* закрыть кран локтем или запястьем
Запрещается закрывать кран руками!
Регистрация аварийных ситуаций
Мероприятия при возникновении аварийных ситуаций:
При повреждении емкости, разливе биологических субстратов:
использовать защитную одежду: перчатки, фартук, маску или щиток;
ограничить место аварии ветошью и залить его дезинфицирующим раствором (3% раствором хлорамина; 0,1% раствором Жавелиона; 6% перекисью водорода и т.д.) на 1 час;
через час собрать разбитую емкость с помощью совка, выбросить, поверхности вымыть водой;
перчатки повторному использованию не подлежат.
При повреждении кожных покровов инструментами, загрязненными биологическими жидкостями пациента:
выдавить кровь из ранки,
обработать 70 0 спиртом,
вымыть руки под проточной водой с двукратным намыливанием,
обработать ранку 5% настойкой йода.
При попадании биологических жидкостей пациентов на слизистую глаз:
* промыть под проточной водой,
* закапать 20 % раствор сульфацила-натрия или промыть 0,05% раствором марганцевокислого калия (разведение 1 : 10000);
При попадании биологических жидкостей пациентов на слизистую носа:
* промыть под проточной водой,
* промыть 0,05% раствором марганцевокислого калия;
При попадании биологических жидкостей пациентов на неповрежденную кожу:
* обработать кожу 70 0 спиртом,
* вымыть руки под проточной водой с двукратным намыливанием,
* повторно обработать 70 0 спиртом,
При попадании биологических жидкостей пациентов на слизистую рта:
* прополоскать 0,05% раствором марганцевокислого калия или 70 0 спиртом;
Внимание! Категорически запрещается тереть слизистые оболочки, загрязненные кровью или другими биологическими жидкостями.
В случае повреждения пробирки с кровью во время работы центрифуги:
Состав аптечки первой помощи при аварийной ситуации:
5% спиртовая настойка йода;
20 % раствор сульфацила-натрия;
навески марганцевокислого калия для приготовления 0,05% раствора (50 мг на 100 мл воды);
бинт, лейкопластырь, напальчники, перчатки.
Порядок регистрации аварийных ситуаций
и перечень необходимых мероприятий.
В случае возникновения аварийной ситуации следует:
поставить в известность госпитального эпидемиолога, старшую медицинскую сестру, заведующего отделением;
зарегистрировать данный факт в журнале учета аварийных ситуаций, который хранится у старшей сестры.
Форма ведения журнала:
Дата и время аварийной ситуации
ФИО пострадавшего, должность
Обстоятельства, характеристика травмы
ФИО пациента, сведения об инфицировании
Мероприятия при травме
Даты и результаты лабораторного обследования пострадавшего (код 120)
В графе 4 отмечаются данные лабораторного обследования пациента (если таковые имеются) на HВsAg, анти-ВГС и ВИЧ на момент аварийной ситуации.
По каждому случаю проводится расследование в соответствии с положением о порядке рассмотрения и учета несчастного случая на производстве, составляется акт о несчастном случае по форме Н-1 в 2-х экземплярах.
Медицинским работникам после аварийных ситуаций рекомендуется практиковать безопасные сексуальные отношения, не планировать беременность, отказаться от донорства в течение 6 месяцев.
Экстренная химиопрофилактика при аварийных ситуациях:
Решение о начале посттравматической профилактике (ПТП) принимается комиссией в составе: ответственного врача по ВИЧ-инфекции (врач КДК, ЦПБС) и заместителя главного врача с учетом всех особенностей зарегистрированного случая в больнице.
Химиотерапия должна проводиться не позднее первых 24 часов с момента аварийной ситуации.
7 правил универсальных мер безопасности медицинского персонала от инфекции
Медицинскому персоналу следует помнить и применять 7 правил безопасности для защиты кожи и слизистых оболочек при контакте с кровью или жидкими выделениями организма любого пациента.
1. Мыть руки до и после любого контакта с пациентом.
2. Рассматривать кровь и биологические жидкости всех пациентов как потенциально инфицированные и работать с ними только с использованием СИЗ.
3. Сразу после применения помещать использованные шприцы, системы, сосудистые катетеры в специальный контейнер для утилизации острых предметов, после выполнения манипуляции не снимать иглу со шприца (катетера, системы) до полного их обеззараживания.
4. Пользоваться средствами защиты глаз и масками для предотвращения возможного попадания брызг крови или других жидких выделений в лицо.
5. Использовать специальную влагонепроницаемую одежду для защиты тела от возможного попадания брызг крови или жидких выделений.
6. Рассматривать все белье, запачканное кровью или жидкими выделениями, как потенциально инфицированное.
7. Рассматривать все образцы лабораторных анализов как потенциально инфицированные.
Точное выполнение инструкций по санитарно–гигиеническим и противоэпидемическим требованиям в стационарах ЛПУ, дезинфекционно-стерилизационному режиму, правил личной гигиены и безопасной работы.
Профилактика внутрибольничных заражений больных и персонала.
Контроль и анализ основных режимных моментов:
Случаев внутрибольничных заражений гнойно-септических инфекций, вирусных гепатитов, инфекционных заболеваний (совместно с госпитальным эпидемиологом).
Технологии выполнения инвазивных манипуляций, соблюдения правил асептики.
Дезинфекции предметов ухода.
Дезинфекции и стерилизации изделий медицинского назначения.
Наличия дезинфекционных средств, соблюдения правил их хранения.
Наличия мерной посуды, маркировки, соответствия количеству приготавливаемого раствора.
Показателей качества дезинфекции и стерилизации изделий медицинского назначения.
Результатов бактериологического лабораторного обследования объектов внешней среды на общую микробную обсемененность (ОМО) и стерильности различных материалов.
Выполнения требований по безопасной работе с кровью и биосредами.
Использования средств индивидуальной защиты (СИЗ).
Наличия, маркировки уборочного инвентаря, правила его использования и хранения.
Выполнения требований к соблюдению бельевого режима.
Выполнения требований к уборке отделения.
Обработки посуды, соблюдения режимных моментов в раздаточной.
Утилизации отходов отделения согласно класса опасности.
Наличия нормативной документации, учетно-отчетных форм.
Обучения персонала отделения мерам профилактики и защиты от внутрибольничных инфекций.
Санитарно-гигиенический режим отделений
Перед поступлением больного в палату кровать, прикроватную тумбочку, подставку для подкладного судна протереть ветошью, смоченной дезинфицирующим раствором. Кровать застелить постельными принадлежностями, прошедшими камерную обработку.
Больному выделить индивидуальные предметы ухода: плевательницу, поилку, кружку или стакан, подкладное судно (по необходимости) и т.д., которые после использования тщательно мыть.
После выписки больного предметы индивидуального пользования подвергнуть обеззараживанию по режиму, предусмотренному для вирусных гепатитов.
При поступлении в больницу больной должен иметь предметы личной гигиены.
Больных с педикулезом, первично обработанных в приемном отделении, взять под особое наблюдение и подвергнуть повторной обработке в отделении.
Каждый пациент обязан принимать гигиеническую ванну в отделении не реже 1 раза в 7 дней (если нет медицинских противопоказаний) с отметкой в истории болезни. Гигиенический уход за тяжелобольными (умывание, протирание кожи лица, частей тела, полоскание полости рта и т.д.) проводится утром, а также после приема пищи и при загрязнении тела. Периодически должны быть организованы стрижка и бритье больных.
Смену нательного и постельного белья производить по мере загрязнения, но не реже 1 раза в 7 дней.
При смене нательного и постельного белья аккуратно собрать его в специальные полиэтиленовые или клеенчатые мешки «Для грязного белья». Разборку грязного белья производить в отделении категорически запрещается.
Ежедневно перед сном и утром больные должны умываться. Перед каждым приемом пищи больные обязаны мыть руки.
Больным запрещается пользоваться для сидения кроватями соседних больных. Медицинским работникам запрещается сидеть на кроватях больных.
Проветривание палат производить не реже 4 раз в день: после ночного и дневного сна и перед ночным и дневным сном.
Установленные режимом часы сна должны строго соблюдаться всеми больными и не нарушаться персоналом больницы.
Выход больных без необходимости для обследования в другие отделения запрещается.
Выписку больных производить в специально отведенном месте.
Постель (матрац, подушку, одеяло) после выписки больного подвергнуть камерной обработке.
Уборку палат проводить не реже 2 раз в день влажным способом с применением дезинфицирующих средств по режиму, предусмотренному типом стационара.
Все емкости, используемые в отделении, маркировать согласно назначению и использовать в соответствие с маркировкой.
После выписки больного из отделения сестра – хозяйка обязана:
Санитарное содержание помещений, оборудования, инвентаря
Коридоры, лестницы моются 2 раза в рабочую смену с применением разрешенных дезинфицирующих средств по режиму, предусмотренному типом стационара.
Перед дневным, после дневного и перед ночным сном выносится мусор и проводится влажная уборка пола. Используется уборочный инвентарь с маркировкой «для палат».
Проветривание проводится перед сном и после сна (4 раза в сутки), после влажной уборки и после ультрафиолетового облучения палат.
Используется уборочный инвентарь с маркировкой «коридор».
Туалеты, ванные комнаты подвергаются генеральной уборке ежедневно ночью, с применением дезинфицирующих средств.
Используется уборочный инвентарь с маркировкой «для туалета».
Уборка производится в специально – выделенном халате и перчатках.
Все помещения, оборудование, медицинский инвентарь должны содержаться в чистоте.
Влажная уборка помещений (мытье полов, протирка мебели, подоконников, дверей и т.д.) – не менее 2-х раз в сутки с применением моющих (мыльно-содовых растворов и других, разрешенных дезинфицирующих средств).
Протирка оконных стекол – не реже 1 раза в месяц изнутри и по мере загрязнения, но не реже 1 раза в 4 месяца снаружи.
Генеральная уборка помещений с тщательным мытьем стен, полов, всего оборудования, а также протирания мебели, светильников, защитных жалюзи от пыли проводится по утвержденному графику отделения:
o Операционные блоки, перевязочные, смотровые, манипуляционные кабинеты, палаты интенсивной терапии – 1 раз в 7 дней;
o Остальные помещения – не реже 1 раза в месяц;
Весь уборочный инвентарь (ведра, ветошь, тряпкодержатели) хранятся в специально выделенном помещении.
На уборочном инвентаре должна стоять четкая маркировка с указанием помещения и видов работ.
Емкости для мытья полов и помещений хранятся раздельно и используются строго по назначению.
После завершения работы весь уборочный инвентарь обрабатывается дезсредством, выдерживая экспозицию, затем ветошь прополаскивается водой, высушивается и хранится в емкости с соответствующей маркировкой.
Палатная медицинская сестра контролирует работу, выполняемую младшим медицинским персоналом:
o Рациональное использование дезрастворов;
o Использование необходимых концентраций дезрастворов для дезинфекции предметов ухода (суден, мочеприемников, плевательниц);
o Качество проведения текущей, заключительной и генеральной уборок;
o Содержание, хранение и использование уборочного инвентаря.
Бельевой режим
Непосредственную ответственность за соблюдение бельевого режима в отделении несут старшие медицинские сестры.
Бельевым режимом отделения предусматривается смена белья больным не реже 1 раза в 7 дней; родильницам – 1 раз в 3 дня, нательного белья и полотенец – ежедневно, подкладных салфеток – по мере необходимости. Перед возвращением пациента в палату после операции производится обязательная смена белья. После операции смена белья производится систематически до прекращения выделений из ран;
в операционных, акушерских стационарах (родильных блоках и других помещениях с асептическим режимом, а также в палатах для новорожденных) должно применяться стерильное белье;
В лечебно-диагностических кабинетах белье используется строго индивидуально для каждого пациента.
Спецодежда персонала родильных отделений, отделении реанимации и интенсивной терапии, оперблоков, процедурных и перевязочных кабинетов, ЦСО, инфекционных больниц (отделений) меняется ежедневно и по мере загрязнения. Спецодежда персонала других отделений меняется 1 раз в 3 дня, а также по мере загрязнения.
Стирка спецодежды медицинского персонала в домашних условиях не допускается.
Сбор, хранение и транспортирование грязного белья
За сбор, хранение и транспортирование грязного белья в отделении ответственность несет сестра – хозяйка отделения.
К сбору, сортировке, счету, транспортированию грязного белья не допускается медицинский персонал, занятый уходом за больными или принимающий участие в различных манипуляциях и исследованиях.
Персонал, работающий с грязным бельем, должен быть обеспечен санитарной одеждой (халат, косынка) и средствами индивидуальной защиты (перчатки, косынка, халат, маска или респиратор). После окончания работы с грязным бельем санитарную одежду направляют в стирку, перчатки и маску обеззараживают в дезинфицирующем растворе, руки обрабатывают одним из антисептических средств и моют водой с мылом.
Для сбора грязного белья в палатах используют специальную тару (мешки из клеенки, полипропилена, баки с крышками, бельевые тележки и т.д.)
При сборе грязного белья запрещается встряхивать его и бросать на пол.
После смены белья в палатах проводят влажную уборку с использованием дезинфицирующих растворов. Для этой цели используют дезинфекционные средства, разрешенные к применению в присутствии больных (0,06% раствор Жавелиона, 3%-ный раствор перекиси водорода с 0,5%-ным раствором моющего средства и другие).
Грязное белье из отделений в упакованном виде на промаркированных тележках (для грязного белья) или специальным автотранспортом доставляется в помещение для сбора грязного белья в больничную прачечную (или в центральную грязновую при отсутствии прачечной лечебного учреждения).
Допускается временное хранение (не более 12 ч) грязного белья в отделениях в санитарных комнатах или других специально отведенных для этой цели помещениях с водостойкой отделкой поверхностей, оборудованных умывальником, устройством для обеззараживания воздуха, в закрытой таре (металлических, пластмассовых бачках, плотных ящиках и других емкостях, подвергающихся дезинфекции).
Производить сдачу белья и спецодежды следует строго в установленные дни в соответствии с утвержденным графиком.
Запрещается разборка грязного белья в отделениях.
Выдача, транспортирование чистого белья
Выдача белья в отделения производится в установленном порядке по утвержденному в медицинском учреждении графику.
Чистое белье выдается на основании накладной, полученной при сдаче белья в стирку.
Для предотвращения возможного загрязнения чистое белье транспортируется в подразделения, упакованное по 10 кг в чистые холщовые мешки.
В отделениях, в помещении для хранения чистого белья, мешки снимают, а белье размещают на стеллажах. Выдается белье сестрой – хозяйкой по мере надобности.
Уборка помещений по типу текущей дезинфекции
Создание безопасной чистой окружающей среды для пациентов и медперсонала.
Разрушение и сведение к минимуму большинства болезнетворных микроорганизмов на поверхности неживых предметов.
Снижение риска перекрестного заражения.
Показания: все помещения лечебно-профилактического учреждения (палаты, кабинеты, вспомогательные помещения), в которых могут находиться пациенты и медперсонал.
Дезинфицирующие /моющие растворы, разрешенные к применению в установленном законом порядке.
Емкости для дезинфицирующих растворов
Уборочный инвентарь либо стационарная или переносная система влажно-вакуумной очистки.
Защитная одежда для медперсонала (комбинезон или халат, влагостойкий фартук, головной убор, 4-слойная маска, перчатки из плотной резины, моющаяся обувь на низком каблуке).
Регулярность уборок: влажная уборка – 2 раза в день, уборка с дезинфицирующими средствами – не реже 1 раза в день.
Убрать весь материал со стерильного стола;
надеть халат «Для уборки кабинета» и резиновые перчатки;
ветошью с дезинфицирующим раствором в концентрации раствора по режиму, предусмотренному для вирусных гепатитов протереть горизонтальные поверхности, столы и др.;
ветошь погрузить в емкость с дезинфицирующим раствором;
в ведре с маркировкой «Для мытья полов» приготовить дезинфицирующий раствор в концентрации по режиму, предусмотренному для вирусных инфекций;
прополоскать и отжать ветошь, вылить раствор в канализацию;
налить в ведро чистой воды, прополоскать ветошь, слить воду в канализацию;
убрать ведро и ветошь в помещение, предназначенное для ее хранения;
вымыть с мылом руки в перчатках, перчатки снять и убрать в тумбочку;
снять и убрать в отведенное для хранения место рабочий халат;
провести гигиеническое мытье рук;
надеть медицинский халат, колпак или косынку;
включить бактерицидный облучатель (время экспозиции зависит от типа облучателя);
после окончания экспозиции бактерицидного облучения проветрить помещение;
после окончания экспозиции бактерицидного облучения и проветривания кабинет готов к работе.
Контроль качества: по результатам бактериологического исследования проб воздуха и смывов с вымытых поверхностей.
Ультрафиолетовое облучение палат, помещений
Время расчета ультрафиолетового облучения помещений проводит главный инженер или другое ответственное лицо по учету бактерицидных установок. Экспозиция облучение зависит от типа и объема помещения, типа бактерицидной установки и фиксируется ответственным лицом в журнал по установленной форме в соответствии с методическим руководством (табл.10).
■ Осуществляется палатными медицинскими сестрами 2 раза в сутки после проведения влажной уборки помещений.
■ Время ультрафиолетового облучения – 20-30 минут (в зависимости от мощности лампы).
■ В отделении пульмонологии – 2 раза в сутки.
■ В отделении гематологии – 2 раза в сутки. Палаты с пациентами, находящимися в миелостатической депрессии – 6-8 раз в сутки.
■ В отделении прогрессирующих заболеваний нервной системы – 2 раза в сутки.
Допустимые уровни бактериальной обсемененности воздушной среды помещений ЛПУ в зависимости от их функционального назначения и класса чистоты (СанПиН 2.1.3.1275-03 «Гигиенические требования к размещению, устройству, оборудованию и эксплуатации больниц, родильных домов и других лечебных стационаров»).
Общее количество микроорганизмов в 1 м 3 воздуха (ОМЧ), КОЕ/м 3
Количество колоний Staphylococcus aureus в 1 м 3 воздуха, КОЕ/м 3
Количество плесневых и дрожжевых грибов в 1 дм воздуха
Операционные, родзалы, асептические боксы для гематологических, ожоговых пациентов, палаты для недоношенных детей, асептический блок аптек, стерилизационная (чистая половина), боксы бактериологической лаборатории
Процедурные, перевязочные, предоперационные, палаты и залы реанимации, детские палаты, комнаты сбора и пастеризации грудного молока, ассистентские и фасовочные аптек, помещения бактериологических и клинических лабораторий, предназначенных для проведения исследований
Палаты хирургических отделений, коридоры, примыкающие к операционным, родильным залам, смотровые, боксы и палаты инфекционных отделений, ординаторские, материальные, кладовые чистого белья
Коридоры и помещения административных зданий, лестничные марши, санитарные комнаты, туалетные комнаты, комнаты для грязного белья и временного хранения отходов
Уборка по типу заключительной дезинфекции
■ Сведение до минимума количества микроорганизмов после полной уборки помещений.
■ Снижение риска перекрестных заражений.
■ Помещения операционного блока, хирургических, перевязочных, процедурных и других манипуляционных кабинетов.
■ Регулярное проведение – 1 раз в 7 дней, график проведения утвержден заведующим отделением.
■ Дезинфицирующие /моющие растворы, разрешенные к применению в установленном законом порядке.
■ Уборочный инвентарь либо стационарная или переносная система влажно-вакуумной очистки.
■ Защитная одежда для медперсонала (комбинезон или халат, влагостойкий фартук, головной убор, 4-слойная маска, перчатки из плотной резины, моющаяся обувь на низком каблуке).
надеть рабочий халат;
освободить поверхности рабочих и перевязочных столов;
освободить шкафы и ящики столов, оставив их открытыми или выдвинутыми; шкафы, столы, оборудование отодвинуть от стен;
надеть защитные очки, перчатки, респиратор;
приготовить в емкости гидропульта дезинфицирующий раствор;
с помощью гидропульта нанести на стены, окна, двери, внутренние поверхности шкафа, тумбочек, столов и другие поверхности дезинфицирующий раствор в концентрации, предусмотренной для режима «вирусные гепатиты» из расчета 0.2л на 1 м2. Если не используется гидропульт, то стены и потолок моют с помощью длинного держателя ветоши;
покинув помещение, плотно закрыть дверь;
выдержать время экспозиции дезинфицирующего раствора;
по окончании экспозиции приготовить в емкостях «Для дезинфекции поверхностей» и «Для мытья пола» приготовить 0.5% моющий раствор;
вымыть стены стерильной ветошью на полную высоту и горизонтальные поверхности, пригласить электрика и протереть плафоны;
прополоскать, тщательно отжать ветошь;
вылить остатки моющего раствора в канализацию;
приготовить в емкости «Для дезинфекции поверхностей» дезинфицирующий раствор (по режиму, предусмотренному для вирусных гепатитов);
протереть все предметы, извлеченные из шкафа и столов (кроме коробок с лекарственными препаратами);
вылить использованный дезинфицирующий раствор;
в ведре с маркировкой «Для мытья пола» приготовить 0.5% раствор моющего средства;
прополоскать и отжать ветошь, вылить раствор в канализацию;
налить в ведро чистой воды, прополоскать ветошь, слить воду в канализацию;
ветошь оставить в расправленном виде для высушивания;
убрать ведро и ветошь в помещение, предназначенное для ее хранения;
вымыть с мылом руки в перчатках, перчатки снять и убрать в тумбочку;
снять и убрать в отведенное для хранения место рабочий халат;
провести гигиеническое мытье рук;
надеть чистый медицинский халат, колпак или косынку;
включить бактерицидный облучатель (время экспозиции зависит от типа облучателя).
после окончания экспозиции бактерицидного облучения выключить облучатель
Уборочный инвентарь после дезинфекции обеззаразить, прополоскать ветошь, высушить и хранить в специальном шкафу или выделенном месте.
Анализ регистрируемых внутрибольничных инфекций.
Анализ результатов бактериологического обследования проб воздуха и смывов с обработанных поверхностей.
Смывы с объектов внешней среды и стерильность материалов проводит лицензированная бактериологическая лаборатория ЛПУ или Лаборатории Роспотребнадзора (согласно договора). Отбор проб производит специально обученный лаборант в стерильные емкости или пробирки. Медицинскому персоналу подразделений ЛПУ самостоятельно производить отбор проб запрещается!
Гигиенические требования при организации питания больных в отделении
Для транспортирования готовой пищи в отделения используют термосы или плотно закрывающуюся посуду. Хлеб можно транспортировать в полиэтиленовых или клеенчатых мешках, хранение хлеба в которых не допускается. Раздачу пищи производят в течение 2 часов после ее изготовления. Не допускается оставлять в буфетных остатки пищи после ее раздачи больным, а также смешивать пищевые остатки со свежими блюдами.
Раздачу пищи больным производят буфетчицы и дежурные медицинские сестры отделения в халатах с маркировкой «Для раздачи пищи». Не допускается к раздаче пищи младший обслуживающий персонал.
В местах приема передач и в отделениях должны быть вывешены списки разрешенных (с указанием их предельного количества) для передачи продуктов.
Ежедневно медицинская сестра отделения должна проверять соблюдение правил и сроков годности (хранения) пищевых продуктов, хранящихся в холодильниках отделения и тумбочках больных. При обнаружении пищевых продуктов с истекшим сроком годности (хранения), хранящихся без целлофановых пакетов (в холодильнике), без указания фамилии больного, а также имеющих признаки порчи они должны изыматься в пищевые отходы. О правилах хранения больной должен быть информирован при поступлении в отделение.
Для обработки посуды необходимо использовать моющие, чистящие и дезинфицирующие средства, разрешенные к применению в лечебных учреждениях в установленном порядке. В моечных отделениях вывешивают инструкцию о правилах мытья посуды и инвентаря с указанием концентраций и объемов применяемых моющих и дезинфицирующих средств.
Обработка столовой, чайной посуды, столовых приборов должна проводиться раздельно в следующей последовательности:
После каждой раздачи пищи производят тщательную уборку помещений буфетных в отделениях с применением дезинфицирующих средств. Уборочный материал после мытья полов заливают раствором дезсредств в том же ведре, которое использовалось для уборки, далее ополаскивают в воде и сушат.
Классификация медицинских отходов
1. Лечебно-профилактическое учреждение вне зависимости от его профиля и коечной мощности в результате своей деятельности образует различные по фракционному составу и степени опасности отходы.
2. Все отходы здравоохранения разделяются по степени их эпидемиологической, токсикологической и радиационной опасности на пять классов опасности (табл.11):
Класс А. Неопасные отходы лечебно-профилактических учреждений.
Класс Б. Опасные (рискованные) отходы лечебно-профилактических учреждений.
Класс В. Чрезвычайно опасные отходы лечебно-профилактических учреждений.
Класс Г. Отходы лечебно-профилактических учреждений, по составу близкие к промышленным.
Класс Д. Радиоактивные отходы лечебно-профилактических учреждений.
Классификация отходов ЛПУ
Характеристика морфологического состава
Отходы, не имеющие контакта с биологическими жидкостями пациентов, инфекционными больными, нетоксичные отходы. Пищевые отходы всех подразделений ЛПУ кроме инфекционных (в т.ч. кожно-венерологических), фтизиатрических. Мебель, инвентарь, неисправное диагностическое оборудование, не содержащее токсичных элементов. Неинфицированная бумага, смет, строительный мусор и т.д.
Класс Б Опасные (рискованные)
Потенциально инфицированные отходы. Материалы и инструменты, загрязненные выделениями, в т.ч. кровью. Выделения пациентов. Патологоанатомические отходы. Органические операционные отходы (органы, ткани и т.п.). Все отходы из инфекционных отделений (в т.ч. пищевые). Отходы из микробиологических лабораторий, работающих с микроорганизмами 3—4-й групп патогенности. Биологические отходы вивариев.
Материалы, контактирующие с больными особо опасными инфекциями. Отходы из лабораторий, работающих с микроорганизмами 1—4-й групп патогенности. Отходы фтизиатрических, микологических больниц. Отходы от пациентов с анаэробной инфекцией
Отходы, по составу близкие к промышленным
Просроченные лекарственные средства, отходы от лекарственных и диагностических препаратов, дез.средства, не подлежащие использованию, с истекшим сроком годности. Цитостатики и другие хим-препараты. Ртутьсодержащие предметы, приборы и оборудование.
Все виды отходов, содержащих радиоактивные компоненты.
Общие правила организации системы сбора, временного хранения и транспортирования отходов в ЛПУ
1. Организованная на территории ЛПУ система сбора, временного хранения и транспортирования отходов должна состоять из следующих звеньев:
сбора отходов внутри медицинского подразделения;
транспортирования и перегрузки отходов в (меж)корпусные контейнеры;
временного хранения отходов на территории ЛПУ;
транспортирования внутри-(меж)корпусных контейнеров к месту обезвреживания отходов.
Порядок проведения работ для каждого звена определяется соответствующими разделами санитарных правил «Правила сбора, хранения и удаления отходов в ЛПУ». В каждом лечебном учреждении разрабатывается и утверждается система сбора, временного хранения и удаления отходов различных классов опасности.
2. К отходам, образующимся на территории лечебно-профилактического учреждения, в зависимости от их класса, предъявляются различные требования по сбору, временному хранению и транспортированию.
3. Смешение отходов различных классов на всех стадиях их сбора, хранения и транспортирования недопустимо.
22.1. При выявлении в отделении больных с подозрением на острую кишечную инфекцию, носителей возбудителей острых кишечных инфекций (ОКИ) обеспечить:
1. изоляцию больного ОКИ в инфекционный стационар или, как исключение, в отдельную палату в случае необходимости продолжения лечения в отделении больницы;
2. карантин в палате и медицинское наблюдение за контактными в течение 7 дней со дня изоляции больного (носителя), измерение температуры тела утром и вечером;
3. забор материала (рвотные массы, промывные воды, испражнения) для бактериологического исследования;
4. однократное бактериологическое обследование контактных по палате;
5. проведение текущей и заключительной дезинфекции в палате с обязательной камерной дезинфекцией постельных принадлежностей;
6. выделение отдельной посуды для питания больных с обязательной дезинфекцией по режиму для кишечных инфекций.
7. передать экстренное извещение на больного по ф.058/у, с обязательной записью в журнале (ф.060/у)
22.2. Перечень предметов, входящих в укладки для забора материала при особо опасных инфекциях:
1. Стерильная укладка:
1. банки широкогорлые с крышками или притертыми пробками, емкостью не менее 100 мл
2. стеклянные трубки с резиновой грушей малого калибра