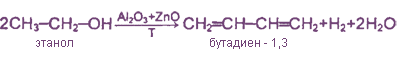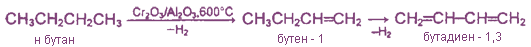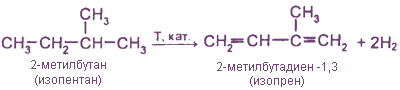Что такое сопряженные диены
Диены с изолированными связями
Если двойные связи разделены в углеродной цепи двумя или более одинарными связями (например, пентадиен-1,4), то такие двойные связи называются
Химические свойства алкадиенов с изолированными двойными связями не отличаются от свойств алкенов с той лишь разницей, что в реакции могут вступать не одна, а две двойные связи независимо друг от друга.
Диены с сопряженными связями
Если двойные связи разделены в цепи только одной одинарной s-связью, то их называют
Важнейшие представители сопряженных диенов:

Диены с кумулированными связями
Существуют также диены с системой С = С = С, называемые
— двойные связи находятся у одного атома углерода, такие двойные связи называют
Строение сопряженных алкадиенов
Далее рассмотрим только сопряженные диены, имеющие большое практическое значение.
В сопряженных диенах р-электронные облака двойных связей перекрываются между собой и образуют единое π-электронное облако. В сопряженной системе p-электроны уже не принадлежат определенным связям, они делокализованы по всем атомам, поэтому структуру диенов можно изобразить следующим образом (на примере бутадиена):
Изомерия и номенклатура
Для алкадиенов характерны те же
1) изомерия углеродного скелета;
2) изомерия положения двойных связей;
Номенклатура
Главную цепь в диенах выбирают так, чтобы она содержала обе двойные связи, и нумеруют с того конца, при котором сумма номеров положений двойных связей минимальна. В названии соответствующего алкана окончание
Физические свойства
Получение
Бутадиен-1,3
2. Дегидрирование н. бутана
Изопрен
Дегидрирование 2-метилбутана
Хлоропрен (2-хлорбутадиен-1,3)
Димеризация ацетилена и гидрохлорирование образующегося винилацетилена
Химические свойства
Для алкадиенов характерны обычные реакции электрофильного присоединения АE, свойственные алкенам. Наибольшее значение имеют диены с сопряженными связями, так как они являются сырьем для получения каучуков. В химическом поведении этих диенов есть особенности, обусловленные наличием в их молекулах сопряжения. Особенность сопряженных диенов состоит в том, что две двойные связи в их молекулах функционируют как единое целое, поэтому реакции присоединения могут протекать в двух направлениях:
а) к одной из двойных связей (1,2-присоединение)
б) в крайние положения сопряженной системы с образованием новой двойной связи в центре системы (1,4-присоединение).
1. Реакции присоединения
Так, присоединение брома к бутадиену может привести к двум продуктам:
Подбор реагентов и условий реакций позволяет направлять присоединение по любому из двух направлений.
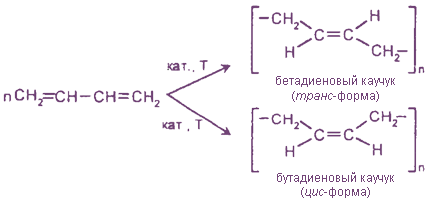
2. Реакции полимеризации (образуются синтетические каучуки)
Использование металлоорганических катализаторов в этой реакции позволяет получить каучук с регулярным строением, в котором все звенья цепи имеют цис-конфигурацию. Аналогичная реакция с изопреном дает синтетический изопреновый каучук, который по строению и свойствам близок к природному каучуку:
Применение
Каучуки
Диеновые углеводороды полимеризуются и сополимеризуются с различными виниловыми мономерами с образованием каучуков, из которых в процессе вулканизации получают различные сорта резин.
Что такое сопряженные диены
4. АЛКАДИЕНЫ (ДИЕНОВЫЕ УГЛЕВОДОРОДЫ, ДИОЛЕФИНЫ)
Диеновые углеводороды – это углеводороды, содержащие в своей структуре две двойные связи. Общая формула – СnН2n-2.
Простейшим представителем алкадиенов является аллен, или пропадиен Н2С=С=СН2.
Для некоторых алкадиенов сохранились тривиальные названия.
В зависимости от взаимного расположения двойных связей алкадиены делятся на три группы.
1. Алкадиены с кумулированными двойными связями – алленовые углеводороды. В алленовых углеводородах двойные связи находятся в положении 1,2.
Представителем является аллен.
2. Алкадиены с изолированными двойными связями. Двойные связи отделены друг от друга двумя и большим числом простых связей.
3. Алкадиены с сопряженными, конъюгиро-ванными двойными связями. Двойные связи разделяются одной простой связью. Первым представителем этого ряда является дивинил, или бутадиен-1,3.
Так, в молекуле бутадиена-1,3 длина связи С2–С3 составляет 0,148 нм, тогда как длина связи С–С в этане – 0,154 нм. Энергия сопряжения бутадиена-1,3 составляет примерно 15 кДж/моль.
Алкадиены с изолированными двойными связями построены аналогично алкенам.
Особенности строения алкадиенов различных типов сказываются на их реакционной способности. Диены с кумулированными и изолированными связями напоминают по химическим свойствам алкены, вступая в реакции присоединения с участием двух двойных связей самостоятельно.
Для сопряженных диенов характерны некоторые особенности в химических свойствах.
АЛКАДИЕНЫ С СОПРЯЖЕННЫМИ СВЯЗЯМИ
1. Каталитическое дегидрирование алканов и алкенов. Это промышленный метод получения дивинила (бутадиена-1,3) и изопрена (2-метилбутадиена-1,3). Катализаторами реакции являются Cr2O3/А12O, (смешанный оксидный алюмохромовый катализатор).
2. Способ СВ. Лебедева. По этому методу бутадиен-1,3 получают из этилового спирта путем одновременного каталитического дегидрирования и дегидратации на смешанном цинкалюминиевом катализаторе:
Сопряженные диены проявляют ненасыщенный характер. Наличие сопряженной системы в их молекуле приводит к тому, что они присоединяют различные вещества не только по месту одной двойной связи (1,2-присоединения), но и к крайним атомам сопряженной системы с перемещением двойной связи (1,4-присоединение). Соотношение этих продуктов зависит от условий проведения реакции и природы электрофильного реагента.
1. Гидрирование. Водород в момент выделения образует с алкадиенами-1,3 обычно продукты 1,4-присоединения, например:
В присутствии катализаторов (Ni, Pt) диены-1,3 присоединяют водород в 1,2- и 1,4-положения с образованием соответствующих алкенов, которые подвергаются дальнейшему гидрированию до алканов:
2. Присоединение галогенов. Присоединение галогенов приводит к образованию смеси продуктов 1,2- и 1,4-присоединения. Как правило, при повышении температуры и переходе от хлора к йоду возрастает выход продукта 1,4-присоединения. Например, в процессе бромирования бутадиена-1,3 при температуре –80 °С образуется преимущественно продукт 1,2-присоединения, а при 40 °С – продукт 1,4-присоединения:
Присоединение галогенов к сопряженным алкадиенам происходит по электрофильному механизму. Особенность механизма состоит в том, что электрофильная частица атакует концевой атом углерода сопряженной системы, поскольку при этом образуется мезомерно стабилизированный карбкатион, строение которого можно представить граничными структурами I и II:
Последующая атака карбкатиона бромид-ионом приводит к образованию продуктов 1,2-(Ш) и 1,4-присоединения (IV):
3. Присоединениегалогеноводородов. Присоединение галогеноводо-родов также происходит с образованием продуктов 1,2- и 1,4-присоединения:
4. Реакция Дильса – Альдера (диеновый синтез). Реакция основана на взаимодействии сопряженных диенов с веществами, имеющими в своем составе двойную или тройную углерод-углеродную связь (так называемыми диенофилами). В процессе реакции диеновые углеводороды присоединяют диенофилы в положение 1,4 с образованием циклических структур:
Эта реакция является качественной на соединения, содержащие сопряженные двойные связи. Протекает по молекулярному механизму, который характеризуется синхронным процессом разрыва и образования связей в реагентах ([4+2]-циклоприсоединение).
5. Полимеризация. Важным свойством сопряженных диенов является их склонность к полимеризации, причем полимеризация происходит предпочтительно по положениям 1 и 4 как по ионному, так и по свободнорадикальному механизму:
При полимеризации замещенных диенов 1,4-присоединение осуществляется по принципу «голова к хвосту»
Реакция полимеризации широко используется в производстве синтетического каучука.
А что же такое натуральный каучук? Его получают из латекса (млечный сок) тропического растения гевеи, произрастающей главным образом в Бразилии. Выделяющийся при подсочке деревьев млечный сок содержит 20–60 % каучука, который осаждают добавлением муравьиной или уксусной кислоты.
По химическому строению натуральный каучук представляет собой линейный стереорегулярныи полимер изопрена (полиизопрен), имеющий цис-конфигураиию изопреновых звеньев:
Молекулярная масса натурального каучука составляет в среднем 100 000-150 000.
Химические свойства алкадиенов
Алкадиены – это непредельные (ненасыщенные) нециклические углеводороды, в молекулах которых присутствуют две двойные связи между атомами углерода С=С.
Общая формула алкадиенов CnH2n-2 (как у алкинов, а также циклоалкенов), где n ≥ 3.
Наличие двух двойных связей между атомами углерода очень сильно влияет на свойства углеводородов. В этой статье мы подробно остановимся на свойствах, способах получения и особенностях строения алкадиенов.
Химические свойства сопряженных алкадиенов
Сопряженные алкадиены – непредельные нециклические углеводороды, в молекулах которых две двойные связи образуют сопряженную систему.
Химические свойства алкадиенов похожи на свойства алкенов. Алкадиены также легко вступают в реакции присоединения и окисления.
| Химические свойства сопряженных алкадиенов отличаются от алкенов некоторыми особенностями, которые обусловлены делокализацией электронной плотности π-связей. |
1. Реакции присоединения
Для алкадиенов характерны реакции присоединения по одной из двойных связей С=С, либо по обоим связям. Реакции с водой, галогенами и галогеноводородами протекают по механизму электрофильного присоединения. При присоединении одной молекулы реагента к алкадиену рвется только одна двойная связь. При присоединении двух молекул реагента к алкадиену разрываются обе двойные связи.
| Помимо присоединения по одной из двух двойных связей (1,2-присоединение), для сопряженных диенов характерно так называемое 1,4-присоединение, когда в реакции участвует вся делокализованная система из двух двойных связей, реагент присоединяется к 1 и 4 атому углерода сопряженной системы, а двойная связь образуется между 2 и 3 атомами углерода. |
1.1. Гидрирование
Гидрирование алкадиенов протекает в присутствии металлических катализаторов, при нагревании и под давлением.
При присоединении одной молекулы водорода к дивинилу образуется смесь продуктов (бутен-1 и бутен-2):
Соотношение продуктов 1,2- и 1,4- присоединения зависит от условий реакции.
| При комнатной и повышенной температуре основным продуктом реакции является 1,4-продукт (бутен-2). |
При полном гидрировании дивинила образуется бутан:
1.2. Галогенирование алкадиенов
Присоединение галогенов к алкадиенам происходит даже при комнатной температуре в растворе (растворители — вода, CCl4).
| При взаимодействии с алкадиенами красно-бурый раствор брома в воде (бромная вода) обесцвечивается. Это качественная реакция на двойную связь. |
| Например, при взаимодействии бутадиена-1,3 с бромной водой преимущественно протекает 1,4 присоединение и образуется 1,4-дибромбутен-2: |
Побочным продуктом бромирования дивинила является 3,4-дибромбутен-1:
При полном бромировании дивинила образуется 1,2,3,4-тетрабромбутан:
1.3. Гидрогалогенирование алкадиенов
Алкадиены взаимодействуют с галогеноводородами. При присоединении хлороводорода к бутадиену-1,3 преимущественно образуется 1-хлорбутен-2:
3-Хлорбутен-1 образуется в небольшом количестве.
При присоединении полярных молекул к алкадиенам образуется смесь изомеров. При этом выполняется правило Марковникова.
| Правило Марковникова: при присоединении полярных молекул типа НХ к алкадиенам водород преимущественно присоединяется к наиболее гидрогенизированному атому углерода при двойной связи. |
1.5. Полимеризация
Полимеризация — это процесс многократного соединения молекул низкомолекулярного вещества (мономера) друг с другом с образованием высокомолекулярного вещества (полимера).
nM → Mn (M – это молекула мономера)
| Полимеризация алкадиенов протекает преимущественно по 1,4-механизму, при этом образуется полимер с кратными связями, называемый каучуком. |
Продукт полимеризации дивинила (бутадиена) называется искусственным каучуком:
При полимеризации изопрена образуется природный (натуральный) каучук:
2. Окисление алкадиенов
Реакции окисления в органической химии сопровождаются увеличением числа атомов кислорода (или числа связей с атомами кислорода) в молекуле и/или уменьшением числа атомов водорода (или числа связей с атомами водорода).
В зависимости от интенсивности и условий окисление можно условно разделить на мягкое и жесткое.
2.1. Мягкое окисление алкадиенов
Мягкое окисление алкадиенов протекает при низкой температуре в присутствии перманганата калия. При этом раствор перманганата обесцвечивается.
В молекуле алкадиена разрываются только π-связи и окисляются атомы углерода при двойных связях. При этом образуются четырехатомные спирты.
| Обесцвечивание алкадиенами водного раствора перманганата калия, как и в случае алкенов – качественная реакция на двойную связь. |
2.2. Жесткое окисление
При жестком окислении под действием перманганатов или соединений хрома (VI) происходит полный разрыв двойных связей С=С и связей С-Н у атомов углерода при двойных связях. При этом у окисляемых атомов углерода образуются связи с атомами кислорода.
Так, если у атома углерода окисляется одна связь, то образуется группа С-О-Н (спирт). При окислении двух связей образуется двойная связь с атомом углерода: С=О, при окислении трех связей — карбоксильная группа СООН, четырех — углекислый газ СО2.
Можно составить таблицу соответствия окисляемого фрагмента молекулы и продукта:
| Окисляемый фрагмент | KMnO4, кислая среда | KMnO4, H2O, t |
| >C= | >C=O | >C=O |
| -CH= | -COOH | -COOK |
| CH2= | CO2 | K2CO3 |
При окислении бутадиена-1,3 перманганатом калия в среде серной кислоты возможно образование щавелевой кислоты и углекислого газа:
2.3. Горение алкадиенов
Алкадиены, как и прочие углеводороды, горят в присутствии кислорода с образованием углекислого газа и воды.
В общем виде уравнение сгорания алкадиенов выглядит так:
Диены — номенклатура, получение, характерные химические свойства
Алкадиены (диены) – непредельные алифатические углеводороды, молекулы которых содержат две двойные связи. Общая формула алкадиенов СnH2n-2.
Свойства алкадиенов в значительной степени зависят от взаимного расположения двойных связей в их молекулах. По этому признаку различают три типа двойных связей в диенах:
1) изолированные двойные связи разделены в цепи двумя или более s-связями:
2) кумулированные двойные связи расположены у одного атома углерода:
СН2=С=СН2 (подобные диены (аллены) менее стабильны, чем другие диены и при нагревании в щелочной среде перегруппировываются в алкины);
3) сопряженные двойные связи разделены одной s-связью:
Перекрывание р-орбиталей молекулы бутадиена имеет место не только между С1 – С2, С3 – С4, но и между С2 – С3. В связи с этим применяют термин: «сопряженная система». Следствием делокализации электронной плотности является то, что длины связей С1 – С2 (С3 – С4) увеличены, по сравнению с длиной двойной связи в этилене (0,132 нм) и составляют 0,137 нм; в свою очередь, длина связи С3 – С4 меньше, чем в этане С – С (0,154 нм) и составляет 0,146 нм. Диены с сопряженной системой двойных связей более энергетически выгодны.
Номенклатура алкадиенов
По правилам IUPAC главная цепь молекулы алкадиена должна включать обе двойные связи. Нумерация атомов углерода в цепи проводится так, чтобы двойные связи получили наименьшие номера. Названия алкадиенов производят от названий соответствующих алканов (с тем же числом атомов углерода) с добавлением окончания –диен.
Виды изомерии алкадиенов:
Структурная изомерия:
1) изомерия положения сопряженных двойных связей;
2) изомерия углеродного скелета;
3) межклассовая (изомерны алкинам)
Пространственная изомерия — диены, имеющие различные заместители при углеродных атомах у двойных связей, подобно алкенам, проявляют цис-транс-изомерию.
Способы получения алкадиенов

Химические свойства алкадиенов

Для сопряженных диенов характерны реакции присоединения (реакции 1, 2). Наличие сопряженной системы p-электронов приводит к особенностям реакций присоединения. Сопряженные диены способны присоединять не только по двойным связям (С1 и С2, С3 и С4), но и к концевым (С1 и С4) атомам углерода сообразованием двойной связи между С2 и С3. Соотношение продуктов 1,2- и 1,4-присоединения зависит от температуры, при которой проводился эксперимент и от полярности применяемого растворителя.
Восстановление (реакция 3) с помощью [Na + C2H5OH] называется восстановлением водородом в момент выделения (при взаимодействии натрия и спирта выделяется водород). Алкены в таких условиях не восстанавливаются, это отличительное свойство сопряженных диенов.
Полимеризация (реакция 4) важнейшее свойство сопряженных диенов, которая происходит под действием различных катализаторов (AlCl3, TiCl4+(C2H5)3Al) или света. В случае применения определенных катализаторов можно получить продукт полимеризации с определенной конфигурацией цепей.
Цис-конфигурацию имеет натуральный каучук. Макромолекулы натурального каучука имеют спиралевидную структуру цепи из-за того, что изопреновые звенья изогнуты, что создает пространственные препятствия упорядоченному расположению цепей. В каучуке длинные молекулы скручены в спутаны друг с другом в спирали. При растяжении каучука спирали растягиваются, а при снятии напряжения они снова скручиваются. В природе существует еще другой полимер изопрена гуттаперча (транс-конфигурация). Гуттаперча обладает стержнеобразной структурой цепи из-за выпрямленности изопреновых звеньев (цепи с транс-конфигурацией двойных связей могут располагаться одна вдоль другой), поэтому гуттаперча твердый, но хрупкий полимер. Натуральный каучук имеют немногие страны и поэтому его заменяют синтетическими каучуками из дивинила, а также из изопрена.
Для практического использования каучуки превращают в резину.
Резина – это вулканизованный каучук с наполнителем (сажа). Суть процесса вулканизации заключается в том, что нагревание смеси каучука и серы приводит к образованию трехмерной сетчатой структуры из линейных макромолекул каучука, придавая ему повышенную прочность. Атомы серы присоединяются по двойным связям макромолекул и образуют между ними сшивающие дисульфидные мостики.
Сетчатый полимер более прочен и проявляет повышенную упругость – высокоэластичность (способность к высоким обратимым деформациям).
В зависимости от количества сшивающего агента (серы) можно получать сетки с различной частотой сшивки. Предельно сшитый натуральный каучук – эбонит – не обладает эластичностью и представляет собой твердый материал.