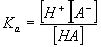Что такое сопряженные кислоты и основания
Что такое сопряженные кислоты и основания
Теоретические представления в органической химии
Кислоты и основания
Йоханес Бренстед и Томас Лоури (1923) сформулировали общую протолитическую теорию кислот и оснований. Они сформулировали определения:
Кислота есть молекула или ион, способные отдавать протон.
Основание есть молекула или ион, способные присоединять протон. Основание – акцептор протонов.
Кислота, отдавая протон, превращается в сопряженное основание. Основание, присоединяя протон, превращается в сопряженную кислоту. Эти пары частиц называют сопряженными кислотно-основными парами. Чем сильнее кислота, тем слабее сопряженное основание и наоборот.
Существуют амфолиты – молекулы или ионы, способные как отдавать, так и присоединять протон, и, следовательно, проявляют свойства кислот и оснований (вода, аминокислоты).
Протолитическое, или кислотно-основное, равновесие устанавливается в результате конкуренции за протон между основаниями взаимодействующих сопряженных кислотно-основных пар. Протолитическое равновесие всегда смещается в сторону образования более слабой кислоты.
Протолитическое равновесие наблюдается при ионизации слабых электролитов в воде. Анион слабой кислоты и вода, как слабое основание, конкурируют за протон. Это – обратимый процесс и он характеризуется константой равновесия Ка :
Константу кислотности Ка часто заменяют показателем кислотности рКа , равным отрицательному десятичному логарифму константы кислотности. Значение рКа равно значению рН водного раствора.
Чем меньше рКа, тем больше кислотность соединения.
Кислотность органических соединений колеблется в очень широких пределах рКа: от 40 для углеводородов, до 0,2 трифторуксусной кислоты (как у сильных минеральных кислот).
Самыми сильными органическими основаниями являются алифатические амины, имеющие рКа для сопряженной кислоты (RNH3 + ), равным »10.
Более общее определение кислот и оснований предложено Гилбертом Ньютоном Льюисом. Кислота – это акцептор электронных пар для дополнения своей электронной оболочки. Основания Льюиса – доноры электронных пар (анионы или нейтральные молекулы). Свойства кислот Льюиса проявляют различные частицы: протон, ионы соли металлов (Al, Fe, Zn, Sn,…), имеющих вакантные d-орбитали низкой энергии и др.
Кислотность некоторых органических соединений в воде.
Вкратце, это можно представить как следующую химическую реакцию:
Кислота + Основание ⇌ Конъюгат Основа + Конъюгат Кислота
СОДЕРЖАНИЕ
Кислотно-основные реакции
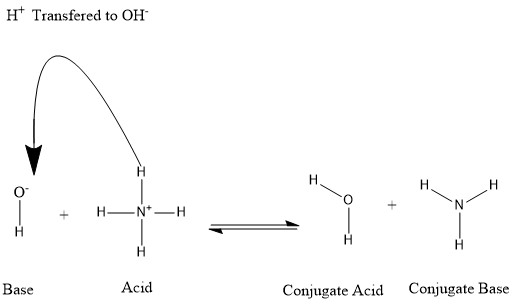
В кислотно-основной реакции кислота плюс основание реагирует с образованием конъюгированного основания и конъюгированной кислоты:
Конъюгаты образуются, когда кислота теряет протон водорода или основание приобретает протон водорода. См. Следующий рисунок:
Сила конъюгатов
Определение пар конъюгата кислота-основание
Рассмотрим следующую кислотно-щелочную реакцию:
Приложения
Кроме того, вот таблица общих буферов.
Таблица кислот и их сопряженных оснований
В таблице ниже приведены несколько примеров кислот и их сопряженных оснований; обратите внимание, как они отличаются всего на один протон ( ион H + ). Сила кислоты уменьшается, а сила сопряженного основания увеличивается вниз по таблице.
Таблица оснований и их сопряженных кислот
Напротив, вот таблица оснований и сопряженных с ними кислот. Точно так же сила основания уменьшается, а сила конъюгированной кислоты увеличивается вниз по таблице.
Что такое сопряженные кислоты и основания
5. КИСЛОТНОСТЬ И ОСНОВНОСТЬ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ
В настоящее время для оценки кислотности и основности соединений, в том числе и органических, применяют две теории: теория Бренстеда и теория Льюиса. Теория Бренстеда (1923 г.) является протолитической или протонной теорией кислот и оснований, а теория Льюиса (1925 г.) – апротонной или электронной теорией кислот и оснований.
КИСЛОТНОСТЬ И ОСНОВНОСТЬ ПО БРЕНСТЕДУ
Согласно теории Бренстеда, кислотой называют соединение, способное отдавать протон, т. е. кислота – донор протона, а основание – соединение, способное присоединять протон, т. е. основание является акцептором протона.
Теория Бренстеда называется протонной или протолитической теорией кислот и оснований, так как определения кислота и основание взаимосвязаны между собой процессом присоединения и отщепления протона.
Кислотно-основный процесс, согласно теории Бренстеда, может быть представлен следующей схемой:
Кислота А–Н, теряя протон, превращается при этом в основание АӨ, которое называется сопряженным основанием данной кислоты. Основание же В, присоединяя протон за счет неподеленной пары электронов, превращается в кислоту ВН+, которая является сопряженной данному основанию.
Таким образом, кислота А–Н и сопряженное основание АӨ, основание В и сопряженная кислота ВН+ образуют две сопряженные кислотно-основные пары.
Кислотность и основность соединений – понятия относительные. Эти два свойства неразрывно связаны между собой и проявляются одновременно, т. е. если одно соединение в данной реакции выступает в роли кислоты, то другое обязательно – в роли основания. Определенное соединение может быть кислотой по отношению к одному веществу и основанием по отношению к другому. Относительность этих понятии становится очевидной при рассмотрении конкретного примера.
Уксусная кислота, которая в воде проявляет кислотные свойства, в безводной серной кислоте ведет себя как основание.
Количественно силу кислот и оснований можно выразить с помощью константы равновесия данной реакции. Величину константы равновесия чаше всего определяют в водной среде. Для реакции:
Учитывая то, что вода в данной реакции выступает в роли растворителя, т. е. концентрация ее практически не изменяется (55,6 моль·л-1), концентрацией воды можно пренебречь. В данном случае константу равновесия называют константой кислотности или константой диссоциации К и выражают формулой:
Любая протолитическая реакция обратима и характеризуется константой диссоциации.
Большинство органических соединений, проявляющих кислотные свойства, в водной среде являются слабыми кислотами, константы которых выражаются малыми величинами. Например, Кa уксусной кислоты при 25°С равна 1,76·10-5. Оперировать такими малыми величинами в практической работе не удобно, поэтому используют значения рКa – показатель константы – отрицательный логарифм константы диссоциации: рКa = – lgKa (например: рКa для СН3СООН равняется 4,75).
Рассматривая зависимость между значениями величин Кa, рКa и силой кислоты, следует отметить одну закономерность: чем больше величина Кa (константа кислотности), тем сильнее кислота, чем больше величина рКa, тем кислота слабее.
Подобно кислотам силу оснований иногда выражают величиной Кb (константа основности), характеризующей легкость, с которой основание отрывает протон от воды:
Для удобства пользуются величиной рКb
При этом, чем меньше рКb, тем сильнее соответствующее основание. Однако намного удобнее выражать степень ионизации кислот и оснований в одной шкале (в шкале рКb) подобно тому, как значение рН одинаково хорошо характеризует и кислотность, и основность. Для основания величина рКa обычно означает кислотность сопряженной кислоты – протонной формы основания рК+вн. Сопряженная кислота в виде R–NH3 отдавая протон, превращается в основание R–NH4+.
Типы органических кислот
В зависимости от природы элемента, который связан с атомом водорода, кислоты разделяют на четыре основные группы:
Наряду с указанными типами кислот известны кислоты: Si-H, Р–Н, As–H, т. е. кислотой может быть любое соединение, содержащее связь А–Н и способное к отщеплению протона. Теория Бренстеда применима к любым типам кислот, способным к диссоциации с разрывом связи элемент–водород.
Кислотность соединений в основном определяется устойчивостью образующегося аниона, которая обусловлена делокализацией (распределением) отрицательного заряда.
Чем устойчивее сопряженное основание, тем сильнее кислота. Устойчивость аниона определяется следующими факторами: природой атома, связанного с атомом водорода (реакционный и кислотный центр); электронодонорными или электроноакцепторными свойствами заместителя, связанного с реакционным центром, и природой растворителя.
При равных других факторах устойчивость анионов, а следовательно, и кислотность возрастают с увеличением электроотрицательности и поляризуемости атомов кислотного центра. С увеличением электроотрицательности увеличивается сила, с которой атом может удержать пару электронов после отщепления водорода. Поскольку в пределах периода периодической системы электроотрицательность атомов возрастает слева направо (поляризуемость не меняется), то ОН-кислоты сильнее соответствующих NH-кислот, а те, в свою очередь, сильнее СН-кислот, например:
В пределах группы периодической системы электроотрицательность атомов уменьшается сверху вниз, но увеличивается их объем, а следовательно, возрастает поляризуемость, т. е. возможность делокализации внешнего электронного облака. Это способствует повышению стабильности аниона и приводит к возрастанию кислотности. Поэтому SH-кислоты обладают большей кислотностью, чем ОН-кислоты, например:
Наряду с природой кислотного центра и строением радикала, значительное влияние на проявление кислотных свойств оказывает растворитель. Наиболее эффективным растворителем является вода, она имеет высокую диэлектрическую постоянную и способна связывать катионы и анионы за счет сольватации. Эффект сольватации приводит к устойчивости образовавшегося аниона, а следовательно, кислотность соединений возрастает.
Типы органических оснований
Согласно теории Бренстеда, любое соединение, способное присоединять протон, может выступать в роли основания; это могут быть как нейтральные молекулы, так и заряженные частицы. В нейтральных молекулах для проявления основных свойств необходимо наличие атома с неподеленной парой электронов или наличие кратной связи. Основаниями могут быть анионы: алкоксид-ион ROӨ; алкилмеркаптид-ион RSӨ, карбанион R3CӨ (триалкилметанид-ион) и другие.
В n-основаниях центром основности, или центром протонирования (местом присоединения протона), чаше всего выступают такие элементы, как азот, кислород, сера. В зависимости от центра основности ониевые основания делятся на три основные группы:
Основность органических соединений в основном определяется устойчивостью образовавшегося катиона, которая обусловлена делокализацией положительного заряда.
На основность значительное влияние оказывает электроотрицательность и поляризуемость элементов, составляющих центр основности, электронодонорное или электроноакцепторное влияние радикала, связанного с центром основности, и природа растворителя.
Большая электроотрицательность атомов основного центра способствует более прочному удержанию им неподеленнои электронной пары, что характеризует меньшую основность соединения, иначе говоря. чем больше электроотрицательность атома, тем меньше основность. Таким образом, аммониевые основания проявляют более сильные основные свойства по сравнению с оксониевыми. Увеличение же поляризуемости атома приводит к уменьшению основности сопряженного основания и увеличению кислотности сопряженной кислоты. Поэтому сульфониевые основания слабее оксониевых.
Существенную роль в проявлении основных свойств играет растворитель. Эффект сольватации способствует устойчивости образовавшегося катиона, а следовательно, приводит к повышению основности.
КИСЛОТЫ И ОСНОВАНИЯ ЛЬЮИСА
Теория кислот и оснований Льюиса, в отличие от теории Бренстеда, является более обшей. Согласно этой теории основанием считается любая частица (атом, молекула или анион), способная отдавать электронную пару для образования ковалентной связи, а кислотой – любая частица (атом, молекула, катион), способная принимать пару электронов с образованием ковалентной связи.
То есть, по Льюису, основание является донором, а кислота – акцептором пары электронов. Из приведенного определения видно, что основания Льюиса тождественны основаниям Бренстеда. Однако кислоты Льюиса охватывают более широкий круг соединений.
Кислотой Льюиса считается любая частица, имеющая вакантную орбиталь.
Согласно теории Льюиса, к кислотам относятся не только соединения, отщепляющие протон (протонные кислоты), но и другие вещества, имеющие вакантную орбиталь и способные принимать пару электронов (апротонные кислоты). Кислотами Льюиса, например, являются такие соединения, как BF4, AlC13, FeCl3, SbCl3, ZnCl2, HgCl3 и др.
Кислотно-основный процесс по Льюису состоит в образовании ковалентнои связи между основанием и кислотой за счет электронной пары основания и вакантной орбитали кислоты. Так, основания Льюиса, имеющие неподеленные пары электронов, образуют с кислотами Льюиса n-комплексы:
Легкость протекания кислотно-основного взаимодействия по Льюису определяется силой кислоты и основания.
Билет №8
1. Кислотность и основность органических соединений. Теории Бренстеда и Льюиса. Сопряжённые кислоты и основания. Кислотные свойства спиртов, простых эфиров, карбоновых кислот, аминов, гидроксид-, алкоксид-, енолят-, ацилат-ионов. Кислотно-основные свойства пиррола, имидазола, пиридина. Общие закономерности в изменении кислотных и основных свойств.
Важными аспектами реакционной способности органических соединений является их кислотные и основные свойства. Для описания кислотных и основных свойств химических соединений существует несколько теорий – теория Бренстеда и Лоури, теория Льюиса и ряд других. Наиболее распространенной является теория Бренстеда и Лоури, или протолитическая теория. По теории Бренстеда – Лоури кислоты – это нейтральные молекулы или ионы, способные отдавать протон (доноры протона), а основания – это нейтральные молекулы или ионы, способные присоединять протон (акцепторы протона).
Кислота и основание образуют сопряжённую кислотно-основную пару, в которой существует обратная зависимость между силой кислоты и основания. Чем стабильнее анион, тем сильнее сопряженная кислота.
Для слабых оснований кислотность определяется константой равновесия реакции:
Чем больше величина её, тем сильнее кислота. Однако для удобства обчно используют pK=-lgK.
Типы кислот по Льюису:
2. Электронодефицитные молекулы с вакантными орбиталями на валентном уровне, например, галогениды бора и алюминия, имеющие вакантную р-орбиталь, соединения кремния, фосфора и р-элементов больших периодов, имеющие вакантные nd-орбитали.
Типы оснований по Льюису:
2. Молекулы с неподеленными электронными парами, например, аммиак, амины, спирты, эфиры, кетоны и др.
Такое распределение электронной плотности обусловливают несколько реакционных центров:
• кислотный центр в составе группы ХН;
• основный центр – гетероатом Х (кислород, сера или азот с неподеленной парой электронов);
• электрофильный центр – α-атом углерода, непосредственно связанный с гетероатомом Х;
• нуклеофильный центр – гетероатом Х;
• СН-кислотный центр – с участием β-атома углерода, связанного с электрофильным центром.
В зависимости от природы элемента, с которым связан протон, различают следующие кислоты Брёнстеда:
• OH-кислоты (спирты, фенолы, карбоновые кислоты);
• SH-кислоты (тиолы, тиофенолы);
• CH-кислоты (углеводороды и их производные).
Для прогнозирования кислотных свойств используют качественный подход, основанный на оценке возможности отщепления протона, которая возрастает с увеличением электроотрицательности элемента в кислотном центре. Другим, зачастую более важным критерием, позволяющим оценивать кислотные свойства близких по строению соединений, является стабильность аниона, образующегося при ионизации кислоты. Чем стабильнее анион, тем сильнее сопряженная кислота. Эти факторы могут действовать в одинаковом или противоположном направлении, и в каждом случае их нужно рассматривать в совокупности.
Одноатомные спиртыявляются нейтральными веществами. Они практически не взаимодействуют со щелочами, но вступают в реакцию со щелочными металлами, образуя соли – алкоксиды металлов.
Фенолы по сравнению со спиртами проявляют более заметные кислотные свойства. Повышенная кислотность фенолов обусловлена лучшей делокализацией заряда в феноксид-ионе, чем в алкоксид-ионах, благодаря р,π-сопряжению (в скобках приведены pKa соответствующих нейтральных соединений).
Обладая относительно невысокой кислотностью, фенолы образуют соли только с сильными основаниями, например гидроксидом натрия, а со слабыми основаниями, например гидрокарбонатом натрия NaHCO3, в реакцию не вступают.
Тиолыобладают большей кислотностью, чем соответствующие спирты, поскольку тиолят-ионы стабильнее алкоксидионов вследствие большего атомного радиуса серы по сравнению с радиусом кислорода (фактор поляризуемости) и, следовательно, более эффективной делокализации отрицательного заряда на атоме серы.
В соответствии с достаточно высокой кислотностью тиолы при обработке водным раствором щелочи превращаются в соли.
Кислотность аминов и тем более углеводородовзначительно ниже кислотности спиртов. Причиной этого является меньшая электроотрицательность атомов азота и углерода по сравнению с атомом кислорода. Это снижает возможность отщепления протона и в то же время приводит к меньшей стабильности анионов (сопряженных оснований) с зарядом на атомах азота и углерода.
В π-основаниях, к которым относятся алкены и арены, центром основности, т. е. местом присоединения протона, являются электроны π-связи. Это очень слабые основания, так как протонируемые пары электронов несвободны.
В результате присоединения протона к нейтральной молекуле основания образуются солеобразные ониевыесоединения.
В зависимости от природы гетероатома могут образовываться соли:
• аммониевые (центр основности – атом азота);
• оксониевые (центр основности – атом кислорода);
• сульфониевые (центр основности – атом серы).
Наибольшей основностью среди органических соединений обладают амины. Основность рассматриваемых классов соединений с одинаковыми заместителями при гетероатоме увеличивается в ряду:
Ароматические амины значительно менее основны, чем алифатические, что связано с делокализацией неподеленной пары электронов азота благодаря р,π-сопряжению с ароматической системой и, следовательно, с меньшей доступностью для атаки протоном. Тем не менее, анилин легко образует соли с минеральными кислотами.
Влияние заместителей в углеводородной части молекулы на основность противоположно рассмотренному выше влиянию их на кислотность. Электронодонорные заместители увеличивают основность, электроноакцепторные – уменьшают.
Спирты и простые эфиры как очень слабые основания могут протонироваться только сильными кислотами. Образующиеся соли легко гидролизуются.
Енолят-анионы проявляют двойственную реакционную способность, присоединяя электрофильные агенты по атомам О или С (соседнему с карбонильной группой). Направление реакции определяется строением енолят-аниона, природой противоиона, характером растворителя и природой электрофильного агента; реакционная способность ионных пар ниже, чем свободного иона (ниже изображён енолят-ион).
Алкоксид-ион СН3-СН2-О- будет обладать низкой стабильностью и поэтому проявляет слабовыраженные кислотные свойства.
Гидроксид-ион является сильным основанием и в значительных количествах присутствует в растворах щелочей.
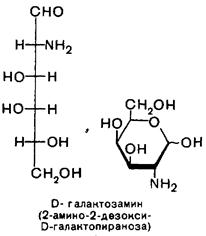
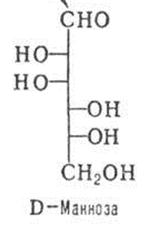
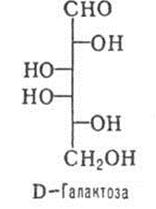
2. Моносахариды. Классификация, стереоизомерия, D- и L-стереохимические ряды. Формулы фишера и Хеуорса. Фуранозы и пиранозы, α- и β-аномеры. Цикло-оксо (кольчато-цепная)-таутомерия. Конформация пиранозных форм моносахаридов. Строение рибозы, ксилозы, глюкозы, маннозы, галактозы, фруктозы, 2-дезоксирибозы, глюкозамина, маннозамина, галактозамина.
Классификация моносахаридов: альдозы (моносахариды содержащие альдегидную группу), кетозы (моносахариды содержащие кетогруппу) Моносахариды в зависимости от длины углеродной цепи (3-10 атомов) делятся на триозы, пентозы, гексозы, гептозы и т.д.
Относительная конфигурация моносахаридов, т.е. принадлежность к D- или L-стереохимическому ряду, определяется путем сравнения конфигурации хирального атома углерода имеющего наибольший номер, с конфигурацией хирального центра в D- или L-глицериновом альдегиде
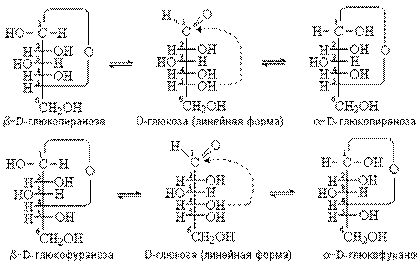
Пяти- и шестиугольные цепи могут иметь клешневидную конформацию. За счет внутримолекулярного воздействия гидроксильной и альдегидной (кетонной) групп в такой конформации образуется циклический полуацеталь. В циклической группе появляется дополнительный центр хиральности (ранее ассиметрический атом углерода входил в оксогруппу). Это хиральный центр называется аномерным. У α-аномера конфигурация совпадает с конфигурацией «концевого» хирального центра. У β-аномера – противоположна. С переходом моносахарида из циклической формы в оксоформу связано явление цикло-оксо таутомерии. В растворе одновременно существуют все три возможные формы (оксоформа и два аномера).
Для пяти- и шестичленных цепей может быть характерна клешневидная конформация. У альдогексоз в реакцию с альдегидной группой приемущественно вступает гидроксильная групп С-5’, так как при этом образуется термодинамически устойчивый шестичленный цикл (пиранозный). Если в реакцию вступает гидроксильная группа у С-4, то полуацеталь содержит пятичленный цикл, называемый фуранозным. Аномерные атомы углерода в α и β-формах имеют противоположную конфигурацию. Но из-за наличия нескольких центров хиральности не являются энантиомерами, а относятся как диастереомеры. Эпимеры и аномеры являются частным случаем диастереомеров. Эпимеры различаются конфигурацией только одного хирального атома углерода. Аномеры – конфигурации отличающиеся по аномерному атому.
Циклические формы моносахаридов изображают в виде перспективных формул Хеуорса, в которых циклы показывают в виде плоских многоугольников, лежащих перпендикулярно плоскости рисунка. Атом кислорода располагают в пиранозном цикле в дальнем правом углу, в фуранозном – за плоскостью цикла. Символы атомов углерода в циклах не указывают.Формулы Фишера неудобны для изображения оксидного цикла, поэтому в циклической форме их принято записывать формулами Хеуорса. Правила перехода от формул Фишера к формулам Хеуорса:
1. В формуле Фишера производят четное число перестановок заместителей при том атоме углерода, гидроксильная группа которого участвует в образовании цикла. Внизу должна оказаться ОН – группа.
2. Все заместители, находящие слева от линии углеродной цепи в фишеровской проекции, располагают над плоскостью Хеуорса.
Установлено, что из двух конформаций пиранозного цикла в D-глюкопиранозе осуществляется та, в которой все большие по размеру заместители – первичноспиртовая и гидроксильные группы – находятся в эваториальном положении. Полуацетальная гидроксильная группа у β-аномера D-глюкопиранозы занимает экваториальное положение, у α-аномера – аксиальное положение. Поэтому в смеси преобладает β-аномер (68%). Стремление RO-группы занять не экваториальное, а аксиальное положение в данном случае связано с так называемым аномерным эффектом.Он является результатом отталкивания между сближенными в пространстве электронными парами двух атомов кислорода.



3. Какие продукты образуются при гидролизе амида масляной кислоты?
Кислотный гидролиз необратим. Реакционная способность амидов в реакциях ацилированя низкая и NH2-плохоуходящая группа, поэтому для гидролиза необходим кислотный катализ.
4. Напишите схему реакции образования лактона из 2-амино-4-гидроксибутановой кислоты.
5. Объясните прототропную таутомерию на примере имидазола и пурина.
Прототропная таутомерия – таутомерия, при которой мигрирующей группой является протон.
Дата добавления: 2015-02-10 ; просмотров: 203 ; Нарушение авторских прав