Что такое сосудистая инвазия
Что такое сосудистая инвазия
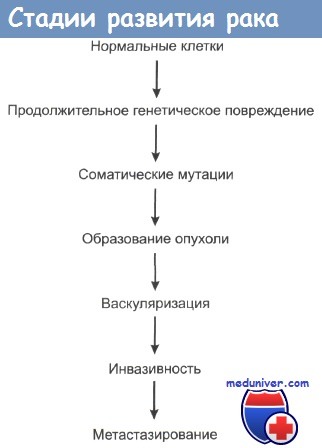
Можно сказать, что раковые клетки в определенной степени не реагируют на механизмы, контролирующие рост и развитие нормальной ткани. При пролиферации нормальной ткани непосредственный контакт клетки со своими соседями обычно служит сигналом к прекращению размножения. Это контактное торможение отсутствует в опухолевых тканях.
При подкожном введении раковых клеток иммунодефицитным мышам происходит рост и развитие опухоли, что никогда не случается при введении здоровых клеток. Раковые клетки отличаются от здоровых по составу мембранных гликопротеинов, по микропотенциалам на клеточной мембране, а также характеризуются повышенным содержанием сиаловой кислоты. Локомоторный клеточный аппарат (микротрубочки и микрофиламенты) раковых клеток деградирует, клетка теряет присущие ей формы, отмечается миграция цитоплазмы раковой клетки в зону контакта со здоровыми клетками.
Одновременно раковые клетки становятся локально инвазивными, хотя биохимические основы этого свойства до сих пор четко не выявлены. Опухолевые клетки часто демонстрируют пониженную адгезивность в сравнении с нормальными клетками. Важным моментом механизма инвазии является секреция определенных ферментов. Некоторые ферменты играют ключевую роль в протеолизе внутриклеточного матрикса, который всегда сопровождает инвазию раковых клеток. К таким ферментам относится семейство матричных металлопротеиназ (ММП), которое включает в себя колллагеназы, желатиназы и стромолизины.
Эти ферменты экскретируются в неактивной форме. Последующий разрыв сульфгидрильной группы и присоединение атома металла (чаще всего цинка) приводят к изменению конформации фермента и переводят его в активное состояние. Тканевые ингибиторы металлопротеиназ (ТИМП) прекращают действие этих ферментов. Некоторые типы тканей изначально обладают повышенной устойчивостью к инвазии. Это, например, компактная костная ткань, ткани крупных сосудов и хрящевая ткань. Предположительно способность к инвазии у опухолевых клеток появляется в результате трансформации нормальных процессов реконструкции и восстановления здоровых тканей. Тем не менее к настоящему моменту неизвестно, какие конкретно изменения генетической структуры раковых клеток ответственны за инвазивный рост.
По мере роста опухоли она выделяет в кровь ангиогенные факторы, которые стимулируют прорастание опухоли кровеносными сосудами и формирование сети капилляров. Сосудистая система кровоснабжения опухоли может стать мишенью для различных видов противораковой терапии. Опухоль стимулирует пролиферацию эндотелиальных клеток, выделяя ангиогенные цитокины, такие как эндотелиальный фактор роста сосудов (ЭФРС), ТФР и факторы роста фибробластов. Эндотелиальные же клетки в свою очередь могут стимулировать рост клеток опухоли. В одном грамме опухолевой ткани может находиться до 10-20 млн эндотелиальных клеток, которые не являются неопластическими.
Антигены нормальных эндотелиальных клеток, включая и профакторы свертываемости крови, могут быть разрегулированы в активно пролиферирующей под действием опухоли эндотелиальной ткани. В дополнение к действию цитокинов, гипоксия, развивающаяся в сети опухолевого кровоснабжения, может стимулировать выбросы ЭФРС и других факторов. В ходе ангиогенеза эндотелиальные клетки внедряются в строму опухоли, активно делятся там с образованием зачатков новых капилляров, которые затем развиваются в сосудистую систему опухоли. Как и в случае инвазии опухолевых клеток, этот процесс идет с участием продуцируемых эндотелием ММП и их естественных ингибиторов.
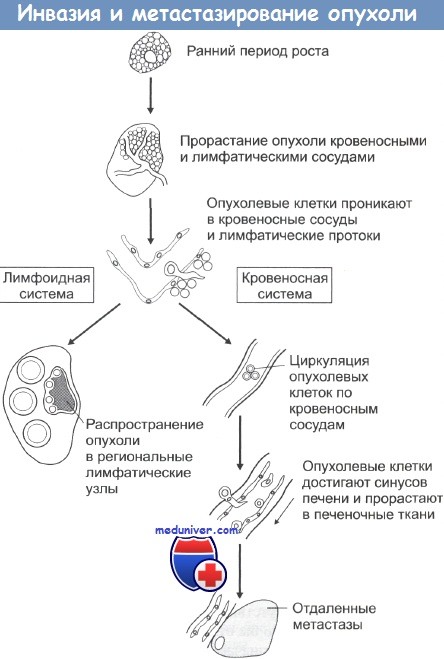
При локальной инвазии рака опухолевые клетки могут попадать в сосудистую систему и давать начало метастазам. Последовательность событий при метастазировании показана на рисунке. Распространение раковых клеток по лимфатической системе, что особенно характерно при карциномах, происходит при попадании опухолевых клеток в лимфатические протоки с последующим оседанием их в местах разветвления протоков и в ближайших лимфатических узлах. Вслед за этим обычно происходит инфильтрация опухолевыми клетками и отдаленных лимфоузлов. Распространение через кровяное русло проходит при проникновении раковых клеток в кровеносные сосуды рядом с местом первичной локализации опухоли либо через грудные протоки. Подхваченные током крови раковые клетки затем захватываются ближайшими капиллярными сетями, чаще всего сетями печени и легких, и оседают в них. При оценке направлений метастазирования очень важно учитывать первичную локализацию опухоли.
Например, опухоли пищеварительного тракта обычно метастазируют через воротную вену в печень. Опухоли также могут метастазировать непосредственно сквозь прилегающие ткани. Так возникающие в брюшной полости новообразования могут очень быстро рассеяться по всему внутрибрюшинному пространству, а клетки рака легкого могут мигрировать через плевру. Некоторые опухоли метастазируют в определенные органы и ткани, другие — бессистемно. Саркомы, например, почти всегда метастазируют в легкие, рак молочной железы поражает также ткани осевого скелета. Тем не менее биологических механизмов, объясняющих такую избирательность, пока не найдено.
Региональные лимфоузлы могут осуществлять барьерную функцию, предотвращая распространение метастазов за пределы области первичной локализации опухоли. До сих пор четко не выяснено, каким образом и за счет каких специфических иммунных механизмов лимфатические узлы создают барьер на пути распространения опухоли.
Проникая в кровеносное русло в районе первичной опухоли, раковые клетки затем могут достигать других органов и тканей. Для того чтобы дать начало новым очагам опухоли, эти клетки на новом месте должны, во-первых, проникнуть в ткани через эндотелий капилляров, а во-вторых, выжить при атаках местных иммунных систем защиты, таких как фагоцитирующие клетки и так называемые естественные киллеры (ЕК).
Способность к инвазированию и расселению в отдаленных органах и тканях у различных видов опухолей сильно варьирует. Эта способность, по-видимому, определяется степенью экспрессии того участка генома, который и обусловливает злокачественный рост клеток. Действительно, со временем почти все раковые опухоли накапливают все больше и больше генетических изменений в своих клетках и приобретают способности к инвазии и метастазированию. Но даже при клиническом обнаружении опухоли метастазы и инвазия могут проявиться лишь спустя несколько лет. Типичным примером является карцинома низкой степени злокачественности. Следует отметить, что даже однотипные виды рака с одинаковой степенью дифференцированности опухолевых клеток по-разному метастазируют у разных больных.
Все это говорит о необходимости поиска молекулярных маркеров, которые смогли бы предсказывать исход течения онкологического заболевания более точно, чем диагностика по гистологическому типу опухоли (хотя последний метод в настоящее время является наиболее точным из всех возможных). Кроме того, даже конкретная опухоль может быть в значительной степени гетерогенной и состоять из клеток, различных по своему метастатическому потенциалу, что было показано на клонированных субпопуляциях, выделенных из одной опухоли. Биологические причины такой вариабельности в настоящее время неизвестны.
Совершенно ясно, что для успешного лечения онкологических пациентов необходимо проводить масштабные исследования в области нахождения механизмов тканевой инвазии, метастатического роста и поиска биологических причин гетерогенности опухолей. Отсутствие гомогенности в опухолях, сходство опухолевых клеток со здоровыми клетками породившей ее ткани, и отсутствие четкого единичного критерия, по которому можно было бы отличить раковую клетку от здоровой, — все это вместе означает, что наши рассуждения о противоопухолевом иммунитете или о механизмах действия лекарственных цитостатических препаратов должны приниматься с изрядной долей скептицизма, особенно если они базируются на экспериментах с гомогенными опухолевыми культурами.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
СОСУДИСТАЯ ИНВАЗИЯ БАССЕЙНА НИЖНЕЙ ПОЛОЙ ВЕНЫ У ДЕТЕЙ С НЕФРОБЛАСТОМОЙ: ОБЩИЕ СВЕДЕНИЯ, КЛАССИФИКАЦИЯ И СТАДИРОВАНИЕ.
Детская онкология №3 2005
А. В. Сухарев, Н.А. Кошечкина, Ю. В. Пашков
СОСУДИСТАЯ ИНВАЗИЯ БАССЕЙНА НИЖНЕЙ ПОЛОЙ ВЕНЫ У ДЕТЕЙ С НЕФРОБЛАСТОМОЙ: ОБЩИЕ СВЕДЕНИЯ, КЛАССИФИКАЦИЯ И СТАДИРОВАНИЕ.
Кафедра детской онкологии РМАПО, Москва
НИИ ДОГ ГУ РОНЦ им. Н. Н. Блохина РАМН, Москва
Ключевые слова: дети, нефробластома, нижняя полая вена, опухолевый тромб. УДК 616-006.85-033.1-053.2:616.146 (048.8)
У взрослых она описывается в виде единичных случаев [40, 41, 71]. Наибольшее число наблюдений (n=30) представлено в исследовании SIOP 93-01 [76].
Факт способности нефробластомы формировать опухолевые тромбы известен еще с конца XIX в.
В 1893 г. англичанин Bland Sutton писал об эмбриональных аденомиосаркомах почек: «Для этих сарком характерно. опухолевая ткань проникает в почечную вену и часто распространяется, даже на значительном протяжении, в нижнюю полую вену; частички ее отрываются и с током крови поступают в легочный круг кровообращения.». (Автор этих строк, по-видимому, считал такой рост опухоли предрасполагающим к развитию тромбоэмболии легочной артерии или метастази-рованию в легкие.)
Позднее, в 1899 г., немецкий хирург Max Wilms дал подробное описание этой группы опухолей и ввел для их обозначения понятие «нефробластома» [73].
Результаты наблюдений Bland Sutton получили подтверждение в дальнейшем, что не могло в XX в. не вызвать интерес онкопедиатров.
Реже у детей встречаются специфические тромбы при других злокачественных опухолях забрюшинного пространства. Так, в мировой литературе имеются описания отдельных клинических наблюдений опухолевого тромбоза сосудов бассейна НПВ при нейро-бластомах надпочечника и забрюшинной области [22; 34; 55; 66; 69], раке почки [11, 36]. Аналогичная локализация специфических тромбов встречается при новообразованиях органов женской репродуктивной системы [15, 69], гепатобластоме [63; 69]. Тромбы сосудов бассейна НПВ у детей могут иметь и неопухолевый генез [19; 35].
Патогенез и особенности строения опухолевых тромбов
На примере рака почки установлены некоторые механизмы опухолевого тромбоза. На определенном этапе опухолевая ткань, продуцируя ферменты, разрушает стенку крупного венозного сосуда, проникает в его просвет и начинает интенсивно расти, увлекаемая током крови. В дальнейшем, по мере заполнения просвета магистральных вен, этот опухолевый массив постепенно принимает специфическую веретенообразную форму, сходную с таковой у коагуляционных тромбов; заполняет просвет вены не только по длине, но и по ширине, увеличивая часто площадь поперечного венозного сосуда. Опухолевые клетки, окружающие тонкостенные сосуды, могут проникать в их просвет через имеющиеся в стенках отверстия [8].
При световой и сканирующей электронной микроскопии, а также при иммуногис-тохимическом картировании интракаваль-ного флоттирующего тромба рака почки P. R. Hanke и соавт. (1996) выявили наличие покрывающей его свободную флоттиру-ющую часть эндотелиальной мембраны, которая препятствует дальнейшему распространению опухолевых клеток; при росте тромба мембрана ведет себя подобно перито-неальной оболочке абдоминальной грыжи. Этим авторы объясняют отсутствие преобладания частоты метастатического поражения легких при тромбозе сосудов бассейна НПВ над таковой без сосудистой инвазии.
Кровоснабжение опухолевого тромба осуществляется за счет артериальных ветвей, исходящих из vasa vasorum венозной стенки. По мере организации и васкуляризации тромба уже внутри него создаются необходимые условия для роста опухолевых клеток [8].
По мнению В. А. Орлова и М. П. Морозовой (1992), образующийся на поверхности интра-венозного тромба при раке почки футляр из слоя фибрина снижает вероятность метаста-зирования и развития эмболии.
Не исключено, что такие феномены тоже имеют место в случаях специфического тромбоза бассейна НПВ при нефробластоме. Однако достоверных сообщений об этом мы при работе с литературными источниками не встречали.
Опухолевый тромб нефробластомы представлен тканью, имеющей такое же микроскопическое строение, что и первичный опухолевый очаг в почке [86; 91]. Описаны случаи наличия в опухолевых тромбах магистральных (почечной, нижней полой) вен при нефробла-стоме кальцинатов [44; 49].
В литературе представлены и так называемые смешанные тромбы при опухоли Вильмса, в которых имеются наряду с опухолевой тканью признаки наличия коагуляци-онных тромбов. Эти тромбы формируются на поверхности опухолевого массива в просвете сосуда, что связано с запуском компонента гиперкоагуляции в системе гемостаза [5; 96].
Потенциями к специфическому тромбооб-разованию в сосудах бассейна НПВ обладают как благоприятные, так и неблагоприятные (по классификации NWTS, на основании признака прогноза) гистологические варианты нефробластомы [65; 67; 78].
По мнению А. С. Переверзева (1995), при раке почки специфические тромбы в НПВ чаще исходят из опухолевого очага в правой почке по причине следующих анатомических особенностей: почечная вена слева располагается впереди брюшной аорты, упругость стенки и непрерывная пульсация которой являются физиологическим защитным барьером на пути растущего тромба. Данный факт аргументируется собственными наблюдениями автора: из 16 левосторонних тромбов 3 распространились в семенные и надпочечниковые вены, у 1 больного развился спонтанный разрыв пораженной раком левой почки, чего ни разу не встретилось справа. У пациентов с левосторонней локализацией рака почки типичным является рост опухоли в основную почечную вену, при котором последняя резко расширяется, удлиняется, лишается анатомофизиологических изгибов, становится плотной и напряженной; это также подтверждает сказанное выше. В аспекте изучаемой проблемы меньшая длина правой почечной вены, по сравнению с левой, уходит на второй план.
На наш взгляд, данное объяснение применимо и к опухолевым тромбам НПВ при нефробластоме.
Факт инвазии в почечные вены, как и при раке почки, не зависит от размеров первичной опухоли [31; 73; 77].
Частота и распространенность
Данные по частоте опухолевого тромбоза почечных вен при нефробластоме в зарубежной литературе последних лет немногочисленны. Так, в 1982 г. Clayman и соавт. сообщили о 12 % таких больных. А в исследование NWTS-3 было включено 211 детей с данной патологией, выявленных среди 1 865 пациентов с опухолью Вильмса что составило 8,8 % [79]. Помнению W. Ceelen и со-авт. (Бельгия, 1997), опухолевый тромбоз почечных вен встречается примерно у 40 % детей с нефробластомой.
Во всех этих случаях опухолевый тромбоз получил гистологическое подтверждение.
Данные по частоте внутрипредсердного опухолевого тромбоза у детей с опухолью Вильмса, имеющиеся в иностранной литературе, разноречивы (табл. 1).
Имеются также и отдельные наблюдения, в которых опухолевый тромб по венозной системе достигает правого предсердия [17; 23; 38; 52; 64; 84; 89; 91; 95]. К 1975 г. в зарубежной литературе было описано 4 таких случая [37]. Сразу о 4 детях с внутрисердечной инвазией опухоли Вильмса упоминают в своей статье Slovis и соавт. (1978). 8 лет спустя Nakayama и соавт. сообщили о 15 больных с таким видом опухолевых тромбов, включенных в исследование NWTS-3. Такое же количество аналогичных пациентов упоминают M. L. Ritchey, P. P. Kelalis и соавт. (1993) в своем исследовании. К сентябрю 1994 г. в мировой литературе было описано уже 70 наблюдений опухолевого тромбоза правого предсердия при нефробластоме [57].
Описан случай локализации краниальной границы опухолевого тромба в ушке правого предсердия [25]. Имеются описания отдельных наблюдений, когда в опухолевый тромбоз вовлекались другие анатомические структуры сердца: правый желудочек с отходящими от него артериями [97], трехстворчатый клапан [94], левое предсердие на фоне дефекта межпредсердной перегородки [58]. В литературе встречаются сообщения и о метастазах нефробластомы в сердце и перикард [20; 72].
Детская онкология №3 2005
Таблица 1. Сводные данные зарубежной литературы последних 10 лет по частоте внутри-предсердного специфического тромбоза у детей с нефробластомой
Количество пациентов с нефробластомой
Количество пациентов с внутрипредсердным тромбозом
Экстрамуральная сосудистая инвазия как индикатор наличия метастазов рака нижнеампулярного отдела прямой кишки
Рак прямой кишки занимает одно из лидирующих мест в структуре смертности у представителей обоих полов, при этом единственным радикальным методом лечения остается хирургическое вмешательство. Для планирования оперативного лечения важной является оценка метастатического поражения локорегионарных лимфатических узлов и наличия экстрамуральной лимфососудистой инвазии, являющейся важным предиктором возникновения рецидива заболевания, а также ранним индикатором появления отдаленных метастазов. Эффективность и достоверность дооперационного стадирования рака нижнеампулярного отдела прямой кишки значительно возросла после внедрения в клиническую практику магнитно-резонансной томографии, а также комплексного предоперационного лучевого обследования пациентов. Статья посвящена проблемам дооперационного стадирования и определению статистически значимых взаимосвязей между наличием экстрамуральной сосудистой инвазии и морфологическим типом, стадией опухоли и наличием отдаленных метастазов при раке нижнеампулярного отдела прямой кишки.
Extramural vascular invasion as an indicator of the presence of distant metastases of low rectal cancer
Rectal cancer is one of the leading pathologies in the structure of mortality for both genders, and the surgical intervention is the only radical method of treatment. Assessment of metastatic lesion of locoregional lymph nodes and the presence of extramural lymphovascular invasion, which is an important predictor of disease recurrence, as well as an early indicator of the appearance of distant metastases, is important for planning surgical treatment. The effectiveness and reliability of preoperative staging of the low rectal cancer significantly increased after the introduction of magnetic resonance imaging in clinical practice, as well as a comprehensive preoperative radiological examination of patients. The article is devoted to the problems of preoperative staging and the determination of a statistically significant correlation between the presence of extramural vascular invasion and the morphological type, stage of the tumor and the presence of distant metastases in patients with low rectal cancer.
Рак прямой кишки (РПК) представляет собой одну из актуальных и сложных проблем современной онкоколопроктологии. Распространенность заболевания и смертность населения от этой патологии по-прежнему остаются высокими. Так, только в России в 2014 году зарегистрировано 26785 новых случаев рака прямой кишки, а смертность составила 9,2 %. В структуре онкологической заболеваемости рак прямой кишки занимает 6-е место (5,2 %) среди мужчин и 7-е место (4,7 %) среди женщин [1]. В ряду колоректальных раков особое место занимают раки прямой кишки низких локализаций (ниже 6 см), при лечении которых применяются комбинированные методы, а частота местных рецидивов, несмотря на выполнение зачастую инвалидизирующих операций, значительно выше.
Магнитно-резонансная томография является диагностическим методом, сочетающим в себе преимущества пространственного и контрастного разрешения в сочетании с отсутствием лучевой нагрузки. Для низких локализаций рака прямой кишки неоспорима диагностическая роль МРТ в прогнозировании вовлечения латерального края резекции, так как на уровне мышц, поднимающих задний проход, толщина мезоректума значительно тоньше, чем в верхне- и среднеампулярных отделах прямой кишки [2, 3]. Высокое пространственное разрешение МР-изображений в коронарных плоскостях позволяет четко визуализировать леваторы ануса, комплекс внутренних и наружных сфинктеров и межсфинктерное пространство, что используется для стадирования низких колоректальных опухолей и планирования объема хирургического вмешательства (стандартная операция, сфинктеросохраняющая резекция, экстралеваторная брюшно-промежностная экстирпация прямой кишки) [4–8].
С помощью магнитно-резонансной томографии возможно визуализировать как нормальные вены мезоректальной клетчатки в виде серпигиозных структур с низким МР-сигналом, так и венозные сосуды патологической структуры при опухолевой инвазии. Это позволяет включить МРТ-исследование в стандартный протокол определения распространенности нижнеампулярного рака прямой кишки в предоперационном стадировании низких раков, непосредственно влияющем на дальнейшую тактику их лечения [10–14].
Карцинома
Один из самых распространенный типов раковых опухолей у людей – карцинома. Этот тип неоплазии, злокачественного роста, который зарождается в тканях, которые покрывают как внешние поверхности тела, так и внутренние полости. Этот вид онкологии относится к опухолям эпителиального происхождения.
Акции
Запись на консультацию со скидкой 10%.
Онкоконсилиум может потребоваться как при лечении в «СМ-Клиника», так и пациентам других медицинских учреждений с целью получения альтернативного мнения.
«СМ-Клиника» предоставляет своим пациентам предоперационное обследование со скидкой до 72%!
Консультация врача-хирурга по поводу операции бесплатно!
Содержание статьи:
Общие данные

Кроме того, будут характеризоваться как карцинома и те злокачественные опухоли, которые состоят из клеток, подвергшихся трансформации, которые имеют специфические характеристики на молекулярном, гистологическом и клеточном уровне, типичные для эпителиальной ткани.
По данным ВОЗ на долю карцином приходится ежегодно до 9,5 млн смертей. Лечение этих видов рака (карциномы) достаточно трудная задача, показатели выживаемости очень разнятся. Участки органов, часто поражаемые карциномами, включают:
Причины возникновения карцином
Пока точные причины, по которой развиваются разные типы рака, включая карциному, не определены. Но ученые выделили ряд факторов, предрасполагающих к развитию патологии:
Типы карциномы, классификация
Хотя карциномы могут возникать во многих частях тела, наиболее распространены следующие типы карциномы:
Основа классификации карцином – тип клеток и их локализация, а также стадии карциномы.
Карциномы могут распространяться на другие части тела или ограничиваться основным местом. Заболевание имеет различные формы, в том числе:
Важно знать также признаки опухоли в разных стадиях развития.

Стадия 2 – опухоль не более 5 см в диаметре, в лимфоузлах определяются единичные метастазы.
Стадия 3 – опухоль превышает 50 мм диаметром, есть массивные метастазы в области лимфоузлов.
Стадия 4 – определяются отдаленные метастазы по всему организму.
Карцинома: симптомы
Врачи дают описание того, как выглядит тот или иной тип карциномы.
Если выявлена базальноклеточная карцинома, вероятно, она возникла из-за слишком длительного пребывания на солнце. Возможно, было несколько серьезных солнечных ожогов или в течение жизни человек много времени проводил на солнце.
Когда плоскоклеточный рак развивается в коже, он часто обнаруживается на участках, подверженных воздействию солнца, таких как:
Плоскоклеточная карцинома, которая развивается на коже, имеет тенденцию к росту и распространению больше, чем рак базальных клеток. В редких случаях он может распространяться на лимфатические узлы.
На фоне карциномы возможен синдром интоксикации с лихорадкой, потерей аппетита и веса, слабостью, локальные изменения в области пораженной кожи, изменение цвета, уплотнение. Если поражен внутренний орган, страдают его функции.
Диагностика
Постановкой диагноза занимаются онкологи, они помимо оценки жалоб и осмотра, назначают целый ряд обследований. К ним относят:
Методы лечения

Карцинома: прогноз

Рекомендации
Для рака кожи основные рекомендации – это снизить облучение кожи УФ-лучами и оградить себя от влияния потенциальных канцерогенов. В целом, ведение здорового образа жизни с рациональным питанием, дозированными нагрузками помогает снизить риск онкологии.