Что такое спиновое квантовое число
Квантовые числа n, ℓ, m не полностью характеризуют движение электронов в атомах. Исследования показали, что электрон имеет свойство, называемое спин. Упрощенно спин можно представить как способ движения (спин) электрона вокруг своей оси (собственный момент количества движения электрона в атоме). Поэтому в теорию строения атома введено еще спиновое квантовое число s, которое может иметь только два значения, численно обозначаемые 
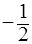
Четыре квантовых числа n, ℓ, m, и s полностью характеризуют движение электрона в атоме. Никаких других независимых от квантовых чисел характеристик у этого движения не может быть.
Поскольку энергия электрона в атоме водорода определяется величиной – n и не зависит от остальных квантовых чисел, то может быть несколько состояний электронов с одинаковой энергией. Эти состояния являются вырожденными (р – трижды вырожденные, d – пять раз вырожденные, , f – семьраз вырожденные). Вырождение исчезает при воздействии на электронв атоме внешнего электрического или магнитного поля. Электрон с одним и тем же значением n, но разными m и s по разному взаимодействуют с внешним полем, в результате энергии электрона в этих состояниях становятся неодинаковыми. Этим объясняется расщепление спектральных линий при помещении источника излучения в электрическое или магнитное поле
2.2.4. Многоэлектронные атомы.
Формирование электронной оболочки многоэлектронных атомов происходит в соответствии со следующими правилами (принципами):
4. принцип минимальной энергии
Электрон в атоме занимает такое положение, чтобы его энергия была минимальна.
В многоэлектронных атомах состояние каждого электрона определяется также значениями четырех квантовых чисел n, ℓ, m, и s, которые принимают те же значения, что и для атома водорода. Но, в многоэлектронных атомах электрон движется не только в поле ядра, но и в поле других электронов. Поэтому энергия электронов в таких атомах определяется значениями двух квантовых чисел n и ℓ. При этом энергия возрастает как с увеличением n, так и ℓ. Зависимость энергии от орбитального квантового числа становится тем большей, чем больше электронов в атоме.
2. принцип (запрет) Паули (открыт в 1925 г)
Согласно этому принципу в атоме не может быть двух электронов, у которых все четыре квантовых числа были бы одинаковыми.
Хотя бы одно n, ℓ, m, s должно отличаться, т.е. 1) в каждом энергетическом состоянии может находиться только один электрон; 2) каждая новая комбинация квантовых чисел определяет новое состояние.
Исходя из значений, которые могут принимать квантовые числа и на основании принципа Паули нетрудно определить максимальное число электронов в атоме, обладающих данным значением главного квантового числа:
Правило Гунда
В соответствии с этим правилом заполнение атомных орбиталей электронами происходит таким образом, чтобы в пределах квантового подуровня суммарный спин был максимальным.
Спин, определяемый собственным моментом импульса электрона, является векторной величиной, поэтому он обозначается стрелкой ↑ ( 
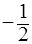
Т.е. при одном и том же и значении орбитального квантового числа должно быть максимальное число электронов, имеющих одно и тоже направление (или 
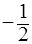
Правило Клечковского
В 1961 г. русский ученый В.М. Клечковский сформулировал общее положение, согласно которому электрон занимает в основном состоянии уровень с наименьшим значением суммы ( n + ℓ), а если эти суммы равны, то вначале заполняется тот подуровень, где n имеет меньшее значение ( соответственно ℓ большее).
Последовательность энергетических уровней в порядке возрастания энергии примерно следующая:
где 1,2 – значения главного квантового числа n;
Графическое изображение распределения электронов по уровням в виде таблицы имеет следующий вид:
-1 0 +1
Лекция 3
Дата добавления: 2021-01-21 ; просмотров: 49 ; Мы поможем в написании вашей работы!



7. Атомные орбитали (АО). Электронная плотность. Распределение электронной плотности s-, p-, d-, f- АО. Формы АО. Последовательность заполнения атомных орбиталей электронами в электронных оболочках многоэлектронных атомов. Принцип Паули и правило Гунда. Правило Клечковского (правило (n+l)-групп).
Атомная орбиталь — множество состояний электрона в атоме. Описывается с помощью совокупности квантовых чисел. В 1925 году В. Паули был высказан принцип: в атоме не может быть двух электронов, имеющих одинаковый набор всех четырех квантовых чисел (принцип Паули). Исходя из принципа Паули можно определить количество электронов на каждой орбитали.
Электро?нная пло?тность — плотность вероятности обнаружения электрона в данной точке конфигурационного пространства.
Магнитное квантовое число m опpеделяе т пpостpанственную оpиентацию данной АО.
При распределении электронов по квантовым ячейкам следует руководствоваться принципом Паули: в атоме не может быть двух электронов с одинаковым набором значений всех квантовых чисел, т. е. атомная орбиталь не может содержать более двух электронов, причем их спиновые моменты должны быть противоположными
Система обозначений в общем виде выглядит так: nlx,
где п − главное, l − орбитальное квантовые числа; х − количество электронов,находящихся в данном квантовом состоянии.
Например, запись 4d3 может бытьистолкована следующим образом: три электрона занимают четвертый энергетический уровень, d- подуровень.
Характер застройки энергетических подуровней определяет принадлежность элемента к тому или иному электронному семейству.
В s-элементах происходит застройка внешнего s-подуровня, например,
11 Na 1s2 2s2 2p6 3s1
В р-элементах происходит застройка внешнего р-подуровня, например,
К s- и p- семействам относятся элементы главных подгрупп периодической таблицы Д. И. Менделеева.
В d-элементах происходит застройка d-подуровня предпоследнего уровня, например,
К d-семейству относятся элементы побочных подгрупп. Валентными у этого семейства являются s-электроны последнего энергетического уровня и d-электроны предпоследнего уровня.
В f-элементах происходит застройка f-подуровня третьего наружного уровня, например,
58Се 1s22s22p63s23p63d l04s24p64d l04f l5s25p65d16s2.
Представителями f-электронного семейства являются лантаноиды и актиноиды.
8. Молекулярный уровень организации вещества. Химическая связь и валентность. История формирования представлений о химической связи. Гипотезы химической связи Косселя и Льюиса. Валентность атомов химических элементов. Валентность s-,p-,d-,f- элементов. Постоянная и переменная валентность. Реальная и максимально возможная валентность.
Молекулярный уровень организации вещества. Часто можно услышать: «молекула состоит из атомов» или «в состав молекулы входят атомы», и далее пишется формула органического или неорганического соединения. Например, СН4, С2Н6, Н2, Н2О. Общее, что объединяет соединения с молекулярной структурой, – это наличие в них ковалентных связей. В молекулах ковалентная связь образуется в результате перекрывания атомных орбиталей при участии пары электронов с противоположными спина- ми. В ионных кристаллах действуют силы электростатического притяжения между положительно и отрицательно заряженными ионами. В металлах положительно заряженные ионы удерживаются в узлах кристаллической решетки отрицательно заряженным «электронным газом». Такую функцию выполняют валентные электроны внешней оболочки атомов металлов.
Химическая связь обусловлена электромагнитным взаимодействием, удерживающим систему ядер и электронов в молекулах или кристаллах.
В молекулярных образованиях и кристаллических телах действуют не только силы притяжения противоположно заряженных частей системы (ядро – электрон) и силы отталкивания одинаковых по знаку заряженных частей (яд ро – ядро, электрон – электрон). Уменьшение энергии системы при образовании химической связи не может быть описано только электростатической моделью и требует учета так называемых квантовых эффектов системы. С учетом квантовых эффектов силы притяжения и отталкивания уравновешены и обеспечивают устойчивость молекулярной и кристаллической системы.
В начале девятнадцатого века в трудах Г. Деви и Йёнса Берцелиуса была разработана электрохимическая теория, суть которой сводилась к тому, что химически взаимодействующие частицы при контакте приобретают противоположные электрические заряды, которые обусловливают связь. Однако эта теория не смогла объяснить существование молекул, образованных одинаковыми атомами (Н2, F2 и т. д.).
Дальнейшее развитие теории химической связи стало возможным после открытия электрона. Первым высказал электронную концепцию Дж. Томсон в 1907 году. Он предположил наличие в атомах определенную устойчивость электронных конфигураций, которые могут реализоваться при потере или присоединении к ним электронов.
Эрнестом Розерфордом и Нильсом Бором была создана теория химической связи, осуществляемая путем перераспределения электронов между атомами. Основы этой теории были представлены в работах Вальтера Косселя, Джильберта Льюиса, Ирвина Ленгмюра.
Коссель предложил (1915 г.) статическую электронную теорию строения атомов и молекул, суть которой в следующем:
1. Атомы благородных газов обладают особенно устойчивой двух- или восьми-электронной внешней оболочкой.
2. Атомы других элементов во внешней оболочке имеют число электронов меньше двух или восьми. Их электронные оболочки менее устойчивы.
3. Образование молекул происходит вследствие передачи определенного числа электронов от атома одного элемента (металла) к атому другого элемента (неметалла).
В результате такого перераспределения электронов каждый атом должен иметь внешнюю оболочку, аналогичную устойчивой электронной оболочке благородного газа. При этом атом металла приобретает положительный, а атом неметалла — отрицательный заряд. Соединение между ними обусловливается в соответствии с законом Кулона силами электростатического притяжения. Такая химическая связь называется ИОННОЙ.
Эта теория не могла объяснить природу связи между одинаковыми атомами. Кроме того, последующие исследования показали, что практически никогда электроны не переходят полностью от одного атома к другому.
Примерно в то же время (1916 г.) Льюис предпринял попытку объяснить механизм образования химической связи между любыми (в том числе и одинаковыми) атомами. Затем теория Льюиса была развита Ленгмюром.
Теория Льюиса-Ленгмюра также исходит из особой стабильности двух- или восьми-электронных внешних оболочек атомов и стремления атомов, участвующих в образовании молекулы, иметь такие оболочки. Химическая связь в данном случае осуществляется посредством образования общей электронной пары, в которую каждый атом дает по одному электрону из своей внешней оболочки. Такую химическую связь Ленгмюр назвал КОВАЛЕНТНОЙ, т. е. совместно действующей. Молекула Фтора, например, по этой теории образуется при обобществлении по одному электрону от каждого атома.
Валентные возможности атомов химических элементов. Строение наружных энергетических уровней атомов химических элементов и определяет в основном свойства их атомов. Поэтому эти уровни называют валентными. Электроны этих уровней, а иногда и предвнешних уровней могут принимать участие в образовании химических связей. Такие электроны также называют валентными.Валентность атома химического элемента определяется в первую очередь числом неспаренных электронов, принимающих участие в образовании химической связи.
Валентные электроны атомов элементов главных подгрупп расположены на s- и р-орбиталях внешнего электронного слоя. У элементов побочных подгрупп, кроме лантаноидов и актиноидов, валентные электроны расположены на s-орбитали внешнего и d-орбиталях предвнешнего слоев.
При переходе атома в возбужденное состояние один из пары электронов d-подуровня может переходить на свободную орбиталь d-подуровня. Валентность фосфора при этом изменяется с трех (в основном состоянии) до пяти (в возбужденном состоянии).
Разъединение спаренных электронов требует затрат энергии, так как спаривание электронов сопровождается понижением потенциальной энергии атомов. Вместе с тем расход энергии на перевод атома в возбужденное состояние компенсируется энергией, выделяющейся при образовании химических связей неспаренными электронами.
Затраты энергии на возбуждение атомов углерода с избытком компенсируются энергией, выделяющейся при образовании двух дополнительных ковалентных связей. Так, для перевода атомов углерода из стационарного состояния 2s22р2 в возбужденное — 2s12р3 требуется затратить около 400 кДж/моль энергии. Но при образовании С—Н-связи в предельных углеводородах выделяется 360 кДж/моль. Следовательно, при образовании двух молей С—Н-связей выделится 720 кДж, что превышает энергию перевода атомов углерода в возбужденное состояние на 320 кДж/моль.
В заключение следует отметить, что валентные возможности атомов химических элементов далеко не исчерпываются числом неспаренных электронов в стационарном и возбужденном состояниях атомов.
Общий вывод Валентные возможности атомов химических элементов определяются: 1) числом неспаренных электронов (одноэлектронных орбиталей); 2) наличием свободных орбиталей; 3) наличием неподеленных пар электронов.
Что такое спиновое квантовое число
Спин (от англ. spin — вертеть[-ся], вращение) — собственный момент импульса элементарных частиц, имеющий квантовую природу и не связанный с перемещением частицы как целого. Спином называют также собственный момент импульса атомного ядра или атома; в этом случае спин определяется как векторная сумма (вычисленная по правилам сложения моментов в квантовой механике) спинов элементарных частиц, образующих систему, и орбитальных моментов этих частиц, обусловленных их движением внутри системы.
В связи с этим говорят о целом или полуцелом спине частицы.
Существование спина в системе тождественных взаимодействующих частиц является причиной нового квантовомеханического явления, не имеющего аналогии в классической механике: обменного взаимодействия.
Содержание
Свойства спина
Любая частица может обладать двумя видами углового момента: орбитальным угловым моментом и спином.
В отличие от орбитального углового момента, который порождается движением частицы в пространстве, спин не связан с движением в пространстве. Спин — это внутренняя, исключительно квантовая характеристика, которую нельзя объяснить в рамках релятивистской механики. Если представлять частицу (например, электрон) как вращающийся шарик, а спин как момент, связанный с этим вращением, то оказывается, что поперечная скорость движения оболочки частицы должна быть выше скорости света, что недопустимо с позиции релятивизма.
Будучи одним из проявлений углового момента, спин в квантовой механике описывается векторным оператором спина 

Примеры
Ниже указаны спины некоторых микрочастиц.
На июль 2004 года, максимальным спином среди известных элементарных частиц обладает барионный резонанс Δ(2950) со спином 15/2. Спин ядер может превышать 20
История
В 1921 году опыт Штерна — Герлаха подтвердил наличие у атомов спина и факт пространственного квантования направления их магнитных моментов.
В 1924 году, ещё до точной формулировки квантовой механики, Вольфганг Паули вводит новую, двухкомпонентную внутреннюю степень свободы для описания валентного электрона в щелочных металлах. В 1927 году он же модифицирует недавно открытое уравнение Шрёдингера для учёта спиновой переменной. Модифицированное таким образом уравнение носит сейчас название уравнение Паули. При таком описании у электрона появляется новая спиновая часть волновой функции, которая описывается спинором — «вектором» в абстрактном (то есть не связанном прямо с обычным) двумерном спиновом пространстве.
В 1928 году Поль Дирак строит релятивистскую теорию спина и вводит уже четырёхкомпонентную величину — биспинор.
Математически теория спина оказалась очень прозрачной, и в дальнейшем по аналогии с ней была построена теория изоспина.
Спин и магнитный момент
Несмотря на то, что спин не связан с реальным вращением частицы, он тем не менее порождает определённый магнитный момент, а значит, приводит к дополнительному (по сравнению с классической электродинамикой) взаимодействию с магнитным полем. Отношение величины магнитного момента к величине спина называется гиромагнитным отношением, и, в отличие от орбитального углового момента, оно не равно магнетону (
Спин и статистика
Вследствие того, что все элементарные частицы одного и того же сорта тождественны, волновая функция системы из нескольких одинаковых частиц должна быть либо симметричной (то есть не изменяется), либо антисимметричной (домножается на −1) относительно перестановки местами двух любых частиц. В первом случае говорят, что частицы подчиняются статистике Бозе — Эйнштейна и называются бозонами. Во втором случае частицы описываются статистикой Ферми — Дирака и называются фермионами.
Оказывается, именно значение спина частицы говорит о том, каковы будут эти симметрийные свойства. Сформулированная Вольфгангом Паули в 1940 году теорема о связи спина со статистикой утверждает, что частицы с целым спином ( s = 0, 1, 2, …) являются бозонами, а частицы с полуцелым спином ( s = 1/2, 3/2, …) — фермионами.
Обобщение спина
Введение спина явилось удачным применением новой физической идеи: постулирование того, что существует пространство состояний, никак не связанных с перемещением частицы в обычном пространстве. Обобщение этой идеи в ядерной физике привело к понятию изотопического спина, который действует в особом изоспиновом пространстве. В дальнейшем, при описании сильных взаимодействий были введены внутреннее цветовое пространство и квантовое число «цвет» — более сложный аналог спина.
Спин классических систем
В силу антисимметрии тензора Леви-Чивиты, 4-вектор спина всегда ортогонален к 4-скорости 
Именно поэтому спин называют собственным моментом импульса.
В квантовой теории поля это определение спина сохраняется. В качестве момента импульса и суммарного импульса выступают интегралы движения соответствующего поля. В результате процедуры вторичного квантования 4-вектор спина становится оператором с дискретными собственными значениями.
См. также
Примечания
Литература
Статьи
Полезное
Смотреть что такое «Спин» в других словарях:
СПИН — собственный момент импульса элементарной частицы или системы, образованной из этих частиц, напр. атомного ядра. Спин частицы не связан с её движением в пространстве и не может быть объяснён с позиций классической физики он обусловлен квантовой… … Большая политехническая энциклопедия
спин — а; м. [англ. spin вращение] Физ. Собственный момент количества движения элементарной частицы, атомного ядра, присущий им и определяющий их квантовые свойства. * * * спин (англ. spin, буквально вращение), собственный момент количества движения… … Энциклопедический словарь
Спин — Спин. Спиновый момент, присущий, например, протону, можно наглядно представить, связав его с вращательным движением частицы. СПИН (английское spin, буквально вращение), собственный момент количества движения микрочастицы, имеющий квантовую… … Иллюстрированный энциклопедический словарь
СПИН — (обозначение s), в КВАНТОВОЙ МЕХАНИКЕ собственный угловой момент, присущий некоторым ЭЛЕМЕНТАРНЫМ ЧАСТИЦАМ, атомам и ядрам. Спин может рассматриваться как вращение частицы вокруг своей оси. Спин является одним из квантовых чисел, посредством… … Научно-технический энциклопедический словарь
СПИН — (английское spin, буквально вращение), собственный момент количества движения микрочастицы, имеющий квантовую природу и не связанный с движением частицы как целого. Измеряется в единицах постоянной Планка h и может быть целым (0, 1, 2. ) или… … Современная энциклопедия
СПИН — (от англ. spin вращаться, вертеться), собственный момент кол ва движения элем. ч ц, имеющий квант. природу и не связанный с перемещением ч цы как целого. С. называют также собств. момент кол ва движения ат. ядра (и иногда атома); в этом случае С … Физическая энциклопедия
Спинёв — Спинёв, Николай Николаевич Спортивные награды Академическая гребля Олимпийские игры Золото Афины 2004 четвёрка Николай Николаевич Спинёв (род. 30 мая 1974, Ростов на Дону) российский спортсмен, олимпийский чемпион … Википедия
спин — (англ. spin вращаться) собственный механический момент количества движения элементарной частиц (электрона, протона, нейтрона) или атомного ядра, всегда присущий данному виду частиц, определяющий их свойства и обусловленный их квантовой природой;… … Словарь иностранных слов русского языка
спин — момент, вращение Словарь русских синонимов. спин сущ., кол во синонимов: 2 • вращение (15) • момент … Словарь синонимов
спин — спин, а (физ.) … Русский орфографический словарь









