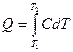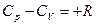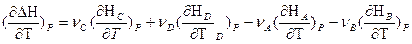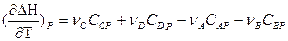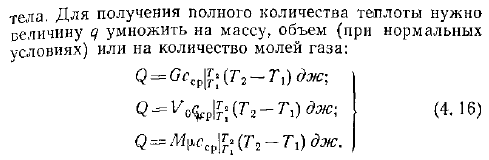Что такое средняя теплоемкость
Истинная и средняя теплоемкость
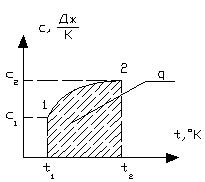
Истинная теплоемкость вещества – это теплоемкость при заданной температуре. Она определяется по формуле:
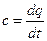
Рисунок 1.7 – Графический пример истинной теплоемкости
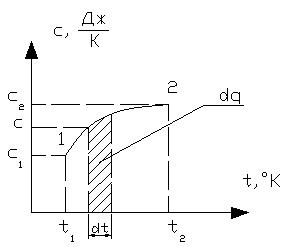
Средняя теплоемкость – это теплоемкость газов в заданном интервале температур от t1 до t2. Обозначается средняя теплоемкость 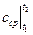
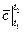
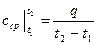
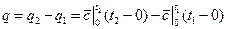
Рисунок 1.8 – Графическая иллюстрация средней теплоемкости
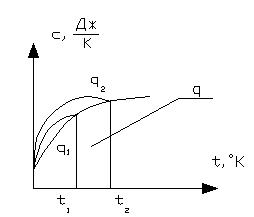
Рисунок 1.9 – Практическое определение средней теплоемкости
Для практических расчетов средней теплоемкости используют следующую формулу, в которой используются табличные средние теплоемкости газа в интервале от нуля до интересующей температуры t1 или t2:
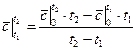
Дата добавления: 2015-09-11 ; просмотров: 5812 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Истинная и средняя теплоемкости



Так как теплоемкость идеального газа зависит от температуры, а реального и от давления, то в технической термодинамике различают истинную и среднюю теплоемкости.
Теплоемкость, определяемая уравнениями (5.1), (5.3), (5.4) при данных значениях параметров состояния υ и Т или р и Т (т. е. в данном состоянии тела), называют истинной теплоемкостью. Следовательно, истинной теплоемкостью называется отношение элементарного количества теплоты, сообщаемой термодинамической системе в каком либо процессе, к бесконечно малой разности температур.
В практических расчетах при определении количества теплоты обычно применяют так называемые средние теплоемкости.
Средней теплоемкостью схт данного процесса в интервале температур от t1 до t2 называют отношение количества теплоты q1-2 к конечной разности температур t2-t1:
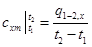
Так как количество теплоты q1-2,x, полученное системой в процессе х=const, определяется уравнением (5.2), где сх — истинная теплоемкость в данном процессе, то
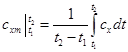
Если средние теплоемкости даны в таблице для интервала температур от 0 до t,°С, то средняя теплоемкость 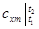
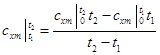
Таким образом, если в каком-либо процессе идеальный газ был нагрет от температуры t1 до t2, то количество теплоты, затраченное на нагревание, равно
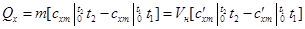
где m – масса газа, Vн – объём при нормальных условиях.
5.5. Отношение теплоемкостей ср и сυ
В термодинамике часто используется отношение теплоемкости при постоянном давлении к теплоемкости при постоянном объеме, обозначаемое обычно буквой k:
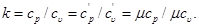
Если считать cx=const, то из табл. 5.1 получаем: для одноатомного газа k = 1,66; для двухатомного газа k=1,4, для трех- и многоатомных газов k= = 1,33.
Теплоемкость истинная, средняя, изохорная и изобарная
Теплоемкостью называется отношение количества сообщенного системе тепла к наблюдаемому при этом повышению температуры ( при отсутствии химической реакции, перехода вещества из одного агрегатного состояния в другое и при А » = 0.)
Теплоемкость обычно рассчитывают на 1 г массы, тогда ее называют удельной (Дж/г*К), или на 1 моль (Дж/моль*К), тогда ее называют молярной.
Различают среднюю и истинную теплоемкости.
Среднейтеплоемкостью называют теплоемкость в интервале температур, т. е. отношение тепла, сообщенного телу к приращению его температуры на величину ΔТ
Истиннойтеплоемкостью тела называют отношение бесконечно малого количества теплоты, полученного телом, к соответствующему приращению его температуры.
Между средней и истинной теплоемкостью легко установить связь:

подставив значения Q в выражение для средней теплоемкости, имеем:
Истинная теплоемкость зависит от природы вещества, температуры и условий, при которых происходит переход тепла к системе.
Так, если система заключена в постоянный объем, т. е. для изохорного процесса имеем:
Если же система расширяется или сжимается, а давление остается постоянным, т.е. для изобарного процесса имеем:
Но ΔQV = dU, а ΔQP = dH поэтому
(если одна или несколько переменных поддерживаются постоянными, в то время как другие изменяются, то производные называются частными по отношению к изменяющейся переменной).
Для идеального газа рV=nRT
для одного моля 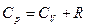
Разность R представляет собой работу изобарного расширения 1 моля идеального газа при повышении температуры на единицу.
У жидкостей и твердых тел вследствие малого изменения объема при нагревании СP = СV
Зависимость теплового эффекта химической реакции от температуры, уравнения Кирхгофа.
Используя закон Гесса, можно вычислить тепловой эффект реакции при той температуре (обычно это 298К), при которой измерены стандартные теплоты образования или сгорания всех участников реакции.
Но чаще бывает необходимо знать тепловой эффект реакции при различных температурах.
Обозначим через Н энтальпию участника реакции, отнесенную к 1 молю. Общее изменение энтальпии ΔΗ(Т) реакции выразится равнением:
Если реакция протекает при постоянном давлении, то изменение энтальпии будет равно тепловому эффекту реакции. И если мы продифференцируем это уравнение по температуре, то получим:
Так как
или
Уравнения для изобарного и изохорного процесса

называют уравнениями Кирхгофа ( в дифференциальной форме). Они позволяют качественнооценить зависимость теплового эффекта от температуры.
Влияние температуры на тепловой эффект обусловливается знаком величины ΔСp (или ΔСV )
При ΔСp> 0 величина 
Для получения расчетной формулы уравнения Кирхгофа интегрируют в пределах интервала температур 298-Т:
Уравнения эти называются уравнениями Кирхгофа в интегральной форме. По этому уравнению можно рассчитать тепловой эффект только для узкого интервала температур.
При расчете теплового эффекта в большем интервале температур уравнение Кирхгофа интегрируют в пределах 0 –Т К и при этом учитывается зависимость теплоемкости от температуры в виде степенного ряда:
где
Дата добавления: 2018-02-28 ; просмотров: 4964 ; Мы поможем в написании вашей работы!
Понятие и виды теплоемкости



Теплоемкость.
Теплоемкость – свойство материала поглощать определенное количество тепла при нагревании и выделять его при охлаждении.
Удельная теплоемкость – количество тепла, необходимое для нагревания единицы количества вещества на один градус.
Формула для расчёта удельной теплоёмкости (или табл.знач.):
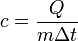
где 
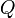
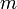
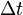
В зависимости от единиц измерения количества вещества различают:
Между различными видами теплоемкостей существует следующая зависимость:
Различают среднюю (Сm) и истинную (С) теплоемкость:
Истинная теплоемкость – первая производная от количества теплоты, подводимой в процессе нагрева к телу, по его температуре.
Теплоемкость газа не постоянна. Она зависит от температуры и давления. Влияние давления на теплоемкость газов незначительное, поэтому обычно учитывают только влияние температуры.
Зависимости средней теплоемкости от температуры:
если тело нагревается от 0 до некоторой температуры t: Сm =a+bt/2;
если тело нагревается от температуры t1 до температуры t2: Сm =a+b(t1+t2),
где a, b, – коэффициенты, зависящие от природы газа, определяются экспериментально и приводятся в справочных таблицах.
Теплоемкость зависит от способа подвода теплоты к газу. Чаще всего используют 2 способа:
Теплоемкости при постоянном давлении и постоянном объеме связаны между собой следующими соотношениями:
Анализ уравнений (1) показывает, что во время нагревания газа при P=const затрачивается тепла больше, чем при V=const.
Значение теплоемкости приближенно можно рассчитать следующим образом:
Массовую Ссм и объемную С’см теплоемость газовых смесей определяют по формулам:
где Ci– массовая теплоемкость отдельного газа, Дж/(кгК);
gi– массовые доли газов, составляющих смесь;
C’i– объемная теплоемкость отдельного газа, Дж/(м 3 К);
ri– объемные доли газов, составляющих смесь.
Количество теплоты, необходимое на нагрев тела, можно определить следующим образом:
где С – удельная теплоемкость вещества.
Рассмотрим пример:
Газ (воздух) нагревается от начальной температуры t1=25 o C до t2=130 o C, масса газа m=21кг. Определить количество подведенного к воздуху тепла Q, считая удельную теплоемкость воздуха постоянной с=const=1,0301 кДж/кг·К. Выразить количество теплоты Q в килокалориях (ккал).
Решение:
Q = mС(t2-t1)=21·1,0301·(130-25)=2271 кДж·0,239=542,769ккал.
Ответ: Q = 2271 кДж=542,769ккал.
Средняя теплоемкость. Вычисление количества теплоты через средние табличные теплоемкости
Средняя теплоемкость. Вычисление количества теплоты через средние табличные теплоемкости
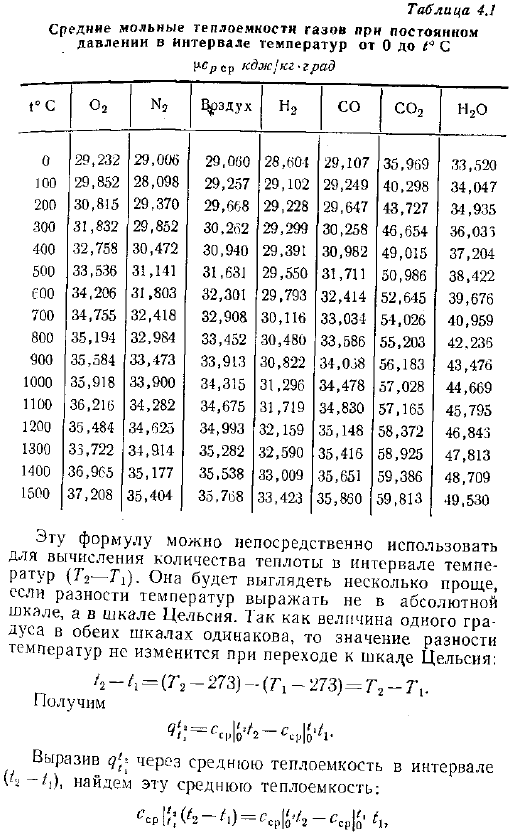
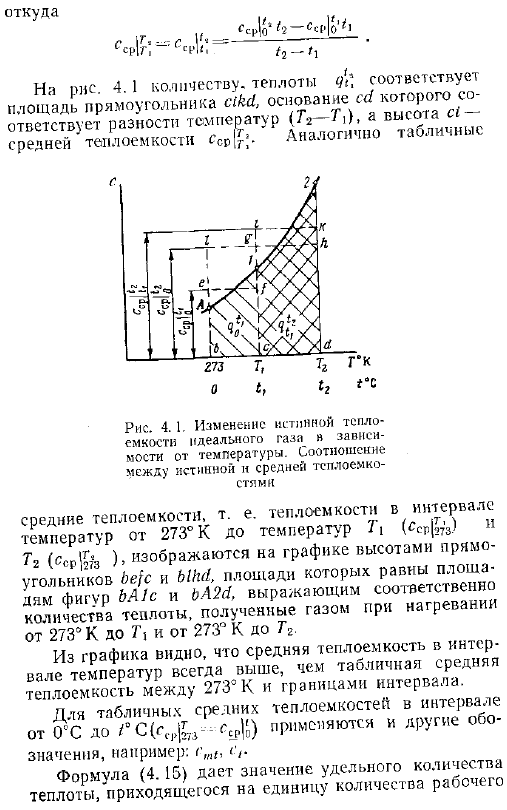
Среднюю теплоемкость газа для любого диапазона температур и соответствующее количество тепла cf или s можно найти, используя таблицу средней молярной теплоемкости таблица 4.1, которая показывает среднюю теплоемкость различных газов от СГС 273 к до диапазона температур или 7к. Рисунок 4. 1 кривая А12 показывает температурную зависимость истинной теплоемкости.
Это определение относится к такому состоянию, когда в смеси неоднородной концентрации одна из компонент переносится с одного места на другое диффузией или конвекцией. Людмила Фирмаль
Количество тепла, которое газ получает при нагревании от температуры Т1 до температуры Т2, рассчитывается по формуле с площадью с12а 4. 12 как показано на этом графике. Эту область можно представить как разность между областями bA2 1 и bA1c. это не более чем количество тепла, которое газ получает при нагревании от 273 к до температур G2 и 7 1. пл.
Возьми MF o, 12 вода o 6 Средняя теплоемкость интервала a — указывает на эту среднюю теплоемкость. Где ССР Р 2- 2 р Количество теплоты в NT 4 соответствует площади прямоугольника SM, 0C1 VAH и hX соответствует разности. Температура 1 г с Средняя теплоемкость СР Г1 Рисунок 4. 1.Изменение истинной теплоемкости идеального газа в зависимости от температуры.
Показать аналитически, как применяется метод обращения спектральных линий путем прослеживания интенсивности пучка, идущего от абсолютно черного тела и проходящего через пламя по направлению к спектроскопу. Людмила Фирмаль
Диапазон температур всегда выше, чем средняя теплоемкость таблицы между 273 K и границей интервала. Для таблицы средняя теплоемкость в диапазоне значений s, p1 FPPMula 4-15 показывает значения удельного количества тепловой энергии, генерируемой ведомым устройством. Body. To получите полное количество тепла, вам нужно значение Масса, Объем при нормальных условиях или умноженное на молярное число газа. Гс 2 22 — J.
Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института