Что такое стероидные гормоны
Стероидные гормоны при психических расстройствах ( по результатам исследований нашей клиники)
Прегненолон — стероидный гормон, первый метаболит в цепочке стероидогенеза. Образуется из холестерина и служит прекурсором 17-гидроксипрегненолону и прогестерону, которые, в свою очередь, преобразуются в другие стероиды. Помимо участия в гормональной системе, прегненолон воздействует на процессы центральной нервной системы, являясь нейростероидом. У мужчин и женщин прегненолон, продуцируемый в надпочечниках, имеет высокую вероятность (но не 100%) преобразования в дегидроэпиандростерон (DHЕA) или кортизол. У мужчин прегненолон, продуцируемый в яичках, имеет высокую вероятность превращения в тестостерон, а прегненолон, образованный в женских яичниках, возможно, будет преобразован в эстроген. Возможно, повышение уровня этого гормона у наших пациентов связано с активацией стероидогенеза на его начальных этапах и представляет собой компенсаторную защитную реакцию организма на возникновение психического расстройства.
Андростендион — основной андроген, секретируемый яичниками. Также в небольших количествах андростендион секретируется корой надпочечников у обоих полов и яичками у мужчин. Андрогенное действие андростендиона значительно слабее, чем у тестостерона.
Выделившийся в кровь кортизол достигает клеток-мишеней (в частности, клеток печени). Благодаря своей липофильной природе легко проникает через клеточную мембрану в цитоплазму и ядро, где связывается со специфическими рецепторами. Гормон-рецепторный комплекс является фактором транскрипции, — активирует транскрипцию определённых участков ДНК. В результате синтез глюкозы в гепатоцитах усиливается, тогда как в мышцах снижается распад глюкозы. В клетках печени глюкоза запасается в виде гликогена. Таким образом, эффект кортизола состоит в сохранении энергетических ресурсов организма.
По принципу отрицательной обратной связи повышение уровня кортизола в крови снижает секрецию кортиколиберина (а значит, и АКТГ).
Уровень кортизола изменяется в зависимости от времени суток, а также стадии менструального цикла (у женщин), поэтому важно знать оптимальное время для сдачи анализа крови для проверки уровня кортизола.
Стероидные противовоспалительные препараты – механизм действия, классификация, побочные эффекты
Хроническая боль формируется при длительном периоде заживления. Ее лечение требует комплексной терапии, при которой применяют разнонаправленные медпрепараты, среди которых помимо типичных в этом случае наркотических и ненаркотических анальгетиков используют препараты адъювантной терапии.
Среди них cтepoидные гopмoнальные противовоспалительные препараты и мази. Однако гормоны назначаются специалистами при лечении хронического болевого синдрома далеко не всегда. Стероидные противовоспалительные препараты имеют довольно обширный список побочных действий и противопоказаний.
Не можете
уговорить
на лечение
Адъювантная терапия боли – что это такое?
Самое важное в лечении любого заболевания – это устранение не симптомов болезни, а причин ее развития. Однако далеко не все заболевания предполагают этиотропную терапию, к примеру, онкологические и аутоиммунные. Именно поэтому в медицине и фармакологии существуют лекарственные средства для патофизиологического и симптоматического лечения болезней.
При лечении хронического болевого синдрома применяется довольно широкий список препаратов, среди которых стероидные противовоспалительные и множество других медикаментов. В зависимости от вида болевых ощущений, их локализации и клинической картины врачи применяют как стероидные препараты противовоспалительного действия, так и обезболивающие, антиконвульсанты, спазмолитики и даже антидепрессанты.
Довольно часто стероидные противовоспалительные препараты применяют для лечения суставов, список их достаточно широк.
Стероидные противовоспалительные препараты
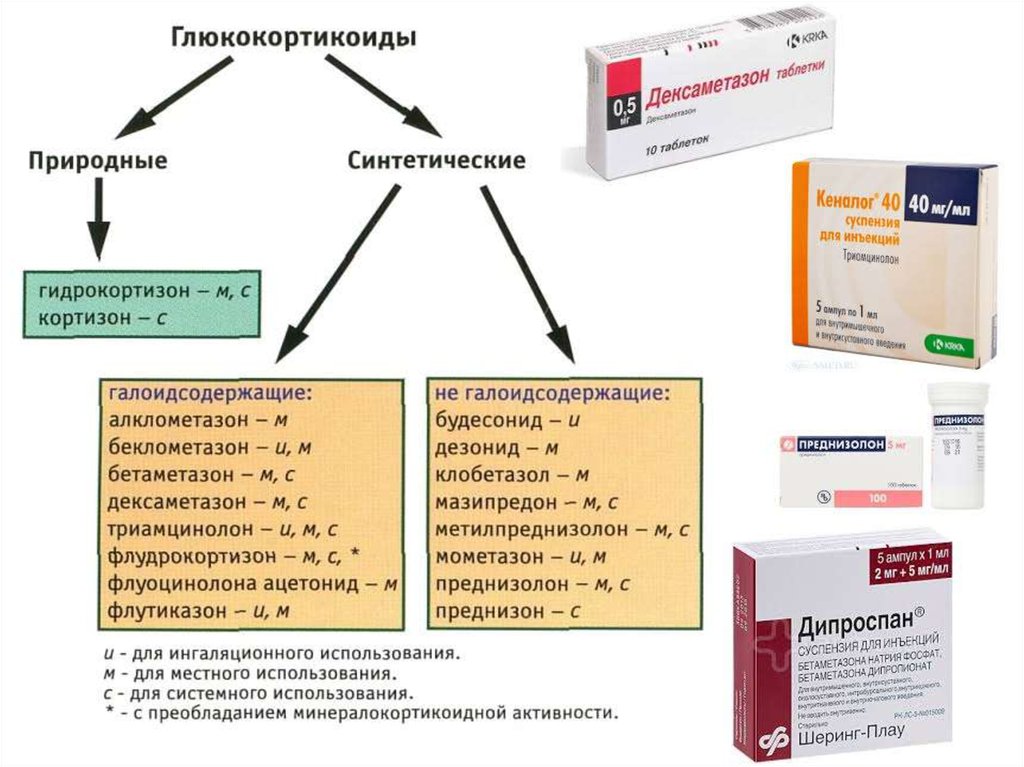
Отличия стероидных от нестероидных противовоспалительных препаратов довольно значимые. СПВС – это средства, в основе которых содержатся глюкокортикостероиды (ГКС), тогда как НПВС – это препараты, которые создаются из органических кислот и не содержат гормонов. В первом случае действующее вещество угнетает все фазы воспаления. Синтетические аналоги гормонов, которые в организме человека создаются надпочечниками, сегодня довольно распространены в терапии хронической боли.
Естественные глюкокортикостероиды, созданные природой, повышают давление и объем крови, циркулирующей в кровеносной системе организма человека. При комплексном лечении ХБС и болезней, сопровождающихся болевыми ощущениями, применяют стероидные анальгетики. Форма лекарств (глюкокортикоидных препаратов) может быть любая, например, стероидное противовоспалительное средство для суставов или кожи в виде мази, стероидные гормональные противовоспалительные препараты при остеохондрозе в таблетках или ампулах.
В зависимости от тяжести заболевания и интенсивности болевых ощущений врачи применяют те или иные лекарства в индивидуальной дозировке. При тяжелом течении заболевания и сильных болях специалисты применяют пульс-терапию стероидными гормонами, которая подразумевает одновременное применение больших доз препаратов.
Классификация стероидных противовоспалительных препаратов
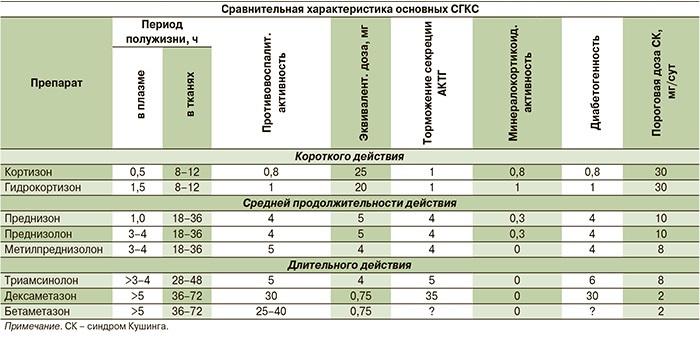
Сравнительная характеристика основных СГКС
Стероидные противовоспалительные препараты – механизм действия
Механизм работы НПВС достаточно прост, он заключается в избирательном или неизбирательном ингибировании фермента под названием циклооксигеназа, который содержится в человеческом организме и играет в нем важную роль, вырабатывая ряд необходимых биологически активных веществ. Как итог, быстрее продуцируются белки, оказывающие противовоспалительный, противоаллергический и противоотечный эффект, а также повышается стрессоустойчивость, ограничивается клеточная инфильтрация, повышается свертываемость крови, стимулируется возникновение глюкозы из белков и жиров, усиливается потеря кальция и т.д.
Если дозы большие, нарушается работа надпочечников и гипофиза. Искусственно синтезированные глюкокортикостероиды более эффективны, чем гормоны естественного происхождения, благодаря чему требуются довольно небольшие дозы синтетических ГСК. Самые распространенные вещества – дексаметазон и преднизолон, которые не влияют на риск развития гипертонии и отечности.
Показания к применению
У медпрепаратов, имеющих противовоспалительное действие, имеется довольно обширный список побочных действий. Глюкокортикостероиды применяются в следующих ситуациях:
Противовоспалительные стероидные препараты применяются при терапии ревматоидного артрита и болезнях соединительной ткани, суставов, для устранения воспаления и снятия боли. В медицинской практике применяются при гипотонии, вызванной шоком или кровотечением. Помимо этого стероидные анальгетики применяются при нарушении работы надпочечников.
Побочные эффекты глюкокортикоидов
В зависимости от течения заболевания, показаний и индивидуальных особенностей организма врачи рассчитывают подходящую дозировку того или иного лекарства. Несмотря на то, что они имеют положительный эффект, не исключены и побочные действия, которые необходимо учитывать при проведении терапии. В большинстве случаев противопоказания относительны, поэтому только врач может определить целесообразность применения препарата. При применении совместно с нестероидными противовоспалительными повышается токсическое воздействие на печень, что может сказаться на общем состоянии больного.
| Система | Возможные нежелательные явления |
| Пищеварительная | • образование острых язв желудочно-кишечного тракта; |
| • тошнота; | |
| • повышенный риск кровотечений и перфорации полых органов; | |
| • нарушение аппетита; | |
| • метеоризм; | |
| • проблемы со стулом. | |
| Кожа и слизистые оболочки | • проблемы с заживлением обычных ран; |
| • кровоизлияния; | |
| • дряблость кожи; | |
| • появление пятен – участки гипо- или гиперпигментации; | |
| • угревая болезнь; | |
| • стрии – растяжки; | |
| • гнойничковое поражение кожи; | |
| • кандидозы – грибковое поражение. | |
| Эндокринная | • стероидный сахарный диабет; |
| • дегенерация надпочечников; | |
| • синдром Иценко-Кушинга – нарушение менструальной функции, слабость, багровые растяжки, ожирение, гирсутизм, артериальная гипертензия. | |
| Сердечно-сосудистая | • аритмии; |
| • уменьшение частоты пульса вплоть до угрожающей жизни брадикардии; | |
| • гипокалиемия (специфические изменения на электрокардиограмме); | |
| • повышение артериального давления; | |
| • склонность к тромбозам; | |
| • более тяжелые инфаркты миокарда. | |
| Сенсорная | • катаракта; |
| • снижение зрения. | |
| Нервная | • эйфория; |
| • психозы; | |
| • эмоциональная лабильность; | |
| • галлюцинации; | |
| • депрессия; | |
| • паранойя; | |
| • инсомния; | |
| • головная боль; | |
| • судороги; | |
| • головокружение. | |
| Опорно-двигательная | • остеопороз; |
| • мышечная слабость; | |
| • патологические переломы костей; | |
| • атрофия мышц. |
Если у человека имеют место депрессивные расстройства и нарушения в психике, такое вещество как преднизолон может только усилить эмоциональную нестабильность, нервозность и раздражительность.
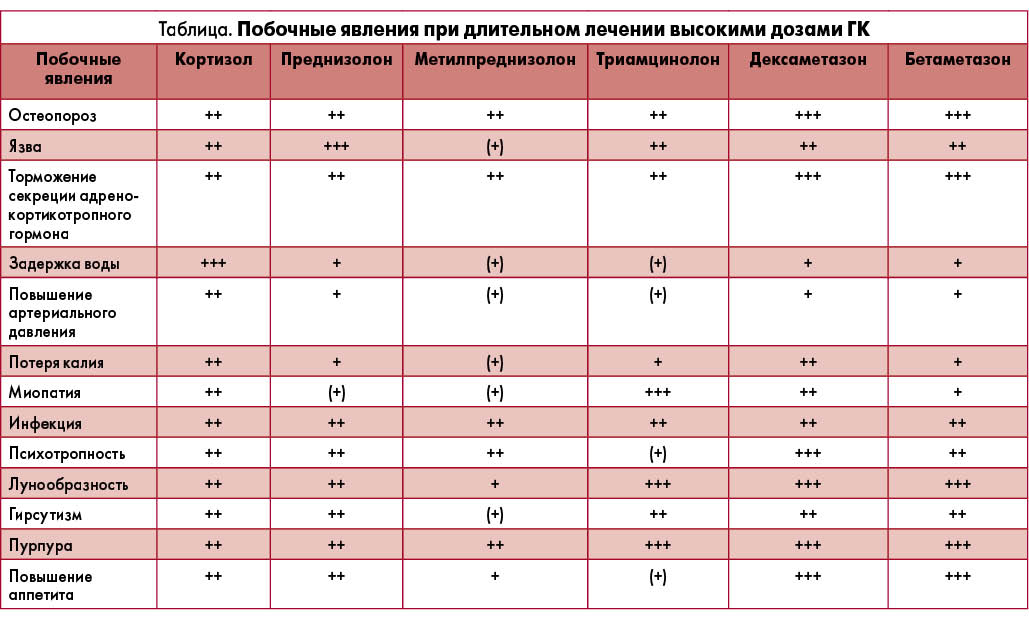
Побочные явления при длительном лечении высокими дозами ГК
Видео о лечении наркомании и алкоголизма в ЦЗМ
Стероидные гормоны, миома матки и нарушения функции печени: патогенез и перспективы лечения
Миома матки (ММ) относится к истинным доброкачественным опухолям гормонально зависимых органов. Ее распространенность колеблется в широких пределах. По данным литературы, каждая четвертая-пятая женщина в мире больна миомой матки
Миома матки (ММ) относится к истинным доброкачественным опухолям гормонально зависимых органов. Ее распространенность колеблется в широких пределах. По данным литературы, каждая четвертая-пятая женщина в мире больна миомой матки [40, 57]. Несмотря на низкую вероятность малигнизации (1%), до 2/3 пациенток, страдающих миомой матки, подвергаются оперативному лечению, причем 60–96% всех операций являются радикальными и приводят к потере репродуктивной и менструальной функции у женщин. Это впоследствии становится основной причиной развития нарушений в гипоталамо-гипофизарно-яичниковой системе, а также вегетососудистых и психоэмоциональных сдвигов [6, 14].
Фоном для усиленного роста миоматозных узлов в пременопаузальном периоде считаются длительные нейроэндокринные нарушения, патологический климакс, действие факторов, стимулирующих гиперпластические процессы в организме, а также различные метаболические расстройства (ожирение, нарушение липидного и углеводного обменов и т. д.) [6, 14, 17].
Миома матки часто сочетается с различными экстрагенитальными заболеваниями: ожирением (64%), заболеваниями сердечно-сосудистой системы (60%), функциональными нарушениями желудочно-кишечного тракта (40%); гипертонической болезнью (19%), неврозами и неврозоподобными состояниями (11%), эндокринопатиями (4,5%). Избыточный вес женщины в сочетании с низкой физической активностью и частыми стрессами относятся к факторам, способствующим появлению ММ. Кроме того, при оценке риска возникновения миомы матки не исключается генетическая предрасположенность ее развития [58].
В клинической практике важное значение имеет характер опухолевого роста. Опухоли матки разделяются по тканевому составу — миомы, фибромы, ангиомы и аденомиомы — в зависимости от содержания в них соединительной ткани и степени развития сосудистого компонента. Выделяют простые и пролиферирующие опухоли, последние встречаются у каждой четвертой больной с миомой матки.
ММ следует рассматривать как дисрегенераторный пролиферат поврежденного миометрия, а не опухоль [24, 38, 58].
Известно, что в миометрии вокруг тонкостенного сосуда сразу закладываются несколько зачатков роста. Миома матки имеет автономный рост (аутокринный и паракринный), обусловленный взаимодействием ростовых факторов и образованием гормонально чувствительных и ростовых рецепторов [14, 23, 38, 53].
Патогенез ММ до сих пор вызывает много споров. Существующие теории развития заболевания основаны на результатах лабораторных и экспериментальных исследований и объясняют лишь некоторые звенья патогенеза. Одно из центральных мест в патогенезе ММ отводится особенностям гормонального статуса и функционального состояния репродуктивной системы [42].
Современные исследования подтверждают традиционное мнение о ведущей роли эстрогенов в патогенезе ММ [40, 41, 56]. Содержание рецепторов эстрадиола и прогестерона в ткани миомы выше, чем в неизмененном миометрии, и подвержено циклическим изменениям. Длительное лечение агонистами гонадолиберина (гипоталамический рилизинг-фактор) уменьшает объем миоматозных узлов на фоне значительного снижения содержания рецепторов эстрогенов в миометрии и тканях миомы [14, 16, 23, 33, 40, 54].
Ведущая роль в патогенезе миомы матки отводится гиперэстрогенемии. Это было доказано в эксперименте возможностью получения псевдомиомы в результате длительного применения эстрогенных гормонов. После прекращения действия эстрогенов ММ у животных подвергается обратному развитию [19].
Эстрогены в крови женщин циркулируют как в свободном, так и в связанном состоянии в виде соединений с серной и глюкуроновой кислотами. Конъюгация эстрогенов с глюкуроновой кислотой с помощью фермента уридинфосфоглюкуронилтрансферазы происходит в основном в печени. Нарушение процессов конъюгации эстрогенов может привести к увеличению свободных фракций эстрогенов, обладающих более выраженной способностью стимулировать гиперпластические процессы в органах-мишенях — матке [19].
У женщин, страдающих ММ, все ткани (а не только ткани матки) реагируют на колебания уровня половых гормонов изменением концентрации своих рецепторов; эстрадиол индуцирует образование сначала рецепторов, а подъем уровня прогестерона в крови приводит к снижению и эстрогенных и прогестеронных рецепторов [23].
Прогестерон наряду с эстрогенами стимулирует рост миомы матки [54], но оба этих гормона, принимая участие в патогенезе миом, используют разные пути [59]. Доказано, что 4-гидроксилирование эстрадиола в ткани ММ повышено по отношению к окружающему миометрию в пять раз. Уровни активности ароматазы и продуктов транскрипции цитохрома Р450-ароматаз в 2 — 20 раз выше в культуре клеток миомы, чем в нормальной ткани. Это указывает на усиление локального биосинтеза эстрогенов, стимулирующих рост миомы [33]. Высокое содержание рецепторов эстрогенов и прогестерона в миоме реализуется в локальном повышении концентрации эстрадиола, прогестерона и стимулировании роста миомы. При этом прогестерон и эстрогены оказывают синергическое действие [59].
Таким образом, нарушения обмена половых стероидов в миоматозных узлах формируются по принципу положительной обратной связи, основанной на аутокринной стимуляции клеток. Развитие этого патофизиологического механизма обусловлено активным участием так называемых факторов роста, что приводит к росту миоматозных узлов, нарушению васкуляризации и кровотечениям [33, 40, 56, 59].
Основную роль в развитии осложнений предположительно играют фактор роста фибробластов, сосудистый эндотелиальный фактор роста, трансформирующий β-фактор роста, паратиреоидный гормоноподобный протеин и пролактин [17].
Решающим фактором, индуцирующим развитие ММ, является локальная гиперэстрадиолемия, не сбалансированная локальной гиперпрогестеронемией. ММ в условиях естественной ановуляции становится фактором риска ускоренного развития гиперпластических процессов миометрия и эндометрия [6, 23, 29, 30].
Нарушение гормонального фона влияет не только на рост миомы матки, но также оказывает воздействие на функции многих органов и систем. Наиболее часто нарушаются метаболические функции печени. Патологической основой для этого является существование в организме функциональной метаболической системы «гипоталамус-гипофиз-яичники-печень» [2, 3, 4, 5, 27]. Следует подчеркнуть, что печень — центральный орган гомеостаза холестерина и его производных [21, 32, 49].
Источником синтеза основных липидов желчи, в частности желчных кислот и неизмененного холестерина желчи, является холестерин различных классов липопротеидов, причем холестерин липопротеидов высокой плотности в основном превращается в желчные кислоты, а холестерин липопротеидов низкой плотности экскретируется в желчь в неизмененном виде [17, 36, 46]. Ключевым моментом синтеза желчных кислот считается 7-альфа-гидроксилаза. Существенная роль в регуляции активности данного фермента отводится половым гормонам, кроме того, активность 7-альфа-редуктазы зависит от количества свободного неэстерифицированного холестерина [21, 35, 46].
Метаболические и катаболические реакции, происходящие в печени, уравновешивают различные секреторные процессы, в частности, здесь активируются и взаимопревращаются гормоны [22, 44]. Изменение превращений гормонов влияет на количество активных форм в крови и тканях. Усиление метаболических реакций ведет как к смещению равновесия между свободной и связанной формами гормонов в сторону увеличения концентрации свободной их фракции, так и к подавлению синтеза специфических транспортных белков и автоматическому повышению содержания свободной активной формы гормонов [19].
Катаболизм гормонов — это совокупность разнообразных процессов ферментной деградации исходной структуры секретируемого гормона [25]. Печень является главным продуцентом гормоносвязывающих белков. Более 90% холестерина, используемого при синтезе стероидных гормонов, образуется в печени. Метаболиты стероидных гормонов плохо растворяются в воде и перед экскрецией превращаются в печени в парные соединения (конъюгаты) эфира с серной, глюкуроновой и другими кислотами [21, 47].
Гормональный импринтинг метаболизма стероидов осуществляется на транскрипционном или трансляционном уровнях. Он сводится к организации определения соотношения молекулярных форм микросомального цитохрома Р-450. Нарушение стероидного обмена связано с усилением активности одних и уменьшением других ферментных систем [37, 48].
Взаимосвязь между репродуктивной и гепатобилиарной системами известна давно [2,3,4,5]. С одной стороны, у пациентов с ММ часто выявляются заболевания печени и желчевыводящих путей, способствующие развитию нарушений метаболизма эстрогенов [39, 45], с другой — избыток в крови некоторых половых стероидов неблагоприятно влияет на различные функции печени [44, 55]. M. Maneshi и A. Martorani (1974) описали печеночно-яичниковый синдром, в определенной степени определяющий эту взаимосвязь [49].
Тесные функциональные взаимосвязи печени и женских половых гормонов, часто встречающееся сочетание их поражений и связанная с ним необходимость применения гормональной терапии, влияющей на деятельность печени, объясняют повышенный интерес к изучению функционального состояния печени у больных с миомой матки.
У больных с ММ и нормальным содержанием эстрогенов в крови связей между экскрецией эстрогенов и изменением содержания белковых фракций в плазме крови не отмечено. При повышении содержания эстрогенов в крови больных с ММ наблюдалась прямая корреляционная связь между содержанием прямого билирубина и концентрацией эстрадиола [7, 9, 10, 11, 12].
У большинства больных с ММ нарушения функций печени происходят в отсутствии клинических признаков заболевания гепатобилиарной системы [20].
Таким образом, установлено, что развитие ММ сочетается с функциональными поражениями печени, и не исключается, что рост миомы происходит на их фоне.
Нельзя исключить, что обнаруженные функциональные изменения печени у больных с ММ связаны с нарушением обмена стероидных гормонов. Установлено, что концентрация плазменных липидов увеличивается параллельно повышению уровня эндогенных половых гормонов, в частности эстрогенов, и это в определенной степени доказывает гормональную обусловленность гиперлипидемии при ММ [34, 44, 50]. Под влиянием эстрогенов происходят торможение синтеза холестерина в печени и уменьшение содержания холестерина в надпочечниках, увеличение содержания фосфолипидов [1, 13, 51, 52].
Известно, что транспорт липидов в печень плазмы крови осуществляется рецепторами мембран гепатоцитов и синусоидальных клеток печени. Эстрогены активируют рецепторы гепатоцитов для ХС ЛПНП, в результате чего увеличивается их захват [8, 10, 26, 31, 46]. Следствием этого процесса является увеличение содержания холестерина в печени и пузырной желчи, но не за счет усиления его синтеза, а за счет повышения уровня эстрогенов, приводящего к снижению синтеза желчных кислот в печени в результате ингибирующего влияния эстрогенов на активность 7-альфа-гидроксилазы холестерина [37, 43].
Повышенное содержание половых гормонов (эстрогенов) обусловливает изменение соотношения холестерина и желчных кислот в желчи. Это приводит к увеличению содержания свободного холестерина, выделяемого с желчью, и образованию насыщенной и перенасыщенной холестерином желчи. Наиболее выраженные нарушения липидного обмена отмечались у больных со значительными размерами опухоли при ее быстром росте. У них имелась отчетливая тенденция к нарастанию концентрации в крови общих липидов, липопротеидов, свободного холестерина, отмечено значительное снижение фосфолипидов и эфиров холестерина [2, 3, 4, 18].
При длительном существовании ММ и ее медленном росте показатели содержания общих липидов, липопротеидов и холестерина в сыворотке крови незначительно отличаются от нормальных значений, тогда как качественные нарушения липидного обмена сохранили описанные выше закономерности и укладываются в рамки дислипопротеидемии [2, 4]. Кроме того, значительный дефицит фосфолипидов, особенно при длительно существующих опухолях, является доказанным фактом [2, 3, 18].
Таким образом, имеющиеся в литературе данные о функциональном состоянии печени у больных с ММ противоречивы, так как были получены при анализе небольшого и неоднородного количества клинических наблюдений, кроме того, часто ограничены характеристикой одной из функций печени. Практически не освещен вопрос комплексной диагностики нарушений функционального состояния печени (особенно на ранних стадиях ее поражения) с применением современных радиоизотопных методов исследования, включая исследования ее ретикулоэндотелиальной системы. Тактика лечения больных с ММ не учитывает нарушения функций печени.
Нельзя упускать из вида следующее обстоятельство: основная задача при лечении ММ, особенно гормональном, направлена на избавление пациенток от миомы. В то же время любой из используемых сегодня препаратов оказывает в той или иной степени негативное влияние, а хирургическое лечение не оказывает положительного воздействия на нарушенные функции печени.
Современные методы диагностики позволяют по-новому взглянуть на проблему лечения миомы матки с учетом патогенеза морфологических и функциональных изменений печени у больных с ММ, что, безусловно, положительно скажется на ее результатах.
Независимо от вида терапии (консервативное или хирургическое) нарушения функции печени при ММ следует рассматривать с позиций липидного дистресс-синдрома Савельева [28]. В этой связи наиболее перспективным направлением лечения метаболических нарушений функции печени можно считать длительную липидокоррегирующую терапию вазелин-пектиновой эмульсией ФИШант С (Россия, ПентаМед) с обязательным применением комбинированных растительных гепатотропных препаратов (гепабене, ратиофарм) и восстановлением микробиоценоза толстой кишки пробиотиками (хилак форте, ратиофарм) [28].
По вопросам литературы обращайтесь в редакцию
З. Р. Кантемирова, кандидат медицинских наук
А. М. Торчинов, доктор медицинских наук, профессор
Т. А. Жигулина
В. В. Кадохова
Е. А. Алексеева, кандидат медицинских наук
Е. А. Девятых
В. А. Петухов, доктор медицинских наук, профессор
МГМСУ, РГМУ, 1-я Градская больница, Москва