Что такое структурированный углерод
LiveInternetLiveInternet
—Метки
—Рубрики
—Музыка
—Стена
—Поиск по дневнику
—Подписка по e-mail
—Статистика
Как ты относишься к структурированному углероду?
Всё ломается: чувства, люди, утюг
— Всё ломается: чувства, люди, утюг.
Особенно утюг меня расстроил. Вот уж от него не ожидала!
— Вот скажи, если муж чистит ногти отверткой, можно назвать его дебилом?
— Ну, если только отвертка крестовая.
— Во! Еще один!
— Братан, братан, быстрее, там наших бьют!
— Да у меня телефон без к амеры.
— Я вас вынужден огорчить, ваша дочь вчера в клубе напилась!
— Врешь! Она вчера в рот ничего не брала!
— Эээ. кажется, я огорчу вас дважды.
— Каким образом можно заставить дурака весь день чего-то ждать с нетерпением?
— Я тебе завтра скажу.
— Три зайца, сколько ушей?
— Сколько зайца не три, все равно два уха будет.
— Что общего между государственным бюджетом и мужем-подкаблучником?
— Их постоянно пилят.
— Не выноси мне мозг!
— Его туда и не заносили.
— А ты красивая!
— Да я сама балдею.
— Папа, а ты ещё вырастешь?
— Нет, сынок.
— А зачем ты тогда кушаешь?
— Скажите, что главное в боксе?
— Шубы!
— Что?! Какие ещё шубы?!
— Шелые пеедние шубы!
— А я на днях себе iPhone купила!
— Не комплексуешь, что телефон умнее хозяйки?
— А вы знаете, что в Америке крыс научили пользоваться айпадом?
— Это что, у нас они давно используют «1С:Предприятие»
Иду по улице, два парня за спиной! Один:
— Вот это ноги! Какая фигура! Просто супер!
Я поворачиваясь:
— Да, я такая!
А они просто картинку в телефоне смотрели!
Стоим вчера с сыном в ванной, чистим зубы перед сном. Пять с половиной ему.
Смотрит на меня в зеркало внимательно и грустно. Спрашиваю его взглядом, что, мол, случилось.
— Пап, а правда, что мужчины раньше женщин умирают?
— Ну, в общем, да. По статистике.
— Значит, ты умрёшь раньше мамы?
— Не исключено.
Повернулся ко мне, очень проникновенно посмотрел в глаза. Отцовское сердце слегка защемило.
— Пап, научи, пожалуйста, маму закачивать игрушки на айпэд.
Дорогой Дед Мороз, у меня есть фото, где ты в бане с тремя снегурочками!
Список своих желаний вышлю следующим письмом!
Если вы сумели заставить себя прекратить грызть семечки, когда там еще оставалось пол-тарелки, то побороть героиновую зависимость для вас вообще пара пустяков.
Коварная жена забила морозилку до отказа мясом, курицей, котлетами какими-то и уехала на 2 недели.
Пельмени хранить негде!
Жрать хочу, помираю!
Когда я была маленькой, я мечтала, что однажды меня заберёт прекрасный принц.
Теперь об этом мечтает мой муж.
Я красивая, интересная, умная, смешливая, интеллигентная, добрая, заботливая, но. не сегодня.
Всегда с недоумением относился к людям, которые желают мне исполнения моих желаний. Они же этого не переживут!
Семь обличий углерода
Как из одного и того же атома создать материалы с совершенно разными свойствами
Важная область практического применения новейших открытий в области физики, химии и даже астрономии — создание и исследование новых материалов с необычными, подчас уникальными свойствами. О том, в каких направлениях ведутся эти работы и чего уже сумели добиться ученые, мы расскажем в серии статей, созданных в партнерстве с Уральским федеральным университетом. Первый наш текст посвящен необычным материалам, которые можно получить из самого обычного вещества — углерода.
Если спросить у химика, какой элемент самый важный, можно получить массу разных ответов. Кто-то скажет про водород — самый распространенный элемент во Вселенной, кто-то про кислород — самый распространенный элемент в земной коре. Но чаще всего вы услышите ответ «углерод» — именно он лежит в основе всех органических веществ, от ДНК и белков до спиртов и углеводородов.
Наша статья посвящена многообразным обличьям этого элемента: оказывается, только из его атомов можно построить десятки различных материалов — от графита до алмаза, от карбина до фуллеренов и нанотрубок. Хотя все они состоят из абсолютно одинаковых атомов углерода, их свойства радикально отличаются — а главную роль в этом играет расположение атомов в материале.
Графит
Чаще всего в природе чистый углерод можно встретить в форме графита — мягкого черного материала, легко расслаивающегося и словно скользкого на ощупь. Многие могут вспомнить, что из графита делаются грифели карандашей — но это не всегда верно. Часто грифель делают из композита графитовой крошки и клея, но встречаются и полностью графитовые карандаши. Интересно, но на карандаши уходит больше одной двадцатой всей мировой добычи естественного графита.
Чем необычен графит? В первую очередь, он хорошо проводит электрический ток — хотя сам углерод и не похож на другие металлы. Если взять пластинку графита, то окажется, что вдоль ее плоскости проводимость примерно в сто раз больше, чем в поперечном направлении. Это напрямую связано с тем, как организованы атомы углерода в материале.
Если посмотреть на структуру графита, то мы увидим, что она состоит из отдельных слоев толщиной в один атом. Каждый из слоев — сетка из шестиугольников, напоминающая собой соты. Атомы углерода внутри слоя связаны ковалентными химическими связями. Более того, часть электронов, обеспечивающих химическую связь, «размазана» по всей плоскости. Легкость их перемещения и определяет высокую проводимость графита вдоль плоскости углеродных чешуек.
Отдельные слои соединяются между собой благодаря ван-дер-ваальсовым силам — они гораздо слабее, чем обычная химическая связь, но достаточны для того, чтобы кристалл графита не расслаивался самопроизвольно. Такое несоответствие приводит к тому, что электронам гораздо сложнее перемещаться перпендикулярно плоскостям — электрическое сопротивление возрастает в 100 раз.
Благодаря своей электропроводности, а также возможности встраивать атомы других элементов между слоями, графит применяется в качестве анодов литий-ионных аккумуляторов и других источников тока. Электроды из графита необходимы для производства металлического алюминия — и даже в троллейбусах используются графитовые скользящие контакты токосъемников.
Кроме того, графит — диамагнетик, причем обладающий одной из самых высоких восприимчивостей на единицу массы. Это означает, что если поместить кусочек графита в магнитное поле, то он всячески будет пытаться вытолкнуть это поле из себя — вплоть до того, что графит может левитировать над достаточно сильным магнитом.
И последнее важное свойство графита — невероятная тугоплавкость. Самым тугоплавким веществом на сегодняшний день считается один из карбидов гафния с температурой плавления около 4000 градусов Цельсия. Однако если попытаться расплавить графит, то при давлениях около ста атмосфер он сохранит твердость вплоть до 4800 градусов Цельсия (при атмосферном давлении графит сублимирует — испаряется, минуя жидкую фазу). Благодаря этому материалы на основе графита используют, например, в корпусах ракетных сопел.
Алмаз
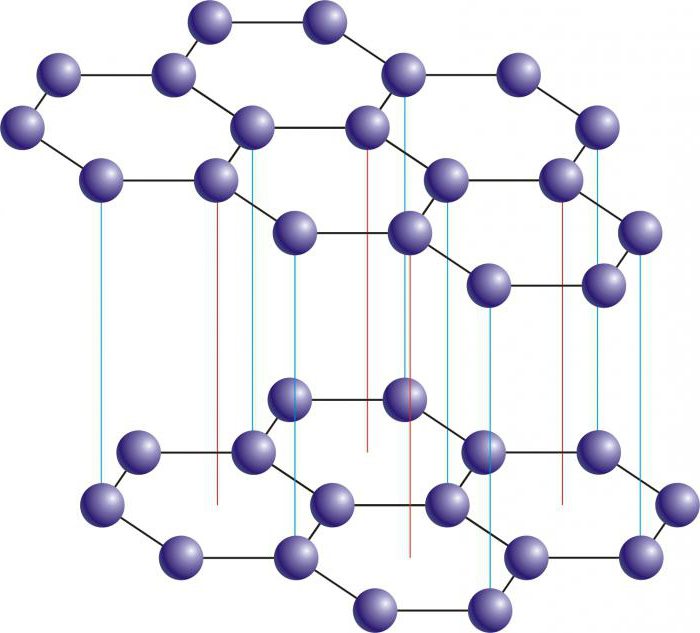
Многие материалы под давлением начинают менять свою атомарную структуру — происходит фазовый переход. Графит в этом смысле ничем не отличается от других материалов. При давлениях в сто тысяч атмосфер и температуре в 1–2 тысячи градусов Цельсия слои углерода начинают сближаться между собой, между ними возникают химические связи, а когда-то гладкие плоскости становятся гофрированными. Образуется алмаз, одна из самых красивых форм углерода.
Свойства алмаза радикально отличаются от свойств графита — это твердый прозрачный материал. Его чрезвычайно сложно поцарапать (обладатель 10-ки по шкале твердости Мооса, это максимум твердости). При этом электропроводность алмаза и графита отличается в квинтиллион раз (это число с 18 нулями).
Что такое структурированный углерод
Раскрытие тайн углерода
Доктор химических наук, профессор В. И. Касаточкин из Института горючих ископаемых вместе с учеными Института элементоорганических соединений доктором химических наук А. М. Сладковым, кандидатом химических наук Ю. П. Кудрявцевым и членом-корреспондентом АН СССР В. В. Коршаком открыли явление существования новой кристаллической формы углерода, названной карбином. Его получили из ацетилена. Третья форма кристаллического углерода обладает полупроводниковыми свойствами и фотопроводимостью.
Карбин обнаружен и в естественном виде. Недавно в кратере Рис (Бавария), который образовался в результате падения метеорита, был обнаружен кристаллический углерод, по структуре близкий к карбину. Такой же углерод найден учеными Института геохимии АН СССР в метеорите Новый Урей.
Описанное открытие внесено в Государственный реестр под № 107 с приоритетом от 4 ноября 1960 г. в следующей формулировке:
Закономерность образования алмазов
Алмаз давно интересует не только минералогов, но и физиков и представителей других областей науки в связи со своими особыми свойствами и необычным, во многом загадочным, происхождением.
До конца XIX в. алмаз применялся в основном для украшений. Однако с развитием промышленности он приобретал все большее техническое значение. Сейчас 78- 80% добываемых в мире алмазов идет на промышленные нужды.
В своем выступлении на XXV съезде КПСС президент АН СССР, академик А. П. Александров отмечал: «Для народного хозяйства дали важные результаты разработки методов получения крупных технических алмазов и эльбора, что повышает производительность труда в механообработке в 2-5 раз, новых технических и ювелирных кристаллов, сапфиров сложных форм, фианитов. » ( «Правда», 1976, 27 февраля)
История алмазов полна приключений, разочарований и крушений надежд. На протяжении веков вокруг этого драгоценного кристалла кипели страсти. В конце прошлого века французский химик А. Муассан сообщил, что ему удалось получить алмазы размером с булавочную головку, растворяя угольный порошок в железе при 3000° и охлаждая расплав в свинце. Однако никто не смог успешно повторить опыт Муассана.
В 1939 г. доктор физико-математических наук, профессор О. И. Лейпунский (Институт химической физики АН СССР) теоретически определил условия образования искусственных алмазов. До тех пор попытки синтеза (кристаллизации) алмаза были неудачны. Основываясь на измерении термодинамических величин Россини и Джессона (1938 г.), О. И. Лейпунский вычислил точную границу равновесия перехода графита в-алмаз в той области температур, где реально может происходить синтез алмаза. Расчеты ученого свелись к таблице значений давлений и температур (Р, Т), описываемых формулой
Для реального образования алмазов необходима благоприятная кинетика. О. И. Лейпунским установлено, что наличие среды, являющейся растворителем для твердой фазы углерода или вступающей с ней в нестойкие химические соединения, может значительно облегчить рекристаллизацию. При этом количественная связь давления и температуры не только необходимое, но и достаточное условие образования алмазов. В частности, синтез алмазов в жидком железоуглеродном растворе должен начаться при температуре 1500-1700° К и давлении 45-50 тыс. ат.
Открытие зарегистрировано под № 101 с приоритетом от августа 1939 г. Формула открытия следующая:
«Теоретически установлена. неизвестная ранее закономерность кристаллизации (синтеза) алмаза из углерода- образование алмаза в области его стабильности в жидкой среде, растворяющей углерод или вступающей с ним в нестойкие химические соединения, при давлении и температуре, большей 1400° К, отвечающих условию:
Теоретический расчет О. И. Лейпунского через 22 года был подтвержден многими экспериментальными работами. На основании установленной закономерности синтез алмазов стал научно рассчитанным процессом.
Технология промышленного производства синтетических алмазов была разработана в начале 60-х гг. Синтетические кристаллы намного дешевле, чем натуральные.
Алмаз работает тем лучше, а расход его тем меньше, чем тверже и хрупче обрабатываемый материал. Поэтому применение алмазов наиболее эффективно при обработке твердых хрупких труднообрабатываемых материалов, таких, как твердые сплавы, полупроводники (германий, кремний), стекло, керамика, гранит, мрамор и др. При обработке этих материалов с помощью алмазов производительность труда на отдельных операциях возрастает в десятки раз.
Нитевидные кристаллы алмаза
Советские ученые вписали в историю алмазов еще одну блистательную страницу. Впервые в мире были получены драгоценные кристаллы из газа при давлении не более 1 ат.
В 1967 г. работники Института физической химии АН СССР член-корреспондент АН СССР Б. В. Дерягин, доктор химических наук В. М. Лукьянович, доктор технических наук Д. В. Федосеев, кандидат технических наук В. А. Рябов, кандидат химических наук Б. В. Спицын и научный сотрудник А. В. Лаврентьев открыли свойство углерода образовывать нитевидные кристаллы алмаза из углеродсодержащей среды. В основе этого явления лежит ориентирующее действие поверхностных сил на процессы роста кристаллов из газовой среды.
Возможность роста алмазных усов на подложке из алмазного кристалла объясняется двояко: исходя, во-первых, из молекулярного механизма роста кристаллов, во-вторых, из общей теории образования новой фазы (явления нуклеации). Если имеется грань затравочного кристалла алмаза, вблизи которой концентрация атомов углерода в виде пара или химически связанного вещества (например, в виде метана или ацетилена) превышает соответствующую равновесную, то избыток атомов углерода будет выделяться на грани. При этом он будет находиться под влиянием молекулярно-силового поля кристаллической решетки, стремящейся продолжить ту «кирпичную кладку», которая в свое время привела к образованию самой подложки. Иными словами, затравочный кристалл алмаза принуждает новые атомы углерода располагаться в определенном порядке.
Во многих странах мира исследователи проявляют глубокий интерес к выращиванию нитевидных кристаллов меди, сапфира, рубина, графита и других веществ.
У таких «иголочек» структура монокристалла с идеально упорядоченным размещением атомов. Благодаря этому их прочность во много раз выше, чем у лучших марок стали, отчего их называют конструкционным материалом будущего.
Методы получения кристаллов алмаза с успехом применяются для получения других нитевидных кристаллов, а также метастабильных структур. Усы некоторых кристаллических веществ уже используются в композиционных материалах, состоящих из ориентированных усов и полимерной или металлической связки.
Сделанное открытие дает возможность получения в метастабильных условиях алмазных монокристаллов значительных линейных размеров. Монокристальная структура, доказанная методами рентгеновской и электронной микродифракции, позволяет ожидать рекордных прочностных свойств. С помощью созданных авторами открытия установок удалось наблюдать за ростом нитевидных кристаллов через микроскоп. Весьма интересна возможность получать кристаллы алмаза, имеющие форму почти правильных многогранников.
Работа, положенная в основу открытия, получила широкое признание за рубежом.
Открытие зарегистрировано под № 73 с приоритетом от 14 апреля 1967 г. Авторам открытия вручены дипломы со следующей его формулой:
«Экспериментально обнаружено ранее неизвестное свойство углерода выделяться из углеродсодержащей среды в форме нитевидных кристаллов алмаза».
Явление ускоренного испарения углерода из металлокарбидных и карбидоуглеродных эвтектик
Ускоренное испарение углерода из жидких металло-карбидных и карбидоуглеродных эвтектик наиболее ярко проявляется при температурах плавления соответствующих эвтектик. Эффект прекращается при 150-200° выше температуры плавления эвтектики. Явление наблюдается в вакууме при атмосферном и избыточном давлениях».
На принципах обнаруженного явления авторы открытия сделали ряд изобретений, имеющих важное народнохозяйственное значение.
Открытие внесено в Государственный реестр открытий СССР под № 143 с приоритетом от 24 октября 1969 г. Оно сформулировано так:
Что такое графен и как он изменит нашу жизнь?
Впервые о графене заговорили в 2004 году, когда Андрей Гейм и Константин Новоселов — британские ученые российского происхождения — опубликовали статью в журнале Science [1]. В ней говорилось о новом материале, который получили с помощью обычного карандаша и скотча. Ученые просто снимали клейкой лентой слой за слоем, пока не дошли до самого тонкого — в один атом. В 2010-м за это их наградили Нобелевской премией. С тех прошло уже десять лет.
Что такое графен и чем он так уникален?
Углерод — это материал, состоящий из кристаллической решетки, которую образуют шестиугольники атомов. Графен — это один слой решетки толщиной в 1 атом.
Отсюда — его первое уникальное свойство: самый тонкий.
Такую структуру графен приобретает за счет sp2-гибридизации. Дело в том, что на внешней оболочке атома углерода расположены четыре электрона. При sp2-гибридизации три из них вступают в связь с соседними атомами, а четвертый находится в состоянии, которое образовывает энергетические зоны. В результате графен еще и прекрасно проводит электрический ток.
Уникальность графена в том, что он обладает такой же структурой, как и полупроводники, при этом он сам проводит электричество — как проводники. А еще у него высокая подвижность носителей заряда внутри материала. Поэтому графен в фото- и видеотехнике обнаруживает сигналы намного быстрее, чем другие материалы.
Графен обладает хорошей теплопроводностью, гибкостью и упругостью, он на 97% прозрачный. При этом, графен — самый прочный из известных материалов: прочнее стали и алмаза.
Миф о токсичности графена
Однако сейчас в биоэлектронике используют другой способ получения графена — путем химического осаждения из газовой фазы. Частицы получаются достаточно крупными. Потом их закрепляют на подложке, и проникнуть сквозь клеточную мембрану они уже не могут.
Где уже используют графен?
Сейчас графен успешно применяют в электронике. Самый массовый продукт — это пауэрбанк [3]: производители обещают, что сам он заряжается за 20 минут, а топовый смартфон заряжает наполовину за полчаса.
Существуют также графеновые куртки и платья. Последние, в частности, оснащены светодиодами [4], которые реагируют на дыхание и температуру тела, меняя цвет.
Теннисные ракетки с графеном весят до 300 грамм меньше, чем обычные, при той же силе удара.
Наконец, машинное масло с графеном призвано снизить износ двигателя.
Где можно применять графен в будущем?
Есть и еще одно свойство графена: он биосовместим, то есть взаимодействует с живыми клетками. Ученые обещают, что материал поможет диагностировать и лечить рак [5]. Это делают с помощью чипа с графеном, который придает повышенную чувствительность. На поверхность чипа высаживают раковые клетки и тестируют на них различные лекарства.
Такие чипы можно использовать и для тестирования других лекарств, а также — определения биомаркеров: иммуноглобулина, ДНК, нейрональных биорецепторов.
Из графена также планируют делать дешевые солнечные батареи, опресняющие устройства для морской воды, гибкие дисплеи, сверхпрочные бронежилеты, сверхчувствительные микропроцессоры, элементы для беспилотников и космических ракет, телефоны с бесконечной зарядкой и умную одежду.
Для России самым перспективным применением графена могут стать нефте- и газодобыча. На основе графена делают жидкости, которые позволят управлять толщиной и свойствами фильтрационной корки буровых растворов. А еще можно делать полимерные трубы и покрытия для нефте- и газопроводов с применением графена.
Графеновый бум
За 7 лет после вручения премии вышло больше 130 тыс. научных работ, посвященных графену и его свойствам. Доля таких исследований среди всех остальных выросла с 0,2% в 2010 году до 1% в 2016-м.
В научном сообществе тестирование свойств графена стало почти мемом. Доходит до того, что в графен добавляют куриный помет, чтобы проверить, как это отразится на его качествах [6].
Всего в мире зарегистрировано более 50 тыс. патентных заявок с упоминанием графена. Больше половины из них принадлежит Китаю, следом идут Южная Корея, США, Япония и Тайвань.
В Китае исследованиями занимаются государственные вузы. В 2013 году здесь создали Инновационный альянс графеновой промышленности, который пророчит Китаю в этой сфере долю в 80% от общемировой.
В остальных странах в графен активно вкладываются коммерческие компании. В Евросоюзе за это отвечает проект Graphene Flagship с инвестициями в €1 млрд [7]. В США — Национальная графеновая ассоциация, в консультативный совет которой входят представители Apple, IBM и Cisco.
В графене заинтересованы гиганты аэрокосмической отрасли: Boeing, Lockheed Martin, Airbus и Thales. Они рассчитывают, что новые материалы позволят им в разы снизить расход топлива — как композиты, которые экономят до 30% горючего в Boeing 787. Электронные корпорации включились в графеновую гонку в надежде, что это принесет им лидерство на рынке смартфонов и аксессуаров к ним.
Среди них — Samsung [8]: компания уже скупила десятки патентов, которых хватит на целую линейку продуктов с графеном. В частности, она представила новый тип аккумуляторов, которые можно будет заряжать за рекордные 12 минут. Такие появятся в новых смартфонах бренда не позднее 2021-го года. Их главный конкурент — Apple — запатентовала акустические диафрагмы с графеном для использования в устройствах следующих поколений. И это, судя по всему — только начало.
В России тоже занимаются изучением графена и даже патентуют электронные устройства на его основе — на базе в Центра фотоники и двумерных материалов МФТИ. Двое ученых-выпускников этого вуза — гендиректор ведущего производителя Graphene 3D Lab Inc. Елена Полякова и профессор Свободного университета Берлина Кирилл Болотин — входят в ту самую американскую ассоциацию.
Почему же графен до сих пор не изменил нашу жизнь?
Во-первых, он все еще очень дорогой. При этом пока нельзя однозначно посчитать, сколько его нужно и для каких целей. Для этого материала нет единой шкалы измерения, так как он может иметь разную структуру — в зависимости от способа получения.
Во-вторых, массовое производство графена пока не налажено, потому что нет технологий, которые бы позволили бы это: например, сложные электронные устройства с графеном делают вручную. Для графена нужна какая-то подложка — например, кварцевая — которая и определяет свойства конечного продукта. При этом пока еще не совсем понятно, какие именно это должны быть свойства.
Углерод в природе, где он находится и как, свойства, использование
углерод в природе это может быть найдено в алмазах, нефти и граффити, среди многих других сценариев. Этот химический элемент занимает шестое место в периодической таблице и находится в горизонтальном ряду или периоде 2 и столбце 14. Он неметаллический и четырехвалентный; то есть вы можете установить 4 химические связи общих электронов или ковалентных связей.
Углерод существует в природе как химический элемент без объединения в форме графита и алмаза. Тем не менее, по большей части он объединяется с образованием химических соединений углерода, таких как карбонат кальция (CaCO).3) и другие соединения в нефти и природном газе.
Он также образует несколько минералов, таких как антрацит, уголь, лигнит и торф. Наибольшее значение углерода заключается в том, что он представляет собой так называемый «строительный блок жизни» и присутствует во всех живых организмах..
Где находится углерод и в какой форме?
Помимо того, что он является химическим компонентом, общим для всех форм жизни, углерод в природе присутствует в трех кристаллических формах: алмаз, графит и фуллерен..
Есть также несколько аморфных минеральных форм угля (антрацит, лигнит, уголь, торф), жидких форм (разновидности масел) и соды (природный газ)..
Кристаллические формы
В кристаллических формах атомы углерода объединяются, образуя упорядоченные структуры с геометрическим пространственным расположением.
графит
Это мягкий сплошной черный цвет с блеском или металлическим блеском теплостойким (огнеупорным). Его кристаллическая структура представляет собой атомы углерода, соединенные в гексагональные кольца, которые, в свою очередь, соединяются вместе, образуя листы.
Месторождения графита редки и были обнаружены в Китае, Индии, Бразилии, Северной Корее и Канаде..
бриллиант
Это очень твердое твердое вещество, прозрачное для прохождения света и намного более плотное, чем графит: значение плотности алмаза эквивалентно почти в два раза больше, чем у графита.
Атомы углерода в алмазе соединяются в тетраэдрической геометрии. Аналогично, алмаз сформирован из графита, подвергнутого условиям очень высоких температур и давлений (3000 ° С и 100 000 атм).
Большая часть алмазов находится на глубине от 140 до 190 км в мантии. Через глубокие извержения вулканов магма может переносить их на расстояния, близкие к поверхности.
Алмазные месторождения имеются в Африке (Намибия, Гана, Демократическая Республика Конго, Сьерра-Леоне и Южная Африка), Америке (Бразилия, Колумбия, Венесуэла, Гайана, Перу), Океании (Австралия) и Азии (Индия)..
фуллерены
Это молекулярные формы углерода, которые образуют кластеры из 60 и 70 атомов углерода в почти сферических молекулах, похожих на футбольные мячи.
Есть также фуллерены, меньшие, чем 20 атомов углерода. Некоторые формы фуллеренов включают углеродные нанотрубки и углеродные волокна.
Аморфные формы
В аморфных формах атомы углерода не объединяются, образуя упорядоченную и правильную кристаллическую структуру. Вместо этого они даже содержат примеси от других элементов.
антрацит
Это самый старый метаморфический минеральный уголь (который происходит от модификации горных пород под воздействием температуры, давления или химического воздействия жидкостей), поскольку его образование относится к первичной или палеозойской эре, каменноугольному периоду..
Как правило, антрацит находится в зонах геологической деформации и составляет приблизительно 1% мировых запасов угля..
Географически он встречается в Канаде, США, Южной Африке, Франции, Великобритании, Германии, России, Китае, Австралии и Колумбии..
Каменный уголь
Это минеральный уголь, осадочная порода органического происхождения, образование которой относится к эпохам палеозоя и мезозоя. Содержание углерода составляет от 75 до 85%..
Это черный, он характеризуется непрозрачностью и имеет матовый и жирный вид, так как он содержит большое количество битумных веществ. Образуется при сжатии лигнита в палеозойскую эру, в каменноугольный и пермский периоды..
Это самая распространенная форма угля на планете. В Соединенных Штатах, Великобритании, Германии, России и Китае имеются крупные месторождения угля..
бурый уголь
Это ископаемый минеральный уголь, образовавшийся в третичном возрасте из торфа при сжатии (высокие давления). Он имеет более низкое содержание углерода, чем уголь, от 70 до 80%.
Это немного компактный материал, рассыпчатый (характеристика, которая отличает его от других углеродных минералов), коричневый или черный. Его текстура похожа на древесину, а содержание углерода колеблется от 60 до 75%..
Это топливо с легким воспламенением, с низкой теплотворной способностью и более низким содержанием воды, чем торф.
В Германии, России, Чехии, Италии (в регионах Венето, Тоскана, Умбрия) и Сардинии имеются важные шахты с бурым углем. В Испании месторождения лигнита находятся в Астурии, Андорре, Сарагосе и Ла-Корунья.
торф
Это материал органического происхождения, образование которого происходит из четвертичной эры, гораздо более поздней, чем предыдущие угли..
Это коричневато-желтый цвет и выглядит как губчатая масса низкой плотности, в которой вы можете увидеть остатки растений от того места, где они произошли.
Торф имеет высокое содержание воды; по этой причине требует использования сушки и уплотнения перед использованием.
Имеет низкое содержание углерода (всего 55%); следовательно, он имеет низкую энергетическую ценность. Когда он подвергается сгоранию, его остаток золы в изобилии и выделяет много дыма.
Существуют важные месторождения торфа в Чили, Аргентине (Огненная Земля), Испании (Эспиноса-де-Серрато, Паленсия), Германии, Дании, Голландии, России, Франции..
Нефть, природный газ и битум
Он образовался в недрах, на больших глубинах и в особых условиях, как физических (высокие давления и температуры), так и химических (присутствие определенных каталитических соединений) в процессе, который занял миллионы лет.
Во время этого процесса C и H высвобождались из органических тканей и снова объединялись, образуя огромное количество углеводородов, которые смешиваются в соответствии с их свойствами, образуя природный газ, нефть и битум..
Нефтяные месторождения планеты расположены в основном в Венесуэле, Саудовской Аравии, Ираке, Иране, Кувейте, Объединенных Арабских Эмиратах, России, Ливии, Нигерии и Канаде..
Есть запасы природного газа в России, Иране, Венесуэле, Катаре, Соединенных Штатах, Саудовской Аравии и Объединенных Арабских Эмиратах, среди других..
Физико-химические свойства
Среди свойств углерода можно отметить следующие:
Химический символ
Атомный номер
Физическое состояние
Твердый, при нормальных условиях давления и температуры (1 атмосфера и 25 ° C).
цвет
Серый (графит) и прозрачный (алмаз).
Атомная масса
Точка плавления
Точка кипения
плотность
растворимость
Нерастворим в воде, растворим в четыреххлористом углероде CCl4.
Электронная конфигурация
Количество электронов во внешнем слое или валентности
Пропускная способность
сцепление
Обладает способностью образовывать химические соединения в длинных цепях..
Биогеохимический цикл
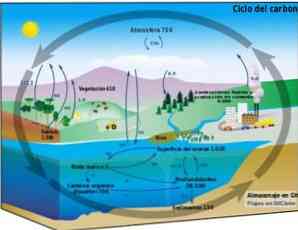
Углеродный цикл представляет собой круговой биогеохимический процесс, посредством которого углерод может обмениваться между биосферой, атмосферой, гидросферой и земной литосферой..
Знание этого циклического углеродного процесса на Земле позволяет продемонстрировать действия человека в этом цикле и его последствия для глобального изменения климата..
Углерод может циркулировать между океанами и другими водоемами, а также между литосферой, почвой и недрами, атмосферой и биосферой. В атмосфере и гидросфере углерод существует в газообразной форме в виде СО2 (углекислый газ).
фотосинтез
Углерод в атмосфере поглощается наземными и водными организмами экосистем (фотосинтезирующими организмами)..
Фотосинтез позволяет химической реакции между СО происходить2 и вода, опосредованная солнечной энергией и хлорофиллом из растений, для производства углеводов или сахаров. Этот процесс превращает простые молекулы с низким содержанием энергии CO2, H2O и кислород O2, в сложных молекулярных формах высокой энергии, которые являются сахарами.
Гетеротрофные организмы, которые не могут осуществлять фотосинтез и являются потребителями в экосистемах, получают углерод и энергию при питании самих производителей и других потребителей..
Дыхание и разложение
Геологические процессы
В результате геологических процессов и, как следствие, с течением времени, углерод анаэробного разложения может превращаться в ископаемое топливо, такое как нефть, природный газ и уголь. Кроме того, углерод также является частью других минералов и горных пород..
Вмешательство человеческой деятельности
Когда человек использует сжигание ископаемого топлива для получения энергии, углерод возвращается в атмосферу в виде огромных количеств СО2 которые не могут быть ассимилированы естественным биогеохимическим циклом углерода.
Это избыток СО2 вызванный деятельностью человека отрицательно влияет на баланс углеродного цикла и является основной причиной глобального потепления.
приложений
Использование углерода и его соединений чрезвычайно разнообразно. Наиболее выдающийся со следующим:
Нефть и природный газ
Масло перегоняется на нефтеперерабатывающих заводах для получения различных производных, таких как бензин, дизельное топливо, керосин, асфальт, смазочные материалы, растворители и другие, которые, в свою очередь, используются в нефтехимической промышленности, которая производит сырье для пластмасс, удобрений, фармацевтической и лакокрасочной промышленности. среди прочих.
графит
Графит используется в следующих действиях:
— Используется при изготовлении карандашей, смешанных с глинами.
— Это часть производства огнеупорных кирпичей и тиглей, термостойких.
— В различных механических устройствах, таких как шайбы, подшипники, поршни и прокладки.
— Это отличная твердая смазка.
— Из-за его электрической проводимости и его химической инертности, он используется в производстве электродов, углей электродвигателей..
— Используется в качестве модератора на атомных электростанциях.
бриллиант
Алмаз обладает особенно исключительными физическими свойствами, такими как более высокая степень твердости и теплопроводность, известные до сих пор..
Эти особенности позволяют промышленное применение в инструментах, используемых для резки и полировки инструментов для их высокой абразивности.
Его оптические свойства, такие как прозрачность и способность расщеплять белый свет и преломлять свет, дают ему множество применений в оптических приборах, например, в производстве линз и призм..
Характерная яркость, полученная из его оптических свойств, также очень ценится в ювелирной промышленности..
антрацит
Антрацит с трудом поджигается, медленно горит и требует много кислорода. Его сгорание производит небольшое пламя бледно-синего цвета и выделяет много тепла.
Несколько лет назад антрацит использовался в термоэлектростанциях и для отопления домов. Его использование имеет такие преимущества, как производство небольшого количества золы или пыли, небольшое количество дыма и медленный процесс сгорания..
Из-за высокой экономической стоимости и дефицита антрацит был заменен природным газом на термоэлектростанциях и электроэнергией в домах..
Каменный уголь
Уголь используется в качестве сырья для получения:
— Кокс, топливо из доменных печей сталелитейных заводов.
— Креозот, полученный путем смешивания смолистых дистиллятов из каменного угля и используемый в качестве защитного герметика для древесины, подверженной атмосферным воздействиям.
— Крезол (химически метилфенол) извлекают из угля и используют в качестве дезинфицирующего и антисептического средства,
— Другие производные, такие как газ, смола или смола, а также соединения, используемые в производстве парфюмерии, инсектицидов, пластмасс, красок, шин и дорожных покрытий, среди прочих.
бурый уголь
Лигнит представляет собой топливо среднего качества. Струя, разновидность лигнита, характеризуется очень компактным из-за длительного процесса карбонизации и высокого давления и используется в ювелирном деле и украшении..
торф
Торф используется в следующих видах деятельности;
— Для роста, поддержки и транспорта видов растений.