Что такое валентные и внешние электроны
Разница между валентностью и валентными электронами
Хотя два термина, валентность и валентные электроны, очень тесно связаны друг с другом, между ними есть тонкие различия. «Валентность» по своему литературному значению в химии связана с емк
Содержание:
Что такое валентность
Валентная диаграмма соединения будет показывать связь атомов в линиях, и это не обязательно будет представлять пару общих электронов. Это была концепция валентности, которая привела к современным теориям, связанным с химической связью, таким как; Теория валентных связей, структуры Льюиса, теория молекулярных орбиталей и теория отталкивания электронных пар валентных оболочек. Элементы основной группы обычно показывают одну валентность, тогда как переходные металлы славятся несколькими валентностями.
Теория валентной связи: две p-орбитали, образующие π-связь.
Что такое валентные электроны
Атомы, которые имеют на один или два валентных электрона больше, чем требуется для формирования конфигурации электронов благородного газа (инертного), очень реактивны по сравнению с атомами, которые имеют больше валентных электронов во внешней оболочке. Например, если элемент должен отдавать свои электроны, чтобы достичь конфигурации электронов благородного газа, легче удалить один или два электрона, чем удалить больше электронов против ядерного притяжения. То же самое происходит, когда электроны необходимы для принятия конфигурации благородного газа. В этом случае легче принять немного электронов, чем много при сильных электроотрицательных воздействиях. Кроме того, поскольку валентные электроны находятся во внешней оболочке элемента, они способны поглощать фотоны энергии и возбуждаться до более высокого энергетического уровня, а также могут выделять энергию и снижаться до более низкого энергетического уровня. В случае окисления электроны, которые поглощают достаточное количество энергии, могут быть удалены из элемента из-за большого количества кинетической энергии.
Разница между валентностью и валентными электронами
Определение
Валентные электроны обычно находятся в самой внешней оболочке элемента и принимают участие в образовании химических связей.
теория
Валентность объясняет образование связей между атомами.
Валентные электроны больше связаны с элементным персонажем.
заявка
Валентность является только концепцией и не включает в себя электронные переходы.
Валентные электроны Принимайте активное участие в формировании связей и создании атомных ионов посредством своей химии переходов.
Влияние на элементы переходного металла
Переходные металлы могут иметь несколько валентности в зависимости от элемента.
Номер валентные электроны В переходном металле это выражается в точке рассмотрения, так как каждое состояние элемента будет иметь определенное количество валентных электронов.
Связь валентности и внешнего слоя электронов у элемента
Валентность электронов на внешнем энергетическом уровне:
В химии нам наиболее важны электроны со внешнего (самого высокого у элемента) уровня. Эти электроны имеют наибольшую энергию и называются валентными (вспоминаем, что такое валентность). Количество этих электронов соответствует номеру группы (столбцу), если элементы из главной подгруппы (А) элементов.
Одинаковое количество электронов на внешнем уровне дает элементам сходные химические свойства. Получается, что электронный аналог атома оказывается и химическим аналогом.
Обратите внимание, что внешние оболочки гелия, неона, аргона заполнены. Если вы помните, то это инертные газы, которые не стремятся вступать с кем-то в реакцию. Да, потому что у них уже сформированы устойчивые уровни, им уже и так хорошо. Электроны укомплектованы в нужном количестве и ни атому, ни электронам ничего не хочется менять.
Редактировать этот урок и/или добавить задание Добавить свой урок и/или задание
Добавить интересную новость
Добавить анкету репетитора и получать бесплатно заявки на обучение от учеников
При правильном ответе Вы получите 1 балл
Как называют атомы с ненулевым зарядом?
Выберите всего один правильный ответ.
Добавление комментариев доступно только зарегистрированным пользователям
Lorem iorLorem ipsum dolor sit amet, sed do eiusmod tempbore et dolore maLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempborgna aliquoLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempbore et dLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempborlore m mollit anim id est laborum.
28.01.17 / 22:14, Иван Иванович Ответить +5
Lorem ipsum dolor sit amet, consectetu sed do eiusmod qui officia deserunt mollit anim id est laborum.
Lorem ipsum dolor sit amet, consectetur adipisicing sed do eiusmod tempboLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod temLorem ipsum dolor sit amet, consectetur adipisicing elit, sed do eiusmod tempborpborrum.
28.01.17 / 22:14, Иван Иванович Ответить +5
Что такое валентные и внешние электроны
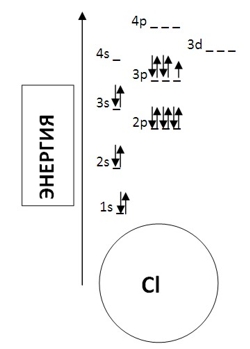
Если вы внимательно посмотрели приложение 4, то, наверное, заметили, что у атомов некоторых элементов последовательность заполнения электронами орбиталей нарушается. Иногда эти нарушения называют «исключениями «, но это не так – исключений из законов Природы не бывает!
Первым элементом с таким нарушением является хром. Рассмотрим подробнее его электронное строение (рис. 6.16 а). У атома хрома на 4s-подуровне не два, как этого следовало бы ожидать, а только один электрон. Зато на 3d-подуровне пять электронов, а ведь этот подуровень заполняется после 4s-подуровня (см. рис. 6.4). Чтобы понять, почему так происходит, посмотрим, что собой представляют электронные облака 3d-подуровня этого атома.
Каждое из пяти 3d-облаков в этом случае образовано одним электроном. Как вы уже знаете из § 4 этой главы, общее электронное облако таких пяти электронов имеет шарообразную форму, или, как говорят, сферически симметрично. По характеру распределения электронной плотности по разным направлениям оно похоже на 1s-ЭО. Энергия подуровня, электроны которого образуют такое облако, оказывается меньше, чем в случае менее симметричного облака. В данном случае энергия орбиталей 3d-подуровня равна энергии 4s-орбитали. При нарушении симметрии, например, при появлении шестого электрона, энергия орбиталей 3d-подуровня вновь становится больше, чем энергия 4s-орбитали. Поэтому у атома марганца опять появляется второй электрон на 4s-АО.
Сферической симметрией обладает общее облако любого подуровня, заполненного электронами как наполовину, так и полностью. Уменьшение энергии в этих случаях носит общий характер и не зависит от того, наполовину или полностью заполнен электронами какой-либо подуровень. А раз так, то следующее нарушение мы должны искать у атома, в электронную оболочку которого последним «приходит»девятый d-электрон. И действительно, у атома меди на 3d-подуровне 10 электронов, а на 4s-подуровне только один (рис. 6.16 б).
Уменьшение энергии орбиталей полностью или наполовину заполненного подуровня является причиной целого ряда важных химических явлений, с некоторыми из которых вы еще познакомитесь.
В химии свойства изолированных атомов, как правило, не изучаются, так как почти все атомы, входя в состав различных веществ, образуют химические связи. Химические связи образуются при взаимодействии электронных оболочек атомов. У всех атомов (кроме водорода) в образовании химических связей принимают участие не все электроны: у бора – три электрона из пяти, у углерода – четыре из шести, а, например, у бария – два из пятидесяти шести. Эти «активные»электроны называются валентными электронами.
Валентные электроны – электроны, которые могут принимать участие в образовании атомом химических связей.
Иногда валентные электроны путают с внешними электронами, а это не одно и то же.
Электронные облака внешних электронов имеют максимальный радиус (и максимальное значение главного квантового числа).
Именно внешние электроны принимают участие в образовании связи в первую очередь, хотя бы потому, что при сближении атомов электронные облака, образованные этими электронами, приходят в соприкосновение прежде всего. Но вместе с ними участие в образовании связи может принимать и часть электронов предвнешнего (предпоследнего) слоя, но только в том случае, если они обладают энергией, не сильно отличающейся от энергии внешних электронов. И те и другие электроны атома являются валентными. (У лантаноидов и актиноидов валентными являются даже некоторые «предвнешние» электроны)
Энергия валентных электронов намного больше, чем энергия других электронов атома, а друг от друга валентные электроны по энергии отличаются существенно меньше.
Внешние электроны – всегда валентные только в том случае, если атом вообще может образовывать химические связи. Так, оба электрона атома гелия – внешние, но назвать их валентными нельзя, так как атом гелия вообще никаких химических связей не образует.
Валентные электроны занимают валентные орбитали, которые в свою очередь образуют валентные подуровни.
| Валентные подуровни – электронные подуровни атома, на которых находятся, или могут находиться «свои «или «чужие «валентные электроны при образовании атомом химических связей. |
В качестве примера рассмотрим атом железа, электронная конфигурация которого показана на рис. 6.17. Из электронов атома железа максимальное главное квантовое число (n = 4) имеют только два 4s-электрона. Следовательно, именно они и являются внешними электронами этого атома. Внешние орбитали атома железа – все орбитали с n = 4, а внешние подуровни – все подуровни, образуемые этими орбиталями, то есть 4s-, 4p-, 4d— и 4f-ЭПУ.
Внешние электроны – всегда валентные, следовательно, 4s-электроны атома железа – валентные электроны. А раз так, то и 3d-электроны, имеющие чуть большую энергию, также будут валентными. На внешнем уровне атома железа кроме заполненной 4s-АО есть еще свободные 4p-, 4d— и 4f-АО. Все они внешние, но валентные среди них только 4р-АО, так как энергия остальных орбиталей значительно больше, и появление электронов на этих орбиталях для атома железа не выгодно.
Итак, у атома железа
внешний электронный уровень – четвертый,
внешние подуровни – 4s-, 4p-, 4d— и 4f-ЭПУ,
внешние орбитали – 4s-, 4p-, 4d— и 4f-АО,
внешние электроны – два 4s-электрона (4s 2 ),
внешний электронный слой – четвертый,
внешнее электронное облако – 4s-ЭО
валентные подуровни – 4s-, 4p-, и 3d-ЭПУ,
валентные орбитали – 4s-, 4p-, и 3d-АО,
валентные электроны – два 4s-электрона (4s 2 ) и шесть 3d-электронов (3d 6 ).
Валентные подуровни могут быть заполнены электронами частично или полностью, а могут и вообще оставаться свободными. С увеличением заряда ядра уменьшаются значения энергии всех подуровней, но из-за взаимодействия электронов между собой энергия разных подуровней уменьшается с разной «скоростью». Энергия полностью заполненных d— и f-подуровней уменьшается настолько сильно, что они перестают быть валентными.
В качестве примера рассмотрим атомы титана и мышьяка (рис. 6.18).
В случае атома титана 3d-ЭПУ заполнен электронами только частично, и его энергия больше, чем энергия 4s-ЭПУ, а 3d-электроны являются валентными. У атома мышьяка 3d-ЭПУ полностью заполнен электронами, и его энергия существенно меньше энергии 4s-ЭПУ, и, следовательно, 3d-электроны не являются валентными.
В приведенных примерах мы анализировали валентную электронную конфигурацию атомов титана и мышьяка.
Валентная электронная конфигурация атома – распределение валентных электронов атома по уровням, подуровням и орбиталям.
Валентная электронная конфигурация атома изображается в виде валентной электронной формулы, или в виде энергетической диаграммы валентных подуровней.

В основу систематизации химических элементов положен естественный ряд элементов и принцип подобия электронных оболочек их атомов.
С естественным рядом химических элементов вы уже знакомы. Теперь познакомимся с принципом подобия электронных оболочек.
Рассматривая валентные электронные формулы атомов в ЕРЭ, легко обнаружить, что у некоторых атомов они отличаются только значениями главного квантового числа. Например, 1s 1 у водорода, 2s 1 у лития, 3s 1 у натрия и т. д. Или 2s 2 2p 5 у фтора, 3s 2 3p 5 у хлора, 4s 2 4p 5 у брома и т. д. Это значит, что внешние области облаков валентных электронов таких атомов по форме очень похожи и отличаются только размерами (и, конечно, электронной плотностью). А раз так, то электронные облака таких атомов и соответствующие им валентные конфигурации можно назвать подобными. Для атомов разных элементов с подобными электронными конфигурациями мы можем записать общие валентные электронные формулы: ns 1 в первом случае и ns 2 np 5 во втором. Двигаясь по естественному ряду элементов, можно найти и другие группы атомов с подобными валентными конфигурациями.
Таким образом, в естественном ряду элементов регулярно встречаются атомы с подобными валентными электронными конфигурациями. Это и есть принцип подобия электронных оболочек.
Попробуем выявить вид этой регулярности. Для этого воспользуемся сделанным вами естественным рядом элементов.
Как видите, использовав ЕРЭ и применив принцип подобия электронных оболочек, нам удалось систематизировать химические элементы. Такая система химических элементов называется естественной, так как основана исключительно на законах Природы. Полученная нами таблица (рис. 6.21) представляет собой один из способов графического изображения естественной системы элементов и называется длиннопериодной таблицей химических элементов.

Познакомимся подробнее со структурой длиннопериодной таблицы химических элементов.
Строки этой таблицы, как вы уже знаете, называются «периодами «элементов. Периоды нумеруются арабскими цифрами от 1 до 7. В первом периоде всего два элемента. Второй и третий периоды, содержащие по восемь элементов, называются короткими периодами. Четвертый и пятый периоды, содержащие по 18 элементов, называются длинными периодами. Шестой и седьмой периоды, содержащие по 32 элемента, называются сверхдлинными периодами.
Столбцы этой таблицы называются группами элементов. Номера групп обозначаются римскими цифрами с латинскими буквами А или В.
Элементы некоторых групп имеют свои общие (групповые) названия: элементы IА группы (Li, Na, K, Rb, Cs, Fr) – щелочные элементы (или элементы щелочных металлов); элементы IIA группы (Ca, Sr, Ba и Ra) – щелочноземельные элементы (или элементы щелочноземельных металлов)(название «щелочные металлы» и щелочноземельные металлы» относятся к простым веществам, образуемым соответствующими элементами и не должны использоваться как названия групп элементов); элементы VIA группы (O, S, Se, Te, Po) – халькогены, элементы VIIA группы (F, Cl, Br, I, At) – галогены, элементы VIIIA группы (He, Ne, Ar, Kr, Xe, Rn) – элементы благородных газов.(Традиционное название «благородные газы» также относится к простым веществам)
Выносимые обычно в нижнюю часть таблицы элементы с порядковыми номерами 58 – 71 (Ce – Lu) называются лантаноиды («следующие за лантаном»), а элементы с порядковыми номерами 90 – 103 (Th – Lr) – актиноиды («следующие за актинием «). Существует вариант длиннопериодной таблицы, в котором лантаноиды и актиноиды не вырезаются из ЕРЭ, а остаются на своих местах в сверхдлинных периодах. Такую таблицу иногда называют сверхдлиннопериодной.
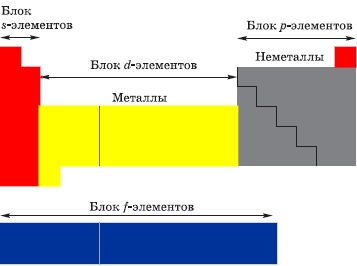
Длиннопериодная таблица делится на четыре блока (или секции).
s-Блок включает элементы IA и IIA-групп с общими валентными электронными формулами ns 1 и ns 2 (s-элементы).
р-Блок включает элементы с IIIA по VIIIA группу с общими валентными электронными формулами от ns 2 np 1 до ns 2 np 6 (p-элементы).
d-Блок включает элементы с IIIB по IIB группу с общими валентными электронными формулами от ns 2 (n–1)d 1 до ns 2 (n–1)d 10 (d-элементы).
f-Блок включает лантаноиды и актиноиды (f-элементы).
Для разных целей нам нужно знать либо полную, либо валентную конфигурацию атома. Каждая из этих электронных конфигураций может изображаться как формулой, так и энергетической диаграммой. То есть, полная электронная конфигурация атома выражается полной электронной формулой атома, или полной энергетической диаграммой атома. В свою очередь, валентная электронная конфигурация атома выражается валентной (или, как ее часто называют, «краткой «) электронной формулой атома, или диаграммой валентных подуровней атома (рис. 6.23).
Раньше мы составляли электронные формулы атомов, используя порядковые номера элементов. При этом мы определяли последовательность заполнения подуровней электронами по энергетической диаграмме: 1s, 2s, 2p, 3s, 3p, 4s, 3d, 4p, 5s, 4d, 5p, 6s, 4f, 5d, 6p, 7s и так далее. И только записав полную электронную формулу, мы могли записать и валентную формулу.
Валентную электронную формулу атома, которая чаще всего и используется, удобнее записывать, исходя из положения элемента в системе химических элементов, по координатам период – группа.
Рассмотрим подробно, как это делается для элементов s-, p— и d-блоков.
Для элементов s-блока валентная электронная формула атома состоит из трех символов. В общем виде ее можно записать так:
На первом месте (на месте большой клеточки) ставится номер периода (равен главному квантовому числу этих s-электронов), а на третьем (в верхнем индексе) – номер группы (равен числу валентных электронов). Взяв в качестве примера атом магния (3-й период, IIA группа), получим:
Для элементов p-блока валентная электронная формула атома состоит из шести символов:
Здесь на месте больших клеточек также ставится номер периода (равен главному квантовому числу этих s— и p-электронов), а номер группы (равен числу валентных электронов) оказывается равным сумме верхних индексов. Для атома кислорода (2-й период, VIA группа) получим:
Валентную электронную формулу большинства элементов d-блока можно записать так:
Примеры электронных формул разных типов приведены в таблице 14.
Электронная структура атомов
Для описания состояния электрона в атоме кроме квантовых чисел используют:
Диаграмма уровней энергии
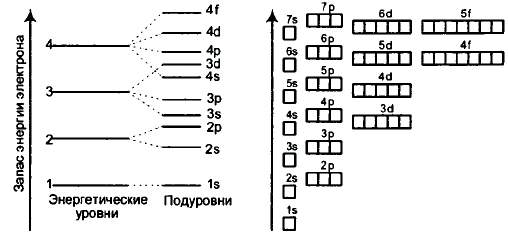
Рис. Энергетические уровни и подуровни атома.
На рисунке показана диаграмма уровней атома, при помощи которой можно описать электроны любого атома.
Энергетические уровни атома (электронные облака, образующие электронные атомные слои) обозначаются цифрами 1, 2, 3, 4.
Энергетические подуровни атома (энергетические уровни, характеризующие энергию связи электрона с атомным ядром) обозначаются буквами s, p, d, f.
Энергетические подуровни могут отображаться в виде квантовых ячеек (рисунок справа): свободных (пустая ячейка); частично заполненных (одна вертикальная стрелочка, направленная вверх или вниз, обозначающая неспаренный электрон); полностью заполненных (две вертикальные разнонаправленные стрелочки, обозначающие спаренные электроны).
Электронная формула атома
Все на диаграммах уровней энергии довольно понятно и наглядно, но громоздко. Используя электронную конфигурацию, диаграмму можно выразить одной короткой строкой.
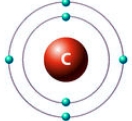
Ниже на рисунках представлены примеры электронных формул атомов углерода и натрия (модель электронной оболочки) и их графическое изображение:
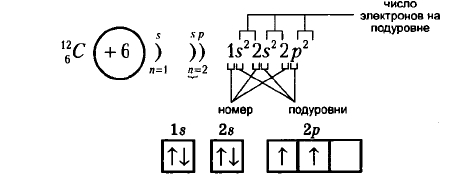
Рис. Электронная формула углерода.
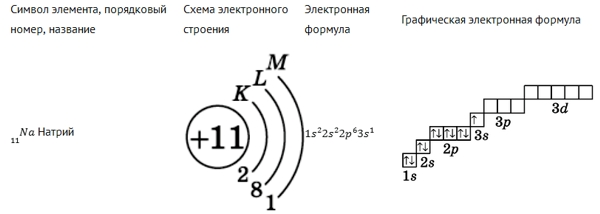
Рис. Электронная формула натрия.
В электронной конфигурации указывается название орбитали энергетического уровня в верхнем индексе которой находится количество электронов, расположенных на этой орбитали.
| Сумма чисел, являющихся верхними индексами, равна порядковому номеру атома, т. е., количеству электронов в атоме. |
Электронная оболочка атома формируется согласно следующих принципов:
Как уже было сказано выше, схематически электрон отображается в виде стрелочки. Если на орбитали находятся два электрона, то они отображаются в виде двух разнонаправленных стрелок (электроны с разными спинами).
Таким образом, диаграмма уровней энергии для хлора будет выглядеть следующим образом:
Внимательный читатель, скорее всего, обратил внимание, что порядок заполнения электронных энергетических подуровней в атомах несколько нарушен, например, сначала заполняется подуровень 4s, а только затем 3d. Данное нарушение обясняется правилом Клечковского, которое гласит, что электроны заполняют атомные уровни (подуровни) в порядке возрастания суммы (n + l), в случае, если суммы главного и орбитального квантовых чисел равны, заполнение происходит в порядке увеличения n (см. Квантово-механическая модель строения атома).
Подуровни 3d, 4p, 5s имеют равные суммы n+l=5, поэтому заполнение идет в порядке возрастания главного квантового числа: 3d→4p→5s.
Правило Клечковского имеет ряд исключений, когда близкие друг к другу подуровни незначительно отличаются энергией, в таком случае электрон стремится занять подуровень с меньшей энергией, пусть он даже будет «вышележащим», при этом «нижележащий» уровень остается незаполненным. Например 5d 1 заполняется раньше, чем 4f.
Классификация химических элементов по строению их атомов:
Валентные электроны
Ранее мы говорили, что атом является нейтрально заряженной частицей, поскольку количество электронов и протонов в нем одинаково. Однако, электроны, находящиеся на самых дальних орбиталях, слабо притягиваются положительными протонами, находящимися в ядре атома. Поэтому, атомы элементов способны отдавать и присоединять электроны.
| Электроны, расположенные на внешнем незавершенном энергетическом уровне, называются валентными электронами. Подробнее см. Валентность. |
НАДО ЗНАТЬ! К валентным относятся внешние электроны, плюс те предвнешние электроны, энергия которых больше, чем у внешних.
Если вам понравился сайт, будем благодарны за его популяризацию 🙂 Расскажите о нас друзьям на форуме, в блоге, сообществе. Это наша кнопочка:
Код кнопки: 
Политика конфиденциальности Об авторе