Что такое весовая часть
Способы выражения количественного
Состава растворов
Количественный состав раствора определяется концентрацией, т.е. относительным содержанием каждого из компонентов, составляющих раствор.
Известно много способов выражения концентрации, основанных на постоянстве количества раствора, растворенного вещества, растворителя или объема раствора.
При постоянном количестве раствора концентрации выражаются в процентах и в долях.
100 ∙ 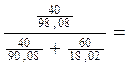
Для сплава, содержащего 66,7 % Na и 33,3 % К состав компонентов в весе % вычисляется следующим образом:

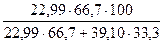
100 – 54,08 = 45,92 веса % К
здесь 22,99 и 39,10 – атомные веса соответственно Na и К.
Весовая доля, мольная доля, атомная доля составляет соответственно одну сотую от весовых, молекулярных и атомных процентов.
При постоянном количестве растворителя концентрация выражается моляльностью и числом граммов растворенного вещества на 1 кг растворителя.
Моляльность.Концентрация определяется числом молей (m) растворенного вещества в 1 кг растворителя.
При постоянном объеме раствора концентрация выражается через молярность, нормальность и титральность.
Титральность. Концентрация определяется количеством грамма вещества, содержащегося в 1 см 3 раствора (1 мл.)
Дата добавления: 2016-12-09 ; просмотров: 3909 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
Весовой процент
Содержание
Массовая доля
В бинарных растворах часто существует однозначная (функциональная) зависимость между плотностью раствора и его концентрацией (при данной температуре). Это даёт возможность определять на практике концентрации важных растворов с помощью денсиметра (спиртометра, сахариметра, лактометра). Некоторые ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора (спирта, жира в молоке, сахара). Следует учитывать, что для некоторых веществ кривая плотности раствора имеет максимум, в этом случае проводят два измерения: непосредственное, и при небольшом разбавлении раствора.
Часто для выражения концентрации (например, серной кислоты в электролите аккумуляторных батарей) пользуются просто их плотностью. Распространены ареометры (денсиметры, плотномеры), предназначенные для определения концентрации растворов веществ.
| ω, % | 5 | 10 | 15 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 95 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ρ H2SO4, г/мл | 1,032 | 1,066 | 1,102 | 1,139 | 1,219 | 1,303 | 1,395 | 1,498 | 1,611 | 1,727 | 1,814 | 1,834 |
Объёмная доля
Объёмная доля компонента — отношение объёма компонента к сумме объёмов компонентов до смешивания. Объёмная доля измеряется в долях единицы или в процентах.
При смешивании жидкостей их суммарный объём может уменьшаться, поэтому не следует заменять сумму объёмов компонентов на объём смеси.
Как было указано выше, существуют ареометры, предназначенные для определения концентрации растворов определённых веществ. Такие ареометры проградуированы не в значениях плотности, а непосредственно концентрации раствора. Для распространённых растворов этилового спирта, концентрация которых обычно выражается в объёмных процентах, такие ареометры получили название спиртомеров или андрометров.
Молярность ( молярная объёмная концентрация )
Молярная концентрация (молярность, мольность [5] ) — количество вещества (число молей) компонента в единице объёма смеси. Молярная концентрация в системе СИ измеряется в моль/м³, однако на практике её гораздо чаще выражают в моль/л или ммоль/л. Также используют выражение «в молярности». Возможно другое обозначение молярной концентрации, которое принято обозначать М. Так, раствор с концентрацией 0,5 моль/л называют 0,5-молярным, записывают «0,5 M».
Примечание: После числа пишут «моль», подобно тому, как после числа пишут «см», «кг» и т. п., не склоняя по падежам.
Нормальная концентрация — количество эквивалентов данного вещества в 1 литре смеси. Нормальную концентрацию выражают в моль-экв/л или г-экв/л (имеется в виду моль эквивалентов). Для записи концентрации таких растворов используют сокращения «н» или «N». Например, раствор, содержащий 0,1 моль-экв/л, называют децинормальным и записывают как 0,1 н.
c ( f e q B ) = c ( ( 1 / z ) B ) = z ⋅ c B = z ⋅ n B V = 1 f e q ⋅ n B V
\mathrm <\big )>=z\cdot c_ <\mathrm >=z\cdot <\frac 
Нормальная концентрация может отличаться в зависимости от реакции, в которой участвует вещество. Например, одномолярный раствор H2SO4 будет однонормальным, если он предназначается для реакции со щёлочью с образованием гидросульфата калия KHSO4, и двухнормальным в реакции с образованием K2SO4.
Мольная ( молярная ) доля
Мольная доля может использоваться, например, для количественного описания уровня загрязнений в воздухе, при этом её часто выражают в частях на миллион (ppm — от англ. parts per million ). Однако, как и в случае с другими безразмерными величинами, во избежание путаницы, следует указывать величину, к которой относится указанное значение.
Моляльная концентрация (моляльность, [5] молярная весовая концентрация) — количество растворённого вещества (число моль) в 1000 г растворителя. Измеряется в молях на кг, также распространено выражение в «моляльности». Так, раствор с концентрацией 0,5 моль/кг называют 0,5-мольным.
Следует обратить особое внимание, что, несмотря на сходство названий, моля р ная концентрация и моля л ьность — величины различные. Прежде всего, в отличие от молярной концентрации, при выражении концентрации в моляльности расчёт ведут на массу растворителя, а не на объём раствора. Моляльность, в отличие от молярной концентрации, не зависит от температуры.
Массовая концентрация (Титр)
Концентрация частиц
Весообъёмные (массо-объёмные) проценты
Другие способы выражения концентрации
Существуют и другие, распространённые в определённых областях знаний или технологиях, методы выражения концентрации. Например, при приготовлении растворов кислот в лабораторной практике часто указывают, сколько объёмных частей воды приходится на одну объёмную часть концентрированной кислоты (например, 1:3). Иногда используют также отношение масс (отношение массы растворённого вещества к массе растворителя) и отношение объёмов (аналогично, отношение объёма растворяемого вещества к объёму растворителя).
Применимость способов выражения концентрации растворов, их свойства
В связи с тем, что моляльность, массовая доля, мольная доля не включают в себя значения объёмов, концентрация таких растворов остаётся неизменной при изменении температуры. Молярность, объёмная доля, титр, нормальность изменяются при изменении температуры, так как при этом изменяется плотность растворов. Именно моляльность используется в формулах повышения температуры кипения и понижения температуры замерзания растворов.
Разные виды выражения концентрации растворов применяются в разных сферах деятельности, в соответствии с удобством применения и приготовления растворов заданных концентраций. Так, титр раствора удобен в аналитической химии для волюмометрии (титриметрического анализа) и т. п.
Формулы перехода от одних выражений концентраций к другим
В зависимости от выбранной формулы погрешность конвертации колеблется от нуля до некоторого знака после запятой.
От молярности к нормальности
\mathrm )>= 
От молярности к титру
Если молярная концентрация выражена в моль/л, а молярная масса — в г/моль, то для выражения ответа в г/мл его следует разделить на 1000 мл/л.
От массовой доли к молярности
Если плотность раствора выражена в г/мл, а молярная масса в г/моль, то для выражения ответа в моль/л выражение следует домножить на 1000 мл/л. Если массовая доля выражена в процентах, то выражение следует также разделить на 100 %.
От массовой доли к титру
От моляльности к молярности
От моляльности к мольной доле
Если моляльность выражена в моль/кг, а молярная масса растворителя в г/моль, то единицу в формуле следует представить как 1000 г/кг, чтобы слагаемые в знаменателе имели одинаковые единицы измерения.
Технология приготовления растворов
В процессе изготовления жидких лекарственных форм используют различные дисперсионные среды (растворители, экстрагенты).
Растворители — это индивидуальные химические соединения или их комбинации, способные растворять различные вещества, т.е. образовывать с ними однородные системы, состоящие из одного или нескольких компонентов. Они представляют собой составную часть раствора, как правило, большую. Растворитель способствуют лучшему проникновению в кровь, различные ткани растворенного вещества. При этом сам растворитель не влияет на организм человека и соответственно не является лекарственной субстанцией. В качестве растворителя чаще всего используют воду дистиллированную (т.е. воду, не содержащую минеральных солей и каких-либо других примесей), реже — спирт этиловый 70, 90, 95%-ный, глицерин и жидкие масла (вазелиновое, оливковое, персиковое). Следовательно, выделяют водные, спиртовые, глицериновые и масляные растворы.
Экстрагенты составляют меньшую часть в растворе. Они представляют собой непосредственно активное вещество, оказывающее влияние на течение болезни, а также такие растворители, которые используются для экстракции растительного или другого биологического сырья. К дисперсионным средам предъявляются такие требования, как достаточная растворяющая способность при изготовлении растворов, химическая индифферентность и биологическая безвредность, отсутствие неприятного вкуса и запаха, благоприятных для размножения микроорганизмов условий, а также экономичность в производстве. Экстрагенты, кроме того, должны обладать избирательной растворимостью, высокими диффузионными способностями для обеспечения проникновения их через поры биологического материала, десорбирующими свойствами.
В технологическом отношении важнейшим вопросом, связанным с растворением жидкостей, является концентрация растворов, другими словами — сколько вещества необходимо растворить или смешать в каком количестве или с каким количеством. Необходимая концентрация растворов определяется указаниями в рецепте или в стандартный прописи, регламентируемой Государственной Фармакопеей. Концентрация раствора — это количество растворенного вещества, содержащегося в определенном весовом количестве или определенном объеме раствора.
В фармацевтической практике концентрация растворов выражается различными способами:
При первом способе концентрация обозначается например: 1 + 9, т.е. в 9 частях растворителя растворяется (смешивается) 1 часть растворяемого вещества.
Второй способ предполагает использование соединительных знаков: “:”, “=”, “—”. Например, 1 : 10, или 1 = 10, или 1—10. Во всех трех случаях 1 весовую часть исходного вещества смешивают с 9 частями растворителя.
При третьем способе выражения концентрации раствора важно различать весовые, объемные и весообъемные проценты. Они неравнозначны. Весовой процент обозначает 1 весовую часть растворенной жидкости (вещества) в 100 весовых частях раствора. Объемный процент — 1 объемная часть (например, 1 мл) растворяемой жидкости в 100 объемных частях (мл) раствора.
Весообъемный процент соответствует 1 весовой части (грамму) растворенной жидкости в 100 объемных частях (мл) раствора.
Весовые и объемные проценты связаны друг с другом следующим соотношением:
A = B х (I1 / I2), где
А — концентрация в весовых процентах;
B — концентрация в объемных процентах;
I1 — плотность исходной жидкости;
I2 — плотность полученного раствора.
Весовые и весообъемные проценты связаны отношением:
A = C х (1 / I3), где
А — концентрация в весовых процентах;
С — концентрация в весообъемных процентах;
I3 — плотность полученной жидкости.
Объемные и весообъемные проценты также связаны между собой:
В = С х (1 / I1), где
В — концентрация раствора в объемных процентах;
С — концентрация в весообъемных процентах;
I1 — плотность исходной жидкости.
Если концентрация выписанного в рецепте лекарственного вещества указана в процентах, следует подразумевать весообъемные проценты. А вот под процентным содержанием спирта (70, 96%-ный) следует подразумевать объемный процент. Растворы с большой концентрацией растворенного вещества называются концентрированными, с малой концентрацией — разбавленными. Необходимо различать понятия “концентрированный” и “насыщенный” раствор.
Насыщенный раствор — это такой раствор, в котором взятое вещество больше не растворяется даже при длительном взбалтывании (перемешивании). Концентрированный раствор не обязательно должен быть насыщенным. Например, состав, содержащий 50 г кальция хлорида в 100 мл раствора, является достаточно концентрированным, но при комнатной температуре он далеко не насыщенный. Для получения насыщенного раствора при этом следует дополнительно взять около 80 г кальция хлорида. В некоторых случаях насыщенный раствор может быть разбавленным. Как правило, это наблюдается, если данное вещество плохо растворяется в растворителе. Так, насыщенный раствор кальция сульфата, который при 20 °С содержит только 0,21 г кальция сульфата в 100 мл жидкости, является достаточно разбавленным. Необходимая концентрация растворов определяется соответствующими указаниями в рецепте или, если раствор стандартизован, в соответствующей прописи. Количественно концентрацию растворов выражают одним из трех способов: чаще всего — в процентах, реже (при больших разведениях) — в отношениях (например, 1 : 1000, 1 : 5000 и т.п.) и совсем редко — в массообъемных соотношениях (например, 0,1 — 200 мл, 0,5 — 180 мл и т.п.).
В процентах.
Rp.: Solutionis Natrii bromidi 2 % — 200 ml
D. S. По 1 ст. л. 3 раза в день.
Раздельным способом, т.е. перечислением растворяемого вещества и растворителя.
Aquae destillatae 200 ml
M. D. S. По 1 ст. л. 3 раза в день.
С указанием доведения раствора до заданного объема.
Aquae destillatae ad 200 ml
M. D. S. По 1 ст. л. 3 раза в день.
Отношением количества вещества в граммах к количеству раствора в мл.
Rp: Solution is natrii bromidi ex 4,0 — 200 ml
D. S. По 1 ст. л. 3 раза в день.
Отношением количества вещества к количеству раствора в частях (в данном случае используются знаки деления “:”, например, 1 : 10, т.е. 1 весовую часть исходного вещества необходимо растворить до получения 10 мл раствора, т.е. получается 10%-ный раствор).
Rp.: Solutionis Natrii bromidi 1 : 50—200 ml
D. S. По 1 ст. л. 3 раза в день.
Этот способ прописывания обычно используют для растворов ядовитых веществ.
Пример
Rp.: Solutionis Hydrargyri dichloridi 1 : 500—5000 ml.
Иногда используется способ выражения концентрации раствора отношением растворенного вещества к растворителю (например, 1 + 2; 1 + 9). При этом 1 весовая часть растворяемого вещества растворяется в 2 частях по массе или соответственно в 9 частях по массе растворителя, т.е. в первом случае получается 33,3%-ный раствор, во втором — 10%-ный раствор. Наиболее часто для выписывания растворов используют первый способ, т.е. обозначение концентрации раствора в процентах. При этом важно различать процент по массе, процент по объему и процент по массообъему. Процент по массе обозначает 1 часть (по массе) растворенного вещества в 100 частях (по массе) раствора, процент по объему — соответственно 1 часть по объему (например, 1 мл) вещества в 100 частях по объему (мл) раствора. Процент по массообъему соответствует 1 части по массе (гр) растворенного вещества в 100 частях по объему (мл) раствора.
Связь процентов по массе и по объему можно выразить соотношением:
А = B х r1 / r2, где
А — концентрация в процентах по массе;
B — концентрация в процентах по объему;
r1 — плотность исходной жидкости;
r2 — плотность получаемого раствора.
Проценты по массе и проценты по массообъему связаны другим отношением:
А = С х 1 / r3, где
А — концентрация раствора в процентах по массе;
С — концентрация раствора в процентах по массообъему;
r3 — плотность раствора.
Переход от процентов по объему к процентам по массообъему можно осуществить с помощью следующей формулы:
B = С х 1 / r1, где
B — концентрация раствора в процентах по объему;
С — концентрация раствора в процентах по массообъему;
r1 — плотность исходной жидкости.
Если концентрация прописанного в рецепте раствора указана в процентах, то следует подразумевать проценты по массообъему. При определении спирта под его процентным содержанием понимают процент по объему. Официальные растворы, т.е. произведенные в промышленных условиях, могут продаваться с этикеткой без указания на ней концентрации раствора, так как всем (работающим в медицине) людям известно, что, к примеру, в изотоническом растворе натрия хлорида содержится 1,8 г натрия хлорида на 200 г воды (т.е. раствор 0,9% концентрации).
Растворы, применяемые в фармацевтической практике, готовят различными способами — по массе, объему и массообъемным способом. Наиболее распространен последний способ, при котором растворяемое вещество берут по массе, а растворитель добавляют до получения требуемого объема раствора. Объемный способ используется для изготовления растворов этанола различной крепости.
По массе обычно готовят растворы на вязких растворителях, таких как глицерин, масла растительные (при этом растворяемое вещество и растворитель берут в количествах по массе). Процесс изготовления растворов включает несколько стадий: проверку доз веществ списков А и Б, расчет количества растворителя, растворение, фильтрование, упаковку, укупорку, контроль качества готового препарата.
часть (весовая)
часть (весовая)
—
[А.С.Гольдберг. Англо-русский энергетический словарь. 2006 г.]
Тематики
Смотреть что такое «часть (весовая)» в других словарях:
весовая часть — masės dalis statusas T sritis chemija apibrėžtis Mišinio ar junginio komponento masės ir visos mišinio ar junginio masės santykis. atitikmenys: angl. mass fraction; mass part; weight part rus. весовая доля; весовая часть; массовая доля; массовая… … Chemijos terminų aiškinamasis žodynas
весовая часть — svorio dalis statusas T sritis Standartizacija ir metrologija apibrėžtis Mišinio sando svorio ir viso mišinio svorio dalmuo. atitikmenys: angl. weight part vok. Gewichtsteil, n rus. весовая доля, f; весовая часть, f pranc. fraction gravimétrique … Penkiakalbis aiškinamasis metrologijos terminų žodynas
весовая доля — masės dalis statusas T sritis chemija apibrėžtis Mišinio ar junginio komponento masės ir visos mišinio ar junginio masės santykis. atitikmenys: angl. mass fraction; mass part; weight part rus. весовая доля; весовая часть; массовая доля; массовая… … Chemijos terminų aiškinamasis žodynas
весовая часть — svorio dalis statusas T sritis fizika atitikmenys: angl. part by weight; weight part vok. Gewichtsteil, m rus. весовая доля, f; весовая часть, f pranc. partie en poids, f … Fizikos terminų žodynas
весовая доля — svorio dalis statusas T sritis Standartizacija ir metrologija apibrėžtis Mišinio sando svorio ir viso mišinio svorio dalmuo. atitikmenys: angl. weight part vok. Gewichtsteil, n rus. весовая доля, f; весовая часть, f pranc. fraction gravimétrique … Penkiakalbis aiškinamasis metrologijos terminų žodynas
весовая доля — svorio dalis statusas T sritis fizika atitikmenys: angl. part by weight; weight part vok. Gewichtsteil, m rus. весовая доля, f; весовая часть, f pranc. partie en poids, f … Fizikos terminų žodynas
весовая доля — masės dalis statusas T sritis Standartizacija ir metrologija apibrėžtis Mišinio sando masės ir visos mišinio masės dalmuo. atitikmenys: angl. mass fraction; mass part vok. Masseanteil, m rus. весовая доля, f; массовая доля, f; массовая часть, f… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
весовая доля — masės dalis statusas T sritis fizika atitikmenys: angl. mass fraction; mass part vok. Masseanteil, m rus. весовая доля, f; массовая доля, f; массовая часть, f pranc. fraction massique, f … Fizikos terminų žodynas
массовая часть — masės dalis statusas T sritis chemija apibrėžtis Mišinio ar junginio komponento masės ir visos mišinio ar junginio masės santykis. atitikmenys: angl. mass fraction; mass part; weight part rus. весовая доля; весовая часть; массовая доля; массовая… … Chemijos terminų aiškinamasis žodynas
Окно (весовая функция) — У этого термина существуют и другие значения, см. Окно (значения). Окно весовая функция, которая используется для управления эффектами, обусловленными наличием боковых лепестков в спектральных оценках (растеканием спектра). Имеющуюся… … Википедия
весовая часть
Смотреть что такое «весовая часть» в других словарях:
весовая часть — masės dalis statusas T sritis chemija apibrėžtis Mišinio ar junginio komponento masės ir visos mišinio ar junginio masės santykis. atitikmenys: angl. mass fraction; mass part; weight part rus. весовая доля; весовая часть; массовая доля; массовая… … Chemijos terminų aiškinamasis žodynas
весовая часть — svorio dalis statusas T sritis Standartizacija ir metrologija apibrėžtis Mišinio sando svorio ir viso mišinio svorio dalmuo. atitikmenys: angl. weight part vok. Gewichtsteil, n rus. весовая доля, f; весовая часть, f pranc. fraction gravimétrique … Penkiakalbis aiškinamasis metrologijos terminų žodynas
весовая часть — svorio dalis statusas T sritis fizika atitikmenys: angl. part by weight; weight part vok. Gewichtsteil, m rus. весовая доля, f; весовая часть, f pranc. partie en poids, f … Fizikos terminų žodynas
весовая доля — masės dalis statusas T sritis chemija apibrėžtis Mišinio ar junginio komponento masės ir visos mišinio ar junginio masės santykis. atitikmenys: angl. mass fraction; mass part; weight part rus. весовая доля; весовая часть; массовая доля; массовая… … Chemijos terminų aiškinamasis žodynas
весовая доля — svorio dalis statusas T sritis Standartizacija ir metrologija apibrėžtis Mišinio sando svorio ir viso mišinio svorio dalmuo. atitikmenys: angl. weight part vok. Gewichtsteil, n rus. весовая доля, f; весовая часть, f pranc. fraction gravimétrique … Penkiakalbis aiškinamasis metrologijos terminų žodynas
весовая доля — svorio dalis statusas T sritis fizika atitikmenys: angl. part by weight; weight part vok. Gewichtsteil, m rus. весовая доля, f; весовая часть, f pranc. partie en poids, f … Fizikos terminų žodynas
часть (весовая) — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN partpt … Справочник технического переводчика
весовая доля — masės dalis statusas T sritis Standartizacija ir metrologija apibrėžtis Mišinio sando masės ir visos mišinio masės dalmuo. atitikmenys: angl. mass fraction; mass part vok. Masseanteil, m rus. весовая доля, f; массовая доля, f; массовая часть, f… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
весовая доля — masės dalis statusas T sritis fizika atitikmenys: angl. mass fraction; mass part vok. Masseanteil, m rus. весовая доля, f; массовая доля, f; массовая часть, f pranc. fraction massique, f … Fizikos terminų žodynas
массовая часть — masės dalis statusas T sritis chemija apibrėžtis Mišinio ar junginio komponento masės ir visos mišinio ar junginio masės santykis. atitikmenys: angl. mass fraction; mass part; weight part rus. весовая доля; весовая часть; массовая доля; массовая… … Chemijos terminų aiškinamasis žodynas
Окно (весовая функция) — У этого термина существуют и другие значения, см. Окно (значения). Окно весовая функция, которая используется для управления эффектами, обусловленными наличием боковых лепестков в спектральных оценках (растеканием спектра). Имеющуюся… … Википедия
