Что такое вспомогательная вентиляция легких
Что такое вспомогательная вентиляция легких
Функциональная характеристика ВПД.
ВПД можно разделить на три фазы (17) для того, чтобы легче представить, как работает респиратор в этом режиме:
Улавливание окончания инспираторной активности и переключение на выдох. Когда скорость потока уменьшится до 12-25% от своего максимального значения, поддержка закончится, и аппарат переключится на выдох (t3-t4). Считается, что при таком соотношении инспираторная активность прекращается (39). Кроме того, в каждом аппарате необходимы меры безопасности, гарантирующие переключение на выдох, если заданное давление превышено, или вдох слишком затянут. Последнее может произойти, когда нарушена герметичность контура. Из-за возникшей утечки газа респиратор не сможет обеспечить нужное давление, вдох затянется, и произойдет перерастяжение легких (6,16). В связи с этим в аппарате должен быть предусмотрен предел продолжительности вдоха, обычно равный 5 секундам.
Таким образом, ВПД является ауторегулируемым, потокоциклическим методом вспомогательной вентиляции легких по давлению. 
ВПД и система дыхания. 






Выбор оптимального уровня ВПД.
Вентиляция поддержкой давлением преследует следующие цели:
ПРИЛОЖЕНИЕ (из 22, с дополнениями).
Некоторые практические рекомендации для проведения ВПД.
Что такое вспомогательная вентиляция легких
Принципиальным физиологическим эффектом искусственной вентиляции легких, в отличие от акта самостоятельного дыхания, является положительное давление в дыхательных путях во время дыхательного цикла. Положительное давление имеет ряд преимуществ при газообмене, включая рекрутинг периферических альвеол, увеличение функциональной остаточной емкости, улучшение вентиляционно-перфузионного соотношения и снижение внутрилегочного шунтирования крови. Отрицательные же эффекты заключаются в возможности появления баротравмы и респираторного повреждения легких при использовании больших дыхательных объемов или давления на вдохе, а также потенциальном снижении сердечного выброса при увеличении среднего внутригрудного давления. В общем, некоторая степень позитивных и негативных эффектов искусственной вентиляции легких свойственна всем используемым режимам. Эта величина неодинакова у различных режимов, что обусловлено уровнем положительного давления на вдохе.
Принудительные (Control-mode, CV) и вспомогательные (assist/control-mode ventilation, ACV) режимы представляют собой циклические, объемные режимы, доставляющие фиксированный дыхательный объем с установленным минимальным числом вдохов и скоростью дыхательного потока. Дыхательные попытки пациента при первом варианте не являются триггерами для начала аппаратного вдоха. При CV, вентилятор не добавляет вдохов, несмотря на попытки пациента. Учитывая безопасность и комфорт вспомогательных режимов вентиляции, CV не должен применяться рутинно.
Режим ACV позволяет по запросу больного в виде дыхательных попыток, инициировать дополнительный аппаратный вдох. В зависимости от состояния пациента, а также чувствительности и типа (потоковый или по давлению) триггера вдоха, режим позволяет пациенту создавать свой ритм дыхания и дыхательный объем (с установлением минимального количества вдохов в качестве системы защиты). Использование ACV типично у больных с паралитическими состояниями (при использовании мышечных релаксантов или при паралитических нейромышечных заболеваниях), требующих большого количества седативных средств, а также при трудностях с синхронизацией или при невозможности инициировать вдох в PSV или IMV режимах. Путем повышения аппаратной ЧДД, приводящего к снижению количества спонтанных вдохов, с помощью ACV режима можно добиться уменьшения работы дыхания пациента. Чрезмерное увеличение количества инициированных вдохов значительно увеличивает цену дыхания. С другой стороны триггер вдоха должен быть достаточно чувствительным, чтобы не приводить к возникновению избыточных усилий при дыхательных попытках, что быстро истощает больного.
Режим вентиляции с контролем по объему (PRVC). При этом режиме возможно ограничение чрезмерно высокого пикового давления, приводящего к перерастяжению альвеол. При PCVR создается регулируемый, снижающийся поток на вдохе, который ограничивает пиковое давление, но доставляет установленный объем, в отличие от режима контроля вентиляции по давлению. Стоит отметить, что теоретические преимущества PCVR, не подтвердились рандомизированными исследованиями благоприятного эффекта при данном режиме, за исключением снижения пикового давления.
Перемежающая принудительная вентиляция (IMV). Режим IMV был разработан в 1970-х с целью сохранения спонтанного дыхания пациента в дополнение к аппаратному, с заранее заданной минимальной частотой и объемом вдохов. Вначале данный режим использовался для отлучения пациента от вентилятора, обеспечивая плавный переход по сравнению с классическим методом использования Т-переходников. Синхронизированный вариант режима (SIMV) создавался для предотвращения наложения аппаратных вдохов на пик или окончание спонтанного вдоха пациента.
SIMV продолжает широко использоваться как режим отлучения, и имеет преимущество, выражающееся в ступенчатом снижении частоты аппаратных вдохов и увеличении спонтанных. У пациентов со сниженным комплаенсом, IMV может не обеспечивать достаточный объем спонтанного вдоха из-за сильно ограниченных дыхательных возможностей. В данных условиях поддержка по давлению может быть использована в помощь к каждому вдоху IMV, значительно увеличивая объем спонтанного вдоха и снижая работу дыхания.
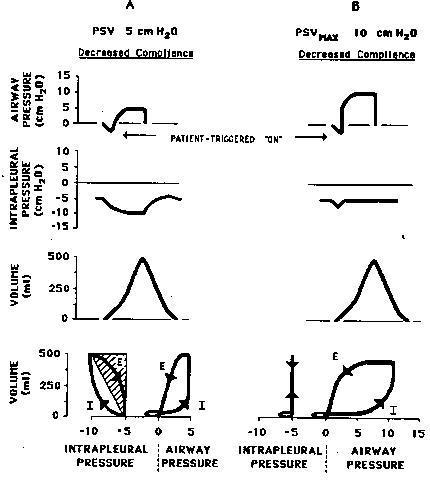
Вентиляция с поддержкой по давлению (PCV). Режим PSV был разработан в 1980-х как вспомогательный режим вентиляции. Каждый вдох в режиме PSV инициируется дышащим пациентом и поддерживается давлением, с максимальным потоком во время фазы вдоха. Окончание поддержки вдоха происходит в момент ослабления собственного потока вдоха пациента ниже установленного уровня, инициируя спонтанный выдох. В этом заключается отличие принципа переключения фаз вдох-выдох, регулируемого по потоку, от регуляции этого переключения по объему (рис. 60-3). Режим поддержки по давлению не подразумевает заранее установленной частоты аппаратных дыханий, так как каждый вдох должен быть инициирован пациентом. Это делает применение PSV невозможным у пациентов с нейромышечными заболеваниями, при применении мышечных релаксантов и глубокой седации.
PSV присущи некоторые преимущества, включая улучшение синхронизации пациента с аппаратом ИВЛ, так как ритм дыхания задает сам больной. PSV может обеспечивать минимальную поддержку дыхания перед моментом эксту-бации или значительную (20-40 мм водн. ст.), что означает полное протезирование дыхательной функции пациента и минимальную работу дыхания. Как режим отлучения, поддержка по давлению может использоваться совместно с IMV режимом, как описано выше, или как единственный режим, с постепенным снижением давления поддержки, позволяя пациенту брать на себя больше работы по обеспечению дыхания. У пациентов со сниженными дыхательными резервами, заниженные уровни поддержки давлением могут приводить к неадекватному минутному объему дыхания, что требует постоянного мониторинга частоты и объема дыхания.
Вентиляция с переключением фаз вдох-выдох
Вентиляция с переключением фаз вдох-выдох по объему в условиях тяжелого острого респираторного дистресс синдрома (ОРДС) и сниженного легочного комплаенса, может приводит к чрезмерному пиковому давлению или/и высокому объему вдоха в некоторых легочных сегментах, вызвав вторичное респиратор-ассоциированное легочное повреждение. Эти соображения привели к большему использованию режимов вентиляции с переключением фаз вдох-выдох по времени с регулированием по давлению. В этом режиме вентиляции дыхательный объем доставляется с постоянным потоком вплоть до достижения установленного давления. Время аппаратного вдоха устанавливается заранее и не зависит от потока, как в случае вентиляции с контролем по давлению. Контроль по давлению имеет преимущества в виде постоянного ограничения пикового давления, независимо от изменений податливости легких и грудной клетки или десинхронизации с аппаратом ИВЛ.
Учитывая вышесказанное, это наиболее распространенный и безопасный режим вентиляции в условиях поражения легких, сопровождающихся низкой податливостью, что типично для ОРДС. Как бы то ни было, PCV не очень хорошо переносится пациентами в сознании, что часто требует достаточного уровня седации.
Вентиляция с измененным соотношением фаз дыхания (IRV) может быть вариантом вентиляции с контролем по объему или по давлению, но наиболее часто используется при PCV. IRV является современной адаптацией практики прошлого, заключавшейся в удлинении фазы вдоха, результатом чего становилось увеличение остаточной функциональной емкости легких и улучшение газообмена у некоторых больных. Традиционная ИВЛ с использованием соотношения вдох-выдох 1:2 или 1:1,2 подразумевает относительно долгую экспираторную фазу, значительно снижая среднее давление в дыхательных путях. При IRV соотношение фаз обычно составляет от 1,1:1 до 2:1, что может быть достигнуто относительно быстрым инспираторным потоком и его снижением для поддержания достигнутого давления в фазу вдоха.
При применении IRV возникают два эффекта: а) удлинение времени вдоха ведет к увеличению среднего давления в дыхательных путях и открытию краевых альвеол, схожего результата достигают применением высокого ПДКВ; б) при более тяжелом поражении дыхательных путей, как результат перибронхиального сужения просвета терминальных отделов, с каждым вдохом происходит медленное выравнивание внутрилегочного давления, что приводит к неравномерной альвеолярной вентиляции. Эта неравномерность может стать причиной снижения перфузии альвеол с увеличением внутрилегочного шунтирования крови. При осторожном применении IRV, могут появляться воздушные ловушки, создающие внутреннее или аутоПДКВ, с селективным увеличинием интраальвеолярное давление в таких замкнутых полостях. Такой эффект может сочетаться с увеличением шунтирования и оксигенации. Внутреннее ПДКВ должно часто измеряться по причине возможного перерастяжения альвеол и вторичного респиратор-ассоциированного легочного повреждения.
Несмотря на привлекательность возможности создания селективного ПДКВ при IRV, остается вопрос, добавляет ли данный эффект что-нибудь новое, помимо простого эффекта повышения среднего давления в дыхательных путях. Исследования, подобные проведенному Lessard, свидетельствуют о том, что вентиляция с контролем по давлению может быть использована для ограничения пикового инспираторного давления и нет значительных преимуществ PCV или PCIRV в сравнении с традиционной объемной ИВЛ с добавлением ПДКВ у пациентов с острой дыхательной недостаточностью. Данная точка зрения в дальнейшем была развита Shanholtz и Brower, которые задались вопросом применения IRV при лечении ОРДС.
Вентиляция с освободждением давления (APRV)
В основе APRV лежит режим постоянно положительного давления в дыхательных путях (СРАР). Короткий период более низкого давления позволяет выводить из легких СО2. Пациент имеет возможность дышать самостоятельно во время всего цикла аппаратного дыхания. Теоретическими преимуществами APRV являются более низкое давление в дыхательных путях и минутная вентиляция, мобилизация спавшихся альвеол, более высокий уровень комфорта пациента при спонтанном дыхании и минимальные гемодинами-ческие эффекты. Поскольку пациент сохраняет способность к самостоятельному дыханию благодаря открытому экспираторному клапану, данный режим легко переносится пациентами, отлучаемыми от седации или имеющими положительную динамику после черепно-мозговой травмы. Раннее начало применения данного режима приводит к улучшению гемодинамики и к мобилизации альвеол. К тому же существуют научные данные, доказывающие, что сохранение самостоятельного дыхания при данном режиме вентиляции снижает потребность в седации.
Высокочастотная вентиляция легких
Интерес к высокочастотной вентиляции легких (HFOV) у взрослых с острой дыхательной недостаточностью возник вследствие того, что традиционные режимы вентиляции могут индуцировать дальнейшее повреждение легких повторяющимся циклом открытия и закрытия дыхательных путей. При HFOV поддерживается относительно высокое среднее давление в дыхательных путях при установленном малом дыхательном объеме, который доставляется с высокой частотой. Таким образом, целью является достижение и поддержание легких открытыми при отсутствии большого давления прилагаемого к альвеолам.
Большая часть опыта по применению данного метода описана в литературе по неонатальной и педиатрической практике. В только что опубликованном исследовании Mehta с соавт. 24 взрослых с ОРДС разной этиологии были вовлечены в проспективное исследование применения HFOV как «терапии спасения». Из этих пациентов 42% показали улучшение оксигенации и получили возможность вернуться к традиционным методам ИВЛ. Выжившие пациенты также провели меньшее количество дней на ИВЛ до перевода на HFOV, чем умершие. Требуются новые исследования, для того чтобы пролить свет на вопрос предполагаемой высокой эффективности данного режима у пациентов с ранними проявлениями ОРДС или ингаляционными поражениями.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Городская больница сообщает!
Важная информация!
Изменено время работы мобильных пунктов вакцинации от COVID-19.
Уважаемые пациенты!
В связи с неблагоприятной эпидемиологической обстановкой в регионе, запись и прием платных пациентов с
ПРИЗНАКАМИ ОРВИ
(повышением температуры, кашель, недомогание)
НЕ ОСУЩЕСТВЛЯЕТСЯ!
Просьба обращаться по месту прикрепления по полису ОМС
Вы здесь
СиПАП-терапия – масочная вспомогательная вентиляция легких
На сегодняшний день терапией первой линии при лечении больных с синдромом обструктивного апноэ сна (СОАС) и синдромом ожирения-гиповентиляции является масочная вспомогательная вентиляция легких. Термин «вспомогательная» подразумевает, что работа лечебного аппарата синхронизирована с самостоятельным дыханием пациента, помогая сделать ему вдох достаточной глубины.
Метод лечения СОАС посредством создания постоянного положительного давления в дыхательных путях был предложен Sullivan C.E. и соавт. в 1981 году. В англоязычной литературе метод получил название CPAP – аббревиатура от английских слов ContinuousPositiveAirwayPressure. Мы также будем употреблять термин CPAP/СиПАП-терапия.
В зависимости от тяжести СОАС и наличия сопутствующих заболеваний используются разные типы аппаратов, но принципиально они представляют собой портативный компрессор, работа которого контролируется мини-компьютером. Специальные датчики отслеживают дыхательный цикл пациента, позволяя аппарату вовремя переключаться от вдоха к выдоху синхронно с собственными дыхательными усилиями человека. Пациент надевает на лицо герметично прилегающую маску из мягкого пластика (носовую или носо-ротовую). Маска закрепляется на лице с помощью эластичных ремней и напоминает маску для плавания, но оставляет открытыми глаза пациента. Маска соединена с лечебным прибором с помощью гибкого воздуховодного шланга. Современные аппараты для СиПАП-терапии адаптированы для использования в домашних условиях – они компактны, имеют малый вес и создают при работе минимальный уровень шума, который не мешает пациенту и его близким спать.
Использование СРАР-аппарата позволяет снизить нагрузку на дыхательную мускулатуру, оптимизировать механику дыхания и восстановить чувствительность дыхательного центра к углекислому газу, одновременно обеспечивая проходимость верхних дыхательных путей во время сна, т.е. избавляя пациента от обструктивного апноэ сна. Благодаря создаваемому резерву, это во многих случаях дает возможность задействовать вспомогательную вентиляцию прерывисто – только во время ночного сна, когда дыхательные нарушения наиболее выражены, в то время как в бодрствовании пациент оказывается способен самостоятельно поддерживать адекватный уровень дыхания и газообмена.
Наибольшее распространение для вспомогательной вентиляции получили портативные аппараты поддержки дыхания в режиме автоСРАР-терапии. При этом давление выдоха устанавливается на уровне, позволяющем устранять обструктивное апноэ и поддерживать верхние дыхательные пути в открытом состоянии (по результатам пробного сеанса СРАР-терапии). Если не происходит устранение обструкции дыхательных путей, то давление вдоха постепенно повышается до величины, позволяющей нормализовать вентиляцию легких, добиться нормального насыщения крови кислородом и удалить избыток углекислоты.
Масочная вспомогательная вентиляция у пациента с СОАС и синдромом ожирения-гиповентиляции – СиПАП-терапия.
При необходимости высокого уровня лечебного давления используются BiPAPаппараты. Аппарат для БиПАП-терапии напоминает СиПАП, но создают не один, а два разных уровня положительного давления воздуха – большое на вдохе и меньшее на выдохе.
Опыт показывает, что вовремя и по показаниям начатая СиПАП-терапия больных с СОАС и хронической дыхательной недостаточностью, резвившейся в исходе выраженного ожирения, позволяет эффективно их реабилитировать и вернуть к активной жизни.
Абсолютных противопоказаний к проведению СРАР-терапии нет. Редко, у пациентов с некоторыми состояниями данный метод следует назначать с осторожностью, взвешивая возможные риски и пользу, и под регулярным контролем врача.
В Лаборатории нарушений дыхания во сне ООО «Медсервис» проводятся подбор маски, комфортного и лечебного давления, предоставляется в аренду аппарат для пробного сеанса СРАР-терапии.
Проведение вспомогательной ИВЛ
Когда пациенту не под силу самостоятельно делать вдохи, его жизнь спасает вспомогательная искусственная вентиляция легких. Данная процедура обеспечивает в механическом режиме естественное, ритмическое нагнетание воздуха в альвеолы легких. Но выдох при этом осуществляется в пассивном режиме при помощи легких и грудной клетки пациента. Таким образом, поддерживается нормальный уровень кислорода в крови болеющего человека.
Клинические показания к ВИВЛ:
Способы вспомогательной ИВЛ
Существует два современных, аппаратных метода вспомогательной ИВЛ: триггерный и адаптационный. В зависимости от того, полностью или частично тяжелобольной может дышать, подбирают тот или иной способ.
Триггерный способ
Для применения триггерного метода необходима специальная аппаратная система с распределением устройства с вдоха на выдох (либо же, наоборот) в момент дыхательного усилия пациента. Триггерный блок (система «откликания») регулируется согласно показателям давления, интенсивности самостоятельных выдохов пациента и скорости поступления воздуха в альвеолы легких. Особенно важно «время задержки». Вспомогательный вдох системы «откликания» в строгом порядке должен соответствовать началу, а не концу самостоятельного вдоха пациента. Если триггерный блок будет плохо отрегулирован, то больному человеку придется прилагать слишком большое усилие, чтобы привести в движение автоматический вспомогательный вдох. А общее самочувствие пациента не всегда позволит сделать это. Либо же будет происходить секундная задержка активации вспомогательного вдоха. Тогда больной уже будет выдыхать воздух, но триггерный блок еще не завершит вспомогательный вдох. Вместо полноценной адаптации пациенту придется тратить значительно больше усилий, чтобы пересилить возникающие дискомфортные ощущения и приспособиться к ритму блока. И хотя в наши дни доктора профессионально настраивают триггерную систему, все же этим способом пользуются ограниченно. Потому как в бессознательном состоянии пациент даже жестами не подтвердит отсутствие затруднений в период проведения процедуры и терпимое самочувствие.
Адаптационный способ
Широко применяется на практике адаптационный метод ВИВЛ. В этом случае аппарат работает в автоматическом режиме. При этом тяжелобольной хоть и продолжает самостоятельно дышать, точнее, делать выдохи, но в тоже время подстраивается под заданный ритм дыхательного аппарата. Адаптационный период пациента проходит намного продуктивнее. Так как все параметры блока строго соответствуют «спонтанному» дыханию больного. К этому способу прибегают доктора в том случае, когда тяжелобольной способен дышать самостоятельно.
Оказание помощи методами вспомогательной ИВЛ может длиться пару часов или несколько месяцев, в зависимости от степени тяжести больного. В последнем случае, чтобы убедиться в хорошей адаптации пациента к респиратору, контролируют следующие симптомы: идентичные шумы в легких с обеих сторон, естественный окрас кожных покровов без испарины, нормальные показатели пульса и АД.