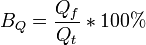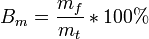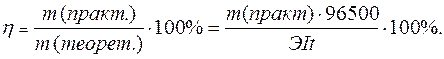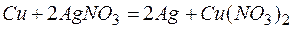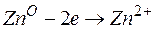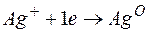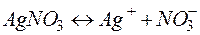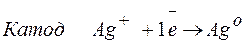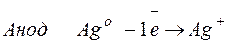Что такое выход по току в электролизе
Билет 37. Электролиз. Количественные законы электролиза. Выход по току



Электролиз – разложение электротоком.
Электролиз – это процесс, обратный процессу, происходящему при работе гальванических элементов.
Электролизом называется превращение электрической энергии в химическую.
Через электролизёр, содержащий расплав или раствор электролита, проходит постоянный ток от внешнего источника питания. В результате на электродах начинают протекать окислительная и восстановительная реакции.
Законы Фарадея. Количественные законы электролиза были установлены в 1834 г. английским ученым М.Фарадеем.
Первый закон Фарадея: количество вещества, превращенного на электроде при электролизе, пропорционально количеству электричества, прошедшего через электролит.
Второй закон Фарадея: массы веществ, испытавших превращения на электродах при прохождении одного и того же количества электричества, относятся между собой как молярные массы их эквивалентов.
Существует три вида электролиза:
Электроды в данном случае выполнены из пассивных материалов (платина, графит)
2.Электролиз водного раствора электролита с пассивными электродами
3.Электролиз раствора с активным анодом
Выходом по току в гальванотехнике называют выраженное в процентах отношение количества фактически пропущенного через электролит заряда (Qf) к теоретически необходимому (Qt) для осуществления фактически наблюдаемого массопереноса (mf).
Иногда выход по току рассчитывается как отношение массы при фактическом массопереносе mf к теоретическому массопереносу mt, рассчитанному по закону Фарадея:
Для случая осаждения массы на электроде выход по току оказывается всегда выше 1. Для случая растворения материала электрода выход по току оказывается всегда ниже 1.
Выход по току связан с электрохимическим эквивалентом.
Лекция 1. Законы Фарадея
Описание
4. Выход вещества по току.
5.Способы определения выхода по току при использовании постоянного и импульсного тока.
6.Второй закон Фарадея.
7.Кажущиеся случаи отклонения от законов Фарадея.
Оглавление
1. Первый закон Фарадея
Первый закон Фарадея устанавливает связь между количеством прошедшего через электрохимическую систему электричества и количеством прореагировавшего вещества.
Математически этот закон выражается уравнением:
2. Электрохимический эквивалент.
Электрохимический эквивалент представляет собой количество вещества, прореагировавшего в результате протекания единицы количества электричества.
Электрохимический эквивалент может быть получен расчетным путем, если известна электрохимическая реакция, т.е. исходные вещества и ее продукты. Уравнение для расчета электрохимического эквивалента выглядит следующим образом:

где М – молярная масса реагента, n – число электронов, участвующих в реакции, F – число или постоянная Фарадея: F = 96486 ≈96500 Кл/моль.
3. Кулонометры. Классификация кулонометров.
В серебряном кулонометре определяется масса серебра, выделяющаяся
В весовых кулонометрах (к ним относятся серебряные и медные) количество прошедшего в них электричества рассчитывается по изменению массы катода или анода. В объемных кулонометрах расчет производится на основании измерения объема получающихся веществ (газа в водородном кулонометре, жидкой ртути в ртутном кулонометре). В титрационныхкулонометрах количествоэлектричества определяется по данным титрования веществ, образующихся в растворе в результате электродной реакции.
Этиловый спирт добавляют в электролит для получения более мелкокристаллических, компактных катодных осадков и с целью предотвращения окисления медных электродов кулонометра.
О количестве прошедшего электричества судят по изменению массы катода, до и после электролиза.
катодом, а анод готовится из чистого серебра.
В качестве электролита в серебряном кулонометре используется нейтральный или слабокислый 30% раствор нитрата серебра.
Газовый водородно-кислородный кулонометр применяется для приближенных измерений малых количеств электричества. В нем измеряют общий объем водорода и кислорода, выделяющихся при электролизе водного раствора H2SO4или NaOH, а из этой величины вычисляют количество прошедшего электричества. Применяют эти кулонометры сравнительно редко, т.к. точность их небольшая, а в работе они менее удобны, чем весовые кулонометры.
Наиболее распространенные из титрационныхкулонометров – йодный
Йодныйкулонометр представляет собой сосуд с разделенными катодным и анодным пространствами платиновоиридиевыми электродами. В анодное отделение вводят концентрированный раствор иодида калия с добавлением соляной кислоты, в катодное отделение – раствор соляной кислоты. При пропускании тока на аноде выделяется йод, который затем титруют тиосульфатом натрия (Na2S2O3). По результатам титрования рассчитывают количество электричества.
4. Выход по току
Часто на электроде протекает не одна электрохимическая реакция, а несколько самостоятельных параллельных реакций. Например, при выделении Zn из кислого раствора ZnSO4наряду с разрядом ионов Zn:
протекает реакция восстановления ионов гидроксония: 2Н3О + +2ē → Н2 + 2H2O.
Если на электроде протекает несколькопараллельных электрохимических реакций, то I закон Фарадея будет справедлив для каждой из них.
Для практических целей, для того, чтобы учесть какая доля тока или количества прошедшего через электрохимическую систему электричества расходуется на каждую конкретную реакцию введено понятие выхода вещества по току.
Таким образом, ВТ позволяет определить часть количества прошедшего через электрохимическую систему электричества, которая приходится на долю данной электрохимической реакции.
Знание ВТ необходимо, как при решении теоретических вопросов: например, при построении парциальных поляризационных кривых и выяснении механизма электрохимической реакции, так и в практике электроосаждения металлов, неметаллов, сплавов, с целью оценки эффективности технологической операции. ВТ на практике чаще всего определяют делением практической массы вещества на теоретическую массу, определенную по закону Фарадея.
5. Способы определения ВТ при использовании импульсного тока
Если же через границу раздела фаз протекает импульсный ток, то при определении ВТ возникают большие трудности. Единой методики или прибора для определения ВТ при импульсномэлектролизе не существует. Сложность определения ВТ в условиях импульсногоэлектролиза обусловлена тем, что проходящий через систему ток расходуется не только на электрохимическую реакцию, но и на заряжение двойного электрического слоя. Электрический ток, проходящий через границу раздела и вызывающий электрохимическое превращение, называется часто фарадеевским током. Ток заряжения расходуется на заряжение двойного электрического слоя, реорганизацию растворителя, самого реагента, т.е. на все на то, что создает условия для протекания электрохимической реакции, поэтому выражение для общего тока, проходящего через электрохимическую систему, будет выглядеть следующим образом:
I = Iз + Iф, где Iз – ток заряжения, Iф – фарадеевский ток.
Если не требуется определения абсолютных значений ВТ, то в качестве критерия оценки эффективности импульсного электролиза можно использовать отношения количества электричества, затраченного на растворение осадка к количеству электричества, затраченного на его формирование.
6. Второй закон Фарадея.
Второй закон Фарадея является непосредственным следствием первого закона. Во втором законе Фарадея отражена связь, существующая между количеством прореагировавшего вещества и его химической природой.
Согласно второму закону Фарадея:
Математически этот закон выражается уравнением:
Второй закон Фарадея является непосредственным следствием первого закона. Во втором законе Фарадея отражена связь, существующая между количеством прореагировавшего вещества и его химической природой.
Согласно второму закону Фарадея:
7. Кажущиеся случаи отклонения от законов Фарадея
Количество образующегося газообразного хлора всегда меньше, чем это следует по закону Фарадея из-за того, что Cl2растворяется в электролите и вступает в реакцию гидролиза:
Если учесть массу хлора, прореагировавшего с водой, получим результат, соответствующий рассчитанному по закону Фарадея.
Часто на электроде протекает не одна электрохимическая реакция, а несколько самостоятельных параллельных реакций. Например, при выделении Zn из кислого раствора ZnSO4наряду с разрядом ионов Zn:
протекает реакция восстановления ионов гидроксония: 2Н3О + +2ē → Н2 + 2H2O.
Если на электроде протекает несколько параллельных электрохимических реакций, то I закон Фарадея будет справедлив для каждой из них.
Законы Фарадея. Выход продукта по току
Количество веществ, образующихся при электролизе на электродах, можно рассчитать, пользуясь двумя законами электролиза, установленными Фарадеем в 1833 г. которые с учетом современной терминологии можно сформулировать в следующем виде:
1) количество вещества, испытавшего электрохимические превращения на электроде, прямо пропорционально количеству прошедшего электричества;
2) массы прореагировавших на электродах веществ при постоянном количестве электричества относятся друг к другу как молярные массы их эквивалентов.
Для расчетов используют математическое выражение обобщенного закона Фарадея:
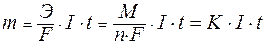
| где: | Э – эквивалентная масса вещества (молярная масса эквивалента); F– постоянная Фарадея, равная 96500 Кл/моль;. I – сила тока, А; t – время проведения электролиза, с; М – молярная масса вещества; n – число отданных или принятых электронов; К – электрохимический эквивалент вещества. |
Практический расход тока при электролизе вследствие протекания побочных процессов (взаимодействие полученных веществ с электродом или электролитом) превышает его количество, рассчитанное согласно закону Фарадея. Следовательно, практическая масса полученных веществ отличается от теоретически рассчитанной. Отношение массы практически полученного вещества к теоретически рассчитанной массе, выраженное в процентах, называется выходом вещества по току:
Примеры решения типовых задач.
Пример 1.Ряд активности металлов, электродных потенциалов.
Задача 1. Медная пластинка массой 10 г была погружена в раствор нитрата серебра, затем промыта водой и высушена. Масса ее оказалась равной 11,0 г. Сколько серебра из раствора выделилось на пластинке?
Решение. Для решения этой задачи необходимо знать стандартные электродные потенциалы металлов, т.е. место их в ряду напряжений (ряду активности металлов Бекетова).
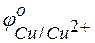
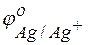
Из этих положительных потенциалов стандартный электродный потенциал меди менее положителен, следовательно, пойдёт реакция вытеснения:
Для того чтобы вычислить количество серебра, выделившегося на медной пластинке, надо помнить, что медная пластинка в этой реакции и сама растворяется, теряя в массе.
Обозначим количество растворившейся меди через x г, тогда масса медной пластинки с учётом её растворения будет (10-х) г, масса выделившегося серебра на основе реакции:
64,0 г Cu – 2 ∙ 108 г Ag
216х =64+64х, 152x=64, x=0,42 г.
Таким образом, в течение реакции растворилось 0,42 г меди и выделилось 1,0 + 0,42 = 1,42 г серебра.
Пример 2.Работа гальванического элемента и расчёт ЭДС.
Задача 1. Напишите уравнения реакций, происходящих при работе гальванического элемента, состоящего из цинковой и серебряной пластин, опущенных в растворы своих солей с концентрацией катионов, равной 1 моль/л.
Решение. Стандартные электродные потенциалы цинкового и серебряного электродов соответственно равны:
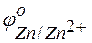
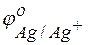
Металл, имеющий более отрицательное значение электродного потенциала при работе гальваничеcкого элемента, является анодом. В данном случае протекают реакции:
т.е. цинк, являясь анодом, растворяется при работе гальваничеcкого элемента, а серебро осаждается в виде металла на катоде. ЭДС гальванического элемента равна
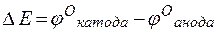
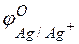
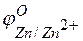
Пример 3. Зависимость электродных процессов от концентрации.
Задача 1. Рассчитайте, чему равна ЭДС элемента, составленного из медной и магниевой пластин, опущенных в растворы своих солей, если концентрация катиона у анода равна 0,1 моль/л, а у катода – 0,001 моль/л.
Решение. Стандартные электродные потенциалы магниевого и медного электродов соответственно равны:
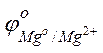
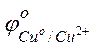
Следовательно, анодом будет магниевый электрод, катодом – медный. Электродный потенциал металла, опущенного в раствор с любой концентрацией катиона в растворе, определяют по формуле Нернста:
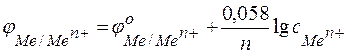
где: с – концентрация катиона, моль/л;
п – число электронов, принимающих участие в реакции.
Отсюда потенциал магниевого электрода
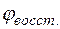
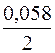
Потенциал медного электрода
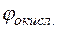
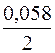
Тогда для гальванического элемента
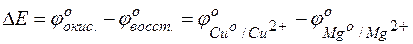
Пример 4. Определение возможности протекания реакции в гальвани-ческом элементе.
Задача 1. Исходя из величины стандартных электродных потенциалов и значения энергии Гиббса ΔG о 298, укажите, можно ли в гальваническом элементе осуществить следующую реакцию:
Решение. Надо составить схему гальванического элемента, отвечающего данной реакции. В этой реакции происходит восстановление ионов кадмия и окисление атомов железа:
Пользуясь таблицей стандартных электродных потенциалов, определяем ЭДС этого гальваничекого элемента:
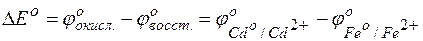
Изменение величины энергии Гиббса с величиной ЭДС связано соотношением:
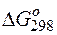
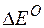
где: 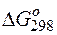
n – число электронов, принимающих участие в реакции;
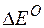
Находим 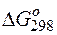
Так как 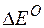
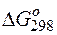
| 96500 Кл – 32 г |
| 1800 Кл – х г |
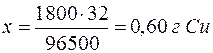 |
Пример 6. Определение электрохимического эквивалента и выхода по току.
Решение. Нитрат серебра диссоциирует:
Процессы, протекающие на электродах:
Молярная масса эквивалента Ag О =108 г/моль.
Определяем массу серебра, которая выделилась бы теоретически при прохождении через раствор данного количества электричества:
Что такое гальваника? Теоретические основы нанесения гальванических покрытий.
Содержание:
1. Понятие об электролизе. Принципиальная схема электролизера.
Электролиз с практической точки зрения является комплексом окислительно-восстановительных реакций, протекающих под действием электрического тока в электролите.
Проходящий через электролит ток обычно постоянный, хотя иногда он может быть и переменным или изменяться по определенной функции. В любом случае, мы всегда сможем выделить катодный (восстановление) и анодный (окисление) процессы.
2. Электролиз с нерастворимыми анодами. Анод не растворяется, на нем происходит побочная реакция, например, выделение кислорода. На катоде происходит восстановление металла, ионы которого подтягиваются из электролита. Происходит непрерывное снижение концентрации ионов металла в растворе.
Схема простейшего электролизера (рисунок 1 и 2) всегда включает в себя:
В случае нанесения анодного оксидного покрытия, например, на алюминии (процесс анодирования), покрываемые изделия находятся на аноде, а катоды выполняют роль противоэлектродов.
Электролизер может комплектоваться и дополнительным оборудованием:
2. Гальваника и закон Фарадея. Выход по току. Метод расчета толщины осаждаемого покрытия.
Закон Фарадея связывает массу выделявшегося на электроде вещества и количество пропущенного через электролит электричества. Применительно к гальванике закон Фарадея можно представить следующим образом:
Отметим, что наиболее часто площадь деталей в гальваностегии выражается в квадратных дециметрах, а плотность тока, соответственно, в амперах на дециметр квадратный. Реже применяется отношение к квадратному сантиметру (научные экспериментальные работы) и квадратному метру (например, при оцинковке стальной ленты). Использование дециметров в гальванике удобно тем, что в этом случае получаются не слишком большие и не слишком малые величины.
Геометрическая площадь (и связанная с ней геометрическая плотность тока) высчитывается исходя из геометрических размеров детали по стандартным математическим формулам.
Реальная площадь (и реальная плотность тока) может быть определена исходя из шероховатости и микрорельефа поверхности. Так, сравнив фотографии серебряного покрытия на рисунке 3 (А и Б) становится очевидно, что площадь поверхности пластинки на самом деле в 2-3 раза больше, чем просто произведение длины на ширину. Следует учитывать реальную площадь при гальваническом покрытии деталей с высокой шероховатостью поверхности, например, после пескоструйной или дробеструйной обработки.
Величина V/S представляет собой искомую толщину покрытия δ, если условно принять покрытие за параллелепипед, то:
Заметим, что толщина покрытия в гальваностегии обычно выражается в микрометрах (мкм).
Расчет толщины гальванического покрытия на практике обычно производится приблизительно по справочными данными о средней толщине покрытия, осаждаемого из данного электролита при данной плотности тока. Эти данные содержатся в ГОСТ 9.305-84, либо в отдельных техпроцессах, поставляемых вместе с фирменными органическими добавками к электролитам. Например, в таблице 1 приведены усредненные данные для гальванического цинкования из щелочного цинкатного электролита с двумя блескообразователями.
Точный расчет по формуле на практике лишен смысла, т.к. невозможно точно определить реальную плотность тока и реальный выход по току на каждом участке сложнопрофильной поверхности. Поэтому расчет всегда будет носить приближенный оценочный характер. В любом случае, перед выбором режима осаждения покрытия отработка и измерение толщины производится на опытных образцах деталей.
Плотность тока, А/дм 2
Скорость осаждения, мкм/мин
3. Потенциал электрода. Перенапряжение (поляризация).
Металлические электроды, опущенные в раствор электролита, содержащего одноименные с металлом ионы, обладают характеристикой, называемой равновесным потенциалом.
В гальванике равновновесный потенциал электрода характеризует динамическое равновесие между ионами металла, выходящими из кристаллической решетки электрода в раствор и одноименными ионами в растворе, стремящимися войти в кристаллическую решетку электрода. Скорость обмена характеризуется так называемым током обмена i0. Такая система реализуется в любом электролите для нанесения покрытий с использованием растворимых металлических анодов, например, когда мы загружаем медные аноды в электролит сернокислого меднения, состоящий из сульфата меди и серной кислоты.
При использовании нерастворимых анодов или при опускании анода в раствор, в котором отсутствую одноименные ему ионы, на нем будет реализовываться стационарный потенциал.
Равновесный потенциал привязан к величине стандартных потенциалов металлов (табличные значения) уравнением Нернста:
Если подставить в уравнение значения R и F, перейти к десятичным логарифмам и принять, что температура 298 К, то уравнение Нернста можно преобразовать в следующий вид:
Перенапряжение обозначается как ηК и ηА соответственно для обозначения катодного и анодного процесса.
Наглядно эти вопросы будут разъяснены при рассмотрении поляризационных кривых.
Отметим, что чем выше перенапряжение выделения металла на катоде, тем более мелкокристаллическим будет покрытие. При осаждении покрытий стремятся получать как можно более мелкокристаллические осадки. Обоснование этого будет дано далее.
4. Напряжение на электролизере.
Для того, чтобы электрический ток прошел через электролизер, необходимо приложить определенное напряжение. При постоянной величине электрического тока I, чем выше сопротивление R в узлах электролизера, тем выше требуется напряжение U. Произведение U*I называется мощностью W, измеряемой в кВт. Произведение мощности на время (в часах) называется киловатт-часами и характеризует затраты электричества на проведение процесса. Следовательно, при прочих равных условиях, необходимо стремиться снизить напряжение на ванне.
Напряжение на работающем электролизере складывается из следующих величин:
5. Лимитирующие стадии электродной реакции. Поляризационная кривая. Предельный диффузионный ток. Концентраторы тока.
Для того, чтобы иону металла восстановиться и осадиться на катоде ему необходимо подойти к поверхности электрода из объема раствора, разрядиться и встроиться в кристаллическую решетку покрытия. Все эти процессы характеризуются определенной скоростью. Стадия, имеющая минимальную скорость будет тормозить всю реакцию. Такая стадия будет называться лимитирующей (замедленной) и будет контролировать электрохимический процесс.
На рисунке 4 представлены типичные виды поляризационных кривых.
Отметим, что в повседневной гальванотехнике поляризационные кривые в рабочих электролитах снимаются редко, поэтому детальное изучение кинетики электрохиимических реакций мы опустим, оставив это курсу теоретической электрохимии.
Рассмотрим прикатодное пространство в электролите при включении внешнего тока (рисунок 5).
Ток обмена характеризует процесс перехода ионов металла из кристаллической решетки катода в раствор и обратно. Как только будет включен источник тока разряжающихся ионов в прикатодном слое начнет падать. Одновременно с этим из глубины электролита за счет диффузии будет происходить поступление новых ионов с определенной скоростью.
Если скорость диффузии будет меньше скорости разряда ионов, то концентрация разряжающихся ионов в приэлектродном пространстве с ростом плотности тока будет продолжать уменьшаться. При определенной плотности тока все подходящие из глубины раствора ионы будут сразу же разряжаться на катоде. Данная плотность тока будет называться предельным током. Увеличить скорость электроосаждения мы теперь уже не сможем, т.к. новые ионы просто не будут успевать подходить из глубины электролита к поверхности катода. Важно знать, что для любой реакции может быть достигнут предельный ток, когда скорость этой реакции достигнет предельного значения. В этом случае на поляризационной кривой будет получена площадка, параллельная оси потенциалов (т.е. оси х).
При перемешивании электролита будет увеличиваться величина предельного диффузионного тока и не будет изменяться величина предельного кинетического.
Если параллельно с осаждением металла на катоде идет выделение водорода (как это имеет место, опять же, при никелировании), то в местах реализации предельного диффузионного тока будет наблюдаться значительно большее газовыделение, чем на остальной поверхности катода. Учитывая крупнокристаллическую структуру покрытия и его плохое сцепление с основой в этих местах, а также значительную скорость его наращивания, выделяющийся водород может просто срывать крупные части покрытия (эффект старой краски, отслаивающейся от покрашенного изделия) вызывая брак всего изделия. Для увеличения значения предельного диффузионного тока и, соответственно, расширения рабочих плотностей тока, как уже говорилось ранее, производится перемешивание электролитов.
6. Одновременное протекание реакций на электроде. Выделение металла одновременно с газом. Сплавообразование.
Случаи, когда при нанесении гальванического покрытия на электроде протекает только одна реакция довольно редки. Гораздо чаще происходит одновременно две и более реакции. Условием для одновременного протекания двух электрохимических процессов является максимальное сближение потенциалов их разряда. Можно классифицировать ситуации следующим образом:
Также в качестве побочных реакций могут выступать реакции неполного восстановления металла (Fe 3+ → Fe 2+ ), реакции восстановления оксидных пленок и т.п.
6.1 Выделение водорода одновременно с осаждением металла на катоде.
Выделение водорода одновременно с покрытием происходит, например, при никелировании, хромировании, цинковании из цинкатного электролита, лужении из кислого электролита и т.д. Выделение водорода усиливается при приближении к предельному диффузионному току.
Выделение водорода при катодном осаждении металла практически всегда отрицательно сказывается на качестве покрытия. Тому есть несколько причин:
6.2 Одновременное выделение двух и более металлов или металла и неметалла (сплавообразование).
Для того, чтобы две электроактивных частицы одновременно восстановились на катоде нам необходимо максимально сблизить их потенциалы разряда. Этого можно достичь следующими способами:
7. Простые и комплексные электролиты в гальванотехнике.
Традиционно в гальванике применяются простые и комплексные электролиты. Отличие состоит в том, в какой форме находятся ионы осаждаемого металла. Простые электролиты содержат сульфаты, нитраты, хлориды и т.п. и осаждаемый металл в них находится в форме простой соли. Соответственно, электролиты будут называться сульфатные, нитратные, хлоридные и т.п. Если используется смесь солей, то название будет двойным, тройным и т.д., например, сульфатно-нитратные, сульфатно-хлоридные.
Для примера рассмотрим таблицу 4, в которой приведены значения констант нестойкости комплексов серебра и рисунок 14, где приведены некоторые поляризационные кривые осаждения серебра из различных комплексов. По рисунку 14 можно заметить, что чем меньше константа нестойкости комплекса, тем больше поляризация, что визуально выражается в более пологой кинетической кривой.