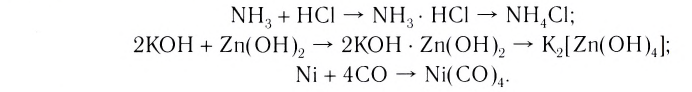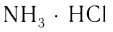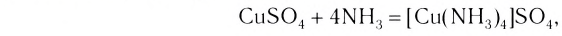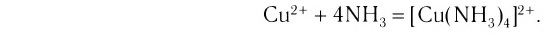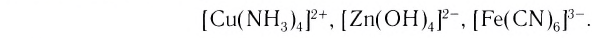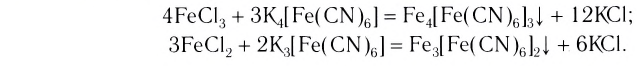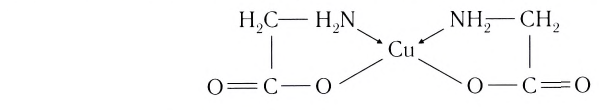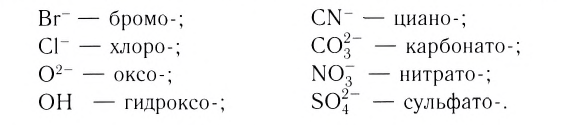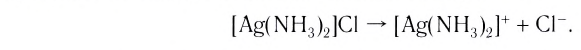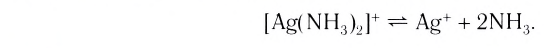Что такое бидентатные лиганды
Содержание:
Комплексные соединения:
Наиболее обширный и разнообразный класс неорганических веществ представляют комплексные соединения. В переводе с латинского complexus означает «сочетание». И действительно, большинство комплексных соединений образуется в результате соединения (сочетания) более простых веществ:
Комплексные соединения, которые образуются в результате таких реакций, обладают свойствами, отличающимися от свойств исходных веществ. Например, аммиак и хлороводород — газы, a
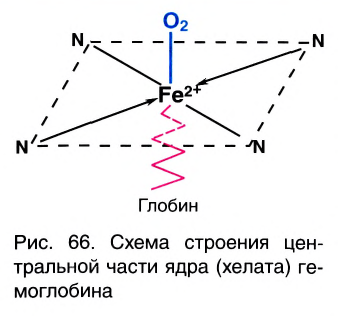
Комплексные соединения имеют большое значение в различных областях науки и техники. Их используют в качестве катализаторов, в производстве синтетических моющих средств и лаков, для получения металлов высокой степени чистоты и разделения смеси металлов, в аналитической химии и медицине, пищевой и фармацевтической промышленности. Особое место занимают комплексные соединения в живой природе. Именно эти соединения образуют активные центры ферментов, многих витаминов, осуществляют перенос кислорода в биологических системах, являются основными участниками большинства ферментативных и фотохимических процессов. Достаточно упомянуть только два таких природных объекта, содержащих комплексные соединения, как хлорофилл и гемоглобин.
У таких соединений есть и второе название — координационные соединения. Это название связано с особенностями их строения, взаимного расположения (координации) всех частиц, входящих в их состав.
Строение и свойства комплексных соединений объясняются координационной теорией, основы которой были заложены швейцарским химиком A. Be line ром в 1893 г. Согласно Вернеру комплексным соединением называется вещество, в узлах кристаллической решетки которого находятся сложные частицы, построенные за счет координации одним атомом (ионом) элекрезультате соединения (сочетания) более простых веществ:
Комплексные соединения, которые образуются в результате таких реакций, обладают свойствами, отличающимися от свойств исходных веществ. Например, аммиак и хлороводород — газы, a NH3 ■ HCI — твердая соль, Ni — металл, СО — газ, а продукт их взаимодействия — бесцветная, легко испаряющаяся жидкость.
Комплексные соединения имеют большое значение в различных областях науки и техники. Их используют в качестве катализаторов, в производстве синтетических моющих средств и лаков, для получения металлов высокой степени чистоты и разделения смеси металлов, в аналитической химии и медицине, пищевой и фармацевтической промышленности. Особое место занимают комплексные соединения в живой природе. Именно эти соединения образуют активные центры ферментов, многих витаминов, осуществляют перенос кислорода в биологических системах, являются основными участниками большинства ферментативных и фотохимических процессов. Достаточно упомянуть только два таких природных объекта, содержащих комплексные соединения, как хлорофилл и гемоглобин.
У таких соединений есть и второе название — координационные соединения. Это название связано с особенностями их строения, взаимного расположения (координации) всех частиц, входящих в их состав.
Строение и свойства комплексных соединений объясняются координационной теорией, основы которой были заложены швейцарским химиком A. Be line ром в 1893 г. Согласно Вернеру комплексным соединением называется вещество, в узлах кристаллической решетки которого находятся сложные частицы, построенные за счет координации одним атомом (ионом) электронейтральных молекул или противоположно заряженных ионов и способные к самостоятельному существованию в растворах.
Альфред Вернер
(1866—1919)
Швейцарский химик-неорганик. Один из создателей координационной теории комплексных соединений. Лауреат Нобелевской премии (1913).
Основные представления о строении комплексных соединений
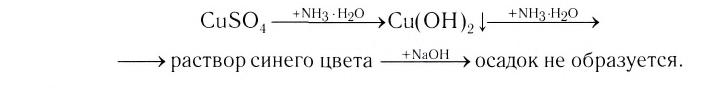
Проведем следующий эксперимент: каплю концентрированного раствора аммиака прильем к раствору сульфата меди(II) CuS04. Образуется голубой осадок гидроксида меди(II) Си(ОН)2, Продолжим добавлять раствор аммиака — осадок растворяется, а раствор приобретает ярко-синий цвет. Если затем добавить к полученному раствору раствор гидроксида натрия — осадок гидроксида меди(II) не образуется:
Значит, ионов Си 2+ в растворе практически нет. В то же время, ионы S04 легко обнаруживаются в растворе при добавлении BaCl2. Следовательно, при приливании избытка аммиака к осадку гидроксида меди(II) образовалось новое соединение.
Как показывает химический анализ, из раствора можно выделить кристаллы 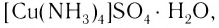

или в сокращенном ионном виде:
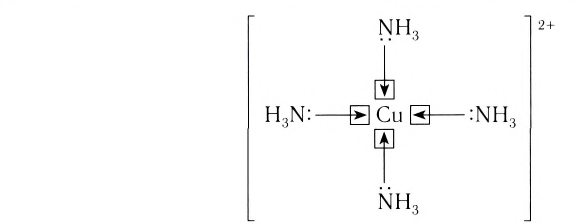
Рассмотрим структуру комплексных соединений. В составе комплексного иона выделяют центральный атом (или ион) — комплексообразователь. В нашем примере — это ион меди(II). В качестве комплексообразователей могут в принципе выступать любые атомы или ионы, но наиболее характерна способность к комплексообразованию для катионов переходных металлов (d-элементов).
Вокруг комплексообразователя группируются (координируются) другие атомы, ионы (чаще анионы) или нейтральные молекулы, которые называются лигандами. Например, лигандами могут выступать нейтральные молекулы: воды Н20, аммиака NH3, оксида углерода(II) СО, этилендиамина 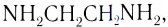
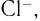
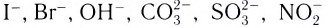
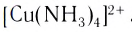
Слово «лиганд» образовано от латинского «ligo» — «связываю». Впервые этот термин в химическую литературу был введен немецким химиком А. Штоком в начале XX в. Однако в современном его значении слово «лиганд» ввел в научную литературу датский ученый Н. Бьеррум.
Число, показывающее, сколько лигандов (ионов или молекул) присоединено к данному комплексообразователю, называется его координационным числом. Так, в комплексном ионе 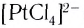
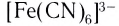
Лиганды могут образовывать химические связи с комплексообразователей посредством одного или нескольких атомов, входящих в их состав. В зависимости от количества таких атомов лиганды подразделяют на монодентатные и полидентатные (от лат. dentatus — «имеющий зубы»). Пример монодентатного лиганда — аммиак NH3, молекулы которого присоединяются к комплексообразователю посредством атома азота, имеющего одну неподеленную пару электронов:
Бидентатными лигандами являются карбонат-ионы 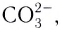
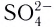
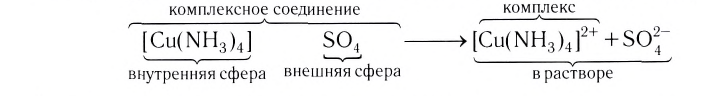
Центральный атом и лиганды образуют внутреннюю сферу — комплексный ион, или комплекс, который способен к самостоятельному существованию в растворе. При написании формул комплексных соединений внутреннюю сферу обычно заключают в квадратные скобки:
Такие формулы называются координационными.
Ионы, окружающие комплексный ион, составляют внешнюю сферу:
Поскольку комплексные соединения в целом электронейтральны, то частицы внешней сферы нейтрализуют заряд внутренней сферы. При диссоциации комплексного соединения в водных растворах образуются комплексные ионы и ионы внешней сферы. Комплексные соединения могут быть кислотами (например, 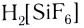
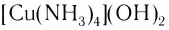
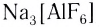
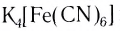
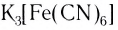
При взаимодействии хлорида железа (III) с раствором желтой кровяной соли 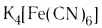
Классификация, номенклатура и устойчивость комплексных соединений
Комплексные соединения весьма разнообразны по составу, строению и свойствам. Существует несколько способов классификации комплексных соединений, основанных на различных принципах.
Классификация комплексных соединений
Наиболее распространенной является классификация по природе лигандов. В зависимости от природы лигандов различают:
Выделяют также циклические, или хелатные (клешневидные), комплексные соединения, содержащие би- и полидеитатные лиганды, связанные с центральным атомом связями, образованными по разным механизмам:
Лиганд, подобно клешням рака, как бы захватывает центральный атом.
На этих и последующих схемах ковалентные связи, образованные за счет неспаренных электронов, обозначены черточками, а образованные по донорно-акцепторному механизму — стрелками.
По знаку электрического заряда внутренней сферы различают комплексы:
Нейтральные комплексы не имеют внешней сферы и являются неэлектролитами.
Существуют также координационные соединения, состоящие из комплексных катионов и комплексных анионов, например 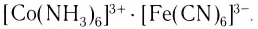
Номенклатура комплексных соединений
Знакомясь с новым классом химических соединений — комплексными соединениями, рассмотрим более подробно основные принципы их номенклатуры.
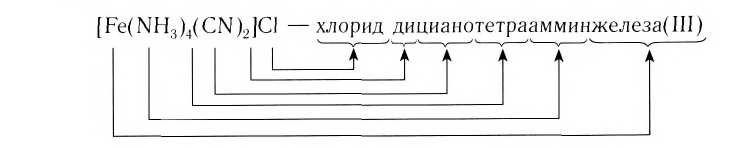
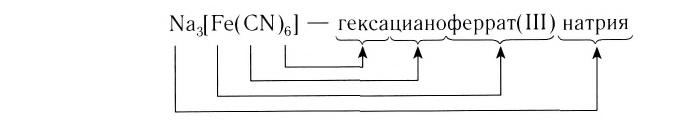
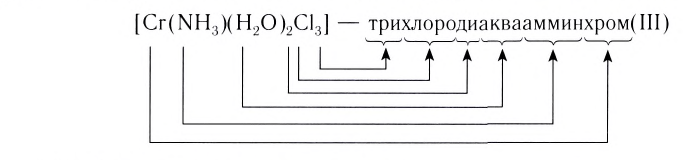
При написании формулы внутренней сферы комплексного соединения вначале записывают центральный атом (Me), а затем лиганды (L) с указанием их числа n. При этом лиганды, в зависимости от их заряда, располагаются в следующем порядке. Сначала записываются электронейтральные лиганды, а затем — лиганды с отрицательным зарядом:
Название комплексного соединения состоит из названия комплексного иона и названия противоиона. При этом сначала указывается анион в именительном падеже, а затем катион в родительном, независимо от того, какой из этих ионов комплексный (Согласно номенклатурным правилам ИЮПАК порядок названия комплексного соединения обратный. При этом и катион, и анион называют в именительном падеже).
Название комплексного иона строится по схеме 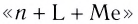
Нейтральные лиганды называют так же, как молекулы, например 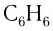
И, наконец, называют центральный атом или ион, указывая римской цифрой в круглых скобках степень окисления центрального атома. Если это комплексный катион, то название центрального атома не меняется:
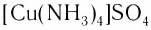
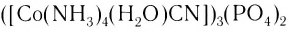
В названии комплексного аниона к корню латинского названия комплексообразователя добавляют суффикс -aт:
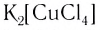
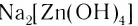
В названии нейтрального комплекса перечисляются все лиганды, а затем указывается русское название комплексообразователя в именительном падеже:
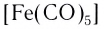
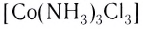
Устойчивость комплексных соединений
Большинство комплексных соединений при обычных условиях представляют собой твердые вещества, как правило, хорошо растворимые в воде. Ионная связь между внешней и внутренней сферами комплексного соединения при растворении вещества в воде легко разрушается. Происходит первичная диссоциация, которая протекает по типу диссоциации сильных электролитов:
Диссоциация внутренней сферы комплекса, называемая вторичной, протекает по типу диссоциации слабых электролитов и характеризуется наличием равновесия между комплексом, центральным ионом и лигандами:
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Что такое бидентатные лиганды
Основы современной координационной теории были изложены в конце прошлого века швейцарским химиком Альфредом Вернером, обобщившим в единую систему весь накопившийся к тому времени экспериментальный материал по комплексным соединениям. Им были введены понятия о центральном атоме (комплексообразователь) и его координационном числе, внутренней и внешней сфере комплексного соединения, изомерии комплексных соединений, предприняты попытки объяснения природы химической связи в комплексах.
Все основные положения координационной теории Вернера используются и в настоящее время. Исключение составляет его учение о природе химической связи, которое представляет сейчас лишь исторический интерес.
Образование комплексного иона или нейтрального комплекса можно представить себе в виде обратимой реакции общего типа:
M + n L 
В комплексных ионах комплексообразователями являются медь(II), кремний(IV), железо(II), бор(III).
Чаще всего комплексообразователем служит атом элемента в положительной степени окисления.
Отрицательные условные ионы (т.е. атомы в отрицательной степени окисления) играют роль комплексообразователей сравнительно редко. Это, например, атом азота(-III) в катионе аммония [NH 4 ] + и т.п.
Атом-комплексообразователь может обладать нулевой степенью окисления. Так, карбонильные комплексы никеля и железа, имеющие состав [Ni(CO) 4 ] и [Fe(CO) 5 ], содержат атомы никеля(0) и железа(0).
Комплексообразователь (выделен синим цветом) может участвовать в реакциях получения комплексов, как будучи одноатомным ионом, например:
так и находясь в составе молекулы:
P H 3 + H + 
B F 3 + NH 3 
В комплексной частице может быть два и более атомов-комплексообразователей. В этом случае говорят о многоядерных комплексах.
Лиганды, как правило, не связаны друг с другом, и между ними действуют силы отталкивания. В отдельных случаях наблюдается межмолекулярное взаимодействие лигандов с образованием водородных связей.
Примером гексадентатного лиганда может служить анион этилендиаминтетрауксусной кислоты:
Полидентатные лиганды могут выступать в роли мостиковых лигандов, объединяющих два и более центральных атома.
Важнейшей характеристикой комплексообразователя является количество химических связей, которые он образует с лигандами, или координационное число ( КЧ ). Эта характеристика комплексообразователя определяется главным образом строением его электронной оболочки и обусловливается валентными возможностями центрального атома или условного иона-комплексообразователя (подробнее см. >>>).
Когда комплексообразователь координирует монодентатные лиганды, то координационное число равно числу присоединяемых лигандов. А число присоединяемых к комплексообразователю полидентатных лигандов всегда меньше значения координационного числа.
Значение координационного числа комплексообразователя зависит от его природы, степени окисления, природы лигандов и условий (температуры, природы растворителя, концентрации комплексообразователя и лигандов и др.), при которых протекает реакция комплексообразования. Значение КЧ может меняться в различных комплексных соединениях от 2 до 8 и даже выше. Наиболее распространенными координационными числами являются 4 и 6.
В аквакомплексах координационное число комплексообразователя в степени окисления +II чаще всего равно 6:
Известны комплексообразователи, которые обладают практически постоянным координационным числом в комплексах разных типов. Таковы кобальт(III), хром(III) или платина(IV) с КЧ 6 и бор(III), платина(II), палладий(II), золото(III) с КЧ 4. Тем не менее большинство комплексообразователей имеет переменное координационное число. Например, для алюминия(III) возможны КЧ 4 и КЧ 6 в комплексах и
Координационные числа 3, 5, 7, 8 и 9 встречаются сравнительно редко. Есть всего несколько соединений, в которых КЧ равно 12 – например, таких как K9 [Bi(NCS) 12 ].
Лиганды, непосредственно связанные с комплексообразователем, образуют вместе с ним внутреннюю (координационную) сферу комплекса.
Так, в комплексном катионе внутренняя сфера образована атомом комплексообразователя – меди(II) и молекулами аммиака, непосредственно с ним связанными.
Обозначается внутренняя сфера квадратными скобками:
В зависимости от соотношения суммарного заряда лигандов и комплексообразователя внутренняя сфера может иметь положительный заряд, например, либо отрицательный, например, или нулевой заряд, например, как для
При растворении в воде комплексные соединения необратимо диссоциируют на ионы:
Кислоты с комплексными анионами в водном растворе подвергаются необратимому протолизу :
в котором реализуется четверная связь Re – Re: одна σ-связь, две π- связи и одна δ-связь. Особенно большое число кластерных комплексов насчитывается среди производных d-элементов.
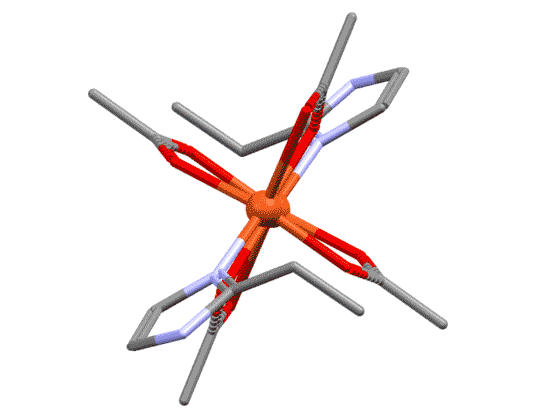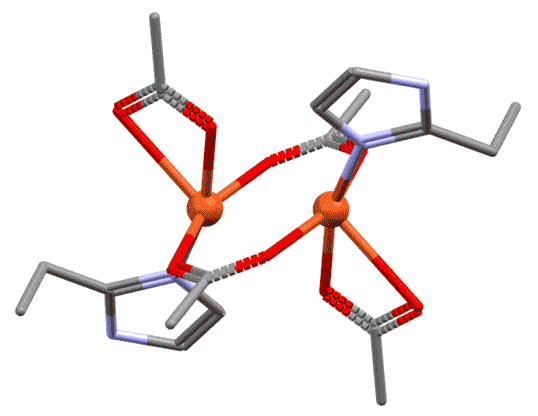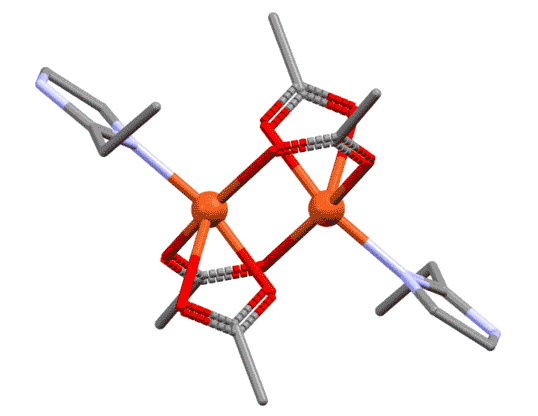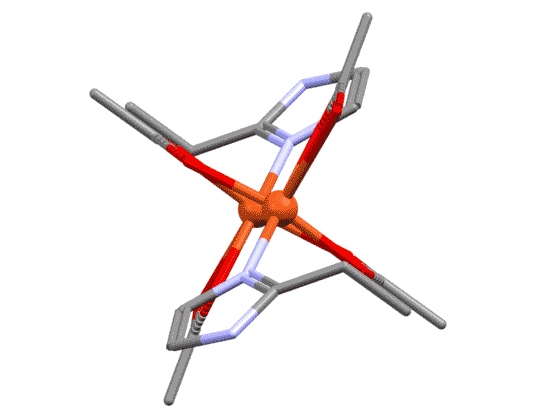
Многоядерные комплексы смешанного типа содержат как связь комплексообразователь–комплексообразователь, так и мостиковые лиганды.
Примером комплекса смешанного типа может служить карбонильный комплекс кобальта состава [Co 2 (CO) 8 ], имеющий следующее строение:
Здесь имеется одинарная связь Co – Co и два бидентатных карбонильных лиганда CO, осуществляющих мостиковое соединение атомов-комплексообразователей.
Что такое бидентатные лиганды
Более сложные лиганды: дентатность и хелатирование
Особенно интересен и важен случай, когда при образовании комплекса координационные центры полидентатного лиганда связываются с одним металлом – образуется циклический комплекс. Такие комплексы принято называть хелатами, опять с помощью аллюзии из мира животных, но в этом случае каждый координационный центр сравнивают с клешней рака или краба, приписывая этим существам привычку хвататься за пищу сразу обеими клешнями. Ну нет у них такой привычки – отлично справляются и одной клешней, но координационным химикам если уж что приснится, то спорить бесполезно.
Самые желанные циклы вроде бы такие же, как и в органической химии – пяти и шестичленные, именно с расчетом на такие циклы проектировали большинство хелатирующих лигандов. Почему 5- или 6-членные? – вовсе не потому, что они якобы самые устойчивые, а потому, что это компромисс, золотая середина, между энергией и энтропией. Для образования меньших циклов приходится сгибать связи за пределы нормальных валентных углов, а это невыгодно (энергия), а для больших циклов быстро уменьшается вероятность образования цикла – чем длиннее цепь, связывающая центры, тем реже сближаются реакционные центры. Тем больше степеней свободы теряет лиганд при связывании в цикл, а это отрицательный вклад в энтропию, и чем больше степеней свободы потеряно, тем больший.
Но – и это очень важно – в органической химии превосходство 5 и 6-членных циклов выражено очень явно и бесспорно; уже 7-членные циклы хоть и получаются в тех же реакциях, но выходы редко превышают 20-30%, а у больших циклов и 1-2% часто считаются прекрасным результатом. С другой стороны 4-членный цикл даже ещё более ненавистен: большинство реакций, ведущих к образованию такого цикла, имеют фотохимическую природу – в возбуждённом состоянии молекулы, как и другие объекты Природы, часто ведут себя довольно странно, хватаются за что ни попадя, часто пренебрегая и напряжением, и стерикой, и обычными для себя невозбуждённых свойствами и реакционной способностью.
Но в комплексообразовании немного другие закономерности, из-за чего золотое правило циклизации – пять или шесть – оказывается не таким однозначным. Это связано и с иной стереохимией переходных металлов и наличием у них более разнообразных стереохимических конфигураций, и с гораздо большей пространственной протяжённостью d-орбиталей, что позволяет связям образовываться при гораздо больших межатомных расстояниях. Кроме того, в хелатировании комплексов переходных металлов при образовании хелатного цикла связи металл-лигандный центр образуются не одномоментно, а последовательно, и связываемая гибкая молекула лиганда теряет много степеней свободы не сразу, а понемногу на каждой стадии.
Поэтому образование больших хелатных циклов, и семи- и восьмичленных, и ещё больших гораздо более распространено. На таких хелатах строится современный дизайн катализаторов, и мы это увидим, когда доберёмся до конкретных методов. Можно даже сказать так: обычные хелаты (5 и 6-членные) обычно играют чисто вспомогательную, служебную роль (стабилизируют металл в нужной степени окисления, защищают координационную сферу от непрошенных гостей, повышают растворимость комплексов и т.п.). В то же время, у необычных хелатов чаще бывает более существенная роль, они настраивают механизм каталитической реакции, определяют селективность и реакционную способность, делают возможным то, что было без них невозможно. Увидим много таких примеров.
Бывают и малые хелатные кольца – четырёхчленные, и нередко. И у них тоже своя роль.
А вот с трёхчленными циклами проблема. Нарисовать такие легко, но при определении того, как реально связан такой лиганд с металлом возникает вопрос, два ли там лигандных центра, или один дигапто-типа (об этом ниже). Вернёмся к этой проблеме, когда разберёмся с гапто-лигандами.
Определение структурного типа комплекса, и других параметров для хелатных комплексов делают точно так же, как для обычных. 
Каждый координационный центр считают отдельно, определяют типы лигандов, а дальше все как обычно. Хелатных циклов может быть несколько. Самый, наверное, знаменитый из хелатирующих лигандов – этилендиаминтетраацетат (ЭДТА, комплексон III, трилон Б) образует до пяти пятичленных хелатных циклов на одном металле, но никаких проблем в определении координационного окружения металла и всех его параметров нет.
Шестичленные хелатные циклы, например, образуют очень широко распространенные лиганды – дикетонаты. С самым распространенным дикетонатом – ацетилацетонатом (сокращается смешно: acac) знакомы все. Комплекс образуется енольной формой, один кислород поэтому связан как X-лиганд, второй как L-лиганд.
Хелатные циклы бывают и других размеров, и четырех, и семичленные (больше совсем уже редко). Четырехчленный хелатный цикл очень часто образуют ионы карбоновых кислот и карбонат-ион, но не только. Конечно, количество комплексов с четырёхчленным циклом на порядки меньше, чем 5- и 6-членных хелатов, но их нельзя считать экзотикой: четырёхчленный хелатный цикл довольно широко распространён, и легко образуется. Вполне понятно почему. На стереохимию переходных металлов нельзя просто так переносить закономерности стереохимии углерода и других неметаллов. У углерода нет стереохимических конфигураций с валентными углами близкими к 90 градусов, поэтому такой валентный угол для углерода невыгоден и ведёт к значительному угловому напряжению. Но у переходных металлов таких конфигураций очень много – это октаэдр и всё, что из него получается сокращением числа лигандов (пирамида, плоский квадрат, уголок), а значит, и никаких напряжений при образовании таких циклов нет.
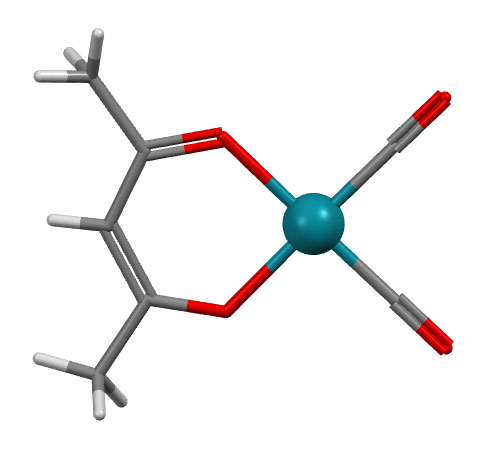
Бидентатные фосфины
Шестичленный хелатор бис(дифенилфосфино)пропан dppp несколько менее популярен. На типичной структуре хорошо видно, что хелатный цикл неплоский и имеет типичную конформацию кресла (точнее, полукресла, больше похожего на форму циклогексанона, чем самого циклогексана.
Бидентатные и полидентатные лиганды не обязательно образуют хелаты
Разглядывая этот двухядерный комплекс, мы можем поупражняться в обычных подсчётах электронов. Каждый атом металла ведёт себя как независимый координационный центр, и мы его оцениваем отдельно. В данном случае оба центра одинаковы, поэтому запишем для любого из них. Мостиковый лиганд мы оцениваем точно так же, как обычный хелатирующий – в данном случае у него два центра, один X-типа, другой L-типа. И если на одном атоме лиганд преоставляет оба типа, то в мостиковом варианте два таких лиганда как бы меняются ролями, уравнивая окружение у каждого атома. Если бы у нас был один мостиковый лиганд такого типа, то центры не смогли бы стать одинаковыми – один получил бы X-конец, второй – L. Слава всем заинтересованным богам, у нас их два. Получаем, что каждый атом меди имеет координационное число 5, степень окисления +2.
Мостиковые лиганды не обязательно являются бидентатными или полидентатными
Для того, чтобы служить мостиком, лиганд не обязательно должен быть настоящим би- или полидентатным. Но обязательно должен иметь минимум два места связывания с атомом металла. Это может быть всё, что угодно – переходные металлы исключительно изобретательны и иногда находят в самых незатейливых молекулах возможности, о которых те и не подозревали. Как минимум, это, например, две неподелённые пары, а это есть, например, у атомов галогенов или кислорода, и поэтому галогениды, вода, гидроксид, алкоксиды и прочее весьма неплохо играют роль мостиков в миллионах координационных соединений.
Когда мы рассматриваем такие комплексы, есть небольшая сложность в том, как учитывать мостиковые лиганды. Общая рекомендация проста – нужно внимательно относиться к валентным возможностям каждого. Фокус здесь в том, что по отношению к связанным мостиком металлу мостиковый лиганд симметричен, каждый металл видит его совершенно одинаково. Но для анализа структуры приходится формально разделить функции. Самый простой и распространённый случай, как в приведённом комплексе. Оба атома металла одинаковы, имеют один и тот же структурный тип. Хлоридный лиганд образует мостик, но до образования мостика он сидел на одном атоме металла хлоридом, то есть X-лигандом. При образовании мостика степень окисления не меняется, поэтому для второго атома металла он стал L-лигандом. Поскольку таких мостика два, второй мы учтём точно так же, но в другом порядке. Это и даст нам симметричное окружение металла. Если металлы в многоядерном комплексе одинаковы, достаточно указать общий структурный тип. Если разные, а так бывает очень часто, то каждый металл должен быть охарактеризован отдельно.
Разберитесь в структуре приведённых комплексов, определите тип лигандов, структурный тип, степень окисления и число d-электронов металла.