Что такое биоматериалы в медицине
Что такое биоматериалы в медицине
Биоматериалы
Костные трансплантаты это любые имплантируемые материалы, которые сами по себе или в комбинации с другими материалами способствуют формированию кости, обеспечивая локальную остеокондуктивную, остеоиндуктивную или остеогенную активность. Костные трансплантаты используются для активизации репаративного остеогенеза при травмах, формировании артро- и спондилодеза, замещении костных дефектов после резекции опухолей.
Остеогенные материалы (аутотрансплантаты и материалы, обогащённые культивируемыми аутогенными костными клетками) содержат живые клетки «хозяина», способные дифференцироваться в остеобласты. Остеокондуктивные материалы способствуют прикреплению, пролиферации и дифференцировке малодифференцированных клеток в остеобласты с последующим аппозиционным формированием кости на их поверхности (играют роль матрицы, на которой формируется кость). Остеоиндуктивные материалы содержат биологически активные вещества, индуцирующие клетки ложа реципиента (недифференцированные стволовые клетки мезенхимального происхождения или клетки предшественники остеобластов) дифференцироваться в остеобласты.
Любые костные трансплантаты должны обладать следующими свойствами:
Для успешного формирования кости также необходимо соблюдение 2-х важных требований – хорошая васкуляризация и механическая стабильность области имплантации.
Костные трансплантаты подразделяют на ауто-, алло-, ксенотрансплантаты, синтетические и композитные материалы.
Костный аутотрансплантат – это трансплантат кости из одной части тела человека в другое место того же человека. Костные аутотрансплантаты обычно забирают из подвздошной кости, а также из дистальной части бедренной или проксимального отдела большеберцовой кости. Аутогенная губчатая кость является «золотым стандартом» для костных трансплантатов, так как обладает тремя видами активности: неколлагеновые белки костного матрикса обеспечивают остеоиндуктивность, аутогенные костные клетки – остеогенную активность, коллаген и минералы кости – остеокондуктивность. Недостатками аутотрансплантатов являются: увеличение времени основной операции, возрастные ограничения (маленькие дети, люди старческого возраста), неудовлетворительные объём и форма аутотрансплантатов, развитие различных осложнений (до 20% случаев), гибель большинства остеогенных клеток трансплантатов сразу после имплантации.
Костный аллотрансплантат – трансплантат кости от одного человека другому. Костный ксенотрансплантат – трансплантат кости от одного вида животного другому или человеку. Костные алло- и ксенотрансплантаты обладают высокой механической прочностью (замороженные кортикальные трансплантаты), остеокондуктивными и слабыми остеоиндуктивными свойствами, выявляемыми лишь в замороженных и лиофилизированных аллотрансплантатах губчатой кости. Использование аллотрансплантатов в 60%-90% случаев способствует успешному восстановлению массивных костных дефектов. Недостатками костных алло- и ксенотрансплантатов являются: медленная остеоинтеграция, риск передачи от реципиента к донору различных заболеваний, возможность развития реакции гистонесовместимости и хронического гранулематозного воспаления, высокая стоимость аллокости, религиозные ограничения. С целью минимизации рисков алло- и ксенотрансплантаты подвергают интенсивной обработке, что значительно уменьшает остеоиндуктивные свойства и механическую прочность этих трансплантатов почти на 50%, хотя риск инфицирования реципиента всё-таки полностью не устраняется.
Деминерализованный костный матрикс, по сравнению с обычными костными аллотрансплантатами, отличается более выраженной остеоиндуктивностью, однако он не обладает структурной прочностью, а показатели остеоиндуктивности могут значительно варьировать – от физиологической до полного их отсутствия, что зависит от метода приготовления матрикса.
Из-за ограниченности наличия, иммунного отторжения и других проблем, связанных c использованием ауто-, алло-, и ксенотрансплантатов, всё чаще применяются различные имплантаты. Имплантат – это искусственный материал или устройство, хирургически помещённое в организм.
В настоящее время в качестве имплантатов в травматолого-ортопедической практике и стоматологии широко используется биокерамика. К последней относятся: оксид алюминия, двуокись циркония, окись титана, гидроксиапатит, трикальцийфосфат, биоактивные стёкла и стеклокерамика. В зависимости от типа реакции в организме биокерамику можно классифицировать на биоинертную, биоактивную и растворяющуюся в организме (резорбирующуюся).
Плотные, непористые, биоинертные керамические материалы, такие как Al2O3 и ZrO2, прикрепляются путём цементирования или путём впрессования в дефект (механическая фиксация). Если эти имплантаты имеют поры с диаметром более 100 мкм, может происходить врастание кости, что обеспечиваете её крепление к материалу (биологическая фиксация).
Ряд кальций-фосфатных материалов, таких как гидроксиапатит, трикальцийфосфат, некоторые составы силикатного стекла и стеклокерамики, относятся к биоактивным материалам, близким по своему составу костной ткани человека. Последние способствуют образованию на их поверхности кости и формированию с последней прочных химических связей (биоактивная фиксация). Эти биоактивные керамические материалы являются остеокондуктивной матрицей, вызывающей адгезию морфогенетических белков, клеток предшественников остеобластов, их пролиферацию и дифференцировку в остеобласты.
Композитный материал Коллапан состоит из синтетического наноструктурированного гидроксиапатита, коллагена и иммобилизованных антибиотиков. Патогистологическое исследование экспериментального и клинического материала показало, что имплантированный в дефекты кости Коллапан постепенно лизируется и замещается новообразованной костью. Во всех случаях отмечается интрамембранный остеогенез, то есть без образования хряща, с последующим формированием зрелой пластинчатой кости, в которой сохраняются остатки постепенно растворяющихся частиц гидроксиапатита.
Сравнительное экспериментально-морфологическое изучение Коллапана с другими кальцийфосфатными и коллагеновыми материалами (Ostim-100, ChronOs, Cerosorb, Коллост), применяемыми в клинике при замещении костных дефектов, выявило, что Коллапан обладает наиболее выраженными свойствами активизации репаративного остеогенеза. Являясь биоактивным материалом, Коллапан, по-видимому, способствует миграции и прикреплению к его поверхности стромальных стволовых клеток, их дифференцировке в остеобласты и последующему репаративному остеогенезу. Минерализация новообразованной кости происходит как за счёт физико-химической репреципитации высвобождаемого из Коллапана кальция и фосфора, так и за счёт остеобластов, прилежащих к Коллапану.
Биокомпозиционный материал Коллапан, является биосовместимой, постепенно резорбируемой и одновременно замещающейся новообразованной костью матрицей, обладающей антибактериальными, остеокондуктивными и остеоиндуктивными свойствами и оказывающий многофакторное влияние на процессы активизации репаративного остеогенеза:
Биокомпозиционный материал Коллапан является идеальным материалом в инжиниринге костной ткани при использовании в качестве матрицы с целью иммобилизации различных ростовых факторов и цитокинов, различных биологически активных веществ, клеточных элементов, способствующих активизации процессов репаративного остеогенеза. Коллапан также может использоваться при различных патологических процессах для иммобилизации и локальной пролонгированной доставки в очаг поражения различных лекарственных средств.
В последнее время в медицинскую практику ЦИТО (8 отделение, зав. отделением проф.Кесян Г.А.) вошло совместное использование Коллапана и PRP.
В своей работе они отметили, что имеющаяся в науке информация о регенерации костной ткани указывает на решающую роль факторов роста в успехе хирургических вмешательств. Американскими учеными был освещен механизм действия двух основных факторов роста: TGF-b и PDFG. А так же то, что увеличение концентрации этих факторов роста методом выделения и концентрирования тромбоцитов (т.е. получения PRP) является доступным и эффективным методом сокращения сроков регенерации кости. Использованный ими метод получения PRP непосредственно перед операцией полностью исключал риск развития аллергических реакций и переноса инфекционных заболеваний.
В их исследовании было показано, что PRP содержит высокие концентрации тромбоцитов и факторов роста, а также, что в аутогенной кости имеются клетки-мишени для факторов роста. Наконец, ими было продемонстрировано, что смешивание факторов роста с костным материалом позволяет получить качественно и количественно лучший результат по сравнению с отсутствием факторов роста.
Авторы так же отметили, что PDGF и TGF-b не являются единственными факторами роста, содержащимися в PRP или участвующими в процессе регенерации.
Приготовление обогащенной тромбоцитами плазмы (PRP – Platelet-Rich Plasma).
Накануне операции (за 2-4 часа) у больного производится аутозабор крови в количестве 420-450 мл. с последующим ее 2-х кратным центрифугированием в аппарате «Multifuge 4 KR» фирмы Termo Electron LED GmbH (Германия) в стерильных пробирках, в лаборатории переливания крови. Не всякая центрифуга пригодна для получения PRP. Идеальной для этой цели является автоматизированная установка двойного центрифугирования SmartPReP, в которой контейнер с кровью подвергается двукратному центрифугированию в обогащенной тромбоцитами плазмы.На первом этапе аутокровь центрифугируется при 2300 оборотах в мин. в течении 5 мин., происходит отделение эритроцитарной массы от плазмы. На втором этапе плазма крови центрифугируется при 4000 оборотах в течении 5 минут, затем отделяется надосадочная жидкость, в стерильном пакете остается обогащенная тромбоцитами аутоплазма в количестве 20-30 мл.
Биоматериал в лаборатории
Содержание
Один из важнейших объектов изучения — это биологический материал. Многие лаборатории, особенно медицинского профиля, ориентированы на исследования различного рода биоматериалов, источником которых является как живой организм, так и объекты окружающей среды. Помимо получения точных результатов бактериологических, вирусологических и других исследований, чрезвычайно важно соблюдение правил безопасности для защиты медицинских работников. Сбор, транспортировка и хранение биоматериалов в лаборатории строго контролируются.
Разновидности биоматериалов
Источники и виды биоматериалов можно представить в следующем виде:
Правила сбора и доставки
Существуют требования, которые необходимы для:
Во время сбора и транспорта биоматериалов в лаборатории необходимо:
Во избежание неточностей и ложных результатов, забор биоматериала проводят:
Перед сбором должны учитываться все риски и польза для больного, а также необходимость получения биоматериала.
Используемые приспособления
Для сбора и доставки проб используются соответствующие для каждого вида материала среды, емкости, наборы инструментов и реактивов, которые разрешены в РФ. Это необходимо из-за того, что разные микроорганизмы сохраняют жизнеспособность при определенных условиях, особенно, анаэробы. Большинство микробов, толерантных к кислороду, могут хорошо храниться в биотканях. Например, фузобактерии чувствительны к кислороду, но, если материал высеять за 2 — 3 ч после забора, то способ транспортировки не важен.
Примеры посуды для забора и доставления в лаборатории в зависимости от типа биоматериала:
Правила хранения
После сбора пробы немедленно или в кратчайшее время отправляются в специализированные лаборатории. Хранить материал необходимо строго при установленных температурах, в основном, в холодильниках (от 2 — 8 °C). Помимо этого, некоторые биоматериалы хранятся в емкостях с определенными средами при комнатных температурах (от 18 до 20 С). Среды, содержащие активированный уголь, около 2—3 суток сохраняют некоторые микроорганизмы. Для анаэробов нужно создать анабиотическую атмосферу, чтобы снизить их метаболизм и рост, не допустив высыхания и скопления продуктов жизнедеятельности. При вирусологических исследованиях нужны термостаты (с температурой 35 — 37 °C).
Применение
Изучение разных материалов используются в терапевтических, противоэпидемических и научно-исследовательских целях:
Четкий надзор за соблюдением всех этапов работы с разными биоматериалами исследования позволяет получать точные и надежные результаты с соблюдением безопасных условий труда.
Взятие биоматериала на исследование
Взятие биоматериала для исследования требует определенной подготовки. Чтобы анализы дали максимально достоверные результаты, надо соблюсти ряд правил. К примеру, мочу и кал в клинико-диагностическую лабораторию надо сдавать в специальных пластиковых контейнерах. А перед забором крови иногда рекомендуется не принимать пищу и не пить ничего, кроме воды.
Забор крови для проведения исследования
На результат анализа крови способны повлиять многие факторы, поэтому перед взятием биоматериала рекомендуется воздержаться от приема медицинских препаратов. Также зачастую советуют не употреблять даже пищу. Если предсказать влияние на организм медикаментов почти невозможно, то из-за всасывания компонентов пищи, после ее приема, гарантирует сдвиг уровня гормонов или лишает образец прозрачности.
Физические перегрузки перед анализом могут привести как к биохимическим, так и к гормональным изменениям, а алкоголь оказывает острое и хроническое воздействие на обмен веществ и его процессы. Влияние на результат может оказать также курение, менструальный цикл у женщин, получение физиотерапевтических процедур, время суток и так далее.
Рекомендации, которые надо учитывать при взятии биоматериала крови для анализа.
Сдавать анализ лучше всего в утреннее время до 10:00. Перед забором крови не есть около 8 часов, но не допускать более 14 часов отдыха кишечника. Пить можно в обычном режиме.
При приеме курса лекарственных препаратов следует проконсультироваться с врачом о необходимости проведения анализа именно в этот период. Или же узнать, можно ли прервать прием лекарств перед взятием биоматериала.
Как минимум, за день прекратить прием алкогольных напитков. От курения отказаться на час до забора крови.
На результаты анализа может оказать влияние физическая активность и эмоциональные перегрузки. Поэтому их тоже советуют исключить.
Взятие мочи для анализа
Цитобактериологическое исследование мочи — это простое исследование, позволяющее, в частности, распознать инфекции мочевыводящих путей и определить микроб.
Рекомендации по сбору.
Перед тем, как сдавать мочу на анализ не стоит употреблять в пищу фрукты и овощи, которые могут изменить цвет биоматериала. Взятие биоматериала происходит в специальный контейнер. Но, перед сбором мочи важно произвести гигиенические процедуры половых органов. Жидкость, полученная в первые секунды мочеиспускания сливается в унитаз. Затем, по возможности не прекращая мочеиспускания, собрать остальную мочу в специальный контейнер, который после надо плотно закрыть крышкой.
Сдать биоматериал желательно в день сбора. Если же этого по каким-либо причинам сделать не получается, то хранить мочу в при температуре от + 2 до + 8 °C.
Сбор суточной мочи происходит примерно также, но наполнять емкость биоматериалом необходимо в течение 24 часов. Хранить контейнер с мочой важно в холодильнике.
Исследование кала
О состоянии пищеварительного тракта человека могут рассказать его фекалии. Во время анализа этого биоматериала значение имеет: цвет, запах, твердость и даже масса. Чаще всего экскременты состоят преимущественно из воды, остатков пищи, бактерий и удаленных клеток слизистой оболочки. Цвет фекалии получает из-за разложившихся желчных пигментов.
Исследование кала необходимо, если в течение длительного периода времени возникают жалобы со стороны пищеварительного тракта. Например, спазмы, боль, диарея или запор. Анализ кала особо рекомендуется регулярно проводить людям в возрасте от 50 лет и старше. Чтобы при необходимости выявить рак на ранней стадии.
Условия сбора:
Соберите стул в специально отведенный контейнер;
Подпишите контейнер и проставьте дату.
Анализ стула позволяет диагностировать различные заболевания. Стул часто исследуют на наличие адъювантов крови в рамках скрининга колоректального рака или для раннего выявления предшественников рака. Однако анализ стула также может обнаружить присутствие в стуле яиц глистов или бактерий.
Как проводится спермограмма, или правила сбора биоматериала.
ВАЖНО: Взятый биоматериал должен быть сдан в клинико-диагностическую лабораторию «KDL клиника» не позднее 48 часов с момента сбора и не более 7 дней полового воздержания. В этот период запрещено употребление алкоголя и лекарств. Исключая жизненно важные медицинские препараты. Нельзя также посещать сауну, баню и подвергаться воздействию УВЧ.
Анализ начинают не позднее, чем через час после получения биоматериала.
Эякулят собирают в пластиковый контейнер. Запрещено собирать биоматериал в презерватив.
На таре для анализа обязательно указывается дата и время получения эякулята.
Если же материал не был успешно получен, то врач назначает немедленный анализ мочи.
Биоматериал
Резюме
Определение
Понятие биоматериалов многозначно, есть разные определения. В области биологии и медицины часто принимается следующее определение:
« Любой материал, природный или нет, составляющий всю или часть живой структуры или биомедицинского устройства, который выполняет или заменяет естественную функцию. «
В 1987 году Уильямс определил биоматериал как:
«Нежизнеспособный материал, используемый в медицинском устройстве, предназначенный для взаимодействия с биологическими системами». «
Приложения
Биоматериалы имеют несколько медицинских или парамедицинских применений, в том числе:
Несмотря на успехи в исследованиях, часто возникают проблемы с биосовместимостью, которые необходимо решить, прежде чем эти продукты можно будет продавать и использовать в клинических условиях. Вот почему к биоматериалам часто предъявляются те же требования, что и к новым лекарственным препаратам. Все компании, работающие в этой области, также должны соблюдать требования по отслеживанию всей своей продукции. Если будет обнаружено неисправное оборудование, будут проверены и другие устройства в том же диапазоне.
Выбор материалов для биоматериалов
Металлы и металлические сплавы
Керамика
Полимеры
В биоматериалах используется много полимерных материалов. Два основных направления использования этих материалов касаются:
Существует несколько проблем, связанных с применением полимеров в биомедицинском секторе, и не только из-за совместимости с организмом:
Полимеры, по природе своей молекулярной конструкции на основе повторов, являются кандидатами для разработки сложных постоянных или временных протезов или для замены существующих в настоящее время материалов в природе.
Материалы натурального происхождения
Исследователи также используют материалы природного происхождения для изготовления биоматериалов. Среди всех этих материалов наиболее распространены:
Заключение
В настоящее время на территории Франции работают несколько лабораторий, среди которых можно выделить:
Тканевая инженерия — окно в современную медицину
Тканевая инженерия — окно в современную медицину
В перспективе тканевая инженерия, если и не приведет к бессмертию, то уж точно сделает решение многих современных проблем медицины более чем реальным.
Автор
Редакторы
Статья на конкурс «био/мол/текст»: Петр I мечтал «прорубить окно в Европу», а ученые нашего времени — окно в современную медицину. Сочетание «медицина + биотехнология» нашло свое отражение в тканевой инженерии — технологии, открывающей возможность восстановления утраченных органов без трансплантации. Методы и результаты тканевой инженерии поражают: это получение живых (а не искусственных!) органов и тканей; регенерация тканей; печать кровеносных сосудов на 3D-принтере; использование «тающих» в организме хирургических шовных нитей и многое другое.
Конкурс «био/мол/текст»-2011
Эта статья представлена на конкурс научно-популярных работ «био/мол/текст»-2011 в номинации «Лучшая обзорная статья».
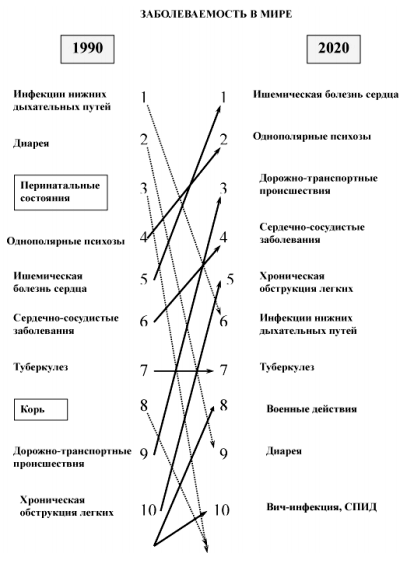
В последние десятилетия стали отчетливо проявляться тревожные тенденции старения населения, роста количества заболеваний и инвалидизации людей трудоспособного возраста, что настоятельно требует освоения и внедрения в клиническую практику новых, более эффективных и доступных методов восстановительного лечения больных. На рисунке 1 показано, как изменяется структура заболеваний в настоящее время.
Рисунок 1. Мировая динамика частоты заболеваний.
На сегодняшний день наука и техника предлагает несколько альтернативных путей восстановления или замены поврежденных или пораженных патологией тканей и органов:
В рамках данной статьи мы подробнее остановимся на возможностях и перспективах тканевой инженерии.
Тканевая инженерия — современная инновационная технология
Принципиально новый подход — клеточная и тканевая инженерия — является последним достижением в области молекулярной и клеточной биологии. Этот подход открыл широкие перспективы для создания эффективных биомедицинских технологий, с помощью которых становится возможным восстановление поврежденных тканей и органов и лечение ряда тяжелых метаболических заболеваний человека.
Цель тканевой инженерии — конструирование и выращивание вне организма человека живых, функциональных тканей или органов для последующей трансплантации пациенту с целью замены или стимуляции регенерации поврежденных органа или ткани. Иными словами, на месте дефекта должна быть восстановлена трехмерная структура ткани.
Важно отметить, что обычные имплантаты из инертных материалов могут устранить только физические и механические недостатки поврежденных тканей, — в отличие от тканей, полученных методом инженерии, которые восстанавливают, в том числе, и биологические (метаболические) функции. То есть, происходит регенерация ткани, а не простое замещение ее синтетическим материалом.
Однако для развития и совершенствования методов реконструктивной медицины на базе тканевой инженерии необходимо освоение новых высокофункциональных материалов. Эти материалы, применяемые для создания биоимплантатов, должны придавать тканеинженерным конструкциям характеристики, присущие живым тканям:
Клетки и матриксы — основа основ для тканевой инженерии
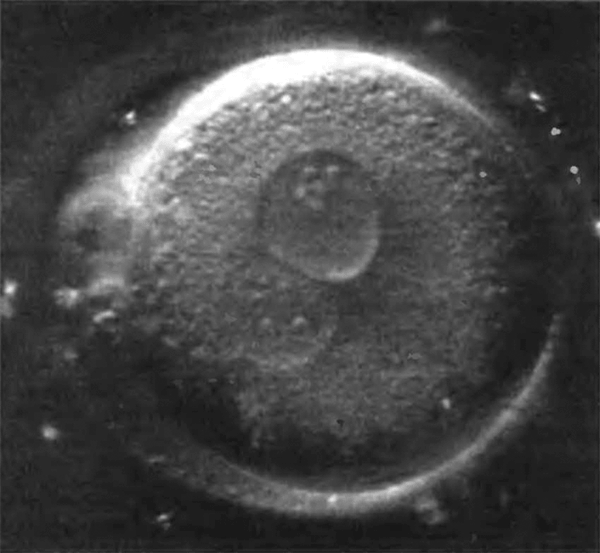
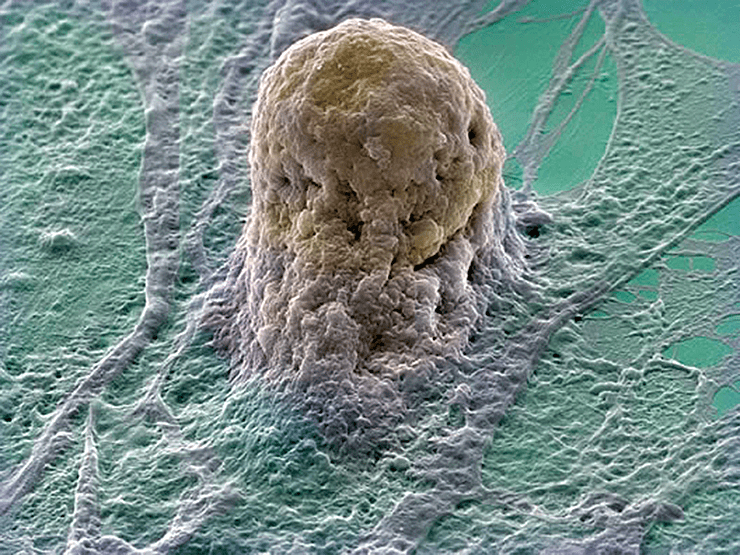
Наиболее важным элементом успеха является наличие необходимого количества функционально активных клеток, способных дифференцироваться, поддерживать соответствующий фенотип и выполнять конкретные биологические функции. Источником клеток могут быть ткани организма и внутренние органы. Возможно использование соответствующих клеток от пациента, нуждающегося в реконструктивной терапии, или от близкого родственника (аутогенных клеток). Могут быть использованы клетки различного происхождения, в том числе первичные (рис. 2) и стволовые клетки (рис. 3).
Рисунок 2. Первичная клетка человека.
библиотека Федерации Киокушинкай г. Южноуральска
Рисунок 3. Стволовая клетка человека.
Первичные клетки — это зрелые клетки определенной ткани, которые могут быть взяты непосредственно от организма-донора (ex vivo) хирургическим путем. Если первичные клетки взяты у определенного организма-донора, и впоследствии необходимо имплантировать эти клетки ему же в качестве реципиента, то вероятность отторжения имплантированной ткани исключается, поскольку присутствует максимально возможная иммунологическая совместимость первичных клеток и реципиента. Однако первичные клетки, как правило, не способны делиться — их потенциал к размножению и росту низок. При культивировании таких клеток in vitro (посредством тканевой инженерии) для некоторых типов клеток возможна дедифференцировка, то есть потеря специфических, индивидуальных свойств. Так, например, хондроциты, вводимые в культуру вне организма, часто продуцируют фиброзный, а не прозрачный хрящ.
Поскольку первичные клетки не способны делиться и могут потерять свои специфичные свойства, возникла необходимость альтернативных источников клеток для развития технологий клеточной инженерии. Таковой альтернативой стали стволовые клетки.
Рисунок 4. Биокерамические изделия из ортофосфатов кальция.
Стволовые клетки — недифференцированные клетки, которые имеют способность к делению, самообновлению и дифференцировке в различные типы специализированных клеток под воздействием конкретных биологических стимулов (см.: «Была клетка простая, стала стволовая» [3]). Стволовые клетки подразделяются на «взрослые» [2] и «эмбриональные». Эмбриональные стволовые клетки образуются из внутренней клеточной массы развития зародыша на ранней стадии, а взрослые — из тканей взрослого организма, пуповины или даже плодных тканей. Однако существует этическая проблема, связанная с неизбежным разрушением человеческого эмбриона при получении эмбриональных стволовых клеток [4]. Поэтому предпочтительнее «добыча» клеток из тканей взрослого организма. Так, например, в 2007 году Шинью Яманакой (Shinya Yamanaka) из Киотского университета Японии были открыты индуцированные плюрипотентные стволовые клетки (ИПСК), получаемые из покровных тканей человека (в основном, из кожи). ИПСК открывают поистине невиданные возможности для регенеративной медицины, хотя, прежде чем они всерьез войдут в медицинскую практику, предстоит решить еще немало проблем (см.: «Снежный ком проблем с плюрипотентностью» [5]).
Для направления организации, поддержания роста и дифференцировки клеток в процессе реконструкции поврежденной ткани необходим специальный носитель клеток — матрикс, представляющий из себя трехмерную сеть, похожую на губку или пемзу (рис. 4). Для их создания применяют биологически инертные синтетические материалы, материалы на основе природных полимеров (хитозан, альгинат, коллаген) и биокомпозиты. Так, например, эквиваленты костной ткани получают путем направленной дифференцировки стволовых клеток костного мозга, пуповинной крови или жировой ткани в остеобласты, которые затем наносят на различные материалы, поддерживающие их деление (например, донорскую кость, коллагеновые матрицы и др.).
«Фирменная» стратегия тканевой инженерии
На сегодняшний день одна из стратегий тканевой инженерии такова:
Матриксы через некоторое время после имплантации в организм хозяина полностью исчезают (в зависимости от скорости роста ткани), а в месте дефекта останется только новая ткань. Также возможно внедрение матрикса с уже частично сформированной новой тканью («биокомпозит»). Безусловно, после имплантации тканеинженерная конструкция должна сохранить свои структуру и функции в течение периода времени, достаточного для восстановления нормально функционирующей ткани в месте дефекта, и интегрироваться с окружающими тканями. Но, к сожалению, идеальные матриксы, удовлетворяющие всем необходимым условиям, пока не созданы.
Кровеносные сосуды из принтера
Перспективные тканеинженерные технологии открыли возможность лабораторного создания живых тканей и органов, но перед созданием сложных органов наука пока бессильна. Однако сравнительно недавно ученые под руководством доктора Гунтера Товара (Gunter Tovar) из Общества Фраунгофера в Германии сделали огромнейший прорыв в сфере тканевой инженерии — они разработали технологию создания кровеносных сосудов. А ведь казалось, что капиллярные структуры создать искусственно невозможно, поскольку они должны быть гибкими, эластичными, малой формы и при этом взаимодействовать с естественными тканями. Как ни странно, но на помощь пришли производственные технологии — метод быстрого прототипирования (другими словами, 3D-печать). Подразумевается, что сложная трехмерная модель (в нашем случае кровеносный сосуд) печатается на трехмерном струйном принтере с использованием специальных «чернил» (рис. 5).
Рисунок 5. Технология «печати» искусственного кровеносного сосуда.
Принтер наносит материал послойно, и в определенных местах слои соединяются химически. Однако заметим, что для мельчайших капилляров трехмерные принтеры пока недостаточно точны. В связи с этим был применен метод многофотонной полимеризации, используемый в полимерной промышленности. Короткие интенсивные лазерные импульсы, обрабатывающие материал, так сильно возбуждают молекулы, что они взаимодействуют друг с другом, соединяясь в длинные цепочки. Таким образом, материал полимеризуется и становится твердым, но эластичным, как естественные материалы. Эти реакции настолько управляемы, что с их помощью можно создавать мельчайшие структуры по трехмерному «чертежу».
А для того, чтобы созданные кровеносные сосуды могли состыковаться с клетками организма, при изготовлении сосудов в них интегрируют модифицированные биологические структуры (например, гепарин) и «якорные» белки. На следующем этапе в системе созданных «трубочек» закрепляются клетки эндотелия (однослойный пласт плоских клеток, выстилающий внутреннюю поверхность кровеносных сосудов) — для того, чтобы компоненты крови не приклеивались к стенкам сосудистой системы, а свободно транспортировались по ней.
Однако прежде чем действительно можно будет имплантировать выращенные в лаборатории органы с собственными кровеносными сосудами, пройдет еще какое-то время.
Давай, Россия, давай вперед!
Без ложной скромности скажем, что и в России создана научная основа для практического применения биомедицинских материалов нового поколения. Интересную разработку предложила молодой учёный из Красноярска Екатерина Игоревна Шишацкая (рис. 6) — растворимый биосовместимый полимер биопластотан [7]. Суть своей разработки она объясняет просто: «в настоящее время практические медики испытывают большой дефицит материалов, способных заменить сегменты человеческого организма. Нам удалось синтезировать уникальный материал, который в состоянии заменить элементы органов и тканей человека». Разработка Екатерины Игоревны найдет применение, прежде всего, в хирургии. «Самое простое — это, например, шовные нити, сделанные из нашего полимера, которые растворяются после того, как зарастает рана, — говорит Шишацкая. — Также можно делать специальные вставки в сосуды — стенты. Это маленькие полые трубки, которые используют, чтобы расширить сосуд. Через некоторое время после операции сосуд восстанавливается, а полимерный заменитель растворяется» [8].
Рисунок 6. Лауреат премии Президента РФ Екатерина Игоревна Шишацкая.
Первый опыт трансплантации тканеинженерной конструкции в клинике
Рисунок 7. Паоло Маккиарини, мастер-класс которого «Клеточные технологии для тканевой инженерии и выращивания органов» прошел в Москве в 2010 году.
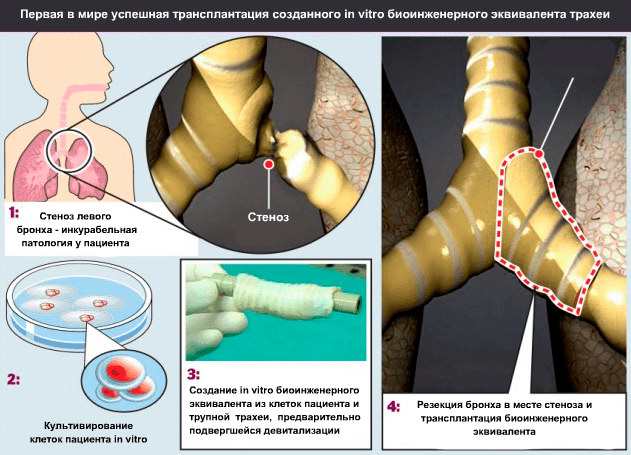
Осенью 2008 года руководитель клиники Университета Барселоны (Испания) и Медицинской школы Ганновера (Германия) профессор Паоло Маккиарини (Paolo Macchiarini; рис. 7) провел первую успешную операцию по трансплантации биоинженерного эквивалента трахеи пациентке со стенозом главного левого бронха на протяжении 3 см (рис. 8) [11].
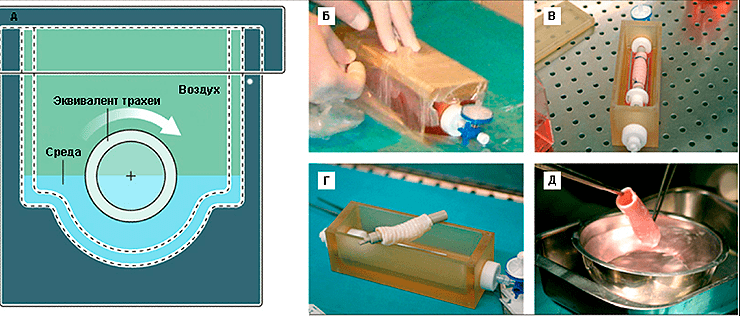
В качестве матрикса будущего трансплантата был взят сегмент трупной трахеи длиной 7 см. Чтобы получить природную матрицу, по свойствам превосходящую все то, что можно сделать из полимерных трубок, трахею очистили от окружающей соединительной ткани, клеток донора и антигенов гистосовместимости. Очищение заключалось в 25 циклах девитализации с применением 4%-деоксихолата натрия и дезоксирибонуклеазы I (процесс занял 6 недель). После каждого цикла девитализации проводили гистологическое исследование ткани для выявления количества оставшихся ядросодержащих клеток, а также иммуногистохимическое исследование на наличие в ткани антигенов гистосовместимости HLA-ABC, HLA-DR, HLA-DP и HLA-DQ. Благодаря биореактору собственной разработки (рис. 9) ученые на поверхность медленно вращающегося отрезка трахеи равномерно нанесли шприцем суспензию клеток. Затем трансплантат, наполовину погруженный в среду для культивирования, вращался вокруг своей оси с целью попеременного контакта клеток со средой и воздухом.
Рисунок 8. Операция по пересадке пациентке трахеи.
Рисунок 9. Биореактор для создания тканеинженерного эквивалента трахеи. А — схема биореактора, вид с боку. Б — герметизация биореактора. В — биореактор с тканеинженерным эквивалентом трахеи in situ. Г — биореактор после удаления эквивалента трахеи. Д — вид эквивалента трахеи непосредственно перед операцией.
Эквивалент трахеи находился в биореакторе 96 часов; затем его трансплантировали пациентке. При операции был полностью удален главный левый бронх и участок трахеи, к которому он примыкал. В образовавшийся промежуток вшили трансплантат, а некоторое несоответствие диаметров просветов тканеинженерного эквивалента и бронха реципиента было преодолено благодаря эластичности донорской ткани.
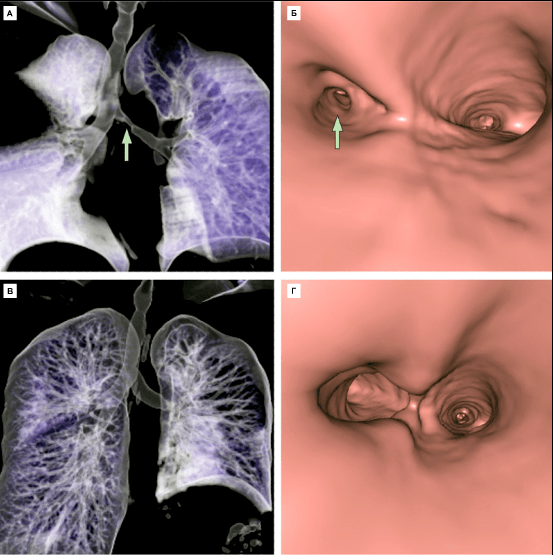
По истечении десяти суток после операции пациентка была выписана из клиники без признаков дыхательной недостаточности и иммунной реакции отторжения трансплантата. По данным компьютерной томографии, с помощью которых была сделана виртуальная 3D реконструкция дыхательных путей, тканеинженерный эквивалент был практически неотличим от собственных бронхов пациентки (рис. 10).
Рисунок 10. Виртуальная 3D-реконструкция дыхательных путей по данным компьютерной томографии и бронхоскопии перед операцией (А, Б) и через 1 месяц и после замены стенозного участка левого главного бронха тканеинженерным эквивалентом (В, Г). Стрелкой указан стеноз.