Что такое браф мутация
Мутация гена BRAF при меланоме
Частота и виды мутаций в гене BRAF
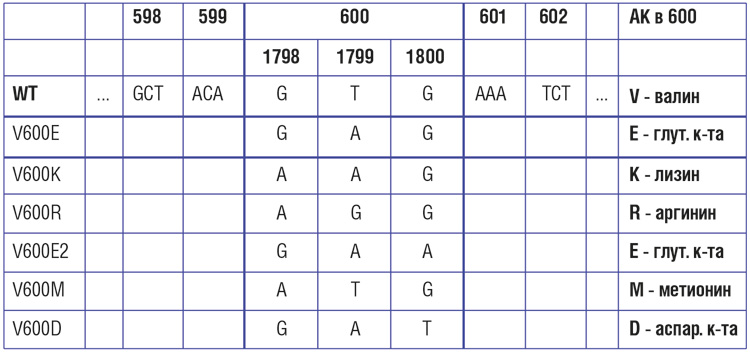
Частота мутаций в гене BRAF при меланоме кожи, по данным разных исследователей, варьирует от 30-40% до 70%. Наиболее распространенной (69-94% случаев) разновидностью BRAF-мутаций является V600E – замена валина на глутамин в 600-м кодоне. Эта мутация представляется доминирующей, но далеко не единственной разновидностью нарушений BRAF [14, 15]. Второй по частоте является мутация V600К – ее частота может достигать 5-10%. Мутации V600D и V600R встречаются значительно реже.
Cтатус мутации гена BRAF и выбор тактики лечения
За последние годы достигнуты значительные успехи в изучении патогенетических основ развития меланомы и сделан огромный шаг к выявлению новых потенциальных молекулярных мишеней. Открытие молекулярной мишени BRAF и понимание ее роли в патогенезе меланомы легли в основу разработки нового класса препаратов – низкомолекулярных ингибиторов мутированного фермента BRAF. Использование этих препаратов позволяет блокировать патологически активированный сигнальный каскад, который запускается мутацией BRAF V600, и, таким образом, тормозить развитие опухоли. Следует особо отметить, что воздействие данной группы препаратов на опухолевые клетки с нормальной последовательностью BRAF, напротив, может сопровождаться патологической активацией каскада RAS-RAF-MEK-ERK и провоцировать рост меланомы. Этот феномен свидетельствует об исключительной важности достоверной диагностики статуса гена BRAF.
BRAF ингибиторы не должны использоваться в тех случаях, когда статус мутации BRAF не определен или мутация не обнаружена!
Следует подчеркнуть, что ингибиторы BRAF и MEK зарегистрированы к применению только для терапии метастатической формы меланомы. В настоящее время отсутствуют данные по использованию ингибиторов BRAF и MEK в адъювантном режиме, поэтому они не могут быть рекомендованы пациентам, перенесшим (условно-)радикальное удаление первичной меланомы и метастических очагов.
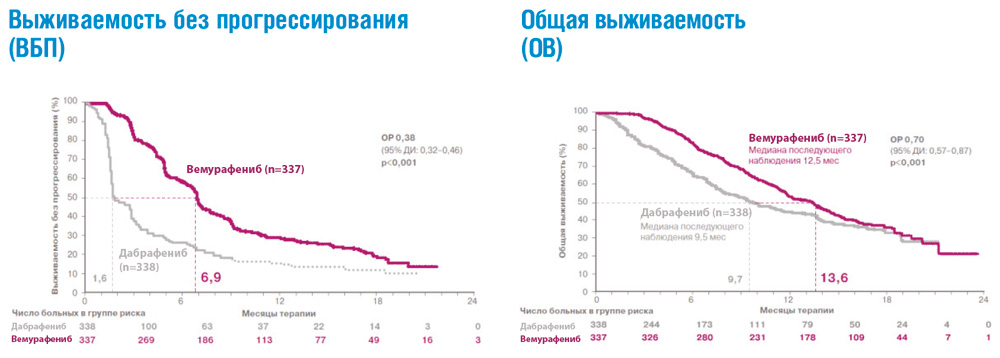
В рандомизированных клинических исследованиях ингибиторы BRAF – вемурафениб и дабрафениб – продемонстрировали значительное преимущество по сравнению со стандартной химиотерапией в отношении частоты объективных ответов, продолжительности жизни без прогрессирования и общей продолжительности жизни у пациентов с метастатической меланомой и подтвержденной мутацией гена BRAF, ранее не получавших системного лечения (см. рис. 2). Полученные результаты привели к пересмотру международных клинических рекомендаций, которые включили эти препараты в современные стандарты лечения метастатической меланомы кожи с BRAF мутацией.
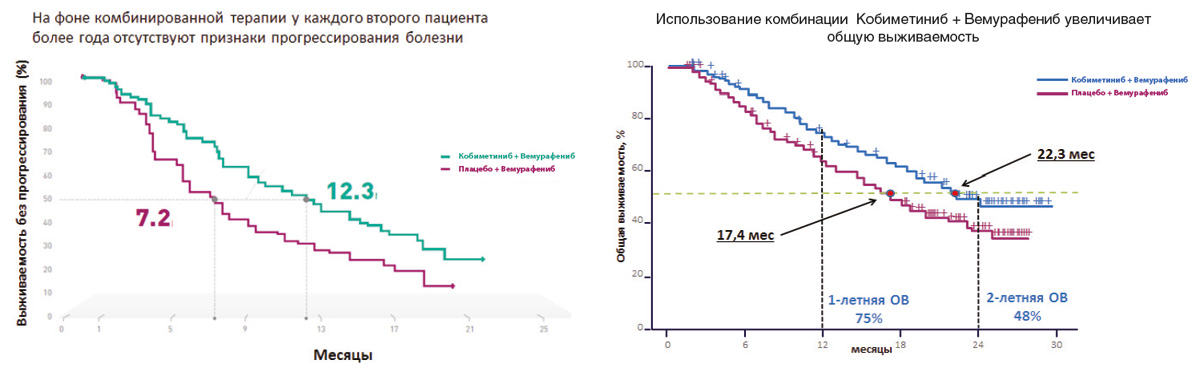
Результаты последних исследований показали, что двойное ингибирование сигнального пути MAРK, которое достигается при одновременном использовании ингибиторов BRAF и MEK, обладает более высокой эффективностью по сравнению с ингибитором BRAF в монорежиме. Важно отметить, что помимо более высокой эффективности комбинация препаратов снижает вероятность развития резистентности к проводимой терапии и отдельных нежелательных явлений, в том числе плоскоклеточного рака кожи. В рамках клинического исследования coBRIM было подтверждено, что комбинированная терапия с использованием препаратов вемурафениб и кобиметиниб в 90% случаев позволяет достичь ответа на терапию у больных BRAF+ метастатической меланомой. У каждого второго пациента более года отсутствовали признаки прогрессирования заболевания, а общая выживаемость приближалась к 2 годам (рис. 3).
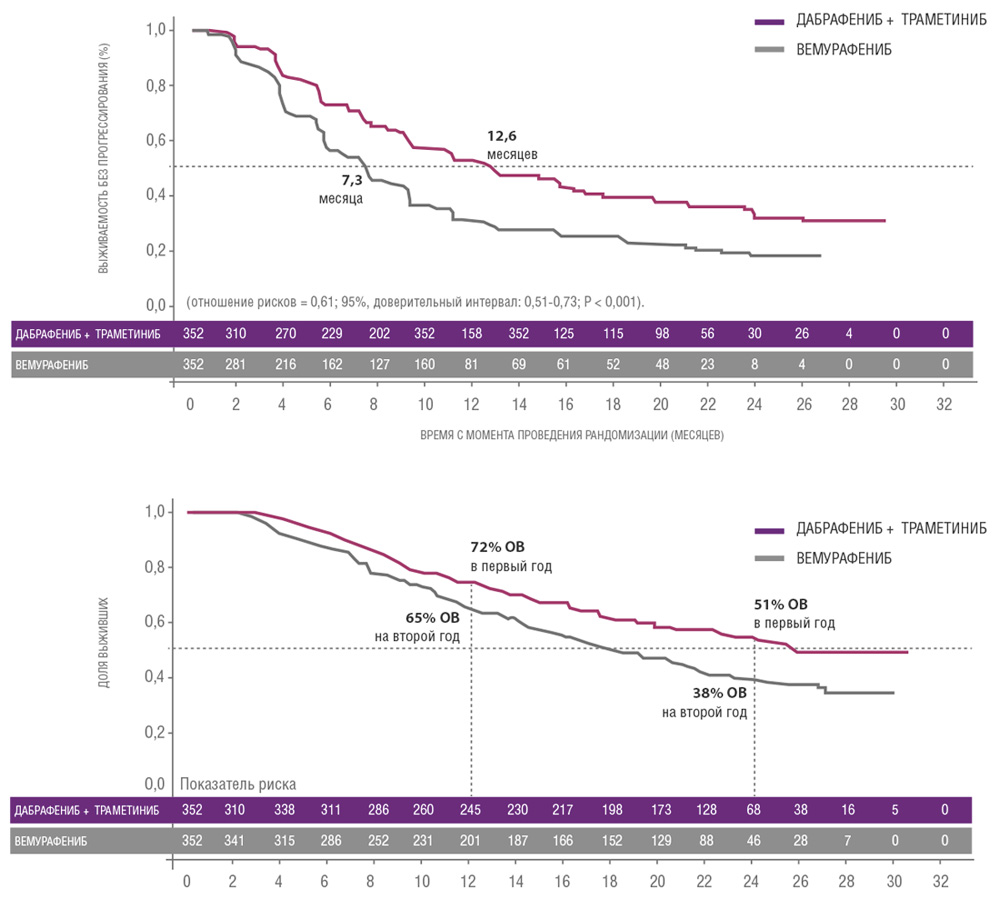
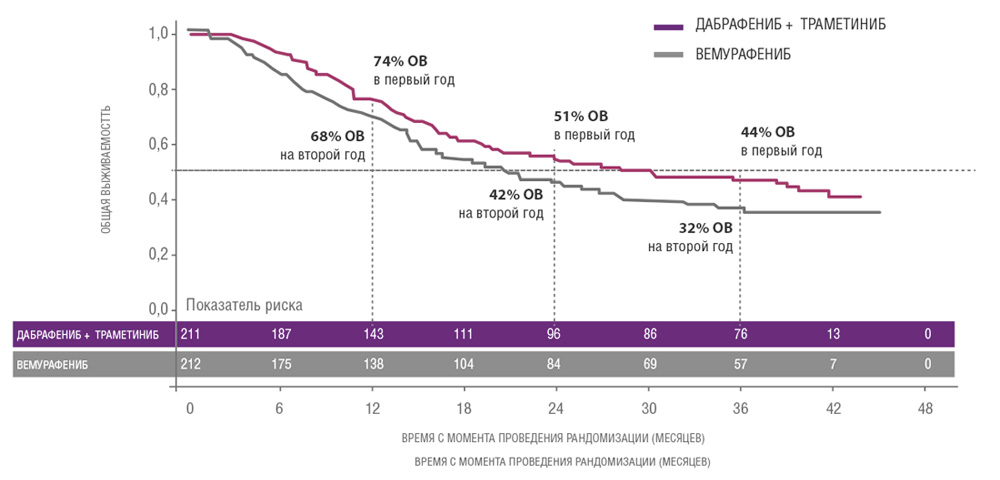
Сходные результаты были продемонстрированы в исследованиях дабрафениба и траметиниба. В частности, исследование COMBI-V (дабрафениб+траметиниб vs монотерапия вемурафенибом) продемонстрировало значимой увеличение общей продолжительности жизни у пациентов, получавших комбинированную терапию, по сравнению с применением вемурафениба без ингибитора MEK (25.6 мес. vs 18 мес.; рис. 4, табл. 1). В клиническом испытании COMBI-D сравнивалась эффективность комбинации дабрафениб+траметиниб по отношению к монотерапии дабрафенибом в сочетании с плацебо. Примечательно, что в этом исследовании были зарегистрированы практические идентичные показатели общей продолжительности жизни (25.1 мес. vs 18.7 мес.; рис. 5, табл. 1).
Определение статуса гена BRAF является обязательным компонентом выработки тактики лечения всех пациентов с неоперабельной/метастатической меланомой кожи.
Рисунок 2. Результаты рандомизированного исследования BRIM-3: сравнение эффективности вемурафениба и дабрафениба в 1-й линии терапии метастатической меланомы с мутацией BRAF.
Рисунок 3. Результаты рандомизированного исследования coBRIM: сравнение эффективности комбинации кобиметиниба+вемурафениба и вемурафениба+плацебо в 1-й линии терапии метастатической меланомы с мутацией BRAF.
Рисунок 4. Результаты клинического исследования COMBI-V: (дабрафениб+траметиниб vs монотерапия вемурафенибом).
Рисунок 5. Результаты клинического испытания COMBI-D: эффективность комбинации дабрафениб+траметиниб по отношению к монотерапии дабрафенибом в сочетании с плацебо.
Сводные данные по всем исследованиям представлены в таблице 1.
| Исследование | COMBI-d | COMBI-v | ||
|---|---|---|---|---|
| Препарат(ы) | Д + T | Д + пла | Д + T | В |
| Кол-во пациентов, n | 211 | 212 | 352 | 352 |
| Медиана ВБП, мес. | 11,0 | 8,8 | 12,6 | 7,3 |
| Медиана ОВ, мес. | 25,1 | 18,7 | 25,6 | 18,0 |
| Медиана ОВ, ЛДГ≤ВГН | Нет анализа | НД | 21,5 | |
| Медиана ОВ, ЛДГ>ВГН | 10,8 | 8,9 | ||
Сокращения: В – вемурафениб, К – кобиметиниб, Д – дабрафениб, Т- траметиниб, пла – плацебо, НД – не достигнута, ВГН – верхняя граница нормы.
Таким образом, использование BRAF/MEK ингибиторов у пациентов с мМК, имеющей BRAF мутацию, представляет первый успешный пример персонализированной терапии, изменившей представление о мМК как об опухоли, рефрактерной к лекарственному лечению. Эти препараты пришли на смену химиотерапии и стали новым стандартом лечения меланомы с BRAF мутацией, что подтверждает ранее сформулированный постулат о необходимости разработки различных подходов к лечению для различных молекулярно-генетических подтипов меланомы. Появляются результаты исследований таргетных препаратов и при других типах меланомы, имеющих альтернативные мутации (NRAS, cKIT). Можно ожидать, что определение молекулярно-генетического портрета опухоли уже в ближайшее время станет неотъемлимой частью разработки стратегии лечения каждого пациента, имеющего диагноз «меланома».
На сегодняшний день все существующие BRAF и MEK ингибиторы зарегистрированы на территории Российской Федерации и, при соответствующем лекарственном обеспечении, с успехом могут быть использованы для терапии мМК. Профиль безопасности этих препаратов позволяет использовать их в амбулаторных условиях.
Для того, чтобы отправить материал на диагностику, вы должны быть зарегистрированным пользователем. Если у вас уже есть логин и пароль, то повторная регистрация не требуется.
Если вы новый пользователь, пожалуйста, пройдите процедуру регистрации.
BRAF, c-Kit, и NRAS мутации меланомы
Дата создания: Октябрь 26, 2017
Дата изменения: Ноябрь 16, 2017
Виды мутаций меланомы
Меланома (рак кожи) — злокачественное новообразование, характеризующееся быстрым течением заболевания, часто возникающими рецидивами и способностью метастазировать почти во все органы. Поэтому ранняя диагностика, адекватная и своевременная терапия в клиниках, специализирующихся на лечении онкологических заболеваний, — необходимое условие на пути к излечению.
В число обязательных обследований в нашей клинике входит анализ на наличие в меланоме различных мутаций. Определение наличия мутации и ее вида очень важно: оно дает представление о механизме развития злокачественных процессов в клетке и предоставляет возможность подобрать препараты, наиболее действенные в лечении меланомы с конкретной мутацией (таргентная терапия).
Выделяют три наиболее часто встречающиеся мутации:
Мутация BRAF
Этот тип мутации обнаруживается наиболее часто: у 40–70% больных раком кожи. Патологические изменения связаны с геном BRAF, ответственным за один из сигнальных путей в клетках. В нормальном состоянии этот путь неактивен. При возникновении мутации ген BRAF начинает вырабатывать особый белок, который провоцирует рост клеток и появление новообразований.
Меланомы с обнаруженной мутацией BRAF называются BRAF-позитивными. Выявление мутации положительно влияет на прогноз лечения — для терапии BRAF-позитивных меланом разработаны специальные препараты, которые блокируют мутирующий ген. Важно помнить, что чем ранее выполнено исследование и чем точнее определена степень мутации, тем больше шансов на благоприятный исход.
Мутация c-Kit
Этот вид мутации не так распространен: чаще всего указывается диапазон от 6 до 15% случаев выявления патологического изменения гена. Наиболее часто c-Kit-мутация определяется в меланомах, расположенных на ладонях, ногтях, а также на слизистых оболочках^ половых органов, прямой кишки, носовых ходов и носоглотки. Меланома c-Kit может сочетаться с BRAF-мутацией. При положительном результате исследования назначаются препараты-ингибиторы c-Kit, ответ на терапию отмечается в 30% случаев.
Мутация NRAS
Мутация NRAS определяется в 15–25 % случаев. Очень редко может присутствовать в комплексе с другими мутациями. Выработка белка NRAS активизирует специфический (злокачественный) рост клетки, поэтому основная задача при обнаружении NRAS-мутации — блокировать выработку протеин-киназы. По препаратам, применяющимся в этом случае, еще ведутся клинические исследования, однако уже сегодня имеются обнадеживающие результаты: у 20% пациентов, получавших терапию соответствующими лекарствами, отмечено уменьшение развития опухоли.
Преимущества прохождения диагностики и лечения меланомы в Израиле
К нам за помощью обращаются пациенты из разных стран, и этому есть вполне обоснованные причины. Как уже говорилось выше, при меланоме (и других онкологических заболеваниях) очень важно вовремя диагностировать процесс и провести лечение при помощи как традиционных средств, так и современных препаратов, зачастую не применяющихся в других клиниках.
Мы предлагаем своим пациентам:
И, конечно же, при обращении в нашу клинику мы гарантируем доброжелательное отношение персонала, комфортные условия и создание психологического климата, помогающего в борьбе с болезнью.
Определение мутации в генах EGFR и V600 BRAF
Каждая клетка организма подчиняется определенным законом и выполняет отведенные ей функции. Работа клеток программируется генетическим кодом, молекулы и белки регулируют жизнь клеток, обеспечивая бесперебойное функционирование организма. Однако в любом механизме могут происходить поломки, и наши гены – не исключение. Сегодня мы расскажем о мутациях в генах EGFR и BRAF. Тестирование на эти мутации помогает онкологам назначать эффективное лечение пациентам со злокачественными новообразованиями.
Биологические функции гена EGFR?
Ключевое свойство любой опухоли — это нарушение баланса между клеточным делением, т.е. размножением клеток, и клеточной гибелью. Для того, чтобы процесс деления осуществлялся в норме, необходимо поступление верного сигнала в клеточное ядро. Подобным сигналом являются специальные белки – факторы роста. Например, фактором роста может выступать белок EGF (Epidermal Growth Factor ‒ перевод «эпидермальный фактор роста»). EGF и другие белки способны стимулировать рост и деление различных клеток.
Белок EGF взаимодействует с соответствующим рецептором на мембране (оболочке) клетки — EGFR (epidermal growth factor receptor). Белок подает «команду» рецептору, в результате внутри клеток запускается последовательность биохимических реакций и клетки начинают делиться. Рецептор EGFR кодируется геном EGFR. Если в гене EGFR есть мутация, то изменяется структура рецептора. Рецептору больше не нужно взаимодействовать с ростовым фактором, т.е. ему больше не нужна «команда» для активации. Вследствие этого в клетках с мутацией сигналы к делению передаются непрерывно, клетки начинают активно делиться и происходит рост опухоли, а также усиление процессов инвазии (прорастания в окружающие ткани), патологического ангиогенеза (образования новых сосудов в опухоли) и метастазирования.
Открытие мутаций в гене EGFR при раке легкого стало одним из важнейших событий в онкологии. Повышенное количество данного белка наблюдается при многих видах рака. С учетом этого факта ученые и медики разрабатывали ингибиторы – вещества, которые подавляют или задерживают течение физиологических или физико-химических процессов. Ожидалось, что эти препараты могут стать «универсальным лекарством против рака». Однако на практике у пациентов редко наблюдались объективные ответы на ингибитор EGFR гефитиниб, т.е. терапия редко оказывала ожидаемый эффект. При этом для малого количества пациентов лечение было эффективным. Врачи выяснили, что опухоли этих пациентов содержали в своём геноме ранее неизвестные мутации в гене EGFR.
Таким образом стало понятно, что именно мутированный белок EGFR является мишенью препарата, и что перед назначением молекулярных ингибиторов EGFR должно проводиться молекулярно-генетическое тестирование. Существует несколько вариантов мутаций EGFR, две из них встречаются наиболее часто – Del19 и L858R. Они встречаются в 15-20% немелкоклеточных неплоскоклеточных опухолей легкого, наиболее часто – в аденокарциномах.
В каких случаях нужно сделать тест на мутацию EGFR?
Тест на мутации в гене EGFR позволяет онкологу принять решение о назначении пациенту с местно-распространенным или метастатическим немелкоклеточным раком легкого терапии низкомолекулярными ингибиторами EGFR (гефитиниб, эрлотиниб, афатиниб, осимертиниб и т.д.). Тест целесообразно назначать только тем пациентам, у которых обнаружена аденокарцинома лёгкого или другая разновидность немелкоклеточного неплоскоклеточного рака. Помимо этого, EGFR-тестирование рекомендуется всем пациентам с местно-распространенным или метастатическим, плоскоклеточным раком лёгкого, которые либо являются женщинами, либо не имеют анамнеза длительного и/или интенсивного курения.
Что делать, если в опухоли лёгкого обнаружена мутация в гене EGFR?
Идентификация мутации в гене EGFR в опухоли является основанием для назначения низкомолекулярных ингибиторов EGFR (гефитиниб, эрлотиниб, афатиниб, осимертиниб). Положительный эффект от лечения наблюдается практически у каждого пациента с мутацией EGFR.
Биологические функции гена BRAF
Процесс деления клеток в норме происходит при поступлении верного сигнала в клеточное ядро. Подобным сигналом являются специальные белки – факторы роста. Они прикрепляются к определённым рецепторам на поверхности клеточной оболочки и запускают внутри клетки ряд последовательных биохимических реакций. Результатом становится производство и накопление внутри клетки белков, которые необходимы для дальнейшего деления.
Белок BRAF принимает участие в описанной выше сигнальной цепи EGFR. В норме BRAF активируется только при поступлении сигнала от расположенного «выше» по цепи белка. А мутации BRAF могут привести к автономной активации процесса деления клетки, т.е. клетки начинают размножаться без «команды» организма.
Наиболее частый тип мутации – это замена 600-ой по счету аминокислоты валин (V) в структуре белка на глутаминовую кислоту (E) (BRAF V600E).
Мутации BRAF встречаются при самых разных типах рака, чаще всего – при меланоме (40-60%), реже – при раке толстой кишки (5-10%), немелкоклеточном раке легкого (2-3%) и др. Помимо этого, генетические дефекты BRAF характерны для редкого онкогематологического заболевания – волосатоклеточного лейкоза (90-100%).
Открытие мутаций гена BRAF привело к созданию низкомолекулярных ингибиторов мутированного фермента BRAF (вемурафениб, дабрафениб). Эти препараты блокируют сигнальную цепочку, которую активирует мутация BRAF, и таким образом держивают рост опухоли.
В каких случаях нужно сделать тест на мутацию V600 BRAF?
Тестирование мутаций в гене BRAF необходимо для выбора тактики лечения при неоперабельной/метастатической меланоме кожи, распространенном немелкоклеточным раке легкого и раке толстой кишки. Присутствие мутации является необходимым условием для назначения ингибиторов BRAF (вемурафениб, дабрафениб). При раке толстой кишки наличие мутации BRAF свидетельствует о необходимости использования комбинации BRAF- и EGFR-ингибиторов.
В настоящее время определение мутаций V600 BRAF в биопсийном производится при диагнозах «меланома кожи и слизистых оболочек», «рак прямой кишки», «рак ободочной кишки и ректосигмоидного отдела», «волосатоклеточный лейкоз»
Как сдать анализ на мутации в гене EGFR и BRAF?
Материалом для молекулярно-генетического тестирования являются опухолевые клетки. В качестве источника опухолевых клеток можно использовать как биопсийный материал, так и опухоль, удалённую в ходе хирургической операции.
В ходе первичного обследования онкологическому пациенту практически всегда выполняют биопсию, на основании которой происходит патоморфологическое подтверждение диагноза. Для этого каждый биоптат проходит многоэтапную химическую обработку, в результате которой создаётся специальный парафиновый блок. С одной стороны, это необходимо для получения качественного тонкого среза (толщиной 5 мкм) с целью патоморфологической диагностики. С другой стороны, в правильно подготовленном парафиновом блоке молекулы ДНК надёжно сохраняются на протяжении десятилетий. Эти же процедуры выполняются в отношение опухолевых тканей, удалённых в ходе операции. Правильное выполнение процедуры фиксации позволяет использовать образцы опухолей для молекулярно-генетического исследования ДНК спустя месяцы и годы после заливки образца в парафин.
Идеальным набором для молекулярно-генетического исследования является следующий комплект: парафиновый блок c тканью опухоли и одно стекло, окрашенное гематоксилином и эозином (всё перечисленное хранится в патологоанатомических архивах медицинских учреждений, а окраска гематоксилином и эозином – основная окраска, используемая в современной патоморфологической диагностике). Если медицинское учреждение по какой-либо причине не может предоставить блоки, то для молекулярно-генетического тестирования достаточно 5-10 неокрашенных срезов ткани опухоли на непокрытых стёклах толщиной 3-5 мкм и одно стекло, окрашенное гематоксилином и эозином.
Кроме того, для молекулярно-генетического исследования пригодны опухолевые клетки, полученные в результате цитологического исследования (мазки, цитоспины, цитоблоки). Для проведения теста необходимо, чтобы в препарате присутствовало не менее 200 (!) опухолевых клеток. Тип окрашивания (по Папаниколау, Романовского-Гимза, Лейшмана, Май-Грюнвальд и т.д.) не влияет на сохранность нуклеиновых кислот.
Требования к упаковке материала перед транспортировкой
В настоящее время многие молекулярно-диагностические исследования выполняются за счет средств территориальных фондов ОМС регионов России
Авторская публикация:
Иванцов Александр Олегович
доктор медицинских наук, старший научный сотрудник научной лаборатории морфологии опухолей ФГБУ «НМИЦ онкологии им. Н.Н. Петрова» Минздрава России
Онкологическая клиника в Москве
+7(925)191-50-55
Анализ мутации гена BRAF
За последние десятилетия учеными был обнаружен ряд генетических мутаций, предрасполагающих к возникновению меланомных опухолей.
При этой онкопатологии, впрочем, как и при прочих заболеваниях подобного рода, перерождение здоровых клеток в раковые сопряжено с изменениями генов, ответственных за деление клеток, их пролиферацию и/или апоптоз (естественное самоуничтожение).
Как показывают наблюдения, для злокачественной трансформации необходимо в среднем от четырех до шести таких мутаций. Однако существуют гены, влияние которых на перечисленные процессы так велико, что одной-единственной мутации в них оказывается достаточно для злокачественного перерождения и дальнейшего поддержания роста опухолевого новообразования без внешних природных сигналов.
Один из этих генов – BRAF (серин/треонин-киназа), мутации в котором, согласно статистике, обнаруживаются приблизительно у 40-70% больных меланомой. BRAF входит в число протеинов, формирующих основной сигнальный путь, активирующий рост и отвечающий за сохранение клеточных элементов.
В норме с EGF-рецептором на поверхности клеточной мембраны взаимодействует специфический эпидермальный фактор роста, в результате чего происходит запуск определенного сигнала, передающегося, как известно, по цепочке белков (в т.ч. и по BRAF-гену) к ядру клетки.
Когда же BRAF-ген мутирует, он начинает передавать ростовой сигнал беспрерывно, вне зависимости от упомянутых внешних сигналов, что приводит к аномальному, неконтролируемому делению, размножению клеток и, следовательно, появлению опухолевых образований.
Диагностируют мутации гена BRAF путем постановки молекулярных проб: теста на мутации в структуре гена BRAF V600E, ПЦР в режиме RT (реального времени). Чтобы исследование на наличие мутации было достоверным, нужно свыше 20% злокачественно-перерожденных клеток.

Поэтому пациенту нужно взять в ней парафиновый блок с фрагментами новообразования и предоставить его на консультацию экспертам молекулярной лаборатории.
Кстати, следует отметить, что для данного исследования вполне подходит и первичная меланомная опухоль на кожных покровах, и ее метастатические очаги.
Для качественного выполнения молекулярного анализа на мутацию BRAF-гена обязательно требуется достаточное количество сохранного генетического материала. Таким образом, с одной стороны, крайне важно чтобы в гистологических лабораториях были соблюдены все правила обработки биоматериала, а с другой, чтобы в молекулярной лаборатории имелось высококачественные реактивы и оборудование, что даст возможность выявить мутации гена в наименьшем объеме исходного материала.
Меланомные опухоли, при которых у пациентов выявляется патологический BRAF-ген, принято называть BRAF-позитивными. По мнению специалистов очень важно сделать все необходимые анализы на определение указанной мутации у лиц с распространенными вариантами меланомы и в тех ситуациях, когда злокачественное новообразование не может быть адекватно удалено хирургическим путем.
Оценив статус мутации на этапе разработки индивидуальной лечебной тактики, доктора смогут назначить больному инновационные препараты, способные блокировать измененный ген и в значительной мере повысить эффективность лечения. Эти современные лекарственные средства, которые не так давно были разработаны и внедрены в мировую онкологическую практику, воздействуют на опухоль независимо от того, где она располагается. Их прием позволяет существенно увеличить продолжительность жизни больных с распространенными меланомами.
+7(925)191-50-55
г. Москва, Духовской переулок, 22б
+7(925)191-50-55 — европейские протоколы лечения в Москве
Современная терапия метастатической BRAFположительной меланомы
Меланома кожи – одна из наиболее злокачественных опухолей человека, характеризующаяся непредсказуемым и агрессивным течением. В рамках XI Съезда онкологов России, организованного Ассоциацией онкологов России, МНИОИ им. П.А. Герцена – филиалом ФГБУ «НМИЦ радиологии» Минздрава России и Ярославской областной клинической онкологической больницей при поддержке компании «РОШ», прозвучали доклады ведущих онкологов России, посвященные вопросам применения комбинации таргетных препаратов в терапии метастатической BRAF-положительной меланомы кожи.
Движение вперед – сегодня и завтра в лечении BRAF+ метастатической меланомы
Современные подходы к лечению меланомы кожи основаны на знании о молекулярно-генетических механизмах развития данного заболевания. Принципиально важное значение для прогноза и определения тактики ведения пациентов с меланомой имеет выявление мутации гена BRAF. Как известно, у пациентов с мутацией BRAF заболевание характеризуется более агрессивным течением, чем у BRAF-негативных больных. С 2015 г. в первой линии терапии у пациентов с метастатической или неоперабельной меланомой кожи с мутацией в гене BRAF успешно применяют комбинации ингибиторов протеинкиназы BRAF и MEK, в частности вемурафениба и кобиметиниба. Использование в первой линии терапии ингибиторов протеинкиназы BRAF и MEK позволяет внести серьезные коррективы в подходы к лечению BRAF-положительной (BRAF+) метастатической неоперабельной меланомы. По данным исследований, клиническая эффективность комбинации «кобиметиниб + вемурафениб» подтверждена примерно у 90% больных метастатической меланомой с мутацией BRAF V600 [1]. При этом полный ответ отмечен в 21% случаев, частичный ответ – в 49%, стабилизация заболевания – в 18% случаев. Результаты наблюдений продемонстрировали, что на фоне комбинации «кобиметиниб + вемурафениб» у пациентов частота объективного ответа (ЧОО) достигла 70%, контроль заболевания достигнут в 88% случаев.
Лишь у 7% больных зафиксировано прогрессирование заболевания. Большинство нежелательных явлений 3-й и более степени тяжести регистрируются в течение первых 28 дней терапии и, как правило, потом нивелируются [2]. Профиль пациента для назначения двойной комбинации «вемурафениб (Зелбораф®) + кобиметиниб (Котеллик®)» – пациенты с метастатической меланомой BRAF+ любого возраста в общем удовлетворительном состоянии (по шкале Eastern Cooperative Oncology Group (ECOG) 0–1 балл), с нормальными показателями лактатдегидроденазы (ЛДГ), средней опухолевой нагрузкой, отсутствием метастазов в головной мозг и печень, со стадией М1a/М1b. Допускается наличие у пациентов аутоиммунных заболеваний. Итак, комбинированную терапию вемурафенибом и кобиметинибом отличают быстрый старт, быстрое клиническое воздействие и снижение симптоматической нагрузки. Однако даже двойное ингибирование BRAF и MEK не гарантирует полного преодоления резистентности у пациентов с метастатической меланомой BRAF+. Поэтому были продолжены исследования, целью которых было получение комбинации, обеспечивающей не только быстрый ответ на терапию, но и продление длительности ответа.
В 2020 г. компания «РОШ» впервые зарегистрировала тройную комбинацию ингибиторов BRAF и MEK с иммуноонкологическим препаратом – PD-L1-ингибитором атезолизумабом для лечения неоперабельной местно-распространенной или метастатической меланомы кожи.
Преимущества данной комбинации в лечении метастатической или неоперабельной меланомы кожи были продемонстрированы в международном многоцентровом рандомизированном исследовании TRILOGY. Получены данные о том, что медиана выживаемости без прогрессирования (ВБП) в группе пациентов, получающих тройную комбинацию «атезолизумаб + кобиметиниб + вемурафениб», превосходит ранее достигнутые значения во всех известных комбинациях и составляет 15,1 месяца. Кроме того, отмечено увеличение длительности ответа в группе тройной комбинированной терапии по сравнению с другими схемами терапии. Так, длительность ответа на комбинации «атезолизумаб + кобиметиниб + вемурафениб» увеличилась почти в два раза по сравнению с двойной комбинацией (кобиметиниб + вемурафениб) – 21,0 против 12,6 месяца соответственно [3].
Важно, что тройная комбинация «атезолизумаб + кобиметиниб + вемурафениб» показала наивысшую ЧОО среди иммунотерапевтических схем при минимальном уровне прогрессирования заболевания. Прогрессирование заболевания на фоне тройной комбинации составило всего 5,5%, тогда как при приеме монотерапии ниволумабом – 38%, а при комбинации «ниволумаб + ипилимумаб» – 24%. Показатели ЧОО в группе пациентов, получающих тройную комбинированную терапию, составили 66,3%, что значительно превышает результаты, полученные на фоне лечения комбинацией «ниволумаб + ипилимумаб», – 58%. Также добавление атезолизумаба к комбинации кобиметиниба и вемурафениба приводило к увеличению показателей частичного ответа практически в два раза по сравнению с другими комбинациями. Промежуточный анализ общей выживаемости (ОВ) в исследовании TRILOGY демонстрирует положительный тренд в группе тройной комбинации «атезолизумаб + кобиметиниб + вемурафениб» по сравнению с двойной (кобиметиниб + вемурафениб) – расхождение на уровне 15,7 месяца.
Очевидно, что лечение пациентов с метастатической меланомой требует особого подхода. Среди данной популяции больных отмечается высокая частота отмены терапии с использованием различных схем. Последние данные свидетельствуют, что при использовании тройной комбинации частота отмены терапии в три раза ниже, чем на комбинированной иммунотерапии, и составляет всего 12,6%. Таким образом, тройная комбинация не только обеспечивает более продолжительный ответ на терапию, но и реже приводит к отмене терапии из-за нежелательных явлений. Безусловно, пациентам с меланомой и массивным метастатическим поражением следует назначать терапию, способную обеспечить быстрый и длительный ответ, снижение опухолевой нагрузки и улучшение клинического состояния. На сегодняшний день после длительных дискуссий специалистов определен профиль пациента для применения тройной комбинации «атезолизумаб (Тецентрик®) + кобиметиниб (Котеллик®) + вемурафениб (Зелбораф®)» в первой линии терапии метастатической меланомы:
Таким образом, соблюдая тщательный подбор пациентов под данную комбинацию, можно достичь хорошего эффекта терапии, быстрого и длительного по своей продолжительности.
Трилогия в реальной клинической практике. Первые результаты
Докладчик рассказал об опыте применения тройной комбинации «атезолизумаб + кобиметиниб + вемурафениб» в реальной клинической практике.
Пациентка, 67 лет. В 2015 г. обнаружила у себя рост давно существующего пигментного образования на коже правого бедра. 19 августа 2015 г. по месту жительства в Архангельском клиническом онкологическом диспансере выполнено широкое иссечение образования кожи правого бедра. Установлен диагноз: меланома кожи правого бедра T3bN0M0, IIВ стадия. В соответствии с актуальными на тот момент клиническими рекомендациями пациентке было рекомендовано динамическое наблюдение. В мае 2019 г. при контрольном обследовании у пациентки выявлено прогрессирование заболевания в виде появления метастазов в регионарных паховых лимфатических узлах справа и солитарного метастаза в мягких тканях правого бедра. 21 июня 2019 г. пациентке выполнено хирургическое лечение – пахово-бедренная лимфаденэктомия (операция Дюкена) справа и удаление солитарного одиночного метастаза в мягких тканях правого бедра.
У пациентки была выявлена BRAF-мутация, в связи с чем назначена адъювантная таргетная терапия – дабрафениб + траметиниб.
Через 10 месяцев от начала адъювантной таргетной терапии, в мае 2020 г. при контрольном обследовании выявлено прогрессирование заболевания. По данным ультразвукового исследования, обнаружен местный рецидив в области мягких тканей правого бедра, метастазы в печени. В июне при проведении компьютерной томографии (КТ) выявлены метастазы в легких, в медиастинальных лимфатических узлах.
Пациентке была назначена иммунотерапия пембролизумабом. С 17 августа по 28 сентября 2020 г. ей выполнено три введения препарата пембролизумаб с удовлетворительной переносимостью. Эффектом терапии явилось клиническое прогрессирование заболевания, отрицательная динамика. При этом не только увеличились уже имевшиеся очаги, но и появилось множество новых очагов в легких, плевре, почках, надпочечниках, поджелудочной железе, паранефральной клетчатке. В октябре – декабре 2020 г. был сделан перерыв в лекарственной терапии.
В ноябре 2020 г. пациентка впервые обратилась за помощью в Ленинградский областной клинический онкологический диспансер, поскольку приехала из Архангельска к родным в Санкт-Петербург. Основные жалобы пациентки были обусловлены наличием крупного мягкотканного метастаза мягких тканей правого бедра. Ей были даны рекомендации для продолжения таргетного лечения ингибиторами BRAF и MEК по месту жительства.
Далее 18 ноября 2020 г. после обращения в Национальный медицинский исследовательский центр онкологии им. Н.Н. Блохина больной произведено паллиативное удаление рецидива опухоли кожи правого бедра. Пациентка была проконсультирована профессором С.А. Проценко, которая также рекомендовала реиндукцию таргетной терапии ингибиторами BRAF и MEК. В Ленинградский областной клинический онкологический диспансер пациентка снова обратилась в конце декабря 2020 г. Ее состояние ухудшилось, она самостоятельно не перемещалась, предъявляла жалобы на выраженную слабость, болевой синдром, отек нижней правой конечности. В связи с тяжелым состоянием пациентки 25 декабря 2020 г. принято решение о назначении терапии комбинацией «вемурафениб 1920 мг/сут + кобиметиниб 60 мг/сут».
В первый месяц комбинированного лечения у пациентки развились нежелательные явления (НЯ) 1–3-й степени, прежде всего выраженная кожная токсичность, гипертермия до 39 ºС, стоматит. Пациентка самостоятельно редуцировала дозу вемурафениба до 480 мг два раза в сутки (960 мг/сут), при этом выраженность НЯ уменьшилась. С 14 января 2021 г. доза вемурафениба увеличена до 960 мг утром и 720 мг вечером (1680 мг/сут), больная получает симптоматическую терапию. На фоне лечения состояние пациентки стабилизировалось.
В начале февраля 2021 г., через полтора месяца лечения таргетной терапией, состояние пациентки значительно улучшилось по сравнению с прежними данными, полученными в декабре 2020 г. Так, состояние больной по шкале ECOG – 1 (в декабре – 2–3), пациентка самостоятельно перемещалась, приходила на прием, отсутствовали жалобы на болевой синдром, отечность нижних конечностей минимальная. Уровень ЛДГ на фоне проводимой терапии остается в пределах нормы.
Пациентка субъективно стала чувствовать себя значительно лучше, хотя некоторая слабость присутствовала. Она стала выполнять домашнюю работу, готовить пищу.
По данным КТ, крупный метастаз в S6 правого легкого практически исчез, визуализируется небольшой очаг в легком S10 справа, уменьшились депозиты в правом надпочечнике, правой почке. В левой почке метастаз не описывается, в печени метастазы уменьшились. По сравнению с данными КТ от октября 2020 г. на фоне назначения комбинированной таргетной терапии вемурафенибом и кобиметинибом отмечена стабилизация заболевания.
Таким образом, в данном клиническом случае получен объективный ответ на комбинированную таргетную терапию. Накопленные данные показывают, что реиндукция таргетной терапии позволяет добиться быстрого ответа на терапию у пациентов, обеспечивает контроль заболевания, улучшает ВБП у пациентов с метастатической меланомой кожи.
Однако для увеличения медианы ВБП, длительности терапевтического эффекта у пациентов с метастатической меланомой к комбинации ингибиторов протеинкиназы BRAF и MEK целесообразно добавление иммуноонкологической терапии.
Добавление 5 марта 2021 г. атезолизумаба (Тецентрик®) в дозе 1200 мг/3 недели к комбинации вемурафениба и кобиметиниба не привело к серьезному изменению профиля токсичности, все НЯ манифестировали в начале лечения и хорошо контролировались. При этом пациентка не почувствовала серьезного изменения в самочувствии после первого введения препарата. При проведении КТ в конце марта 2021 г. отмечена положительная динамика и продолжающийся положительный эффект тройной терапии. Субъективно пациентка стала чувствовать себя значительно лучше (ECOG – 0), она самостоятельно ухаживает за собой, выходит из дома, много гуляет. На сегодняшний день продолжается динамическое наблюдение за состоянием пациентки на фоне проводимой тройной комбинированной терапии.
Таким образом, данный клинический случай наглядно демонстрирует возможности таргетной комбинированной терапии метастатической меланомы. Назначение комбинированной таргетной терапии (вемурафениб + кобиметиниб) пациентке 67 лет с метастатической меланомой привело к значительной положительной динамике субъективного ответа через полтора месяца лечения. С первых недель терапии наблюдалась стабилизация состояния пациентки. Кроме того, комбинированная таргетная терапия показала удовлетворительный профиль переносимости. А интенсификация терапии до тройной комбинации «вемурафениб (Зелбораф®) + кобиметиниб (Котеллик®) + атезолизумаб (Тецентрик®)» не показала значимого изменения профиля токсичности