Что такое дистрофия желудка
Что надо знать об атрофическом гастрите?
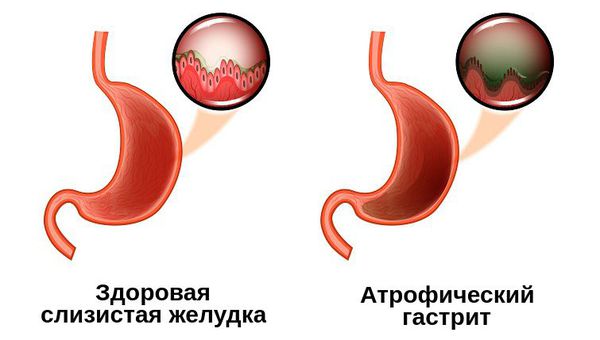
Атрофический гастрит или более правильное медицинское название атрофия слизистой оболочки желудка – это необратимый процесс, при котором происходит гибель клеток слизистой желудка, вырабатывающих желудочных сок и соляную кислоту. К атрофии, также относится постепенное замещение клеток желудка соединительной тканью и клетками, сходными по строению с клетками слизистой оболочки кишечника.
Атрофия слизистой оболочки желудка – это опасное для здоровья состояние, так как с течением времени и, особенно, при наличии дополнительных факторов риска, она может привести к развитию рака желудка.
Причины атрофического гастрита

Хронический гастрит – это распространенное заболевание (выявляется до 30% населения в различных популяциях), имеющее хроническое и рецидивирующее течение, проявляющееся воспалением слизистой оболочки желудка и подтвержденное морфологическим исследованием.
Причинами развития хронического гастрита являются:
То есть, в большинстве случаев атрофия слизистой желудка является результатом наиболее часто встречающегося (80%) хронического гастрита, вызванного хеликобактерной инфекцией, или аутоиммунного гастрита, который встречается в 1-2% случаев. В данной статье подробно рассмотрена атрофия, связанная с этими двумя причинами.
Что происходит с клетками слизистой оболочки при атрофии?
Атрофия слизистой оболочки желудка затрагивает верхний слой и собственную пластинку желудка и является почти необратимым процессом, который можно замедлить, если устранить причины воспаления.
Слизистая желудка находится под действием агрессивной среды, поэтому ее клетки полностью обновляются каждые три дня. Воспалительный процесс, развивающийся вследствие влияния внешних факторов, например, бактериальная инфекция или внутренних причин, например, реакция иммунной системы, нарушает процесс обновления (регенерации) клеток слизистой желудка, в том числе и клеток желез желудка, вырабатывающих желудочный сок. В результате клетки желез желудка погибают и замещаются клетками соединительной ткани, а также клетками по строению схожими с клетками кишечника.
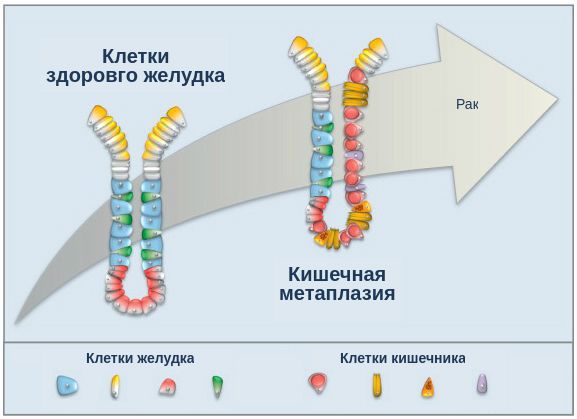
Этот процесс можно диагностировать с помощью гистологического исследования образцов слизистой желудка. Если выявлено только уменьшение количества клеток желудочных желез, то говорят только об атрофии слизистой оболочки желудка. Если же в исследуемом образце будут обнаружены клетки кишечника, то устанавливается диагноз атрофия с кишечной метаплазией. Метаплазия – это появление клеток, нетипичных для данного органа.
Как правильно диагностировать атрофию слизистой желудка?

Диагноз устанавливается врачом-морфологом после проведения гистологического исследования. На основании данного исследования подбирается лечение и определяется периодичность обследований для своевременного выявления онкологического процесса.
Также для оценки выраженности атрофии используется определение активности секреторной функции желудка по лабораторному анализу крови – Гастропанель (ссылка).
Диагностику хеликобактерной инфекции проводят с помощью исследования биоптатов и 13 С-уреазного дыхательного теста.
При аутоиммунном гастрите проводятся лабораторная диагностика анализа крови на определение антител к клеткам желудка и к внутреннему фактору Кастла.
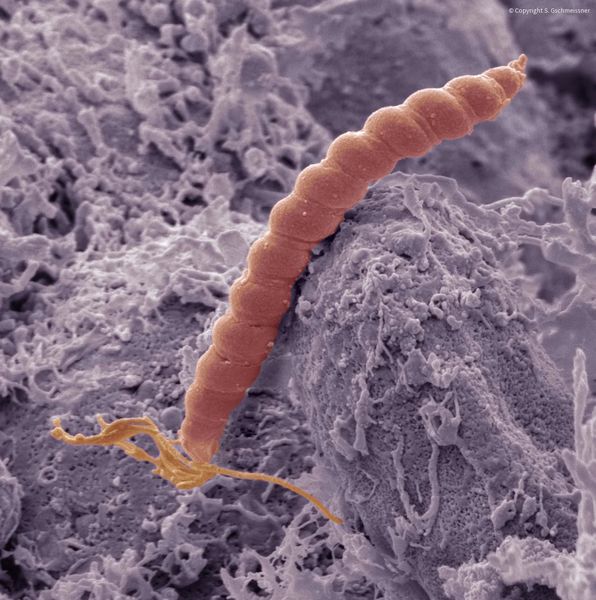
Атрофический гастрит, связанный с хеликобактерной инфекцией
После инфицирования бактерией Helicobacter Pylory, в слизистой желудка развивается воспаление и хронический неатрофический гастрит. Железы желудка в начале заболевания вырабатывают достаточное количество желудочного сока. При отсутствии лечения, воспаление становится более активным и распространяется на все отделы желудка, приводя к атрофии слизистой) и частичному замещению клеток желудка кишечными клетками (кишечная метаплазия).
Симптомы

Лечение
Эрадикация (уничтожение) Helicobacter Pylory является первым этапом лечения при данном варианте атрофического гастрита.
Аутоиммунный атрофический гастрит
При данном типе хронического гастрита клетки желудка повреждаются антителами, которые вырабатывает собственная иммунная система. При этом развивается хроническое воспаление, приводящее к атрофии желез желудка и снижению выработки соляной кислоты и внутреннего фактора Кастла, обеспечивающего усвоение витамина B12. Значительное снижение выработки внутреннего фактора Кастла может вызывать анемию В12-дефицитную анемию (пернициозную анемию) – заболевание, для которого характерно нарушение кроветворения.
Симптомы
Симптомы аутоиммунного атрофического гастрита схожи с симптомами, атрофии, вызванной хеликобактерной инфекцией.
Дополнительно развивается анемия, часто аутоиммунному гастриту могут сопутствовать другие аутоиммунные заболевания.
Лечение
Специфического лечения при аутоиммунном гастрите нет, лечение кортикостероидами используется только в исключительных случаях.
Питание при атрофии слизистой
Специфической диеты при атрофическом гастрите не существует, питание должно быть регулярным, сбалансированным с учетом индивидуальной переносимости. Также рекомендуется сократить в рационе питания: грубую клетчатку, рафинированные сахара, избыток соли, насыщенные жиры, алкоголь, а также консерванты и стабилизаторы.
Прогноз и факторы риска при атрофическом гастрите
В зависимости от уменьшения количества желез в слизистой оболочке желудка выделяют три степени атрофии:
Наибольший риск рака желудка имеют пациенты с тяжелой атрофией, кишечной метаплазией, а в особенности с наличием дисплазии.
Дополнительными факторами риска рака желудка являются:
При наличии атрофии наиболее актуальным является профилактика рака желудка, для чего профессор Мехтиев, главный врач центра Эксперт рекомендует регулярное наблюдение у гастроэнтеролога, который следит за симптомами и определяет периодичность выполнения ФГДС (гастроскопии) с расширенной гистологией и Гастропанели.
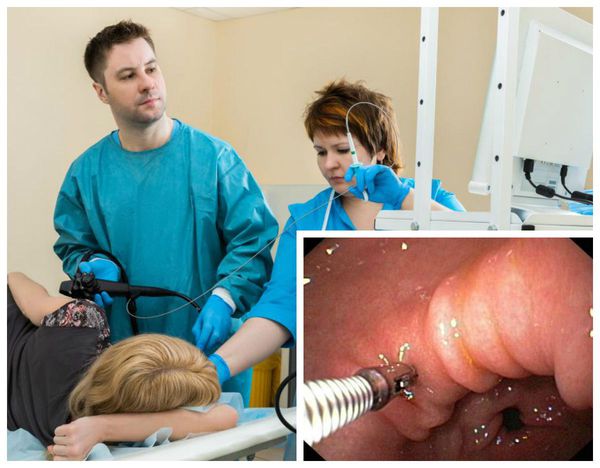
Получить консультацию гастроэнтеролога, специализирующегося на ведении пациентов с атрофическим гастритом, можно в Гастроэнтерологическом центре Эксперт. ФГДС (гастроскопия) в ГЦ Эксперт выполняется опытными специалистами с помощью видеоэндоскопической системы, оснащенной технологией виртуальной хромоэндоскопии i-Scan, что повышает точность забора образцов слизистой для гистологического исследования.
Что такое атрофический гастрит? Причины возникновения, диагностику и методы лечения разберем в статье доктора Жуковой М. А., гастроэнтеролога со стажем в 26 лет.
Определение болезни. Причины заболевания
Атрофический гастрит — это наиболее коварный тип хронического гастрита, при котором изменяются париетальные клетки желудка, из-за чего слизистая оболочка становится тоньше, а железы желудка, вырабатывающие соляную кислоту, атрофируются. Это закономерно приводит к недостаточной выработке соляной кислоты и нарушению переваривания пищи.
Краткое содержание статьи — в видео:
Так как желудок является начальным звеном пищеварительной системы, нарушение его функции неизбежно влияет на состояние других органов: недостаточно переработанная в механическом и химическом отношении пища нарушает работу тонкого и толстого кишечника, а также поджелудочной железы.
Атрофический гастрит возникает и прогрессирует по разнообразным причинам, связанным с воздействием на слизистую оболочку желудка. Принято разделять их на две группы — экзогенные (внешние) и эндогенные (внутренние).
Существенными причинами появления заболевания также являются возрастные изменения: у людей до 30 лет атрофические процессы встречаются в 5 % случаев, до 50 лет — в 30 % случаев, после 50 лет — в 50-70 % случаев. Возможна и генетически обусловленная перестройка слизистой желудка по типу гипо- и атрофии.
Симптомы атрофического гастрита
Клиническая картина хронического гастрита связана с местными и общими расстройствами. Часто болезнь может протекать бессимптомно, особенно у людей после 50 лет. Симптомы, как правило, связаны с недостаточной работой желудка и зависят от степени поражения определённого звена пищеварения.
Основными функциями желудка являются:
При значительном снижении синтеза и отсутствии соляной кислоты возникают следующие местные проявления :
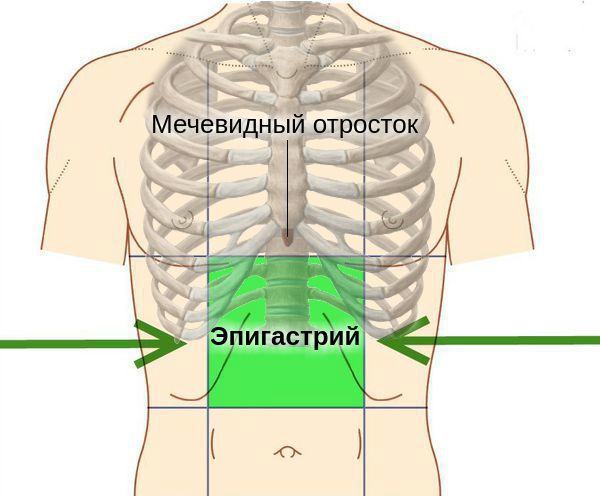
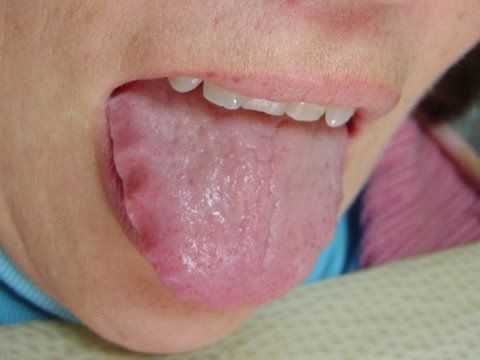
У людей с атрофическим гастритом отмечается «лакированный» язык, при обострениях язык увеличивается (видны отпечатки зубов), он обложен густым белым налётом. При пальпации (прощупывании) области желудка болезненность обычно отсутствует, но иногда возникает слабо выраженная разлитая болезненность в эпигастральной области.
У людей с аутоиммунным гастритом выявляются антитела к париетальным клеткам, сопутствует анемия, вызванная дефицитом витамина B12, и значительное снижение секреции соляной кислоты.
Симптомы общих расстройств:
Клинические симптомы гастрита нельзя сопоставить с гистологическими изменениями. Атрофический гастрит развивается медленно, поражение при этом начинается со дна желудка, переходя на его тело, а затем и на остальную слизистую. Считается, что на первых этапах умеренно выраженного атрофического гастрита клиника малосимптомная, стёртая и не имеет специфических проявлений. Но на дальнейших стадиях появляются симптомы, связанные с моторной и секреторной недостаточность желудка.
Патогенез атрофического гастрита
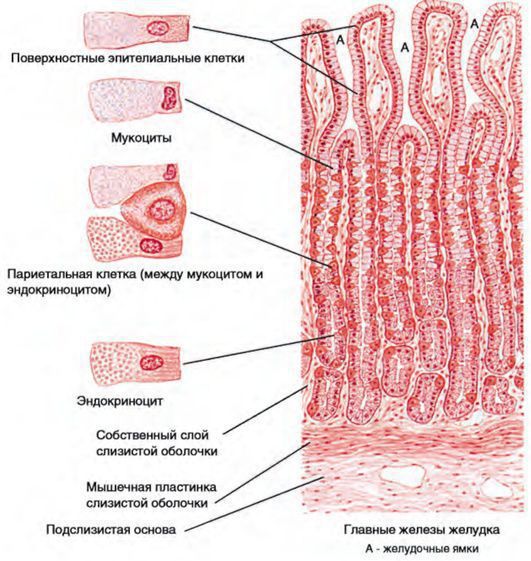
Эпителий слизистой оболочки желудка двухслойный:
При гастрите оба слоя эпителия желудка вовлечены в патологический процесс. Заселение слизистой H. pylori вызывает хроническое повреждение клеток, ослабляет защитные свойства слизистой желудка, что ведёт к повреждению клеточных ядер свободными радикалами и токсинами. При этом изменяется клеточная структура, нарушается специализация клеток, появляются «гибридные» клетки, которые имеют свойства предраковых. Данный процесс называется кишечной метаплазией. В связи с этими изменениями слизистая желудка сначала приобретает вид тонкокишечного эпителия, затем — толстокишечного эпителия. Чем дальше заходит процесс метаплазии, тем больше вероятность развития аденокарциномы — железистого рака желудка.
Данный нарушенный процесс обновления клеток в слизистой желудка лежит в основе образования атрофии при гастрите. Прослеживается определённый патогенетический каскад, спровоцированный Н. pylori: от инфекционного гастрита через стадии атрофии, метаплазии и дисплазии к раку желудка. Особенно опасно появление неполной — толстокишечной — метаплазии.
Повреждение слизистой оболочки желудка при аутоиммунном гастрите реализуется через другой механизм: нарушение иммунитета приводит к образованию антител, повреждению ткани желудка иммунными комплексами. Чаще всего антитела вырабатываются к фактору Касла, который отвечает за всасывание витамина В12, и G-клеткам. Из-за этого постепенно снижается кислотность желудка, изменяется структура слизистой, снижается выработка соляной кислоты. В желудке нарушается всасывание железа и витаминов, развивается В12-дефицитная анемия. При этом заболевании в 90 % случаев выявляются антитела к париетальным клеткам, вырабатывающим соляную кислоту, и к Н + /К +- АТФазе, в 60 % случаев — антитела к фактору Касла.
Классификация и стадии развития атрофического гастрита
Сиднейская классификация гастритов
В последующем эта классификация дополнялась и уточнялась в связи с новыми научными данными. Сейчас для правильной формулировки диагноза «хронический гастрит» важно установить причину заболевания, распространённость поражения, степени активности и атрофии.
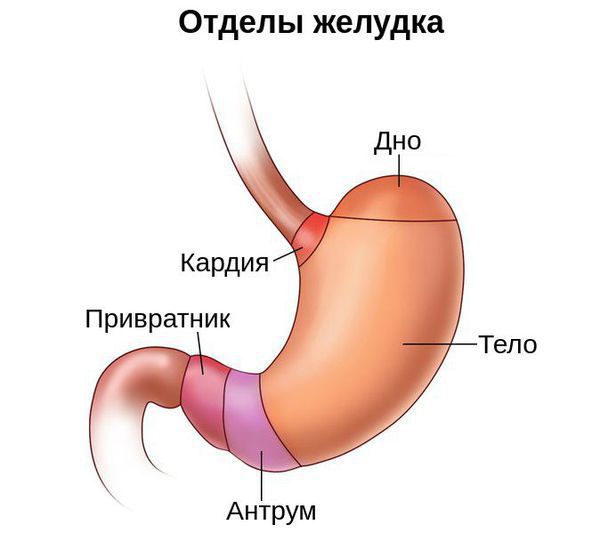
Условно желудок можно поделить на пять отделов: кардия, свод (дно, или фундальный отдел), тело, антрум и привратник. Атрофия может затронуть как один из этих отделов, так и весь желудок. В связи с этим выделяют диффузный атрофический гастрит (в фундальном, антральном или другом отделе) и мультифокальный атрофический гастрит (во всём желудке).
Морфологическая классификация гастрита широко применяется в практике, т. к. именно гистологические характеристики процесса помогают определить прогноз и тактику лечения пациента. Для этого используют визуально-аналоговую шкалу. Она позволяет оценить морфологическую картину слизистой желудка по:
Степень атрофии также оценивается по визуально-аналоговой шкале, изображённой на схеме ниже. По выраженности атрофии и её виду выделяют три категории изменений слизистой оболочки желудка:
При этом учитывается локализация и степень выраженности атрофических изменений (слабая, средняя, сильная), а также наличие и площадь очагов кишечной метаплазии.
Развитие болезни проходит определённые стадии:
Осложнения атрофического гастрита
Выраженный атрофический гастрит всегда сопровождается В12-дефицитной анемией, при которой париетальные клетки, вырабатывающие соляную кислоту, практически отсутствуют. Витамин В12, поступающий с пищей, не всасывается, что приводит к хронической анемии с характерными проявлениями в виде быстрой утомляемости, нарушения зрения и вкусовых ощущений, мышечной слабости, головокружений, чувства покалывания и онемения в конечностях.
При ахлоргидрии — отсутствии соляной кислоты в желудочном соке — происходит к выраженное нарушение пищеварения, ухудшается переработка пищи, снижается всасывание отдельных микроэлементов и витаминов.
Диагностика атрофического гастрита
Гастрит — диагноз морфологический, т. е. он основан не на симптомах, а на изменениях строения слизистой желудка. Поэтому он может считаться объективным только после оценки слизистой желудка, взятой во время биопсии. Этим занимается патоморфолог. Только с помощью морфологического исследования можно достоверно выявить атрофию, воспаление и деструкцию слизистой желудка.
Клинический диагноз гастрита, т. е. диагноз без морфологического исследования, практически не имеет смысла. Симптомы диспепсии, которые заставляют больного обратиться к врачу, носят лишь функциональный характер и не всегда указывают на те морфологические изменения, которые составляют суть гастрита.
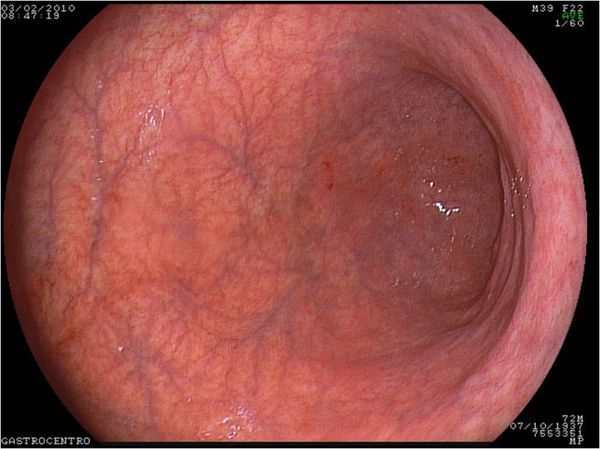
Изменения слизистой можно обнаружить при проведении эзофагогастродуоденоскопии (ЭГДС) — осмотре желудка и двенадцатиперстной кишки с помощью эндоскопа (через видео-трубку). Но результаты этого исследования являются субъективными и только косвенным образом могут указывать на наличие гастрита: они не позволяют оценить степень его прогрессирования.
Оптимальным методом является морфологическое исследование биоптатов. Также в практике широко используется быстрый уреазный тест — определение H. pylori методом оценки количества аммиака в мочевине, образуемого этими бактериями. К другим способам относятся дыхательный тест и иммуноферментные анализы.
Крайне важно провести диагностику Н. pylori до лечения и после уничтожения бактерий, чтобы контролировать эффективность выбранной схемы терапии. Это связано с появлением штаммов бактерий, устойчивых к антибиотикам.
Дефекты пищеварения хорошо выявляет анализ кала (микроскопическое исследование) — достаточно простой метод, который позволяет обнаружить косвенные признаки снижения выработки соляной кислоты, а также изменения, характерные для патологии других органов пищеварительной системы. Так, при атрофическом гастрите в кале появляется большое количество неизменённых мышечных волокон, перевариваемой клетчатки соединительной ткани и внутриклеточного крахмала.
Лечение атрофического гастрита
Современная терапия хронического гастрита предполагает воздействие на причины заболевания, в частности устранение H. pylori и лечение аутоиммунного гастрита.
Устранить аутоиммунные механизмы повреждения слизистой желудка можно только благодаря гормональной терапии. Назначение глюкокортикостероидов оправдано только при сопутствующей В12-дефицитной анемии.
Совершенно другой подход при обнаружении инфекции H. pylori и лабораторных подтверждений атрофических изменений. Он предполагает эрадикацию — уничтожение H. pylori. Терапия назначается после проведения суточной рН-метрии. При значении рН менее 6, несмотря на пониженную выработку соляной кислоты, назначаются ингибиторы протонной помпы (ИПП); при анацидном состоянии (рН ≥ 6) ИПП исключаются из схемы эрадикации и назначаются только антибиотики.
Через 4-6 недель после окончания антихеликобактерной терапии необходимо провести контрольное исследование — С13-уреазный дыхательный тест.
Хронический химикоиндуцированный или желчный рефлюкс-гастрит объединяет большую группу больных, включая:
Цель лечения — нормализовать моторику желудочно-кишечного тракта и связывание желчных кислот.
Тактика лечения зависит от основной причины гастрита:
Прогноз. Профилактика
Прогноз заболевания серьёзнее у пациентов старше 50 лет, т. к. в этом возрасте метапластические процессы развиваются гораздо быстрее и чаще приводят к появлению рака. Эффективность лечения зависит от степени выраженности атрофии и площади поражения. Большое значение имеет ранее начало лечения и полное устранение H. pylori (иногда лечение помогает только времено подавить активность инфекции [13] ). При выявлении H. pylori после проведённой терапии необходимо повторное лечение.
Предраковые изменения на фоне атрофического гастрита (кишечная метаплазия и дисплазия) представляют наибольшую опасность. При этом своевременная диагностика и полное удаление H. pylori уже через пять лет восстанавливают слизистую желудка и значительно уменьшают площадь метаплазии.
Атрофический гастрит – скрытая угроза: как поставить диагноз и помочь больному
Оксана Михайловна Драпкина, профессор:
– Приступим к дальнейшей программе. У нас будет лекция доцента Лапиной Татьяны Львовны, посвященная атрофическому гастриту (АГ).
Татьяна Львовна Лапина, доцент:
– Уважаемые коллеги! Тема моей лекции: «Атрофический гастрит – скрытая угроза: как поставить диагноз и помочь больному».
Зачем вообще нужно ставить диагноз атрофического гастрита?
Все дело в том, что уже многие десятилетия ясно, что АГ и такое изменение слизистой оболочки желудка, которое называется кишечной метаплазией (это маркер, признак АГ), являются предраковыми заболеваниями желудка.
Хронический гастрит и АГ, как правило, не имеют своей симптоматики. Не имея явной симптоматики, гастрит «молчит» о себе. Атрофия слизистой оболочки о себе никак не заявляет. Но молчание это очень громкое и грозное, потому что в итоге мы можем получить опухоль желудка.
Открытие пилорического хеликобактера в этой цепочке патогенетических событий от хронического гастрита к раку желудка позволило очень четко показать, что именно этот микроорганизм является причиной хронического воспаления слизистой оболочки желудка.
Действительно, абсолютно четко доказано, что для инфекции пилорического хеликобактера связь с АГ очевидна.
Посмотрите, пожалуйста. Это данные недавнего мета-анализа, которые четко связывают наличие инфекции пилорического хеликобактера с частотой случаев АГ. Суммарный относительный риск составляет 5. Многократно наличие инфекции пилорического хеликобактера усиливает риск АГ.
Естественно, пилорический хеликобактер как таковой связан с тем раком желудка, который в качестве своего предракового изменения имеет АГ. С некардиальным раком желудка, а именно с диффузной аденокарциномой кишечного типа по классификации Lauren.
Посмотрите, пожалуйста. Специально представляю данные мета-анализа по связи с инфекцией пилорического хеликобактера некардиального рака желудка и рака кардии. Рак кардии не связан с АГ. Четко видно, что нет связи с инфекцией пилорического хеликобактера.
Дистальный рак желудка кишечного типа имеет в качестве стадии определенный, предшествующий своему развитию АГ. Он четко связан с инфекцией пилорического хеликобактера.
Почему пилорический хеликобактер может привести к формированию рака желудка? В первую очередь, через воспалительные изменения слизистой оболочки – через гастрит.
Сама бактерия непосредственна. Например, благодаря тем эпигенетическим изменениям, которые инфекция пилорического хеликобактера вызывает в эпителиоцитах слизистой оболочки желудка.
На этой схеме, которая взята из очень хорошего обзора (он так и называется «Воспаление, атрофия и рак желудка») очень четко показано, что на молекулярном уровне ясно, какие события в эпителиоците желудка запускает инфекция пилорического хеликобактера. В результате может происходить дисбаланс процессов пролиферации, апоптоза, накапливаться генетические мутации.
Конечно, интересно понять, можно ли с помощью эрадикации пилорического хеликобактера добиться профилактики рака желудка.
Самые яркие работы – это работы по проведении эрадикационной терапии у пациентов, у которых диагностирован ранний рак желудка. Это работы японские. Вы знаете, что в этой стране очень хороший алгоритм ведения таких пациентов. Пациенты с ранним раком желудка подлежат эндоскопической резекции опухоли.
Посмотрите, пожалуйста: 544 больных после эндоскопической резекции раннего рака желудка наблюдались три года. Половине из них провели эрадикацию инфекции пилорического хеликобактера, половине не провели.
Через три года у пациентов после эрадикационной терапии случаи нового обнаружения опухолей желудка составили 3%. Пациенты, у которых осталась инфекция пилорического хеликобактера, в течение 3-х лет наблюдения – практически 9%. В три раза чаще выявлялась новая опухоль желудка.
Очень легко все представить на этой модели эндоскопической резекции рака желудка. На самом деле, эпидемиологические исследования по предотвращению рака желудка с помощью эрадикации пилорического хеликобактера очень сложно претворить в жизнь, очень сложно составить правильный план таких исследований.
Тем не менее, видно, что такие исследования проводятся. Действительно, из анализа этих исследований делается вывод, что эрадикация пилорического хеликобактера статистически значимо снижает частоту рака желудка примерно на 1/3.
Исходя из этих расчетов, в качестве некоторых рекомендаций определенных сообществ врачей даются рекомендации по возможному проведению скрининга инфекции пилорического хеликобактера в популяции. Особенно в тех популяциях, где высока частота инфекции пилорического хеликобактера.
Эрадикация инфекции у серопозитивных лиц как стратегия и мера профилактики рака желудка.
С точки зрения разработки такого алгоритма по профилактике рака желудка в Японии интересна эта статья очень известных исследователей. Благодаря их расчетам для Японии: возраст пациентов, когда была проведена эрадикационная терапия инфекции пилорического хеликобактера, и возможное снижение частоты рака желудка.
Вы видите, чем более молодой возраст (в зависимости от пола), тем более эффективна эрадикационная терапия как мера профилактики рака желудка.
С точки зрения диагностики атрофии рекомендуется использовать так называемый уровень сывороточного пепсиногена I. Это белок, который вырабатывается главными клетками желез тела желудка. При АГ утрачиваются железы и главные клетки, поэтому уровень сывороточного пепсиногена достоверно понижается. Определенные пороговые значения могут свидетельствовать о наличии атрофии тела желудка.
В зависимости от наличия инфекции пилорического хеликобактера и наличия сывороточного пепсиногена в низком титре как маркера атрофии выделяются определенные группы лиц популяции, которые могут подлежать (а могут и не подлежать) дальнейшему наблюдению.
Естественно, лица без инфекции пилорического хеликобактера и те, у кого сывороточный пепсиноген в норме, не требуют дальнейшего наблюдения. Но если речь идет о наличии инфекции пилорического хеликобактера, обязательно имеется в виду эрадикационная терапия.
Особенно тяжелая группа: пилорический хеликобактер + и сывороточный пепсиноген как маркер атрофии низкий. Есть специальная группа больных, когда атрофия зашла настолько глубоко, что пепсиноген низкий. Даже не определяется антитело к пилорическому хеликобактеру.
Эти пациенты должны подлежать эндоскопическому исследованию ежегодно после проведения эрадикационной терапии.
Наиболее интересна работа, которая говорит о профилактических мероприятиях с точки зрения профилактики рака желудка. Это работа Ванга (B. C. Wahg) и соавторов. Она выполнена в регионе с высокой частотой рака желудка. Наблюдалась в течение многих лет когорта из 1630 лиц. При этом почти 1000 из них на момент вовлечения в исследования не имели АГ и маркера АГ (кишечной метаплазии). У них не было выявлено дисплазии.
После эрадикационной терапии и группа сравнения, которая получала плацебо. Частота выявления рака желудка спустя годы наблюдения 7 человек и 11 человек с раком желудка.
Разницы вроде бы никакой нет. Но когда посмотрели пациентов, у которых эрадикационная терапия была начата до формирования признаков АГ, кишечной метаплазии, без дисплазии, то в результате наблюдения ноль случаев опухоли желудка. Шесть случаев диагностированного рака желудка при отсутствии эрадикации пилорического хеликобактера.
Конечно, присутствуют независимые факторы риска: курение, возраст пациентов. Тем не менее, в этом исследовании прекрасно доказано, что чем раньше начата эрадикационная терапия (может быть, до развития АГ), тем лучше эта мера действует с точки зрения профилактики.
Кому и когда проводить лечение?
Вы видите, перечислен ряд болезней и состояний, которые могут считаться показаниями для эрадикации инфекции пилорического хеликобактера.
Действительно, здесь присутствует АГ. Но будем ли мы проводить широкомасштабный скрининг на сывороточный пепсиноген и на антитела к пилорическому хеликобактеру? Пока мало регионов в России, в которых такие работы ведутся широкомасштабно.
Что делать практическому врачу?
Практическому врачу нужно использовать рекомендации Российской гастроэнтерологической ассоциации по диагностике и лечению инфекции пилорического хеликобактера у взрослых. Они были разработаны группой экспертов в результате, на мой взгляд, очень живого и длительного обсуждения и опубликованы в № 1 российского журнала «Гастроэнтерология, гепатология, колопроктология» за текущий (2012-й) год.
Назначение эрадикационной терапии желательно при хроническом гастрите, вызванном инфекцией пилорического хеликобактера. В том числе при АГ.
Пациент, у которого НПВС-гастропатия, гастроэзофагеально-рефлюксная болезнь, функциональная диспепсия, который пришел к доктору, предъявляя определенные жалобы, который настроен на проведение эзофагогастродуоденоскопии, гастроэнтерологического обследования – конечно, всегда следует иметь в виду диагностику инфекции пилорического хеликобактера. По возможности широкое назначение эрадикационной терапии, если это показано и если нет противопоказаний.
Как мы будем назначать эрадикационную терапию?
Мы будем назначать, конечно, хорошо зарекомендовавшую себя стандартную тройную терапию.
Ингибитор протонной помпы (ИПП) в стандартной дозе 2 раза в сутки. «Кларитромицин» («Clarithromycin») – грамм в сутки. «Амоксициллин» («Amoxicillin») – 1 грамм в сутки. Возможна комбинация «Кларитромицина» с «Метронидазолом» («Metronidazolum»).
Российские рекомендации по ведению пациентов с инфекцией пилорического хеликобактера рекомендуют определенные методы, которые могут усилить эффект от стандартной тройной терапии.
Например, назначение дважды в сутки высокой дозы ИПП, удвоенной по сравнению со стандартной дозировкой.
Мне бы хотелось обратить ваше внимание на тот пункт, который помечен восклицательным знаком. Добавление к стандартной тройной терапии препарата «Висмута трикалия дицитрата» («Bismuthate tripotassium dicitrate»).
ИПП в стандартной дозе 2 раза в сутки. «Кларитромицин», «Амоксициллин» и «Висмут трикалия дицитрат» 240 мг 2 раза в сутки.
Я должна сказать, что соли «Висмута» крайне интересны и с точки зрения включения их в эрадикационную терапию, и с точки зрения возможного назначения при хроническом гастрите и АГ.
Одна из самых надежных схем лечения включает соль «Висмута». Например, «Висмут трикалия дицитрат». Это классическая квадротерапия с препаратом «Висмута». Она рекомендуется и в качестве терапии 1-й линии, и как стандартная тройная терапия.
Например, в ситуации, когда вы хотите однозначно добиться эрадикации, потому что квадротерапия – это очень мощное лечение.
Когда у нас встретилась MALT-лимфома желудка, ассоциированная с пилорическим хеликобактером, мы пациентке назначили квадротерапию, нисколько не сомневаясь в нашем решении.
Возможно, пациент не переносит антибиотики пенициллинового ряда, поэтому стандартная тройная терапия, которая может включать «Амоксициллин», в этой ситуации невозможна к применению. Мы обращаемся к квадротерапии.
Если мы провели стандартную тройную терапию, и все-таки она не оказалась эффективной, в качестве 2-й лечебной линии выбираем квадротерапию с препаратом «Висмута».
Это действительно очень надежное лечение. Посмотрите, пожалуйста, работу 2011-го года. Квадротерапия на 14 и 10 дней. Даже по очень жесткому критерию эффективности Intention to treat (ITT) 92% эрадикации, причем и 10, и 14 дней.
На предыдущем слайде в рекомендациях Российской гастроэнтерологической ассоциации вы видели рекомендуемую продолжительность квадротерапии – 10 дней.
Препараты «Висмута» – это препараты, с самого начала «хеликобактерной эры», применявшиеся для эрадикации пилорического хеликобактера.
Первооткрыватель бактерии H.pylori Барри Маршалл (Barry Marshall) придумал назначать препараты «Висмута» для проведения эрадикационной терапии инфекции пилорического хеликобактера.
В результате многолетних исследований сформировался более или менее ясный алгоритм проведения эрадикационной терапии, который и положен в основу рекомендаций Российской гастроэнтерологической ассоциации по этому вопросу.
Конечно, есть разные исследования. Есть исследования, которые говорят о низкой эффективности тройной терапии. Вот работа, которая показывает низкую эффективность и тройной терапии, и не очень высокую эффективность квадротерапии.
Хотя для реальной клинической практики 77-78%. По большому счету, это очень близко к желанным 80%. Можно поспорить, насколько этот показатель для реальной практической деятельности является показателем провала схемы.
Мне бы хотелось обратить ваше внимание на поиски эффективности комбинации различных препаратов. Я вам показывала, что рекомендует Российская гастроэнтерологическая ассоциация: усиление стандартной тройной терапии препаратом «Висмута».
Недавно проведенное исследование в регионе, где резистентность к «Метронидазолу» 42%, к «Кларитромицину» 18%. Высокие уровни резистентности. Неизвестно, что назначить.
Назначили стандартную тройную терапию с препаратом «Висмута». Получили прекрасный процент эрадикации – 80% по жесткому критерию подсчета эффективности по критерию ITT (Intention to treat).
Этот подход – прибавление «Висмута» к эрадикационной терапии – не новый. Это подход, который в разные годы поисков оптимальной эрадикационной терапии занимает то одну ступеньку, то другую. То он ближе к терапии 1-й линии, то чуть-чуть дальше от нее.
Огромный мета-анализ. 93 рандомизированных контролируемых исследования. Ели вы посмотрите последнюю группу работ, это четырехкомпонентные терапии. Это та самая терапия «Метранидазол»-«Тетрациклин»-«Висмут» и антисекреторный препарат.
Вместе с тем различные другие варианты присоединения «Висмута» к стандартной тройной терапии.
Такое добавление этого специального антихеликобатерного препарата, конечно, существенно может прибавить к эффективности эрадикации.
Как нам вести пациентов с гастритом, в том числе с АГ.
Это рекомендации Российской гастроэнтерологической ассоциации, основанные на алгоритме, предложенном Владимиром Трофимовичем Ивашкиным, в 2008-м году.
Мы рекомендуем с точки зрения профилактики рака желудка при гастрите:
• возможно, прием антиоксидантов;
• отказ от курения, концентрированного алкоголя.
Специфическая профилактика при наличии инфекции пилорического хеликобактера – это эрадикация пилорического хеликобактера. Но препараты «Висмута», безусловно, занимают здесь определенную нишу.
Посмотрите, пожалуйста, как рекомендует Российская гастроэнтерологическая ассоциация. При хроническом гастрите, в том числе атрофическом, после окончания эрадикационной терапии по желанию врача, по его мнению, возможно продолжить лечение препаратом «Висмута» до 4-8 недель для реализации защитных свойств этого препарата.
Вы знаете, что препараты «Висмута», помимо антихеликобактерной активности, обладают очень мощным потенциалом по защите клеток слизистой оболочки желудка.
Наверное, к цитопротективным эффектам «Висмута» мы еще вернемся в следующих лекциях.