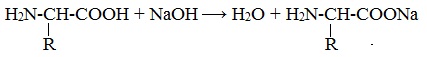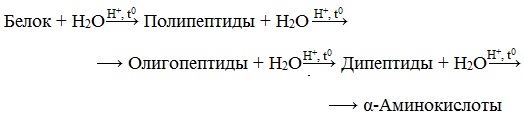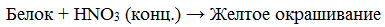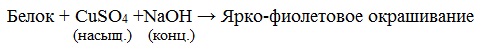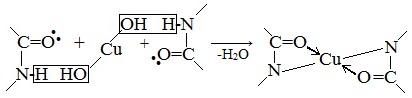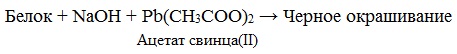Что такое гидролиз белков
Гидролиз белков
Общие понятия о белках
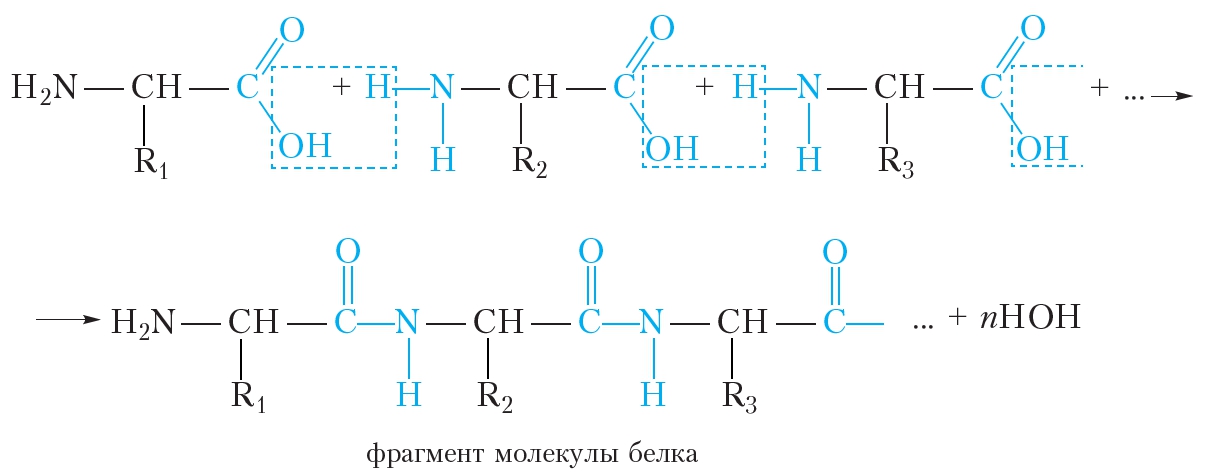
Мономерными звеньями белков выступают пептиды, которые состоят из аминокислот. Если вещество содержит более, чем 100 аминокислотных остатков его классифицируют как протеин, менее 100 – это ещё пептид. Образование белков (пептидная связь) схематично можно изобразить следующим образом:
Гидролиз белков
Белки способны частично гидролизоваться. Если представить, что гидролиз протекает до конца, т.е. полностью, то в качестве продуктов реакции получается смесь аминокислот. Кроме этих веществ в растворе после гидролиза были найдены углеводы, пиримидиновые и пуриновые основания, ортофосфорная кислота. Гидролиз белков протекает при определенных условиях: кипячение в растворе кислоты или щелочи.
Если в составе белков имеются амидные связи за счет наличия аминокислот с разветвленными боковыми радикалами, создающими стерические препятствия, как например в лейцине или валине, то гидролиз невозможен.
Если белок распадается на составляющие в щелочной среде, то гидролиз проводят в кислой и наоборот.
Условно уравнение реакции гидролиза белков можно записать как:
Для чего нужен гидролиз белков?
Поскольку белки являются высокомолекулярными соединения, то они могут плохо восприниматься организмом, так как любой продукт питания, растительного или животного происхождения имеет в составе белки. Гидролиз разрушает белки до низкомолекулярных продуктов, поэтому его используют для ускорения усвояемости белков (спортивное питание), снижения аллергических реакций (детское питание, в особенности молочные смеси), получения аминокислот.
Примеры решения задач
| Задание | Напишите уравнение реакции гидролиза белков имеющих общую формулу (-NH-CH(R)-CO-)n. |
| Решение | Уравнение реакции будет выглядеть следующим образом: |
| Задание | В чем заключается суть гидролиза белков под действием ферментов (энзимов)? |
| Решение | Гидролиз белков под действием ферментов является естественным процессом, который протекает в человеческом организме в ходе пищеварения. Под действием энзимов белки распадаются до аминокислот и усваиваются организмом. Подобную реакцию можно провести и в лабораторных условиях: сначала осуществляют реакцию денатурации белка – нарушение структуры – под действием нагревания, а затем полученную фракцию смешивают с ферментами. Так получают спортивное питание. |
Копирование материалов с сайта возможно только с разрешения
администрации портала и при наличие активной ссылки на источник.
Химия. 10 класс
§ 48. Белки
Белки
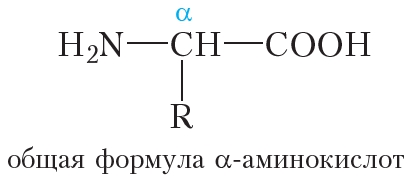
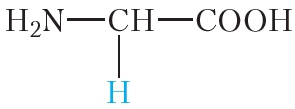
Молекулы белков построены из остатков α-аминокислот:
Образование молекулы белка из α-аминокислот можно представить следующей схемой:
Видно, что в молекулах белков аминокислотные остатки соединены пептидными связями, следовательно, белки являются полипептидами.
Молекулы белков обычно содержат сотни и даже тысячи аминокислотных остатков. При этом наиболее часто в составе белков встречаются остатки 20 разных аминокислот (табл. 48.1).
Таблица 48.1. Некоторые аминокислоты, остатки которых входят в состав белков

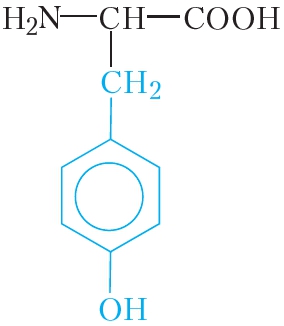
Остатки этих аминокислот расположены в макромолекуле белка в строго определённой последовательности (рис. 48.1).

На первый взгляд может показаться, что использование 20 разных аминокислот для построения молекул белков существенно ограничивает разнообразие белковых структур. На самом деле количество комбинаций, которое можно составить, используя для построения полипептидных цепей 20 разных аминокислот, практически бесконечно. Например, если полипептидная цепь будет состоять из 100 аминокислотных остатков, то, используя для её построения 20 различных аминокислот, можно составить 20 100 комбинаций!
3.8.2. Белки
Белки — высокомолекулярные органические соединения, состоящие из остатков аминокислот, соединённых в длинную цепочку пептидной связью.
В состав белков живых организмов входит всего 20 типов аминокислот, все из которых относятся к альфа-аминокислотами, а аминокислотный состав белков и их порядок соединения друг с другом определяются индивидуальным генетическим кодом живого организма.
Одной из особенностей белков является их способность самопроизвольно формировать пространственные структуры характерные только для данного конкретного белка.
| первичная | последовательность соединения остатков аминокислот | |
| вторичная | ||
| третичная |
Из-за специфики своего строения белки могут обладать разнообразными свойствами. Например, белки, имеющие глобулярную четвертичную структуру, в частности белок куриного яйца, растворяются в воде с образованием коллоидных растворов. Белки, обладающие фибриллярной четвертичной структурой в воде не растворяются. Фибриллярными белками, в частности, образованы ногти, волосы, хрящи.
Химические свойства белков
Гидролиз
Белок + nH2O => смесь из α-аминокислот
Денатурация
Разрушение вторичной, третичной и четвертичной структур белка без разрушения его первичной структуры называют денатурацией. Денатурация белка может протекать под действием растворов солей натрия, калия или аммония – такая денатурация является обратимой:
Денатурация же протекающая под действием излучения (например, нагрева) или обработке белка солями тяжелых металлов является необратимой:
Так, например, необратимая денатурация белка наблюдается при термической обработке яиц в процессе их приготовления. В результате денатурации яичного белка его способность растворяться в воде с образованием коллоидного раствора исчезает.
Качественные реакции на белки
Биуретовая реакция
Если к раствору, содержащему белок добавить 10%-й раствор гидроксида натрия, а затем небольшое количество 1 %-го раствора сульфата меди, то появится фиолетовое окрашивание.
раствор белка + NаОН(10%-ный р-р) + СuSO4 = фиолетовое окрашивание
Ксантопротеиновая реакция
растворы белка при кипячении с концентрированной азотной кислотой окрашиваются в желтый цвет:
раствор белка + HNO3(конц.) => желтое окрашивание
Что такое гидролиз белков
По химическому составу белки делятся на две группы:
а) простые белки – протеины, которые при гидролизе распадаются только на аминокислоты;
б) сложные белки или протеиды, образующие при гидролизе аминокислоты и вещества небелковой природы (углеводы, нуклеиновые кислоты и др.) — соединения белковых веществ с небелковыми.
1. Амфотерные свойства белков
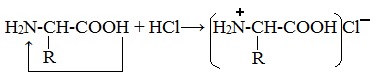
Так, при действии щелочей белок реагирует в форме аниона – соединяется с катионом щелочи:
При действии же кислот он выступает в форме катиона:
Если в молекуле белка преобладают карбоксильные группы, то он проявляет свойства кислот, если же преобладают аминогруппы, — свойства оснований.
Очень важным для жизнедеятельности живых организмов является буферное свойство белков, т.е. способность связывать как кислоты, так и основания, и поддерживать постоянное значение рН различных систем живого организма.
Белки обладают и специфическими физико-химическими свойствами.
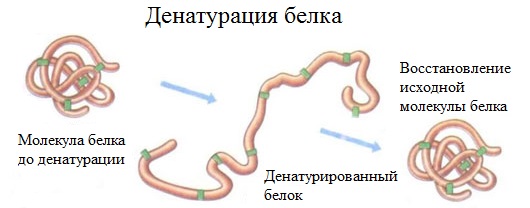
2. Денатурация белка (необратимое осаждение, свертывание)
Денатурация – это разрушение вторичной и третичной структуры белка (полное или частичное) и изменение его природных свойств с сохранением первичной структуры белка.
Сущность денатурации белка сводится к разрушению связей, обусловливающих вторичную и третичную структуры молекулы (водородных, солевых и других мостиков). А это приводит к дезориентации конфигурации белковой молекулы.
Денатурация бывает обратимой и необратимой.
Обратимая денатурация белка происходит при употреблении алкоголя, солёной пищи.
Например, яичный белок альбумин осаждается из раствора (свертывается) при варке яиц (при температуре 60-70 0 С), теряя способность растворяться в воде.
Видеоопыт «Свертывание белков при нагревании»
Видеоопыт «Осаждение белков солями тяжелых металлов»
Видеоопыт «Осаждение белков спиртом»
3. Гидролиз белков
Гидролиз белков – это необратимое разрушение первичной структуры в кислом или щелочном растворе с образованием аминокислот.
Анализируя продукты гидролиза, можно установить количественный состав белков.
Переваривание белков в организме по своей сути представляет ферментативный гидролиз белковых молекул.
В лабораторных условиях и в промышленности проводится кислотный гидролиз.
В ходе гидролиза белков происходит разрушение пептидных связей. Гидролиз белка имеет ступенчатый характер:
4. Цветные (качественные) реакции на белки
Для белков известно несколько качественных реакций.
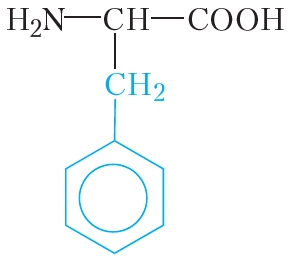
а) Ксантопротеиновая реакция (на остатки аминокислот, содержащих бензольные кольца)
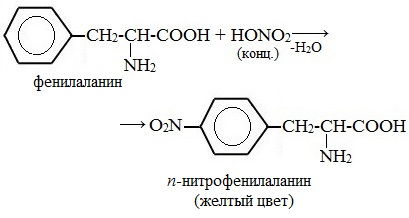
Белки, содержащие остатки ароматических аминокислот (фенилаланина, тирозина), дают желтое окрашивание при действии концентрированной азотной кислоты.
Причина появления окраски – образование нитропроизводных ароматических аминокислот, например, фенилаланина:
Видеоопыт «Ксантопротеиновая реакция на белки»
б) Биуретовая реакция (на пептидные связи)
Все соединения, содержащие пептидную связь, дают фиолетовое окрашивание при действии на них солей меди (II) в щелочном растворе.
Причина появления окраски – образование комплексных соединений с координационным узлом:
Видеоопыт «Биуретовая реакция белков»
Видеоопыт «Качественные реакции на белки: биуретовая и ксантопротеиновая»
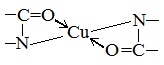
в) Цистеиновая реакция (на остатки аминокислот, содержащих серу)
Причина появления окраски – образование черного осадка сульфида серебра (II) PbS.
Видеоопыт «Качественное определение азота в органических соединениях»
Классификация белков и их гидролиз
Общая характеристика и классификация белков как высокомолекулярных органических соединений. Процесс разрушения первичной структуры белков. Особенности кислотного, энзимного и щелочного гидролиза белков. Значение аминокислот для организма человека.
| Рубрика | Биология и естествознание |
| Вид | реферат |
| Язык | русский |
| Дата добавления | 28.05.2015 |
| Размер файла | 19,3 K |
Отправить свою хорошую работу в базу знаний просто. Используйте форму, расположенную ниже
Студенты, аспиранты, молодые ученые, использующие базу знаний в своей учебе и работе, будут вам очень благодарны.
Размещено на http://www.allbest.ru/
Белки разделяются на протеины (простые белки), состоящие только из аминокислот и при гидролизе почти не образующие других продуктов, и протеиды (сложные белки), состоящие из собственно белковой части, построенной из б-аминокислот, и из соединенной с ней небелковой части, иначе называемой простетической группой. При гидролизе протеиды кроме б-аминокислот образуют и другие вещества, например, фосфорную кислоту, глюкозу, гетероциклические соединения и т. д.
1. Протеины разделяются на группы в зависимости от их растворимости и положения изоэлектрической точки:
1) Альбумины. Растворимы в воде, при нагревании свертываются. Осаждаются насыщенными растворами солей (не осаждаются насыщенным раствором хлорида натрия NaCl, но могут быть осаждены при насыщении раствора сульфатом аммония). Имеют сравнительно небольшую молекулярную массу. При гидролизе дают мало гликоколя. Входят в состав белка яйца, сыворотки крови, молока, а также ферментов и семян растений.
2) Глобулины. Нерастворимы в воде. Растворяются в разбавленных растворах солей и осаждаются концентрированными растворами солей. Свертываются при нагревании. Имеют большую молекулярную массу, чем альбумины. Входят в состав мышечных волокон (миозин), яйца, молока, крови, растительных семян (конопля, горох).
3) Проламины. Нерастворимы в воде. Растворяются в 60—80 %-ном спирте. Не свертываются при кипячении. Содержат много пролина. Входят в состав растительных белков (глиадин пшеницы, гордеин ячменя, зеин кукурузы).
2. Протеиды разделяются на группы в зависимости от состава небелковой части:
1) Нуклеопротеиды. Гидролизуются на простой белок (чаще всего гистоны или протамины) и нуклеиновые кислоты. Последние в свою очередь гидролизуются с образованием углевода, фосфорной кислоты, гетероциклического основания. Растворимы в щелочах и нерастворимы в кислотах. Входят в состав протоплазмы, клеточных ядер, вирусов.
3) Гликопротеиды. Гидролизуются на простой белок и углевод. Нерастворимы в воде. Растворяются в разбавленных щелочах. Нейтральны. Не свертываются при нагревании. Входят в состав слизей. Представитель: муцин, входящий в состав слюны.
4) Хромопротеиды. Распадаются при гидролизе на простой белок и красящее вещество. Примером является гемоглобин крови; при гидролизе он расщепляется, образуя белок глобин и красящее вещество гем красного цвета.
5) Липопротеиды. Это соединения белка с липидами. Содержатся в протоплазме клеток, в сыворотке крови, в яичном желтке.
Белки классифицируются также по форме их молекул:
1) фибриллярные (волокнистые) белки, молекулы которых имеют нитевидную форму; к ним относят фиброин шелка, кератин шерсти;
2) глобулярные белки, молекулы которых имеют округлую форму; к ним относятся, например, альбумины, глобулины и ряд других, в том числе и сложные белки.
классификация гидролиз белок
Процесс гидролиза белков
2.1 Кислотный гидролиз
2.2 Энзимный (ферментативный) гидролиз белка
На первом этапе ферментного гидролиза сырье подвергают легкой температурной обработке. В итоге белок частично денатурирует (разрушается). После чего полученную фракцию смешивают с ферментами, которые завершают процесс гидролиза.
2.3 Щелочной гидролиз белка
При щелочном гидролизе происходит рацемизация большинства аминокислот и полное разрушение аргинина, лизина, цистина и цистеина. В результате такого гидролиза образуется комплекс дефектных, чуждых организму компонентов.
А насчет применения гидролиза в органике, то чаще это связано с получением тех или иных соединений, активные группы которых защищают для того, чтобы на этапе синтеза они не вступали в ненужные реакции. А затем путем гидролиза блокировку групп снимают. Очень часто гидролиз применяют в пептидном синтезе.
Например, щелочным гидролизом (омылением) кокосового жира получают основу для производства мыла. Триглицериды кокосового жира при этом распадаются на натриевые (калиевые) соли жирных кислот и глицерин.
3. Роль отдельных аминокислот для организма человека
Гамма-аминомасляная кислота незаменима в случаях заболевания артериальной гипертензией и эпилепсией.
Глутаминовая кислота необходима в случае язв или дистрофии мышц.
Глицин отвечает за скорейшее восстановление поврежденных тканей.
Изолейцин необходим для правильной регулировки уровня сахара в крови.
Лейцин ускоряет восстановлению или лечению мышечной ткани, костей и кожи.
Лизин необходим для правильного усвоения кальция, правильно распределяет его для роста и питания костей. Также он необходим для укрепления сердечного тонуса, усиливает резистентность организма, понижает уровень вредного холестерина в крови.
Метионин нужен для лечения аллергии химического происхождения, а также при остеопорозе.
Пролин отвечает за укрепление сердечной мышцы.
Серин балансирует обмен жирных кислот и жиров в организме.
Таурин просто необходим при гипогликемии, при заболевании атеросклерозом, отвечает за метаболизм желчной кислоты.
Треонин необходим для поддержания иммунитета, регулирует обмен белков и жиров, предотвращает отложение в печени жиров.
Тирозин очень полезен, если у человека хроническая усталость, данная аминокислота стоит перед гормонами щитовидки, также она отвечает за образование адреналина и норадреналина.
Триптофан, полезен сердечникам, а также при хронической бессоннице. Вообще триптофан синтезирует в организме огромное количество витамина РР, стоит непосредственно перед нейромедиатором серотонином. Именно серотонин отвечает за эмоциональное состояние человека, при недостатке человек впадает в депрессию.
Цистеин необходим для лечения ревматоидного артрита, используется при лечении рака и болезнях артерий.
Размещено на Allbest.ru
Подобные документы
Понятие белков как высокомолекулярных природных соединений (биополимеров), состоящих из остатков аминокислот, которые соединены пептидной связью. Функции и значение белков в организме человека, их превращение и структура: первичная, вторичная, третичная.
презентация [564,0 K], добавлен 07.04.2014
Физические, биологические и химические свойства белков. Синтез и анализ белков. Определение первичной, вторичной, третичной и четвертичной структуры белков. Денатурация, выделение и очистка белков. Использование белков в промышленности и медицине.
реферат [296,5 K], добавлен 10.06.2015
Физические и химические свойства, цветные реакции белков. Состав и строение, функции белков в клетке. Уровни структуры белков. Гидролиз белков, их транспортная и защитная роль. Белок как строительный материал клетки, его энергетическая ценность.
реферат [271,2 K], добавлен 18.06.2010
Белки (протеины) – высоко молекулярные, азотосодержащие природные органические вещества, молекулы которых построены из аминокислот. Строение белков. Классификация белков. Физико-химические свойства белков. Биологические функции белков. Фермент.
реферат [4,0 M], добавлен 15.05.2007
контрольная работа [199,0 K], добавлен 13.03.2013