Что такое мультифакториальные заболевания
Мультифакториальные заболевания
Генетическая информация в сочетании с влиянием внешней среды определяют уникальность каждого человека. Под «внешней средой» мы здесь понимаем совокупность множества факторов влияющих на жизнь человека таких, как вредные привычки, воспитание, профессиональная деятельность, физическая активность и многих, многих других.
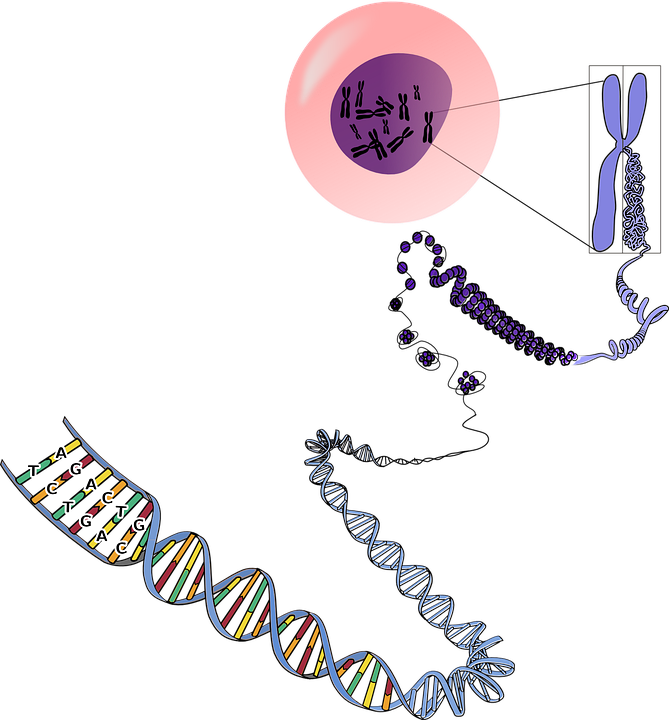
Каждая клетка человеческого организма содержит 23 пары хромосом.
В каждой паре одна хромосома от матери, одна от отца. Исключение составляют половые клетки (яйцеклетки и сперматозоиды), которые содержат по одной хромосоме из каждой пары.
После оплодотворения яйцеклетки сперматозоидом, получается зародыш с 23 парами хромосом, из которого развивается человек с полным объемом генетической информации.
Молекула ДНК представляет собой последовательность нуклеотидов («букв»). Эта последовательность нуклеотидов кодирует наследственную информацию.
В результате международной программы «Геном человека» в 2003 году была расшифрована такая последовательность для всех хромосом человека (за исключением ряда участков, чья расшифровка затруднена в связи с их структурными особенностями).

Кроме внешности, характера или способностей человек наследует также особенности своего здоровья – устойчивость к стрессам, способность переносить физические нагрузки, особенности обмена веществ, переносимость медикаментов. Уникальность наследственной информации проявляется в особенностях функционирования организма на молекулярном уровне. Например, у одного человека определенный фермент может быть более активен, чем у другого, а у третьего этот фермент может вообще отсутствовать. Такие вариации могут приводить к различным заболеваниям, причем эти заболевания делятся на наследственные и мультифакториальные.
Наследственные заболевания
В случае наследственных заболеваний изменения в геноме (мутации) напрямую ведут к развитию заболевания. То есть если мутацию передал один из родителей, то человек становится носителем заболевания, если мутацию передали оба родителя, то человек заболеет. К самым распространенным генетическим (или наследственным) заболеваниям относят муковисцидоз, фенилкетонурию, гемофилию, дальтонизм и другие.
Наследственные заболевания достаточно редкое явление, в основном вариации в геноме связаны с мультифакториальными заболеваниями.
Мультифакториальные заболевания.
Полиморфизмы встречаются с частотой больше 1-2%. Они могут быть нейтральными (никак не воздействовать на организм), предрасполагать к заболеваниям при определенных условиях либо, наоборот, в некоторой степени защищать от развития заболевания.
То есть само наличие генетической предрасположенности к заболеванию не обязательно приведет к развитию этого заболевания. Однако при наличии неблагоприятных факторов «внешней среды», человек с наследственной предрасположенностью имеет значительно большую вероятность заболеть, чем люди, не имеющие такой предрасположенности.
В качестве наглядного примера можно привести предрасположенность к раку легкого и такой фактор «внешней среды», как курение. Всем известно о вреде курения и о том, что эта вредная привычка может привести к раку. Однако от курильщиков в качестве опровержения вреда курения часто можно услышать истории про то, как кто-либо курил всю жизнь по две пачки сигарет в день и прожил до 90 лет. Да, такое случается, только это не опровергает вред курения, это говорит о том, что одни люди предрасположены генетически к развитию рака легкого, а другие нет. И в сочетании с таким фактором «внешней среды», как курение, наследственная предрасположенность с большой вероятностью приведет к развитию рака.
Что такое мультифакториальные заболевания
СОВРЕМЕННЫЕ АСПЕКТЫ ГЕНЕТИКИ МУЛЬТИФАКТОРИАЛЬНЫХ ЗАБОЛЕВАНИЙ
Проблема изучения генетических механизмов предрасположения к болезням, наследование которых не подчиняется менделевским правилам, остается пока что одной из наименее разработанных в генетике человека. Важность этой проблемы определяется огромным значением группы мультифакториальных заболеваний для современной медицины. Она составляет приблизительно 94 % от всех болезней человека, в развитии которых наследственные факторы играют ту или иную роль. Предполагается, что лишь вскрытие генетических механизмов предрасположения к развитию этих болезней может решить такие кардинальные проблемы современной клинической медицины, как классификация форм болезней и их нозологическая принадлежность, высоко индивидуализированная терапия заболеваний, научно обоснованная профилактика и т. д.
Группа мультифакториальных заболеваний характеризуется, как теперь уже установлено, важными характерными отличиями от менделирующих наследственных болезней. Среди них можно отметить следующие:
а) высокая частота распространения в общей популяции независимо от географических, этнических и культурных факторов, хотя в отдельных случаях эти факторы могут обусловить незначительные различия между отдельными популяциями; б) значительная вариабельность
возраста проявления основных клинических симптомов; в) как правило, более раннее начало и некоторое утяжеление клинических проявлений в нисходящих поколениях семейных случаев; г) существование четких половых различий в популяционной частоте отдельных типичных клинических форм данного заболевания; д) обычно низкий уровень конкордантности по манифестным проявлениям патологического признака в парах монозиготных близнецов.
Совокупность указанных факторов лежит в основе характерного для мультифакториальных заболеваний (МФБ) клинического континуума двух типов: первый определяется наличием многообразных стертых и субклинических вариантов, образующих непрерывный переход от выраженных форм болезни до нормы; второй тип континуума основан на множественных переходных вариантах патологии между типичными манифестными формами того или иного заболевания (рис. 1).
Рис. 1. Два основных типа клинического континуума при мультифакториальных заболеваниях (МФБ).
Стало очевидным, что МФБ являются особой группой признаков, эффективный генетический анализ которых требует разработки адекватной стратегии исследования и специальных аналитических приемов.
Эта методология основана на использовании концепции наследуемости, разработанной Р. Фишером, как известно, применительно к хозяйственно полезным признакам в селекционной практике. Все мы хорошо понимаем определенную ограниченность этой концепции в приложении к анализу сложных фенотипов у человека. Эта ограниченность определяется, во-первых, тем фактом, что концепция наследуемости, будучи сугубо описательной, слабо отражает содержательный аспект изучаемого признака и не углубляет наших представлений о природе самих генетических детерминант, определяющих признак. Что требует достаточно осторожного использования соответствующего аналитического аппарата, но в то же время является важным стимулом для дальнейшей разработки данной методологии с целью повышения ее эффективности в прикладных исследованиях по генетике человека. Тем не менее современный уровень разработки проблемы наследуемости в рамках пороговых моделей подверженности к проявлению МФБ позволяет получать на основе репрезентативных генетико-эпидемиологических материалов принципиально новые данные в области клинической генетики. Возвращаясь к приведенной табл. 1, укажем, что данный подход позволяет ответить на вопрос о том, являются ли какие-либо две различные клинические формы болезни генетически едиными, независимыми или частично связанными, т. е. детерминированными частично общими генами. Для этого необходимо располагать сведениями о популяционной частоте данных форм патологии и о частоте пораженных родственников пробандов страдающих теми же формами.
Хорошей иллюстрацией этого подхода могут служить данные, полученные в лаборатории общей патофизиологии Института психиатрии АМН СССР о наследуемости и генетической корреляции между основными клиническими формами эндогенных функциональных психозов. В течение десятилетий вопросы о взаимоотношениях основных форм эндогенных психозов (шизофрения, шизоаффективные психозы и маниакально-депрессивный психоз) вызывали наиболее ожесточенные дискуссии и продолжают оставаться нерешенными до сих нор. Стало уже очевидным, что решение этой проблемы не может быть достигнуто на пути чисто клинического анализа. Изложенная выше методология генетического изучения квазинепрерывных признаков позволяет, на наш взгляд, внести определенную ясность в решение этой проблемы. В табл. 2 приведены результаты
Таблица 1. Генетический анализ различных клинических форм болезней [ Reich , 1972; Smith , 1976 (пороговая модель подверженности)
Генетические корреляции между А и Б
Таблица 2. Наследуемость (Н%) и генетическая корреляция ( rG ) между различными формами эндогенных психозов
Клинические формы шизофрении
анализа четырех основных форм эндогенных психозов, основанные на большом генетико-эпидемиологическом материале, составляющем 600 семей и почти 3000 родственников первой степени, собранном в Институте психиатрии АМН СССР. Как видно из этой таблицы, наследуемость всех указанных форм достаточно высокая (в пределах 75—95 %), что свидетельствует о существенном вкладе генетических факторов в их развитие. Но самое существенное состоит в том, что, как оказалось, генетическая корреляция между отдельными формами психозов значительно варьирует. При этом генетическая общность наиболее тяжелых форм шизофрении и наиболее легких форм шизоаффективных психозов оказывается минимальной (корреляция 0,21), тогда как генетическая общность маниакально-депрессивного психоза и периодической шизофрении близка к максимальной (корреляция 0,99), что, в свою очередь, свидетельствует почти о полной идентичности генетических факторов, детерминирующих эти две формы психозов. Приведенные корреляции являются еще одним доказательством, постулирующим и объясняющим природу клинического континуума различных форм эндогенных психозов.
Другим фундаментальным аспектом в исследовании генетики МФБ является изучение биологических маркеров предрасположения к заболеванию, которые могут непосредственным образом отражать патогенез болезни (так называемые патогенетические маркеры) или же являться лишь, вторичными проявлениями заболевания. Прежде всего для генетического анализа необходимо располагать достаточно обширными данными не только относительно больных и их родственников, но и данными относительно родственников здоровых лиц (здоровые семьи). Ниже представлена схема методологии генетического анализа биологических маркеров патогенеза.
Стратегия генетического исследования биологических маркеров представлена на третьей схеме. Как видно из этой схемы, все биологические маркеры могут быть разделены на две основные группы: одномерные маркеры и совокупность коррелирующих биологических показателей — так называемые многомерные маркеры. Для тех в других необходимым является определение их наследуемости для дальнейшего установления генетической корреляции того или иного маркера с подверженностью к заболеванию, а также для установления генетической и средовой корреляции, между различными маркерами. Такой подход позволяет выделить среди большого разнообразия биологических показателей заболевания именно те, которые наиболее интимно связаны с генетическими детерминантами патологии и которые принято называть патогенетическими маркерами предрасположения.
Так, например, в совместном исследовании лаборатории общей патофизиологии Института психиатрии АМН СССР и Всесоюзного кардиологического научного центра [В. А. Кошечкин и соавт.] было показано (табл. 3), что генетическая корреляция показателей сывороточного холестерина и триглицеридов с подверженностью к ишемической болезни сердца (ИБС) существенно различается.
Если повышенный уровень холестерина достаточно высоко коррелирует (за счет общности генетических факторов) с подверженностью к ИБС (гс=0,54), то повышенный уровень триглицеридов если и обнаруживает корреляцию с подверженностью к ИБС, то не за счет общности генетических факторов ( rQ =0,03), а скорее всего за счет общности каких-то средовых детерминант. Эти результаты представляются нам достаточно важными, поскольку они позволяют четко дискриминировать участие генотипических и средовых факторов не на уровне общих количественных оценок наследуемости, а на уровне конкретных биологических показателей, отражающих различные звенья патогенеза заболевания.
Приведенные данные являются примером более или менее классической ситуации, когда из нескольких маркеров лишь один обнаруживает наиболее жесткую генетическую корреляцию с подверженностью к заболеванию. Однако более типичными для генетики МФБ являются примеры, когда одновременно несколько различных биологических показателей обнаруживают хотя и не очень выраженную, но значимую генетическую корреляцию с подверженностью к заболеванию (табл. 4). Так, в Лаборатории общей патофизиологии Института психиатрии АМН СССР при мультидисциплинарном изучении шизофрении было показано, что целый ряд биологических маркеров коррелировал с подверженностью к развитию психоза в пределах 0,36—0,48. Среди этих маркеров наиболее важными оказались сывороточный нейротропный фактор, сывороточные антитела к мембранным антигенам тимоцитов и уровень сывороточной лактатдегидрогеназы.
В качестве иллюстрации другой более сложной ситуации мы хотели бы привести результаты генетического анализа многомерной совокупности количественных показателей, отражающих один из важных нейропсихических механизмов познавательной деятельности человека. Согласно данным патопсихологов Института психиатрии АМН СССР [Ю. Ф. Поляков, 1974], этот механизм выражается в «избирательном» привлечении из памяти сведений, обусловленных прошлым опытом индивида. При шизофрении этот механизм нарушается. Проведенный в Лаборатории общей патофизиологии Института психиатрии АМН СССР дискриминантный анализ, основанный на изучении межиндивидуальных различий по 12 первичным психометрическим характеристикам, показал, что наилучшее разделение больных шизофренией и здоровых лиц достигается по 7 из 12 первичных показателей. Эта дискриминантная функция может рассматриваться как интегральная характеристика исследуемых психометрических показателей. Генетический анализ данной интегральной характеристики дает возможность оценить вклад генетических факторов не в отдельные показатели, а в суммарные различия между больными и здоровыми. Как оказалось, вклад аддитивной и доминантной генетических компонент составляет 55 %, а генетическая корреляция этой интегральной характеристики с подверженностью к шизофреническим психозам равна 0,48. Этот результат позволяет рассматривать указанную интегральную характеристику в качестве патогенетического маркера предрасположения к шизофрении.
Таблица 3. Корреляция холестерина и триглицеридов плазмы с подверженностью ишемической болезни сердца (ИБС) (наследуемость подверженности кИБССа (п2)=0,60)
Таблица 4. Наследуемость (Н%) и генетическая корреляция ( rG ) биологических маркеров с предрасположенностью к шизофрении
Генетическая корреляция с подверженностью
Сывороточный нейротропный фактор
ЛДГ сыворотки крови
Таблица 5. Оценка пенетрантности для некоторых МФБ на основе простых менделевских моделей
Тестируемые параметры моногенных менделевских моделей
Популяционная частота фенотипа
Конкордантность пробандовая МЗ-пары
Такого рода результаты дают основание для развития гипотезы об олиголокусных моделях наследования подверженности к развитию болезни. В рамках подобных моделей попытка обнаружения одного специфического биологического нарушения представляется малоперспективной. С точки зрения олигогенной гипотезы детерминации заболевания биологическая структура патогенеза включает в себя констелляции нескольких патофизиологических сдвигов, часть из которых оказываются общими для некоторых клинических форм, а часть — различными к специфическими только для отдельных из них. В такой ситуации общая структура генетических корреляций отдельных биологических маркеров как с подверженностью к заболеванию, так и между собой может иметь достаточно сложный характер.
Важно подчеркнуть, что попытки анализа олиголокусных моделей на основе традиционного аналитического аппарата для менделевских моделей приводит к необходимости постулировать так называемую неполную пенетрантность основного генотипа. В связи с этим следует заметить, что в прошлом предположения о неполной пенетрантности в рамках простых моделей наследования довольно часто привлекались для интерпретации результатов сегрегационного анализа. Однако из-за отсутствия адекватного аналитического аппарата для количественной оценки пенетрантности подобные предположения оставались в рамках спекулятивных гипотез.
Значение олигогенных моделей для клинической медицины состоит также и в том, что с этих позиций некоторые давно известные факты и дискуссии, имевшие место в прошлом, могут приобрести новое содержание.
В связи с этим я бы хотел остановиться на проблеме новейших генетических интерпретаций феномена антиципации. Хорошо известна продолжительная дискуссия по этому вопросу в 30—40-х годах, завершившаяся окончательными утверждениями об артефактной природе этого явления, обусловленного систематическим смещением регистрации семейных случаев заболевания. Естественно, что касается классических доминантных менделирующих, т. е. моногенных заболеваний, это объяснение вполне очевидно и не нуждается в пересмотре. Однако клиническая практика показывает, что при многих МФБ и определенно при эндогенных психозах (о чем свидетельствуют клинические данные) более раннее проявление и некоторое утяжеление патологии в нисходящих поколениях встречается настолько систематически и часто, что возникают сомнения в правомерности критических оценок самого феномена. Эти сомнения подкрепляются еще тем фактом, что для МФБ моногенная детерминация является наименее вероятной.
В связи с этим в лаборатории общей патофизиологии Института психиатрии АМН СССР была предпринята попытка проверки реальности существования феномена антиципации с учетом основных дефектов прошлых исследований по этому вопросу. С этой целью в исследовании были взяты не два поколения, а три и в качестве контроля к родителям пробандов исследовались также сибсы родителей, т. е. дяди—тети пробандов. Эти и ряд других методических приемов позволили исключить систематическое влиянии особенностей регистрации семейных случаев по пораженным детям на кривые динамики возраста начала психоза в последующих поколениях (рис. 2). На представленном рисунке отчетливо видно, что в трех последовательных поколениях происходит явное понижение возраста начала психоза, а указанная зависимость носит линейный характер. Более подробная аргументация относительно изложенных результатов представлена в работе В. И. Трубникова и соавт. [1978].
Здесь же я бы хотел в большей степени уделить внимание возможной интерпретации феномена антиципации при МФБ с генетической точки зрения. В рамках олиголокусных моделей детерминации необходимость постулирования двустороннего наследования соответствующих генетических детерминант почти очевидна. Между тем двустороннее наследование генов означает, что в нисходящих поколениях имеет место гомозиготизация по локусам, вовлеченным в общую олигогенную систему детерминант, предрасполагающих к заболеванию. Естественно поставить вопрос: какова динамика этого процесса и каков ее предел в ряду нескольких поколений? То есть сколь долго этот процесс может продолжаться в пределах одной большой семьи или рода? На основании генетических данных и оценок эффективного числа локусов, определяющих различия между поздними и ранними формами эндогенных психозов, мы предполагаем, что указанный процесс гомозиготизации действует в пределах 3—4 поколений. При этом важным механизмом, поддерживающим этот процесс в отдельных семьях, является, как нам кажется, позитивная брачная ассортативность среди лиц, предрасположенных к проявлению аномалий психической деятельности.
Эти предположения непосредственным образом вытекали из тех фактов, которые были получены в Институте психиатрии АМН СССР при анализе многочисленных генеалогий, так же как и при анализе корреляции между родителями наших пробандов по ряду психометрических и биологических показателей. Об этих результатах более подробно сообщено в других работах сотрудников лаборатории общей патофизиологии Института психиатрии АМН СССР.
На рис. 3 приведена схема (так называемая воронка), которая отражает динамику и последствия предполагаемой гомозиготизации в пределах нескольких поколений и может в некоторой степени служить моделью, объясняющей поддержание частот заболеваний психозами в популяции.
Рис. 2. Возраст начала заболевания в трех поколениях семей больных шизофренией
Рис. 3. Динамика и последствия гомозиготизации в пределах нескольких поколений
Генетическое тестирование: моногенные и мультифакториальные болезни
Однако разработки и внедрение новых, высокотехнологичных способов анализа генома человека, в том числе с использованием микрочип-технологий, дали возможность определять нарушение структуры генов во всех хромосомах. Разработана и внедряется технология полногеномного секвенирования генома человека.
На основе достижений в исследовании генома человека удалось идентифицировать не только гены, вызывающие наследственные болезни (НБ), но и мутации, которые приводят к наиболее частым, т.н. мультифакториальным заболеваниям. Впервые открывается возможность проводить не только точную молекулярную диагностику, но и определять предрасположенность человека к тому или иному заболеванию. Исследование генетических механизмов широко распространенных болезней особенно важно, так как эта патология вносит основной вклад не только в структуру заболеваемости, но и смертности взрослых и детей.
Доказана существенная роль генетических факторов в возникновении эссенциальной гипертонии, сахарного диабета, бронхиальной астмы, атеросклероза, некоторых форм рака, многих врожденных пороков развития и др. Большинство этих заболеваний имеют мультифакториальную природу, т.е. проявления клинических симптомов возникают только в результате совместного действия некоторого числа генетических и средовых факторов. Такие болезни получили название мультифакториальных (другие их названия: мультифакторные; полигенные), или болезней с наследственной предрасположенностью. Термин «мультифакториальные» заболевания (МФЗ) ввел L.S. Penrose в 1947 г. [2]. Гены, аллельные варианты которых предрасполагают к определенным заболеваниям, получили название генов предрасположенности [3].
Внимание к изучению генетических механизмов широко распространенных болезней, вносящих основной вклад в структуру заболеваемости и смертности человека, особенно усилилось после завершения масштабной программы «Геном человека».
Генетические основы болезней с выраженным наследственным предрасположением остаются во многом неисследованными, неясны их этиология и патогенез, тем не менее уже сейчас очевидно, что механизмы их формирования сложны и многообразны. Единодушно всеми признается, что в основе наследственной предрасположенности к болезням лежит широкий генетический балансированный полиморфизм популяций человека по ферментам, структурным и транспортным белкам, антигенам. В популяциях человека не менее 25-30% локусов (из 40 000) представлено двумя и более аллелями [1]. Они обеспечивают генетическую уникальность каждого человека.
Без провоцирующей роли среды не возникают и МФЗ. Наследственная предрасположенность к болезни может иметь полигенную или моногенную основу.
Моногенная предрасположенность определяется одним геном (мутацией), но для патологического проявления мутации необходимо обязательное, провоцирующее действие факторов внешней среды.
Полигенная предрасположенность определяется сочетанием аллелей нескольких генов, их определенной комбинацией при провоцирующем влиянии внешнесредовых факторов. Идентификация этих генов и их аллелей весьма затруднительна. Но они определяют и формируют мультифакториальные болезни.
Каждая нозологическая форма болезни с наследственным предрасположением на самом деле генетически гетерогенная группа. Отдельные болезни (например, гипертоническая болезнь, ишемическая болезнь сердца, язвенная болезнь желудка, сахарный диабет и др.) представляют собой не одну болезнь, а группу болезней с одинаковым конечным проявлением. Чем выше наследственная предрасположенность и больше вредных воздействий среды, тем выше вероятность заболеть тем или иным заболеванием.
Болезни с наследственным предрасположением отличаются от других форм наследственной патологии (генных и хромосомных болезней) характером клинической картины. В отличие от генных болезней, при которых всех членов семьи пробанда можно разделить на больных и здоровых, клиническая картина болезней с наследственным предрасположением имеет непрерывные клинические переходы (клинический континуум) в пределах одной и той же нозологической формы. Для МФЗ характерно различие в их проявлении и тяжести течения в зависимости от пола и возраста. Механизмы популяционной распространенности таких болезней во времени достаточно сложны, поскольку в популяциях могут изменяться в ту или иную сторону и генетические характеристики предрасположенности, и факторы среды.
Основные методы и генетические тесты наследственной предрасположености к заболеваниям
В норме у человека имеется 46 хромосом. Все хромосомы содержат примерно 3 млрд пар нуклеотидов ДНК, в которых содержится примерно 20-25 тыс. генов. При этом оказалось, что только 1,5-2% всех генов являются функционально значимыми, т.е. способны кодировать белки и функционально важные регуляторные межгенные участки.
Несмотря на исключительную важность функциональных участков, у разных людей они до определенной степени не идентичны, что в результате приводит к разнообразию фенотипического (внешнего) проявления, наследственным заболеваниям, различным генетически обусловленным индивидуальным предрасположенностям. В основном эти отличия обусловлены вариациями единичных нуклетотидов, т.е. однонуклеотидными полиморфизмами SNP (от англ. single nucleotide polymorphism).
К настоящему времени структура генома человека известна, что позволяет выявлять и анализировать индивидуальные генетические отличия конкретного человека. Для их выявления используются методы ПЦР, секвенирование и анализ с использованием микрочипов. Каждый из этих методов имеет свои технологические особенности.
После завершения очередных стадий проектов «Геном человека», «Геномы рас», «1000 и 1 геном», таких проектов как GWAS (Genome-Wide Association Study), накоплено огромное количество информации как о полиморфных участках генома человека в целом, так и об их корреляциях с заболеваниями человека. Это касается моногенных рецессивных наследственных заболеваний, мультифакториальных (полигенных) заболеваний и различных генетически обусловленных предрасположенностей.
Исследования генома человека сделали реальной раннюю, досимптоматическую диагностику не только генных, но и многих мультифакториальных заболеваний.
Для многих МФЗ уже известны такие гены. Предлагается сочетания генов для каждой конкретной нозологии называть генной сетью [4]. В каждой из таких сетей выделяют главные (центральные) гены, обеспечивающие координацию функций остальных элементов, и дополнительные (вспомогательные) гены, называемые иногда «гены-модификаторы», которые ускоряют и усугубляют патологический процесс.
Участие нескольких генов в генетическом контроле может иметь форму их аддитивного действия, либо вклад одного из генов настолько велик, что можно говорить об эффекте «главного гена», который наиболее важен для формирования наследственной предрасположенности, а остальные будут иметь модифицирующее влияние. Однако наличия этого гена хотя и необходимо, но недостаточно для развития заболевания. Предположение о наличии главного гена может быть высказано только в том случае, если у пациентов обнаружены мутации в этом гене, не встречающиеся у здоровых людей. В большинстве случаев продукт главного гена играет ключевую роль в патогенетических механизмах формирования патологических симптомов заболевания. В качестве примера можно привести значительный вклад двух генов pCA1 и pCA2 в предрасположенность к семейным формам рака молочной железы. Существование «эффекта главного гена» позволяет использовать классический параметрический подход для анализа сцепления выбранных генов-кандидатов при картировании генов предрасположенности к заболеваниям.
Гены предрасположенности условно разделяют на гены «внешней среды», гены-«триггеры» и гены клеточных рецепторов [5].
Гены, кодирующие ферменты детоксикации, характеризуются значительным полиморфизмом первичной молекулярной структуры и обнаруживают существенные популяционные и расовые вариации, связанные с исторически сложившимися традициями, различиями в потреблении продуктов питания, географической среды обитания, с эпидемиями инфекционных болезней и др.
Дефектный ген ангиотензинпревращающего фермента (АСЕ) ассоциирован с развитием гипертрофии миокарда и гладкой мускулатуры сосудов, а также состоянием инсулинорезистентности, что имеет существенное значение в генезе эссенциальной гипертензии, инфаркта миокарда, инсулиннезависимого сахарного диабета, диабетической нефропатии и другой сосудистой патологии [6].
Один из аллелей (4-й) гена аполипопротеина Е (АроЕ) ассоциирован не только с предрасположенностью к атеросклерозу, но и с болезнью Альцгеймера, хореей Гентингтона, другими нейродегенеративными заболеваниями.
Таким образом, тестирование аллельных вариантов практически любого гена предрасположенности дает в распоряжение врача-клинициста богатую информацию о состоянии многих систем организма и позволяет оценить предрасположенность пациента сразу к нескольким различным, зачастую патогенетически далеко отстоящим друг от друга, заболеваниям. В последние годы в результате интенсивного развития молекулярно-генетических методов удается идентифицировать гены, мутации которых вносят существенный вклад в предрасположенность к развитию различных МФЗ.
Основные причины трудностей идентификации генов, вносящих вклад в генетическую предрасположенность к мультифакториальным заболеваниям, связаны со следующими факторами: 1) отсутствием менделевского типа наследования у большинства заболеваний; 2) наличием у них выраженной генетической гетерогенности (каждая клиническая форма представляет собой группу наследственных дефектов с одинаковым проявлением); 3) недостаточной изученностью патогенетических механизмов заболеваний.
С помощью модели главного гена в группе мультифакториальных заболеваний удалось выделить формы, имеющие моногенное наследование.
Методы идентификации генов предрасположенности
В настоящее время для идентификации генов предрасположенности к мультифакториальным заболеваниям используют три основных метода: 1) анализ ассоциации заболевания с полиморфными маркерами; 2) анализ сцепления заболевания с полиморфными маркерными генами; 3) экспериментальные скрещивания животных.
Анализ ассоциации БНП с полиморфными маркерами
В основе этого метода лежит сравнительный анализ частоты встречаемости определенного полиморфного маркера у больных и в контрольной выборке здоровых индивидов из той же популяции. В качестве полиморфных маркеров при их изучении с мультифакториальными заболеваниями используется генетические маркеры (определенные аллели гена) и антигены главного комплекса гистосовместимости (HLA-комплекса (human leucocyte antigens)).
Наиболее четкие ассоциации с антигенами различных классов HLA-комплекса были выявлены для аутоиммунных и инфекционных заболеваний, в патогенезе которых ведущее место занимают иммунологические реакции. Возможно, что гены комплекса HLA могут быть одним из генов (даже главными генами), формирующими генетическую компоненту этих мультифакторальных заболеваний. В некоторых случаях (например, при ревматоидном артрите) ассоциации настолько достоверны, что часто рассматриваются как маркеры заболевания и имеют диагностическое и дифференциально-диагностическое значение.
Анализ сцепления МФЗ с полиморфными маркерами
Этот метод в настоящее время считается одним из наиболее перспективных подходов к идентификации генов предрасположенности к МФЗ. Это подход основан на анализе сцепления заболевания с полиморфными ДНК-маркерами. Для анализа используют от 300 до 500 таких маркеров, распределенных по всему геному. В последние годы для выявления сцепления МФЗ с определенным геном все чаще используют метод полногеномного скрининга. Однако до настоящего времени ни для одного МФЗ не удалось идентифицировать все гены.
Метод экспериментального скрещивания модельных животных
Полезная информация о локализации генов МФЗ может быть получена при скрещивания модельных животных, принадлежащих к одной генетической линии. Использование этого метода позволяет исключить влияние генетической гетерогенности изучаемого заболевания и контролировать действие внешнесредовых факторов. Благодаря большому количеству потомков и высокой скорости размножения экспериментальных животных при их скрещивании удается картировать локусы количественных признаков, связанных с определенными видами наследственной патологии. К ограничениям этого метода следует отнести невозможность прямой экстраполяции результатов, полученных на животных к человеку. В этом случае проводится анализ сходства генетических механизмов гомологичных участков генома человека и экспериментального животного.
Генетические технологии выявления генных болезней и наследственной предрасположенности могут быть рекомендованы для пар, вступающих в брак, по следующим направлениям:





