Что такое нативная конформация
Недоупорядоченные белки
Недоупорядоченные белки
Процесс сворачивания (или фолдинга) биомакромолекул часто описывают с помощью метафоры поверхности свободной энергии, наиболее глубокий «колодец» на которой соответствует нативному (наиболее заселённому) состоянию молекулы. На картинке — схема фолдинга молекулы РНК L–21
Автор
Редакторы
Одна из основных догм структурной биофизики гласит, что строение молекулы определяет её функцию, подразумевая тем самым наличие чётко заданной пространственной структуры. Для большинства белков, организация и функции которых хорошо изучены, — таких, как «классические» ферменты, — хорошо известно, как именно должны быть расположены те или иные фрагменты белковой молекулы, чтобы она выполняла свою функцию. Однако в последнее время было открыто довольно много белков, структура которых не столь чётко задана, — которые, выражаясь в терминах физики белка, пребывают в состоянии расплавленной глобулы, вообще не имея «плотно упакованного» состояния и обладая аномально высокой подвижностью. И, что самое интересное, такие белки, тем не менее, выполняют важные функции, и некоторые особенности такой их «несовершенной» организации, возможно, играют особенную роль в таких биологических процессах как регуляция транскрипции и передача сигналов.
В течение уже, по крайней мере, века, умы биохимиков и молекулярных биологов заняты загадкой ферментативного катализа, а в особенности самой главной его чертой — способностью к невероятному ускорению практически любой биологически важной химической реакции. Современное представление о механизме ферментативного катализа основывается на идее Лайнуса Полинга о том, что фермент имеет сродство к переходному состоянию реакции (существующему очень короткое время), снижая тем самым энергетический барьер для данного превращения. Обычно, говоря о белковом катализе, исходят из представления о практически статичном активном сайте фермента, «вылепленном» эволюцией для идеального соответствия (пространственного и электростатического) структуре переходного состояния. Впрочем, недавно в экспериментах по ЯМР-спектроскопии было наглядно продемонстрировано, что активные сайты обладают динамической подвижностью, и что характерные времена этих движений тесно связаны с временами соответствующей ферментативной реакции [1]. И хоть само по себе открытие динамической подвижности не сотрясает основ структурной биологии (центральная догма — «структура определяет функцию»), в качестве такого «сотрясения» можно выделить открытие того, что от 1/6 до 1/3 эукариотических белков не имеют чётко заданной структуры — они либо слабо упорядочены, либо содержат довольно большие неупорядоченные области [2]. Классификация слабо упорядоченных белков показала, что они принимают участие во многих регуляторных процессах, связанных с транскрипцией и передачей сигналов.
(Кстати, открытие «не до конца свёрнутых» белков — уже не первое событие, претендующее на то, чтобы расширить традиционные представления о фолдинге: недавно показано, что белок лимфотактин имеет сразу две нативные структуры, выполняющие каждая свою функцию [3], а путём введения мутаций в изначально негомологичные белки можно добиться идентичности последовательностей 90–95%, сохранив, тем не менее, первоначальные упаковку и биохимические свойства [4].)
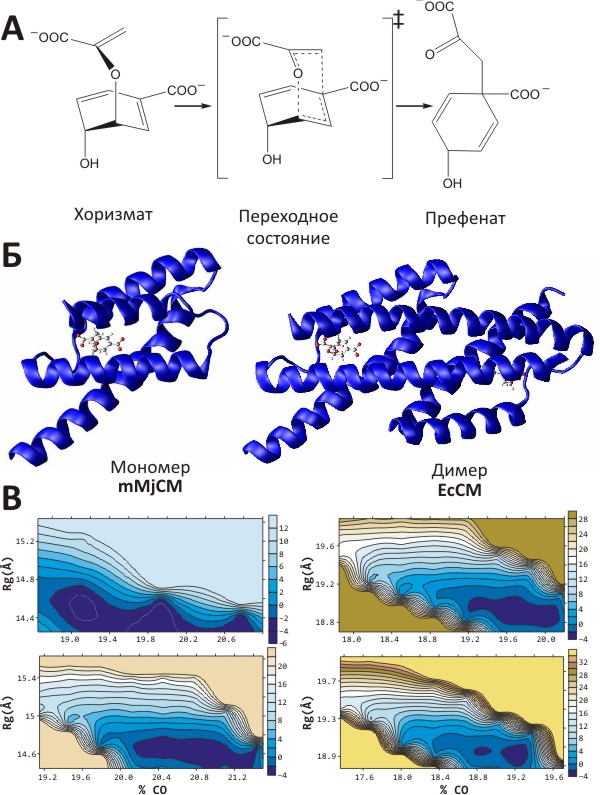
Эксперименты по определению строения «не до конца свёрнутых» белков показали, что они находятся в состоянии «расплавленной глобулы» [5], — то есть в форме, традиционно считающейся промежуточной на пути к нативной, «плотно упакованной», структуре. И, тем не менее, такие белки, для которых характерна аномально высокая подвижность главной цепи, обладают ферментативной активностью [6] (!), что было довольно-таки непросто объяснить, учитывая, что чётко заданной структуры у них просто-напросто нет. Фермент, для которого были проведены эти исследования, называется хоризматмутазой — это катализатор превращения хоризмовой кислоты (важного метаболита растений и микроорганизмов) в префеновою кислоту (промежуточное соединение в биосинтезе ароматических аминокислот). Фермент выделен из бактерии Methanococcus jannaschii. Точнее, свойствами расплавленной глобулы обладает не сама хоризматмутаза (существующая в виде стабильного димера), а её генно-инженерный мономерный вариант (mMjCM), сохраняющий те же биохимические свойства, что и димер, но обладающий при этом очень высокой подвижностью главной цепи молекулы [6] (рис. 1а, б). Нужно добавить, что в несвязанном с лигандом состоянии определить структуру mMjCM вообще не удаётся из-за очень высокой подвижности. Но если в раствор добавить специальную молекулу — аналог переходного состояния реакции, — с которой фермент связывается, но не может расщепить, это приводит к некоторой стабилизации молекулы и позволяет изучить её структуру и подвижность с помощью методики ЯМР-спектроскопии [6].
Рисунок 1. Исследование энергетического ландшафта мономерного варианта хоризматмутазы. А. Химическая реакция, катализируемая харизматмутазой Methanococcus jannaschii. Согласно представлению о ферментативном катализе, переходное состояние реакции обладает сродством к ферменту, её катализирующему. Б. Нативная форма хоризматмутазы представляет слитый димер (справа; структура фермента E. coli), однако с помощью генно-инженерных модификаций его можно превратить в мономер, функционирующий в состоянии расплавленной глобулы [6] (слева; структура фермента M. jannaschii). В обоих случаях в активном сайте находится молекула аналога переходного состояния (АПС). В. Упрощённый энергетический ландшафт, рассчитанный для обоих ферментов в присутствии (снизу) или отсутствии АПС (сверху) с помощью метода молекулярной динамики [7]. Хорошо заметна бóльшая протяжённость области низкой энергии (показана тёмно-синим) для мономера (mMjCM) по сравнению с димером (EcCM), что согласуется с данными о высокой конформационной подвижности mMjCM (вверху слева). При связывании с АПС (снизу) размер низкоэнергетических областей сокращается для обоих ферментов, но в случае mMjCM — особенно выраженно (внизу слева).
В качестве «пространственных» координат выступают радиус гирации молекулы (Rg) и порядок внутримолекулярных контактов (% CO); соответствующие значения энергии показаны с помощью изолиний. Шкалы (в ккал/моль) даны справа от карт.
Объяснить (пока, видимо, только предварительно) наличие ферментативной активности у белкá, не обладающего фиксированной трёхмерной структурой, удалось с помощью компьютерных расчётов, позволяющих получить упрощённый вариант гиперповерхности потенциальной энергии молекулы и понять некоторые особенности её функционирования [7]. Получавшиеся в таких расчетах энергетические поверхности были уже не «гипер», а «обычными», то есть описывались всего тремя измерениями — по сравнению с астрономическим числом координат, необходимых для характеристики «честной» гиперповерхности (рис. 1в). На основании анализа молекулярной динамики димерной и мономерной (mMjCM) форм хоризматмутазы в присутствии и отсутствии аналога переходного состояния (АПС), учёные построили характерные для этих систем упрощённые энергетические карты и сделали интересные наблюдения:
Каким же образом хаотически свёрнутому белку, не обладающему чётко заданной трёхмерной структурой, удаётся выполнять вполне конкретные биологические функции? Одним из возможных объяснений является стабилизация неупорядоченной белковой цепи при взаимодействии со специфической мишенью или лигандом [8], — то есть, мы имеем дело с фолдингом, происходящим одновременно со связыванием с другой молекулой. Расчёты подтверждают, что такое специфическое взаимодействие способно вызвать образование устойчивых структурных элементов в практически хаотической (до связывания) структуре (рис. 1в).
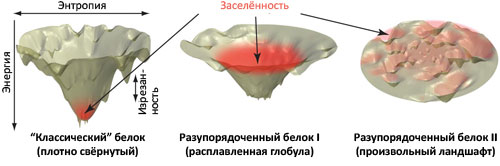
В отличие от «классического» примера глобулярных белков, на которых были выработаны современные представления о фолдинге биополимеров (сильно изрезанная энергетическая гиперповерхность с одним чётко выраженным глубоким «колодцем», соответствующим нативному состоянию (рис. 2, слева)), энергетический ландшафт слабо упорядоченных белков выглядит по-другому. Для таких белков «колодец» не очень «глубокий», но зато достаточно «широкий», что и определяет динамические свойства молекулы (рис. 2, в центре). «Углубить» этот «колодец» (и вызвать образование стабильной нативной структуры) могут специфические межмолекулярные взаимодействия, такие как взаимодействие с лигандом в случае мономерной формы хоризматмутазы. Однако остаётся ещё одна проблема: такой процесс неизбежно будет связан с уменьшением энтропии по мере того, как хаотически устроенная цепь белка будет сворачиваться в нативную форму с участием другой молекулы, — а это невыгодно с термодинамической точки зрения. Так что же привело к появлению таких невыгодных форм существования белковых молекул?
Рисунок 2. Взаимосвязь между фолдингом белкá и профилем поверхности свободной энергии. Слева: схема энергетического ландшафта «классического» глобулярного белкá, имеющего один ярко выраженный «колодец» на энергетической поверхности, где находится нативная конформация, соответствующая в данном случае глобальному термодинамическому минимуму свободной энергии и доступная с позиций кинетики фолдинга. Подобные схемы подразумевают разделение свободной энергии системы на структурную энтропию белкá (по горизонтальной оси) и эффективную энергию (или просто энергию). Последняя, впрочем, тоже содержит энтропийное слагаемое, но оно относится уже не к белку, а к растворителю. В центре: энергетические ландшафты слабо упорядоченных белков характеризуются меньшей изрезанностью, малой «глубиной» и большей «шириной» энергетического «колодца» [2]. Возникающая при этом сила, управляющая сворачиванием молекулы, достаточно слаба, и белок может оставаться разупорядоченным. Однако специфические взаимодействия с другими молекулами (белкáми, лигандами) могут способствовать образованию дополнительных контактов, углубляющих энергетический «колодец» и вызывающих одновременное со связыванием сворачивание [2], [6]. Справа: произвольно организованный энергетический ландшафт, для которого «поиск» каталитической конформации занял бы неопределённо большое время. Красным цветом на всех трёх схемах показана «заселённость» различных областей конфигурационного пространства.
На этот счёт существует несколько гипотез относительно преимуществ, которыми обладают слабо упорядоченные белки, например — более быстрая или специфическая кинетика реакции или разнообразие выполняемых функций [8] — способность взаимодействовать более чем с одной мишенью и/или связывать более одного лиганда. Однако предсказать или экспериментально определить, какой же именно функцией обладает слабо упорядоченный белок, очень сложно: динамика расплавленной глобулы, фактически, «размазывает» функциональную конформацию белка среди обширного ансамбля произвольных структур.
Может ли расплавленная глобула катализировать ферментативную реакцию? Ответ на этот вопрос положителен ([6] и рисунок 1). Однако может ли белок с произвольным образом организованным энергетическим ландшафтом также осуществлять катализ? Это уже вряд ли: в этом случае белку потребовалось бы астрономически большое время, чтобы случайно принять конформацию, способную катализировать превращение (см. рис. 2, справа). Тут возникает аналогия с парадоксом Левинталя (см. «Торжество компьютерных методов: предсказание строения белков» [10]), но этот парадокс уже не кажущийся: ведь в этом случае отсутствуют выделенные направления на поверхности потенциальной энергии, которые как раз и обеспечивают выход из парадокса Левинталя.
Из этих рассуждений следует, что в слабо упорядоченных белкáх всё-таки важна именно упорядоченность, а точнее — профиль энергетического ландшафта, отличающийся от поверхности произвольного рельефа наличием области низкой энергии, пусть и значительно менее выраженной, чем в случае плотно упакованных белков. Достижение каталитической конформации будет дополнительно «стоить» «не до конца свёрнутым» белкáм сопутствующего этому снижения энтропии, и катализ с участием таких ферментов, при прочих равных, будет менее эффективным. Среди возможных преимуществ слабо упорядоченных белков в качестве ферментов или регуляторов можно в дополнение к уже названному добавить их меньшую стабильность (т. е., более быструю деградацию на протеасомах), что может быть плюсом, если требуется очень короткий «всплеск» определённой активности.
Похоже, что эти странные, слабо упорядоченные белковые молекулы могут играть важную роль в регуляции клеточных процессов. И чтобы более пóлно понять их функции и механизмы, по которым они осуществляют катализ и другие процессы, потребуется ещё много лабораторных и компьютерных экспериментов.
Статья написана по материалам журнала PNAS [9].
Методические указания Биохимия
Нативной (природной, неизменной) конформацией называют характерную трехмерную структуру белка, в которой он стабилен и проявляет биологическую активность при физиологических условиях (температура и рН).
Концевые амино- и карбоксильные группы полипептидной цепи и способные к ионизации радикалы аминокислотных остатков определяют кислотно-основные свойства белков (наличие заряда, амфотерность и др.) В зависимости от рН Среды белковые молекулы могут менять свой заряд и вести себя как кислоты или как основания. Значение рН при котором молекула белка не имеет суммарного заряда называют изоэлектрической точкой. Если через раствор белка пропускать постоянный электический ток, то молекулы его в зависимости от рН Среды будут перемещаться к катоду или аноду. Разделение белков на индивидуальные компоненты при помощи постоянного электрического тока называют электрофорезом.
Растворимость белков в воде связана с наличием заряда и с гидратацией каждой его молекулы. Удаление заряда и гидратной оболочки сопровождается выпадением белка в осадак. Осаждение белков из раствора нейтральными солями (хлоридом натрия, сульфат аммония, сультат магния и др.) называют высаливанием.
Белки выполняют свойственные им функции только при физиологичсеких условиях (оптимальная температура, рН, концентрация солей и т.п.) При воздействии различных физических (температура выше 60 0 С, высушивание, ультразвук, ультрофиолетовое излучение и др.) и химических (крепкие кислоты и щелочи, мочевина, соли тяжелых металлов, дубильные вещества и др.) факторов белки сравнительно легко изменяют нативную структуру макромолекул, теряя при этом ряд своих первоначальных свойств, и прежде всего, растворимость и биологическую активность. это явление получило название денатурации. Денатурация характерна только для белков, связана с нарушением третичной и частично вторичной структурой белковой молекулы и не сопровождается изменениями первичной структуры.
Процессы денатурации имеют важное значение в пищевой и легкой промышленности. На них основано консервирование пищевых продуктов, дубление кож, хлебопечение и т.п. Денатурированные белки хорошо перевариваются и усваиваются организмом человека.
Денатурацию белков в какой-то мере можно и предотвратить. Это особенно важно при изготовлении ферментативных препаратов. При низких температурах (не выше +5 0 С) органические растворители ( спирт, ацетон) не денатурируют белков. Из большенства белков методом лиофилизации (высушивание в вакууме из замороженного состояния) можно получить сухой порошок, который сохраняется при комнатной температуре ( в запаянных ампулах) в течении длительного времени без потери нативных свойств.
При изучении темы следует обратить внимание и на то, что единственным методом получения чистых белков является выделение их из природных источников ( муки, дрожжей, зерна и др.). Для успешного выделения белка из биологического объекта необходимо тончайшее измельчение тканей вплоть до разрушения клеточных стенок ( растирание в ступке с песком или стеклом, размалывание на валковых или шаровых мельницах, измельчение в гомогенизаторах). Извлечение растворимых белков производят дистиллированной водой, растворами нейтральных солей ( 8-10 % ), буферными растворами, растворами спирта, спиртовосолевыми смесями и т.п. Практически экстракцию белков проводят одновременно с измельчением биологического объекта. Чтобы избежать денатурацию белка в процессе его выделения, все операции проводят в мягких условиях: при низкой температуре, оптимальном значении рН, избегая действия резких химических реагентов. В раствор из биологического объекта в процессе выделения переходят различные группы белков. Разделение их на отдельные группы или индивидуальные белки (фракционирование) ведут разными способами: высаливание, осаждение органическими растворителями, диализ, электрофорез, хроматография, метод молекулярных сит и т. п.
Методы качественного обнаружения белков в растворах основаны на их способности давать при взаимодействии с отдельными химическими веществами окрашенные соединения (цветные реакции) или выпадать в осадок ( реакции осаждения). Для количественного определения белков в биологических объектах и пищевых продуктах широко применяют химические и физические методы анализа. Из химических наиболее часто используют метод Къельдаля (основан на определении содержания азота), метод Лоури, метод основанный на биуретовой реакции. Среди физических методов наибольшее распостраненние получили рефрактометрический (по показателю преломлению белковых растворов) спектрофотометрический ( по поглощению в ультрафиолетовой области спектра).
Протеины в зависимости от растворимости в различных растворителях разделяют на следующие группы: альбумины, глобулины, проламины, глютелины, гистоны, протеиноиды. Многие из этих белков входят в состав как растительных, так и животных организмов. Только в растительных организмах содержится проламины и глютелины. Они составляют основную массу клейковины.
В зависимости от химической природы добавочной (небелковой, простетической) группы различают следующие протеиды: нуклеопротеины, хромопротеины, липопротеины, гликопротеины, фосфопротеины, металлопротены. При изучении групп сложных белков нельзя отождествлять металлопротеины и хромопротеины. В металлопротеинах металлы (железо, медь, магний и др.) связаны непосредственно со структурными элементами полипептидной цепи. В хромопротеинах (гемоглобин, цитохромы, миоглобин и др.) металлы входят в состав небелковой группы и непосредственно с белковой частью не связаны. Изучите химическое строение небелковой части протеидов.
После ознакомления с материалом по методическим указаниям необходимо сопоставить его с рабочей программой. На этом этапе работы Вы получите представление о сложности дисциплины и затратах времени на его изучение. Определив место данной дисциплины в своем учебном плене, приступайте к изучению ее материала по учебнику. После работы над каждым разделом, используя учебник, необходимо ответить на вопросы для самопроверки. Подобные вопросы будут включены в экзаменационные билеты. Такая работа над материалом каждого раздела поможет понять суть и важность биохимии для инженера-технолога пищевых отраслей промышленности и накопить знания для последующего обучения.
Вопросы для самопроверки
1. Что такое белки? Каковы их элементный состав, содержание в пищевом растительном сырье? Ф.Энгельс о роли белка в явлениях жизни.
2. На каких свойствах белков основаны их качественное обнаружение и количественное определение? Назовите цветные реакции на белки.
3. Как можно определить аминокислотный состав белков?
4. Какие аминокислоты называются протеиногенными, их общее число, строение и свойства?
5. Принципы классификации аминокислот. Гидрофильные (полярные) и гидрофобные (неполярные) аминокислоты, их характеристика и место расположения в молекуле белка радикалов этих аминокислот.
6. Что такое пептиды и полипептиды? Строение белков. Ковалентные связи в молекуле белка. Функциональные группы в белках. Полноценные и неполноценные белки.
7. Какие нековалентные связи имеются в молекуле белка? Характеристика и схема образования этих связей.
8. Объясните первичную, вторичную, третичную и четвертичную структуру белковой молекулы? Какие связи поддерживают каждую из этих структур? Нативная конформация белков.
9. Что такое денатурация белков? Какие факторы ее вызывают? Роль денатурации в пищевой и ферментативной промышленности.
10. Относительная молекулярная масса белков. Растворимость и осаждаемость белков. Какие факторы обуславливают устойчивость раствора белка.
11. Каким образом производят выделение, разделение и очистку белков? Что такое диализ и высаливание?
12. Амфотерность и изоэлектрическая точка белков. Кислые и основные белки. Электрофорез и его практическое применение.
13. Принцип классификации белков. Группы простых белков растительных организмов, их краткая характеристика и технологическое значение. Содержание этих белков в зернах злаковых и бобовых культур.
14. Сложные белки растительных организмов, их химический состав и биологическая роль.
3. Нуклеиновые кислоты
Образование АТФ в организме растений осуществляется в результате окислительного, субстратного и фотосинтетического фосфорилирования; есть и другие пути образования АТФ. Другие нуклеозидди- и нуклеозидтрифосфаты ( УТФ, ЦТФ и др.) образуются, в основном, при участии соответствующих ферментов и АТФ: например, УДФ+ АТФ УТФ+ АДФ.
Вопросы для самопроверки
1. Какие Вы знаете пуриновые и пиримидиновые основания, входящие в состав каждой их нуклеиновых кислот? Напишите их формулы.
2. Назовите нуклеозиды и нуклеотиды, входящие в состав РНК и ДНК. Напишите их формулы.
3. Напишите формулы АДФ, АТФ, УДФ, УТФ, ЦДФ, ЦТФ.
4. РНК, ее состав, строение, типы, биологическая роль.
5. ДНК, ее состав, строение, биологическая роль. Принцип комплементарности, правило Чаргаффа.
Ферменты идеально приспособленны для работы в живой клетке; однако после выделения из организма они не теряют свои каталитические свойства. На этом основано практическое применение ферментов в виноделии, производстве соков, хлебопечении и других отраслях пищевой, легкой и химической промышленности.
В технологии наиболее широко применяют препараты свободных ферментов и срок их использования составляет всего один производственный цикл. В последние 15-20 лет научились иммобилизировать ( прикреплять) ферменты к поверхности различных твердых носителей ( полиакриламид, пористое стекло, целлюлоза, найлон и др.), что позволило не только сохранить их каталитические свойства, но и в сотни, тысячи и даже миллионы раз повысить стабильность. Такие ферменты получили название иммобилизованные.
Наличие и количество ( точнее активность) фермента в биологическом объекте определяют по производимому им действию на субстрат(вещество)
причем либо измеряется убыль субстрата, либо прирост продуктов реакции. Активность ферментов выражают в международных единицах ( МЕ). За активность фермента принимают то его количество, которое катализирует превращение одного микромоля субстрата в 1 мин при оптимальных условиях Если для определения активности фермента используют субстрат с неизвестной молярной массой ( например, крахмал для определения активности амилазы), то тогда выражения активности фермента мольные единицы заменяют масовыми ( обычно 1 мг превращенного вещества).
У однокомпонентных ферментов роль активных групп выполняют определенные химические группировки белковой молекулы (ОН-группы серина и тирозина, имидазольное кольцо гистидина, индольная группа триптофана, гуанидиновая группа аргинина, СООН-группы аспарагиновой и глутаминовой кислот, SН- группа цистеина и др.).
Большинство ферментов имеют относительную молекулярную массу свыше 50 тыс и построены из нескольких протомеров ( субъединиц). Например, фермент уреаза, имеющая М=480 тыс составлена из восьми протомеров с относительной молекулярной массой каждого по 60 тыс; лактатдегидрогеназа ( М= 140 тыс) имеет четыре протомера ( М=35 тыс каждого) и т.д. Ферменты, состоящие из нескольких протомеров получили название ферментов-мультимеров.
Наряду с изоферментами, в клетках организма имеются мультимолекулярные ( надмолекулярные) ферментные комплексы ( системы), представляющие собой не сочетание однотипных в каталитическом отношении протомеров, а разные ферменты, катализирующие последовательные ступени превращения какого-либо субстрата. Типичным примером мультиферментного комплекса является пируватдегидрогеназная система, катализирующая окисление пировиноградной кислоты до ацетил-КоА ( см. 4.8).
Изучая механизм действия ферментов уясните, что они, как и катализаторы неорганической природы, не вызывают каких-либо новых химических реакций, а ускоряют существующие посредством снижения энергии активации, необходимой для прохождения химических реакций. Ведущая роль в механизме ферментативного катализа принадлежит образованию промежуточного фермент-субстратного комплекса, который, в конце реакции распадается с освобождением фермента и продуктов реакции. В ходе ферментативного катализа выделяют следующие стадии :


Важно запомнить, что ферменты обладают всеми свойствами белков. Наряду с этими они имеют свои специфические свойства: специфичность, зависимость от рН, температуры, концентрации фермента и концентрации субстрата, активаторов и ингибиторов и т.п.
Скорость ферментативных реакций зависит от концентрации фермента и субстрата в среде. Когда в среде субстрата достаточно, скорость ферменативной реакции возрастает пропорционально увеличению количества фермента. При низкой концентрации субстрата скорость реакции возрастает пропорционально увеличению его концентрации, но до тех пор, пока не произойдет насыщение субстратом. При избытке субстрата фактором, лимитирующим скорость ферментативной реакции, становится вновь концентрация фермента в среде.
Изучение влияние концентрации субстрата на скорость ферментативных реакций привело к установлению так называемая константы Михиэлиса
( К m ). Если скорость реакции при высоких концентрациях субстрата достигает некоторой максимальной величины U, то концентрация субстрата S, при которой V= V max /2, называется КОНСТАНТОЙ МИХАЭЛИСА. Таким образом, константа Михаэлиса равна концентрации субстрата ( моль/л), при которой скорость ферментативной реакции составляет половину от максимальной. Этот важный показатель в характеристике ферментов служит для приближенной оценки степени сродства фермента и субстрата. Низкие значения Кm означает, что ферментативный катализ происходит интенсивно.
Новая ( систематическая) классификация и номенклатура ферментов была разработана Комиссией по ферментам Международного биохимического конгресса в 1961 г. в Москве. По этой классификации ферменты в зависимости от типа катализируемой реакции разделили на шесть главных классов, каждый из которых в свою очередь подразделили на подклассы и подподклассы, более точно характеризующие реакцию.
Первое число указывает к какому из шести классов списка ферментов принадлежит данный фермент: к 1) оксидоредукиазам, 2) трансферазам,
3) гидролазам, 4) лиазам, 5) изомеразам и 6) лигазам (синтетазам).