Что такое нпвп гастропатия
НПВС-гастропатия

Заподозрить данную патологию можно при возникновении следующих симптомов:
При обнаружении одного или нескольких таких признаков необходимо обратиться к врачу. Специалист оценит ситуацию и назначит дообследование.
Для диагностики НПВС-гастропатии проводится эзофагогастродуоденоскопия, которая позволяет оценить состояние слизистой оболочки желудка и двенадцатиперстной кишки и выявить эрозивно-язвенные поражения, а также исследование на наличие инфекции H. Рylori.
Опасность данной патологии кроется в развитии желудочно-кишечных кровотечений, пенетрации и перфорации язвенных дефектов.
Гастроэнтерологами отделения патологии верхних отделов пищеварительного тракта Московского клинического научно-практического центра им. А. С. Логинова осуществляется подбор терапии в зависимости от степени эрозивно-язвенного поражения, а также определяются меры профилактики для предупреждения развития рецидивов и осложнений данной патологии.
Не откладывайте свой визит к специалистам нашего Центра. Это поможет своевременно диагностировать заболевание и правильно выбрать тактику лечения. Врачи отделения патологии верхних отделов пищеварительного тракта ГБУЗ МКНЦ имени А.С. Логинова ДЗМ всегда готовы Вам помочь.
Как защитить желудок от НПВП — советы эксперта
Что вы делаете, когда болит голова, поднялась высокая температура или беспокоит боль в суставах? 90% опрошенных ответят: «Пью таблетку».
«Волшебные» пилюли
Существует группа препаратов, под общим названием нестероидные противовоспалительные (НПВП), которые мы все хотя бы раз в жизни, а многие регулярно, принимали. Это препараты, обладающие обезболивающим противовоспалительным и / или жаропонижающим действием. В качестве примера можно назвать Аспирин, Нурофен, Найс, Кетанов, Кетопрофен и прочие. Учитывая «волшебные эффекты» от их действия — снятие воспаления, боли и жара, — их назначают практически все, всем и всегда. Назначают травматологи, ревматологи, терапевты, лоры, стоматологи. Плюс, их можно совершенно свободно приобрести в любой аптеке. Но, наряду с «волшебными свойствами» эти лекарства обладают рядом побочных действий, которые можно разделить на 2 группы: кардиориски и гастро риски. Собственно о гастрорисках и пойдёт речь в данной статье.
НПВП-гастропатия
В научной литературе эта проблема называется «НПВП-гастропатия». Впервые термин был предложен в 1986 году для разграничения специфического поражения слизистой оболочки желудка, возникающего при длительном употреблении НПВП, от классической язвенной болезни.
Отличие НПВП-гастропатии от язвенной болезни можно проследить и по зоне поражения. Чаще всего язвы можно увидеть в желудке, а не в кишке. Плюс, изменения встречаются чаще у пожилых, а не у молодых людей.
Немного цифр
Немного статистики. В Великобритании назначается около 24 млн. НПВС в год. 70% лиц старше 70 лет принимают НПВС 1 раз в неделю, а 34% ежедневно. В США продается НПВС на сумму до 6 млрд. в год. Как следствие, риск развития желудочно-кишечных кровотечений (ЖКК) возрастает прободения — в 6 раз, риск смерти от осложнений до 8 раз. До всех случаев острых ЖКК связаны с НПВС.
Проблема эта актуальна и в нашей стране, к примеру по данным Научного Центра сердечно-сосудистой хирургии им. А.Н. Бакулева из 240 больных, ежедневно принимающих аспирин даже в малых дозах, на гастроскопии поражения желудка и 12 п.к выявлены у 30% (из них язвы — у 23,6%, эрозии — у 76,4%). Аналогичная картина у коллег из ВНИИ ревматологии РАМН — у 2126 пациентов, принимающих НПВС без «прикрытия» (защиты) желудка, эрозии и язвы гастродуоденальной зоны найдены в 33,8% случаев. Это очень впечатляющие и драматические цифры осложнений от приема НПВС, учитывая количество употребляющих эти препараты людей в развитых странах.
Как это работает?
Как же действуют эти препараты в наших желудках? Всё очень просто, негативное воздействие реализуется за счёт дисбаланса защитных и агрессивных сил. У нас в желудке существует ряд защитных механизмов, позволяющих противостоять натиску агрессоров. Среди последних:
Защищается желудок за счет мощного слоя слизи и бикарбонатов, которые нейтрализуют кислоту, адекватного кровоснабжения, способности очень быстро регенерировать. Когда мы используем НПВС препараты, баланс сил изменяется в сторону агрессивных механизмов и происходит поражение слизистого и подслизистого слоя желудка и кишки.
Диагностика
Для диагностики подобных изменений используется гастроскопия, являющаяся «золотым стандартом». Интересный факт, дело в том, что порядка 40% больных с эрозивно-язвенными изменениями, принимающих эти препараты длительно (более 6 недель) не ощущают никакого дискомфорта или неприятных, болезненных ощущений. Проблемы с желудком диагностируются лишь при походе к другим врачам, а не к гастроэнтерологу. И, наоборот, у 40% пациентов, на фоне жалоб, которые они предъявляют, ничего не находят.
Что же делать в таком случае?!
Алгоритм действий для пациентов, не имеющих проблем с желудком, и тех, у кого в анамнезе была язвенная болезнь или эрозивные изменения, различен. Для первой группы, при назначении нестероидных противовоспалительных препаратов более, чем на 5 дней, обязательно назначение препаратов из группы ингибиторов протонной помпы (ИПП). Таких как, омепразол, пантопразол, рабепразол и т. д. (на весь курс приема). Для второй группы, любые назначения из группы НПВС, независимо от срока приёма, требуют параллельного назначения ингибиторов протонной помпы. Так же обязателен прием ИПП пациентам, принимающих длительно аспирин.
Мифы, с которыми мы сталкиваемся в ежедневной практике
Миф 1. Использование НПВС препаратов в виде свечей является менее агрессивным для желудка, нежели приём таблеток
Это 100% миф. Патогенное, разрушительное действие лекарства реализуется через кровь, доставляющую его по сосудам в желудок.
Миф 2. В качестве «гастропротекторов» можно использовать лекарства из группы антацидов — Ренни, Маалокс, Фосфалюгель и H2-блокаторы (Ранитидин и Фамотидин)
В данном случае они не эффективны.
Миф 3. Принимать ингибиторы протонной помпы можно нерегулярно
Дело в том, что если пожилому человеку назначили на всю жизнь противовоспалительный препарат, абсолютно бессмысленно назначать гастропротекцию на месяц. В подобных случаях лекарства должны приниматься строго параллельно.
Миф 4. В качестве «гастропротекторов» могут выступать пищевые продукты (кисели и пр.)
Этот миф, как абсолютно фантастический, мы оставим без комментариев.
Как выбрать лекарство
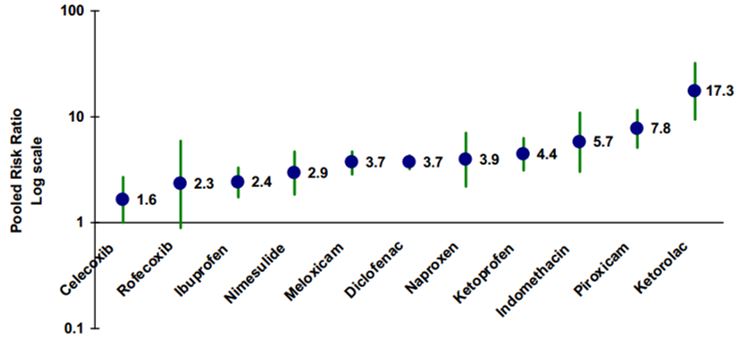
На самом деле, самым важным моментом является то, какие именно лекарства мы принимаем. На рисунке можно увидеть шкалу агрессивности различных препаратов из группы НПВС по отношению к желудку.
Самыми агрессивными препаратами являются Аспирин, Кеторолак, Пироксикам, Индометацин. По возможности рекомендуется использовать селективные препараты, которые обладают минимальными гастро-рисками. Их применение всегда более желательно, к ним относится Целекоксиб и Рофекоксиб. Но несмотря на их относительную безопасность, назначать их должен строго по показаниям лечащий доктор, не забывайте об этом.
Про Helicobacter pylori
Еще одним очень важным компонентом профилактики осложнений, является диагностика инфекции Helicobacter pylori у пациента планирующего длительно принимать НПВС (особенно аcпирин). Наличие бактерии увеличивает риски эрозивно-язвенных поражений ЖКТ и кровотечения в При её выявлении должна в обязательном порядке проводится эрадикация (уничтожение этой бактерии).
Резюме
Итак делаем выводы:
Врачебная практика при сочетанной патологии: ассоциированные с приемом нестероидных противовоспалительных препаратов поражения желудочно-кишечного тра
В обзоре освещены современные представления о ведении и мерах профилактики НПВП-гастропатий у пациентов в условиях врачебной практики, в том числе при полиморбидных состояниях.
Воспалительно-деструктивные поражения желудочно-кишечного тракта, возникающие на фоне приема нестероидных противовоспалительных препаратов (НПВП), занимают в практике врача одно из ведущих мест. Проблема их лечения — по сути своей типичный пример сложности ведения коморбидных состояний. Если мы обратимся к протоколам и результатам любых рандомизированных клинических исследований, то непременно заметим, что наличие коморбидности чаще всего является критерием исключения. В то же время на практике нередко мы имеем дело с пациентами, у которых имеются три и более заболеваний, но при этом стандарты терапии сочетанной патологии и доказательные исследования в подобной сфере редки. Эпидемиологические исследования последних лет убедительно показывают высокую частоту коморбидности и акцентируют внимание на существенном повышении ее с возрастом: от 69% у больных молодого возраста до 93% среди лиц средних лет и до 98% — у пациентов старшей возрастной группы. При этом число хронических заболеваний варьирует от 2,8 у молодых пациентов до 6,4 — у стариков [1]. По данным А. Л. Вёрткина c соавт. [2] частота коморбидности у больных с декомпенсацией хронических заболеваний (средний возраст 67,8 ± 11,6 года) составляет 94,2%. Наиболее часто в работе врача встречаются комбинации из двух и трех нозологий, но в 2,7% случаев у одного пациента сочетаются до 6–8 болезней одновременно.
Целью настоящего обзора было показать значение распознавания и своевременной терапии гастропатий, индуцированных приемом НПВП в условиях врачебной практики, в том числе при полиморбидных состояниях.
Распространенность НПВП-гастропатий
Более 30 млн человек в мире, прежде всего лица пожилого и старческого возраста, употребляют НПВП ежедневно как обезболивающие, противовоспалительные и антиагрегантные средства. Среди всех лекарственных препаратов НПВП являются лидерами по показаниям к использованию, по продажам в аптечной сети и, к сожалению, по частоте побочных эффектов, осложнений, нередко приводящих к летальным исходам. По статистическим данным Европы, США и Канады 10–20% лиц старше 65 лет регулярно принимают НПВП и ацетилсалициловую кислоту (АСК) для лечения системных заболеваний, остеоартроза, невралгий и миалгий, заболеваний позвоночника, сердечно-сосудистой патологии, лихорадочных состояний инфекционно-воспалительного генеза, головной и зубной боли и т. д. Частота потребления медикаментов, по разным оценкам, неуклонно возрастает пропорционально возрасту — до 40 лет лекарственные средства используют 25,4% населения, а в 80 лет и старше — 66,5%. Риск желудочно-кишечных кровотечений у больных, принимающих НПВП, возрастает в 3–5 раз, прободений язв — в 6 раз, риск смерти от осложнений, связанных с поражением желудочно-кишечного тракта, — в 8 раз [3]. В обзоре В. Т. Ивашкина и Т. Л. Лапиной (2012) было показано, что в поликлинической практике основной причиной желудочно-кишечного кровотечения являются эрозивно-язвенные поражения гастродуоденальной зоны, и более половины из них возникли на фоне приема АСК, НПВП и непрямых антикоагулянтов.
Несмотря на многочисленные исследования, касающиеся НПВП-гастропатий и внедрение в клиническую практику нового класса НПВП с селективным ингибированием циклооксигеназы-2 (ЦОГ-2), количество осложнений, связанных с приемом антиагрегантов и НПВП, продолжают увеличиваться.
Патогенез НПВП-гастропатий
Патогенетические механизмы неблагоприятного действия НПВП на слизистую оболочку достаточно многообразны. В 1971 г. J. Vane установил, что НПВП ингибируют активность фермента циклооксигеназы (ЦОГ), имеющего два изомера — ЦОГ-1 и ЦОГ-2 [5]. Угнетение активности ЦОГ-1 вызывает нарушение синтеза простагландинов в слизистой оболочке желудка, в то время как подавление активности изомера ЦОГ-2 определяет противовоспалительное действие данных препаратов. Кроме того, ингибирование ЦОГ-1 тромбоцитов ведет к расстройству их функции, что служит одним из факторов, способствующих высокой частоте желудочно-кишечных кровотечений. В последующие годы были найдены и другие возможные механизмы ульцерогенного действия НПВП. Большинство этих средств являются слабыми кислотами, способными оказывать прямое раздражающее влияние на слизистую оболочку желудка и кишечника. Кроме того, прием НПВП приводит к снижению кровотока в слизистой оболочке желудка, уменьшению выработки желудочной слизи и бикарбонатов, стимуляции секреции соляной кислоты и продукции пепсиногена, усилению апоптоза и десквамации эпителиальных клеток, изменениям гастродуоденальной моторики, повышению образования свободных радикалов, фактора некроза опухолей, увеличению хемотаксиса нейтрофилов [3]. Антиагреганты не менее безопасны, чем малые дозы АСК, в отношении риска развития желудочно-кишечных кровотечений.
Факторы риска НПВП-гастропатии
В 2008 г. были опубликованы рекомендации 1-й Международной рабочей группы по изучению желудочно-кишечных и сердечно-сосудистых эффектов НПВП и антиагрегантов [6] с изменением стратификации по факторам риска, новыми данными о кардиотоксических эффектах большинства НПВП (кроме напроксена) и антиагрегантов (табл. 1 и 2).
Уже в следующем 2009 г. было опубликовано Канадское национальное руководство по профилактике НПВП-гастропатии, включившее последние достижения в этой области и положения международных согласительных документов [7]. Данный консенсус включает ряд положений и алгоритм профилактики гастропатии (рис.).
В контексте данного обзора остановимся на следующих основных положениях [7, 8]:
Остановимся на последнем пункте. H. pylori — независимый и дополнительный фактор риска НПВП-гастропатий, который рассматривается отдельно. По данным ряда авторов, наличие инфекции H. pylori в 1,5–3,5 раза повышает их риск развития [3, 9, 10] и служит фактором риска желудочно-кишечных кровотечений при использовании этих препаратов, включая низкие дозы АСК.
Так, M. Griffin в своих исследованиях показал, что инфекция Н. pylori усиливает ульцерогенный эффект НПВП и проведение эрадикационной терапии позволяет контролировать рецидив кровотечений и снизить летальность при данной патологии [10]. Исследования F. Chan и соавт. [11] подтвердили, что антихеликобактерная терапия способна снизить риск развития НПВП-гастропатии. Результаты европейского исследования HELP NSAID показали, что частота рецидивов язв и эрозий у больных после курса антихеликобактерной терапии не ниже, чем у больных, получавших только противоязвенное лечение ИПП. C. Hawkey и соавт. отметили, что эрадикация H. рylori у больных с НПВП-гастропатией не только не приводит к клиническому эффекту, но, напротив, ухудшает результаты лечения и качество жизни пациентов, обосновывая гипотезу о стимулирующем влиянии H. рylori на синтез простагландинов [12]. Все эти данные свидетельствуют о том, что H. рylori и хронический HР-ассоциированный гастрит являются фоном, но не этиологическими факторами развития НПВП-гастропатии.
Результаты анализа исследований, посвященных вопросам взаимоотношений H. рylori и НПВП-гастропатии, были изложены экспертами в итоговых документах Второго Маастрихтского соглашения (2000). Было подтверждено мнение, что H. pylori-инфекция и прием НПВП/АСК являются независимыми факторами риска для развития язв. НПВП-гастропатия вошла в группу заболеваний, при которых «целесообразно» проведение эрадикации H. рylori. Было отмечено, что эрадикация H. рylori снижает частоту язв, если проводится до начала курса НПВП, но сама по себе не является достаточной для предотвращения повторных язвенных кровотечений при приеме НПВП, а также не ускоряет заживление гастродуоденальных язв у больных, получающих антисекреторную терапию на фоне приема НПВП [13].
Согласно Четвертому Маастрихтскому соглашению (Флоренция, 2010) риск развития НПВП-гастропатии повышен у больных с H. рylori-инфекцией, а эрадикация снижает риск развития язв и эрозий желудка у пациентов, принимающих НПВП [14]. Рекомендуется предварительно тестирование на наличие инфекции H. pylori в случаях, если планируется назначение НПВП, а при положительном результате тестирования следует проводить эрадикацию H. рylori. При этом использование высоких доз ИПП позволяет избежать феномена «быстрого метаболизма» макролидов и создает оптимальные условия для бактерицидного действия амоксициллина и кларитромицина при эрадикации [15].
Лечение НПВП-гастропатий
При появлении побочных эффектов от приема НПВП в первую очередь необходимо пересмотреть показания к их использованию, а при невозможности отмены лекарства уменьшить его дозу либо назначить препарат с меньшим числом побочных эффектов (селективные НПВП). Однако необходимо помнить, что селективные ингибиторы ЦОГ-2 при наличии двух и более факторов риска в той же степени, что и неселективные, вызывают грозные побочные эффекты, что ярко было показано в исследовании C. Hawkey, M. Skelly (2002) [16].
Невсасывающиеся антацидные препараты (Алмагель, Маалокс, Гастал, Фосфалюгель и др.) в настоящее время не рекомендуются в качестве монотерапии при НПВП-гастропатиях. Особенно это касается лиц пожилого и старческого возраста в силу ряда ограничений: неудобная схема приема — 4 раза в день; наличие запоров (актуальнейшей проблемы лиц старшей возрастной группы); нарушение всасывания НПВП; невозможность длительного профилактического приема из-за развития остеопороза за счет связывания солей фосфора и появление интоксикации солями алюминия.
Цитопротекторы. Основные фармакологические эффекты гастроцитопротекторов заключаются в повышении синтеза слизи и бикарбонатов, простагландинов, снижении содержания провоспалительных цитокинов, пепсина, связывании желчных кислот и белков в зоне воспаления, приводящих к ингибированию NO-синтетазы и адгезии бактерий. В настоящее время в качестве гастроцитопротекторов рассматриваются четыре группы препаратов: сукральфат, висмута субцитрат, мизопростол и пентоксифиллин. Оценка цитопротекторов в лечении различных повреждений желудочно-кишечного тракта систематизирована А. В. Яковенко с соавт. (2006), которыми отмечена возможность применения при НПВП-гастропатиях препаратов висмута и мизопростола.
Препараты солей висмута (висмута трикалия дицитрат) с успехом используются и входят в современные стандарты лечения язвенной болезни и НПВП-гастропатии (Рекомендации Российской гастроэнтерологической ассоциации; Стандарты диагностики и лечения кислотозависимых и ассоциированных с H. рylori заболеваний, Четвертое Московское соглашение, 2010). Однако следует помнить, что данные лекарственные средства нельзя принимать более 8 недель, особенно пожилым людям, поскольку при длительном применении в высоких дозах возможно развитие энцефалопатии, связанной с накоплением висмута в центральной нервной системе.
Синтетический аналог простагландина Е1 — мизопростол. Его применение связано с высокой частотой возникновения серьезных побочных эффектов: проявлений синдрома желудочной и кишечной диспепсии (диареи и др.), системной вазоплегии (гипотонии, головных болей, гиперемии лица), что особенно существенно для лиц пожилого возраста. В ряде исследований показана высокая частота побочных эффектов при применении мизопростола 25% против 10–12% при применении ИПП. Негативными моментами, кроме плохой переносимости, являются необходимость частого приема препарата (4 раза в день) и его высокая стоимость [9, 18].
Использование антисекреторных препаратов при НПВП-гастропатиях наиболее оправдано с точки зрения фармакотерапевтических эффектов этих лекарственных средств. Их влияние на ключевые звенья патогенеза данной патологии заключается в нормализации секреции бикарбонатов, уменьшении обратной диффузии ионов водорода, уменьшении активации трипсина при повышении антрального рН выше 4,0 с последующим снижением агрессивности желудочного сока и значительным снижением диффузии «кислых» НПВП в париетальную клетку.
Как уже отмечалось, современные рекомендации по лечению НПВП-гастропатий рекомендуют ИПП в качестве основной группы препаратов. В рандомизированных многоцентровых исследованиях SCUR, OPPULENT, ASTRONAUT, OMNIUM было доказано несомненное преимущество ИПП перед Н2-гистаминоблокаторами, аналогами простагландина и плацебо. Так, по результатам исследований SCUR и OPPULENT профилактический прием омепразола 20 мг/сут в течение 3–6 мес у больных, получавших НПВП, в 4 раза снижал риск развития гастродуоденальных язв в сравнении с плацебо [3, 9, 19, 20]. В исследовании ASTRONAUT при сопоставлении эффективности омепразола в дозе 20 и 40 мг/сут и ранитидина в дозе 150 мг/сут показана одинаковая эффективность дозы 20 и 40 мг/сут омепразола (частота рубцевания язв желудка 83% и 82%, двенадцатиперстной кишки — 93% и 88% соответственно), превосходящая таковую у ранитидина (частота рубцевания язв — 64% и 79% соответственно). В исследовании OMNIUM была доказана большая эффективность омепразола, чем мизопростола, в лечении язвенных дефектов, вызванных приемом НПВП (83% и 77% — язвы желудка, 93% и 79% — язвы двенадцатиперстной кишки). В качестве вторичной профилактики омепразол был более предпочтителен для предупреждения развития язв, хотя для первичной профилактики чаще встречающихся эрозивных поражений мизопростол оказался эффективнее омепразола и ранитидина (по данным исследования ASTRONAUT) [3, 9, 21].
Ингибиторы протонной помпы — такие одинаковые и такие разные
ГБОУ ВПО СЗГМУ им. И. И. Мечникова МЗ РФ, Санкт-Петербург
Abstract. Purpose of review: demonstrate modern concepts of management of patients and prevention of NSAID-gastropathy in patients in medical practice, including polymorbid patients.
Гастропатия, обусловленная нестероидными противовоспалительными препаратами: от понимания механизмов развития к разработке стратегии лечения и профилактики
В. А. Ахмедов, В. А. Винжегина, А. Н. Судакова, Е. И. Розенблит
ГАСТРОПАТИЯ, ОБУСЛОВЛЕННАЯ НЕСТЕРОИДНЫМИ ПРОТИВОВОСПАЛИТЕЛЬНЫМИ ПРЕПАРАТАМИ: ОТ ПОНИМАНИЯ МЕХАНИЗМОВ РАЗВИТИЯ К РАЗРАБОТКЕ СТРАТЕГИИ ЛЕЧЕНИЯ И ПРОФИЛАКТИКИ
Омская государственная медицинская академия, кафедра факультетской терапии
Нестероидная гастропатия (НПВП-гастропатия) представляет собой специфический синдром, который ассоциируется с лечением пациентов нестероидными противовоспалительными препаратами (НПВП) и преимущественно проявляется поражением желудка (чаще антрального отдела), реже двенадцатиперстной кишки с появлением эритемы, эрозий и/или язв.
В последние годы данная проблема занимает важное место: ведутся поиск новых механизмов формирования НПВП-гастропатии и разработка новых лекарственных препаратов для лечения и профилактики с учетом полученных данных.
В представленном обзоре освещены результаты исследований последних лет, позволившие «пролить свет» на многие аспекты формирования НПВП-гастропатий.
Проводилась оценка роли сульфида азота в развитии повреждения слизистой оболочки желудка (СОЖ) у пациентов, принимающих НПВП [1]. Данное вещество представляет собой эндогенный газообразный медиатор, вырабатывающийся у млекопитающих и человека с помощью цистатионин-бета-синтазы и цистатионин-гамма-лиазы. В экспериментах на животных было установлено, что сульфид азота уменьшает кровоток в сосудах СОЖ и ассоциированную с ацетилсалициловой кислотой лейкоцитарную инфильтрацию в мезентериальных венулах, при этом не подавляя синтез простагландина (Пг) Е2, блокируемый НПВП. Следовательно, сульфид азота рассматривается как важный физиологический регулятор СОЖ при приеме НПВП
При экспериментальной оценке влияния аспирина на состояние СОЖ было отмечено, что данный препарат способствует ее повреждению при токсическом воздействии на клетки лизофосфатидилхолина [5]. Кроме того, при исследовании свойств аспирина было отмечено, что данный препарат вызывает парадоксальное повышение содержания ПгЕ2 в СОЖ, стимулируя определенный защитный эффект.
Защитное влияние на СОЖ при язвах, индуцированных приемом аспирина, оказывает трансформирующий а-фактор роста (а-ТФР) [6]. Помимо этого, а-ТФР усиливает заживление язвенного дефекта [7].
Одним из наиболее важных факторов риска формирования НПВП-гастропатий является пожилой возраст [8]. Данный факт объясняется вовлечением артериолосклероза в патогенез формирования язвенных дефектов у пожилых людей при НПВП-гастропатии [9].
При оценке механизмов влияния индометацина на СОЖ было отмечено, что данный препарат нарушает регуляцию трефоилпептидов, физиологическая роль которых состоит в поддержании целостности СОЖ [10]. Следовательно, данный механизм является одним из факторов формирования НПВП-гастропатий при использовании индометацина.
Большое значение в механизмах повреждения индометацином СОЖ отводится сурвивину [11]. Данное вещество представляет собой белок с антиапоптозной активностью. В экспериментах на животных было отмечено значительное снижене уровня сурвивина у животных с повреждением желудка, индуцированным индометацином, и степень снижения ассоциировалась с более глубокими и выраженными повреждениями.
Одним из важных механизмов формирования повреждения СОЖ при приеме индометацина является увеличение синтеза в ней лейкотриена-4 [12]. Эффективным средством, блокирующим синтез лейкотриена-4, является ликофелон, двойной ингибитор ЦОГ-2 и 5-липоксигеназы, что было доказано в экспериментах на животных.
В механизмы повреждения СОЖ при НПВП-гастропатии включаются плазминогенный активатор урокиназного типа и его рецептор, находящиеся в желудочных фибробластах и способствующие выработке ПгЕ2 [13]. Прием НПВП резко подавляет синтез плазминогенного активатора урокиназного типа, а следовательно, и продукцию эндогенного Пг.
У пациентов на фоне повреждения СОЖ при лечении НПВП и сопутствующего сахарного диабета возможно присоединение вторичной инфекции, в частности формирование энтерококкового гастрита, поэтому необходимо уделять особое внимание пациентам с сахарным диабетом, находящимся на длительной терапии НПВП [14].
В последние годы большое внимание уделяется связи патологии верхних отделов желудочно-кишечного тракта, ассоциированной с приемом НПВП, и инфекции Helicobacter pylori. Отмечена высокая частота выявления Н. pylori у пациентов с НПВП-гастропатией, особенно у лиц, принимающих новые препараты из группы ингибиторов ЦОГ-2 [15].
Метаанализ данных об эффективности эрадикации Н. pylori у пациентов с НПВП-гастропатией показал, что эрадикационная терапия в целом снижает риск возникновения пептической язвы [16]. В то же время эрадикационная терапия менее эффективна у пациентов с НПВП-гастропатиями по сравнению с поддерживающей терапией ингибиторами протонного насоса.
Согласно мнению ряда авторов [17, 18], эрадикация Н. pylori не дает клинически значимых побочных эффектов в отношении сроков заживления и предотвращения формирования язв у пациентов, принимающих НПВП. Эрадикационная терапия может предотвратить повреждения СОЖ и двенадцатиперстной кишки у пациентов, находящихся на длительном лечении среднетерапевтическими дозами аспирина [19], однако с этим согласны не все исследователи. В двойном слепом плацебо-контролируемом исследовании было продемонстрировано, что эрадикация Н. pylori у пациентов, получающих длительную терапию НПВП, не позволяет предотвратить формирование язвенных дефектов [20]. Показано, что Н. pylori выявляется значительно реже, особенно среди пожилых пациентов, принимающих НПВП, при наличии таких осложнений, как перфорация и кровотечение [21]. Данный факт объясняется исследователями прямым подавляющим воздействием НПВП на Н. pylori. В экспериментах на животных было показано, что Н. pylori и индометацин могут оказывать си-нергический повреждающий эффект на эпителий желудка при одномоментном попадании, в то же время предшествующая приему индометацина колонизация Н. pylori в желудке оказывала защитное действие на СОЖ [22].
Наличие CagA-позитивного штамма Н. pylori ассоциируется с 2-кратным увеличением риска кровотечений из язвенного дефекта у пациентов с НПВП-гастропатией [23]. У пациентов с клинически выраженной диспепсией на фоне приема НПВП при наличии Н. pylori чаще выявлялся гастрит, а не формирование язвенных дефектов [24].
Предшествующая лечению НПВП длительная инфекция Н. pylori усиливает повреждающее воздействие НПВП на желудок, в то же время на ранних фазах инфицирования гиперемия желудка ассоциируется с увеличением выработки оксида азота в слизистой оболочке, что играет защитную роль [25].
Следовательно, мнения большинства исследователей об участии и роли Н. pylori при НПВП-гастропатии противоречивы и требуют продолжения исследований в этом направлении.
Важное значение в современной литературе отводится медикаментозной профилактике НПВП-гастропатий с учетом выясненных механизмов развития данной патологии.
Одну из ключевых ролей в стимуляции рубцевания язвенного дефекта отводят простангландинам [26, 27], которые синтезируются в клетках слизистой оболочки с помощью ЦОГ-1 и ЦОГ-2. Высокие уровни ЦОГ-2 в краях хорошо рубцующейся язвы подтверждают важную роль данного механизма в процессе заживления. В опытах на животных с оценкой уровня ЦОГ-2, ПгЕ2 и миелопероксидазной активности при язвах, индуцированных приемом ацетилсалициловой кислоты и леченных омепразолом, мизопростолом и селективным ингибитором ЦОГ-2 целекоксибом, было отмечено, что омепразол значительно повышал уровень ЦОГ-2, ПгЕ2 и понижал миелопероксидазную активность, в 89,7% случаев приводя к эффективному рубцеванию язвенного дефекта.
Аналогичные тенденции прослеживались при назначении мизопростола, однако содержание ЦОГ-2 было значительно меньше и отмечалось более медленное рубцевание язвенного дефекта. Целекоксиб продемонстрировал низкую активность в отношении как выработки ЦОГ-2, так и рубцевания язвенного дефекта. По результатам исследования сделан вывод, что индукция препаратами выработки ЦОГ-2, приводящая к увеличению синтеза Пг, является ведущим показателем эффективности лекарственных препаратов при лечении НПВП-гастропатии [28]. Использовать целекоксиб в качестве альтернативы предлагают исследователи 29, которые доказали, что по своим анальгетическим свойствам данный препарат сравним с обычными НПВП, а в дозе 200 мг на 1 кг массы тела не оказывает повреждающего действия на СОЖ. Имеются данные о положительном эффекте другого селективного ингибитора ЦОГ-2 этодолака, который проявил высокую эффективность в экспериментах на животных [32]. Данный препарат показал клинически выраженную противовоспалительную и противоболевую активность и более безопасен для желудка по сравнению с диклофенаком и индометацином.
В исследовании, проведенном в Японии среди пациентов с ревматоидным артритом, получающим длительную терапию НПВП, проводилась оценка эффективности профилактического приема блокаторов ингибиторов протонного насоса гистаминовых (Н2-) рецепторов и аналогов Пг Е, [33]. При этом частота формирования пептической язвы была значительно ниже у пациентов, принимающих фамотидин в дозе 20 мг/сут. Исходя из полученных результатов, авторы делают вывод, что в Японии блокаторы Н2-рецепторов будут одними из важнейших профилактических препаратов у пациентов, нуждающихся в длительной терапии НПВП. В то же время другие авторы признают бо-лее рациональным использование ингибиторов протонного насоса для профилактики НПВП-гастропатий. Так, было доказано, что ингибиторы протонного насоса являются наиболее предпочтительными препаратами у пожилых пациентов, которым необходима терапия НПВП и/или аспирином [34].
Определенное значение в профилактике НПВП-гастропатий отводится кальцитонин-ген-связанному пептиду, который защищает СОЖ от повреждения ацетилсалициловой кислотой [36]. Активатором высвобождения кальцитонин-ген-связанного пептида является рутаэкарпин, который активирует ваниллоидные рецепторы, а те в свою очередь способствуют высвобождению пептида. Следовательно, рутаэкарпин может быть использован как средство профилактики НПВП-гастропатий.
Для оценки роли L-аргинина в профилактике развития НПВП-гастропатий проводились экспериментальные исследования, при которых L-аргинин назначался совместно с ибупрофеном и проводилось сравнение с изолированным назначением ибупрофена [37]. При этом было отмечено, что комбинированное назначение L-аргинина с ибупрофеном улучшает прогноз после формирования повреждения СОЖ от НПВП за счет усиления выработки эндогенного Пг и Пг2, что в конечном итоге приводило к усилению роста сосудов в пораженной области.
Одним из средств профилактики НПВП-гастропатий является Д-002 (абексол), представляющий собой высокоалифатическую вытяжку из пчелиного воска с выраженными антиоксидантными свойствами [38]. Эффективность данного вещества оценена при экспериментальных язвах у животных, вызванных применением индометацина и ацетилсалициловой кислоты. Авторы делают вывод о значительном усилении заживления язв на фоне использования данного препарата и приходят к заключению о целесообразности его профилактического использования.
В современной научной литературе определенное значение в механизмах повреждения целостности ткани и процессах репарации отводится матриксным металлопротеазам (ММП) [39]. Для оценки роли ММП при язвах, индуцированных индометацином, в эксперименте использован препарат куркумин, обладающий выраженными антиоксидантными и противовоспалительными свойствами и регулирующий активность ММП. Результаты данного исследования показали, что назначение кур-кумина приводит к ингибированию синтеза ММП9, что значительно ускоряет заживление язвенного дефекта и оправдывает применение куркумина для профилактики НПВП-гастропатий.
Имеются данные о профилактической роли терапии глюкокортикоидными препаратами до назначения НПВП в качестве средства, предотвращающего развитие НПВП-гастропатий [40]. Данный механизм связан с высвобождением аннексина-1, за-щищающего СОЖ от повреждения, индуцированного индометацином. Следовательно, в ряде случаев аннексии-1 может играть важную роль как эндогенный медиатор защиты слизистой оболочки от повреждения.
Хороший профилактический эффект в отношении развития НПВП-гастропатий дает эзомепразол [41]. В экспериментах на животных было показано, что данный препарат усиливает выработку свободных радикалов в ткани с усилением активности антиоксидантной защиты желудка, что позволяет использовать эзомепразол для профилактики НПВП-гастропатий.
Предпринимались попытки назначения комбинированного приема аспирина с аскорбиновой кислотой для предотвращения повреждения СОЖ [42]. Данная комбинация показала свою эффективность благодаря гастропротективному эффекту, связанному с угнетением свободнорадикального окисления, и выработке провоспалительных цитокинов. Гастропротективный эффект аскорбиновой кислоты достигается путем переноса гем-оксигеназы-1 матричной РНК в активный белок, что приводит к значительному усилению антиоксидантной защиты [43].
Определенную роль в профилактике формирования гастропатий, индуцированных индометацином, может играть пентоксифиллин [44]. Эффект данного препарата напрямую связан с его способностью ингибировать нейтрофильную инфильтрацию слизистой оболочки и тормозить синтез провоспалительных цитокинов, таких как моноцитарный хемотаксический белок, макрофагальный воспалительный белок.
Проводилась оценка возможности терапии НПВП пациентов с пищеводом Барретта [45]. На основании комплексного анализа авторы делают вывод о безопасности использования Н ПВП у данной категории больных при условии адекватной кислотоподавляющей терапии. В проведенном метаанализе связи приема НПВП с риском развития рака желудка было показано, что прием НПВП ассоциируется с низкой частотой возникновения рака [46], несмотря на частые и выраженные повреждения СОЖ.
Проводились экспериментальные исследования с целью оценки эффективности комплексного применения диклофенака и цинка для профилактики НПВП-гастропатий [47]. При этом были получены достаточно обнадеживающие результаты, которые дали исследователям основание говорить о данном комплексе как о возможной альтернативе изолированной терапии диклофенаком в плане безопасности для СОЖ. Аналогичные результаты были получены при сравнении эффективности комплекса цинк-теноксикам в сравнении с изолированной терапией теноксикамом [48]. Было показано, что при применении комплекса, содержащего цинк, значительно снижается риск повреждения желудка.
Выявлена высокая эффективность мелатонина при повреждениях желудка, вызванных приемом пироксикама [49]. Данный эффект был связан со стабилизирующим влиянием мелатонина на Си, Zn-супероксиддисмутазу, каталазу, ЦОГ, а также альфа-актин, содержание которых значительно изменяется при терапии пироксикамом. Исходя из полученных результатов, исследователи делают заключение о том, что мелатонин может рассматриваться как важное средство профилактики НПВП-гастропатий при одновременном назначении с пироксикамом или другими НПВП.
Хороший профилактический эффект в отношении формирования эрозий в желудке при терапии НПВП дает сукральфат, обладая при этом хорошей переносимостью [50]. Аналогичные результаты при профилактике НПВП-гастропатий обеспечивает субколлоидный цитрат висмута (Де-нол) [51].
Большое значение в современной литературе отводится роли растительных фитопрепаратов в комплексном лечении НПВП-гастропатий. Так, исследователями проводилась оценка эффективности водного экстракта лишайника Usnea longissima при экспериментальных язвах, индуцированных индометацином [56]. Была выявлена положительная роль данного растения в комплексной терапии, связанная с мощным антиоксидантным действием экстракта.
При изучении лечебных свойств компонента травяной микстуры SK1306X [57], используемого в корейской медицине для лечения остеоартроза, было отмечено, что данное вещество обладает выраженной противовоспалительной и анальгетической активностью. В экспериментальных исследованиях было доказано, что данное вещество является очень эффективным в дозе 2 г на 1 кг массы тела и его эффективность напрямую связана с подавлением синтеза лейкотриенов в желудке.
Проводились исследования по оценке эффективности применения астаксантина, полученного из растения Xanthophyllomyces dendrorhous, в профилактике антральных язв, связанных с приемом напроксена [59]. Прием астаксантина в дозе 1, 5 и 25 мг на 1 кг массы тела обеспечивал значительный защитный эффект в отношении повреждений, вызываемых приемом напроксена в дозе 80 мг на 1 кг массы тела, что проявлялось угнетением процессов перекисного окисления липидов в слизистой оболочке. Кроме того, предварительное лечение астаксантином приводило к исчезновению повреждения СОЖ, подтвержденного гистологически, от предшествующей терапии напроксеном. В связи с полученными результатами данный препарат предлагается активно использовать для профилактики НПВП-гастропатий.
В экспериментальных исследованиях была показана эффективность настойки и экстракта растения Justicia prostrata при повреждениях желудка, индуцированных аспирином [6]. Данный эффект был связан с увеличением содержания бикарбонатов в желудочном соке.
В проведенных экспериментальных исследованиях эффективным средством профилактики НПВП-гастропатий зарекомендовал себя водный экстракт корня Rumex patientia [61] благодаря выраженным антиоксидантным свойствам.
Таким образом, данные литературы свидетельствуют о многообразии факторов, способствующих формированию НПВП-гастропатии, что побуждает исследователей во многих странах мира продолжать изучать это состояние с целью разработки наиболее эффективных методов терапии и профилактики.
ЛИТЕРАТУРА
1. Fiorucci S., Antonelli Е., Distrutti Е. et al. Inhibition of hydrogen sulfide generation contributes to gastric injury caused by anti-inflammatory nonsteroidal drugs. Gastroenterology 2005; 129 (4): 1210-1224.
2. Hayashi Y., Yamamoto H., Kita H. et al. Non-steroidal anti-inflammatory drug-induced small bowel injuries identified by double-balloon endoscopy. Wld J. Gastroenterol. 2005; 11 (31): 4861-4864.
3. Yokota A., Taniguchi M., Takahira Y. et al. Rofecoxib produces intestinal but not gastric damage in the presence of a low dose of indomethacin in rats. J. Pharmacol. Exp. Then 2005; 314 (1): 302-309.
4. Takeuchi K., Tanaka A., Hayashi Y. et al. Functional mechanism underlying COX-2 expression following administration of indomethacin in rat stomachs: importance of gastric hypermo-tility. Dig. Dis. Sci. 2004; 49 (2): 180-187.
5. Darling R. L., Romero J. J., Dial E. J. et al. The effects of aspirin on gastric mucosal integrity, surface hydrophobicity, and prostaglandin metabolism in cyclooxygenase knockout mice. Gastroenterology 2004; 127 (1): 94-104.
6. Yetkin G., Celebi N., Ozer C. et al. The healing effect of TGF-alpha on gastric ulcer induced by acetylsalicylic acid in rats. Int. J. Pharm. 2004; 277 (1-2): 163-172.
7. Gonul В., Akbulut K. G., Ozer C. et al. The role of transforming growth factor alpha formulation on aspirin-induced ulcer healing and oxidant stress in the gastric mucosa. Surg. Today 2004; 34 (12): 1035-1040.
8. Lee H. L., Han D. S., Kim J. B. et al. Importance of age and other risk factors in NSAID-induced gastropathy. Korean J. Gastroenterol. 2004; 44 (5): 246-251.
9. Yakabi K., Kamiichi H., Ohno S. et al. Arteriosclerosis and gas-troduodenal ulcer. Nippon Rinsho 2004; 62 (3): 525-531.
10. Koitabashi A., Shimada Т., Fujii Y. et al. Indometacin up-regu-lates TFF2 expression in gastric epithelial cells. Aliment. Pharmacol. Then 2004; 20 (suppl. 1): 171-176.
11. Chiou S. K., Tanigawa Т., Akahoshi T. et al. Survivin: a novel target for indomethacin-induced gastric injury. Gastroenterology 2005; 128 (1): 63-73.
12. Singh V. P., Patil C. S., Kulkarni S. K. Effect of licofelone against NSAIDs-induced gastrointestinal ulceration and inflammation. Indian J. Exp. Biol. 2005; 43 (3): 247-253.
13. Iwamoto J., Takahashi K., Mizokami Y. et al. Expression of urokinase-type plasminogen activator and its receptor in gastric fibroblasts and effects of nonsteroidal antiinflammatory drugs and prostaglandin. Dig. Dis. Sci. 2003; 48 (12): 2247-2256.
14. El-Zimaity H. M., Ramchatesingh J., Clarridge J. E. et al. Ente-rococcus gastritis. Hum. Pathol. 2003; 34 (9): 944-945.
15. Chiba Т., Sato K., Endo M. et al. Upper gastrointestinal disorders induced by non-steroidal anti-inflammatory drugs. Hepa-togastroenterology 2005; 52 (64): 1134-1138.
16. Vergara M., Catalan M., Gisbert J. P. et al. Meta-analysis: role of Helicobacter pylori eradication in the prevention of peptic ulcer in NSAID users. Aliment. Pharmacol. Ther. 2005; 21 (12): 1411-1418.
17. Chan F. K. Should we eradicate Helicobacter pylori infection in patients receiving nonsteroidal anti-inflammatory drugs or low-dose aspirin? Chin. J. Dig. Dis. 2005; 6 (1): 1-5.
18. Wu C. Y, Wu M. S., Chen C. J. et al. The interaction of H. pylori infection and NSAIDs in cyclooxygenase-2 mRNA expression in gastric antral, corpus mucosa, and gastric ulcer. Clin. Gastroenterol. 2005; 39 (1): 50-55.
19. GiralA., Ozdogan O., Celikel C. A. et al. Effect of Helicobacter pylori eradication on anti-thrombotic dose aspirin-induced gastroduodenal mucosal injury. J. Gastroenterol. Hepatol. 2004; 19 (7): 773-777.
20. Lai К. C, Lau C. S., Ip W. Y. et al. Effect of treatment of Helicobacter pylori on the prevention of gastroduodenal ulcers in patients receiving long-term NSAIDs: a double-blind, placebo-controlled trial. Aliment. Pharmacol. Ther. 2003; 17 (6): 799-805.
21. Bobrzynski A., Konturek P. C, Konturek S. J. et al. Helicobacter pylori and nonsteroidal anti-inflammatory drugs in perforations and bleeding of peptic ulcers. Med. Sci. Monit. 2005; 11 (3): 132-135.
22. Ji K. Y., Ни F. J., Li A. D. et al. Interaction of Helicobacter pylori and indomethacin in gastric mucosa injury of Balb/c mice. Zhonghua Yi Xue Za Zhi 2003; 83 (9): 726-730.
23. Tzourmakliotis D., Economou M., Manolakopoulos S. et al. Clinical significance of cytotoxin-associated gene A status of Helicobacter pylori among non-steroidal anti-inflammatory drug users with peptic ulcer bleeding: a multicenter case-control study. Scand. J. Gasroenterol. 2004; 39 (12): 1180-1185.
24. Matsukawa Y., Aoki M., Nishinarita S. et al. Prevalence of Helicobacter pylori in NSAID users with gastric ulcer. Rheumatology (Oxford) 2003; 42 (8): 947-950.
25. Elizalde J. I., Mendez A., Gomez J- et al. Gastric mucosal blood flow changes in Helicobacter pylori infection and NSAID-induced gastric injury. Helicobacter 2003; 8 (2): 124- 131.
26. Poonam D., Vinay С S., Gautam P. Cyclo-oxygenase-2 expression and prostaglandin E2 production in experimental chronic gastric ulcer healing. Eur. J. Pharmacol. 2005; 519 (3): 277- 284.
27. Goldstein J. L. Challenges in managing NSAID-associated gastrointestinal tract injury. Digestion 2004; suppl. 1: 25-33.
Ж Villegas ]., La Casa C, de la Lastra C. A. et al. Mucosal damage induced by preferential COX-1 and COX-2 inhibitors: role of prostaglandins and inflammatory response. Life Sci. 2004; 74 (7): 873-884.
29. Yoshino Т., Kimoto A., Kobayashi S. et al. Pharmacological profile of celecoxib, a specific cyclooxygenase-2 inhibitor. Arzneimittel-Forsch. 2005; 55 (7): 394-402.
30. Каратеев A. E. Гастродуоденальная безопасность селективных ингибиторов циклооксигеназы-2: проверка практикой. Тер. арх. 2005; 5: 69-72.
31. Маев И. В., Вьючнова Е. С, Стасева И. В. Сравнительная оценка различных схем терапии гастропатий, вызванных нестероидными противовоспалительными препаратами. Тер. арх. 2004; 2: 27-31.
32. Tachibana М., Inoue N., Yoshida Е. et al. Anti-inflammatory effect and low ulcerogenic activity of etodolac, a cyclooxygenase-2 selective non-steroidal anti-inflammatory drug, on adjuvant-induced arthritis in rats. Pharmacology 2003; 68 (2): 96- 104.
33. Miyake K., Ueki N., Suzuki K. et al. Preventive therapy for non-steroidal anti-inflammatory drug-induced ulcers in Japanese patients with rheumatoid arthritis: the current situation and a prospective controlled-study of the preventive effects of lansoprazole or famotidine. Aliment. Pharmacol. Ther. 2005; suppl. 2: 67-72.
34. Pilotto A., Franceschi M., Leandro G. et al. Proton-pump inhibitors reduce the risk of uncomplicated peptic ulcer in elderly either acute or chronic users of aspirin/non-steroidal anti-inflammatory drugs. Aliment. Pharmacol. Ther. 2004; 20 (10): 1091-1097.
35. Odashima M., Otaka M., Jin M. et al. Rolipram, a specific type IV phosphodiesterase inhibitor, ameliorates aspirin-induced gastric mucosal injury in rats. Dig. Dis. Sci. 2005; 50 (6): 1097-1102.
36. Wang L., Ни С. P., Deng P. Y. et al. The protective effects of rutaecarpine on gastric mucosa injury in rats. Planta Med. 2005; 71 (5): 416-419.
37. Sanchez-Fidalgo S., Martin-Lacave I., Illanes M. et al. Administration of L-arginine reduces the delay of the healing process caused by ibuprofen. Implication of COX and growth factors expression. Histol. Histopathol. 2005; 20 (2): 437-447.
38. Molina V., Carbajal D., Arruzazabala L. et al. Therapeutic effect of D-002 (abexol) on gastric ulcer induced experimentally in rats. J. Med. Food 2005; 8 (1): 59-62.
39. Swarnakar S., Ganguly K., Kundu P. et al. Curcumin regulates expression and activity of matrix metalloproteinases 9 and 2 during prevention and healing of indomethacin-induced gastric ulcer. J. Biol. Chem. 2005; 280 (10): 9409-9415.
40. Zanardo R. С, Perretli М., Wallace J. L. Annexin-1 is an endogenous gastroprotective factor against indomethacin-induced damage. Am. J. Physiol. Gastrointest. Liver Physiol. 2005; 288 (3): 481-486.
41. Koch T. R., Petro A., Darrabie M. et al. Effects of esomepra-zole magnesium on nonsteroidal anti-inflammatory drug gas-tropathy. Dig. Dis. Sci. 2005; 50 (1): 86-93.
42. Konturek P. C, Kama J., Gessner U. et al. Effect of vitamin C-releasing acetylsalicylic acid on gastric mucosal damage before and after Helicobacter pylori eradication therapy. Eur. J. Phar-macol. 2004; 506 (2): 169-177.
44. Waianabe Т., Higuchi K., Hamaguchi M. et al. Monocyte chemotactic protein-1 regulates leukocyte recruitment during gastric ulcer recurrence induced by tumor necrosis factor-alpha. Am. J. Physiol. Gastrointest. Liver Physiol. 2004; 287 (4): 919-928.
45. Tsibouris P., Hendhckse M. Т., Isaacs P. E. Daily use of nonsteroidal anti-inflammatory drugs is less frequent in patients with Barrett’s oesophagus who develop an oesophageal adeno-carcinoma. Aliment. Pharmacol. Ther. 2004; 20 (6): 645-655.
46. Wang W. #., Huang J. Q., Zheng G. F. et al. Non-steroidal anti-inflammatory drug use and the risk of gastric cancer: a systematic review and meta-analysis. J. Natl. Cancer Inst. 2003; 95 (23): 1784-1791.
47. Santos L. H, Feres C. A., Melo F. H. et al. Anti-inflammatory, antinociceptive and ulcerogenic activity of a zinc-di-clofenac complex in rats. Braz. J. Med. Biol. Res. 2004; 37 (8): 1205-1213.
48. Nascimento J. W., Santos L. H., Nothenberg M. S. et al. Antiinflammatory activity and gastric lesions induced by zinc-ten-oxicam. Pharmacology 2003; 68 (2): 64-69.
49. Bandyopadhyay D., Ghosh G., Bandyopadhyay A. et al. Melatonin protects against piroxicam-induced gastric ulceration. J. Pineal Res. 2004; 36 (3): 195-203.
50. Malagelada J. R., Rodriguez de la Serna A., Dammann H. G. et al. Sucralfate therapy in NSAID bleeding gastropathy. Clin. Gastroenterol. Hepatol. 2003; 1 (1): 51-56.
40. Каратеев A. E., Насонов E. Л., Раденска-Лоповок С. Г. Эффективность коллоидного субцитрата висмута (де-нола) при гастропатиях, индуцированных нестероидными про тивовоспалительными препаратами: открытое контролируемое 4-недельное исследование. Тер. арх. 2005; 2: 46- 49.
41. Wallace J. L., Zamuner S. R., McKnight W. et al. Aspirin, but not NO-releasing aspirin (NCX-4016), interacts with selective COX-2 inhibitors to aggravate gastric damage and inflamma-tion. Am. J. Physiol. Gastrointest. Liver Physiol. 2004; 286 (1): 76-81.
42. Konturek P. C, Brzozowski Т., Kania J. et al. Nitric oxide-releasing aspirin protects gastric mucosa against ethanol damage in rats with functional ablation of sensory nerves. Inflamm. Res. 2003; 52 (9): 359-365.
43. Hawkey C. J., Jones J. I., Atherton С. T. et al. Gastrointestinal safety of AZD3582, a cyclooxygenase inhibiting nitric oxide donator: proof of concept study in humans. Gut 2003; 52 (11): 1537-1542.
44. Tordjman C, Andre N., Bresson Y. et al. General pharmacology of the butanamide derivative S 19812, a new dual inhibitor of cyclooxygenase and lipoxygenase pathways. Arzneimittel-For-sch. 2003; 53 (12): 844-849.
45. Halici M., Odabasoglu F., Suleyman H. et al. Effects of water extract of Usnea longissima on antioxidant enzyme activity and mucosal damage caused by indomethacin in rats. Phyto-medicine 2005; 12 (9): 656-662.
46. Kim J. H., Rhee H. I., Jung J. H. et al. SKI306X, an oriental herbal mixture, suppresses gastric leukotriene B4 synthesis without causing mucosal unjury and the diclofenac-induced gastric lesions. Life Sci. 2005; 77 (11): 1181-1193.
47. Valcheva-Kuzmanova S., Marazova K., Krasnaliev I. et al. Effect of Aronia melanocarpa fruit juice on indomethacin-induced gastric mucosal damage and oxidative stress in rats. Exp. Toxicol. Pathol. 2005; 56 (6): 385-392.
48. Kim J. H, Kim Y. S., Song G. G. et al. Protective effect of astaxanthin on naproxen-induced gastric antral ulceration in rats. Eur. J. Pharmacol. 2005; 514 (1): 53-59.
49. Sanmugapriya E., Shanmugasundaram P., Venkataraman S. Antiulcerogenic effect of Justicia prostrata Gamble. Indian J. Exp. Biol. 2005; 43 (2): 181-186.
50. Suleyman H., Demirezer L. O., Kuruuzum Uz A. Effects of Rumex patientia root extract on indomethacine and ethanol induced gastric damage in rats. Pharmazie 2004; 59 (2): 147- 149.
.gif)