Что такое обмен белков в организме
Что такое обмен белков в организме
В последние десятилетия были предприняты значительные усилия, направленные на понимание регуляции белкового обмена у новорожденных. Эта область исследования является наиболее актуальной, поскольку на протяжении того же периода количество случаев преждевременного родоразрешения в США значительно увеличилось. В 2005 г. гестационный возраст 12,5% детей, родившихся в США, составлял менее 37 нед (повышение на 31% по сравнению с 1981 г.).
Повышенная частота преждевременных родов и очень низкая масса тела детей при рождении создают многочисленную популяцию новорожденных, которым необходима дополнительная нутритивная поддержка. Большинство неонатологов согласятся с тем, что, хотя усовершенствование процесса перинатальной помощи увеличило выживаемость, современные нормы питания для многих недоношенных детей и детей с ОНМТ не являются оптимальными.
Итак, существует необходимость в дальнейшем изучении проблемы, каким образом с помощью нутритивной поддержки можно обеспечить максимальный рост новорожденных.
Технологический прогресс, достигнутый благодаря использованию меченных изотопами аминокислот в качестве индикаторов и основным достижениям молекулярной биологии, начал проливать свет на механизм и клиническое воздействие аминокислот на интенсификацию роста и увеличение объема белков в растущем организме новорожденных.
Данные, полученные в результате этих исследований, показывают, что текущие рекомендации по употреблению в пищу белков и аминокислот могут быть неадекватными в плане обеспечения максимального роста и увеличения объема белков у младенцев, родившихся преждевременно.
В задачи дальнейших статей на сайте входит, во-первых, провести обзор основных представлений о белковом обмене, синтезе и кругообороте белка, уделяя больше внимания потребностям новорожденных, необходимым для их роста. Во-вторых, сделать обзор текущих рекомендаций по кормлению недоношенных детей, уделяя особое внимание потреблению белка.
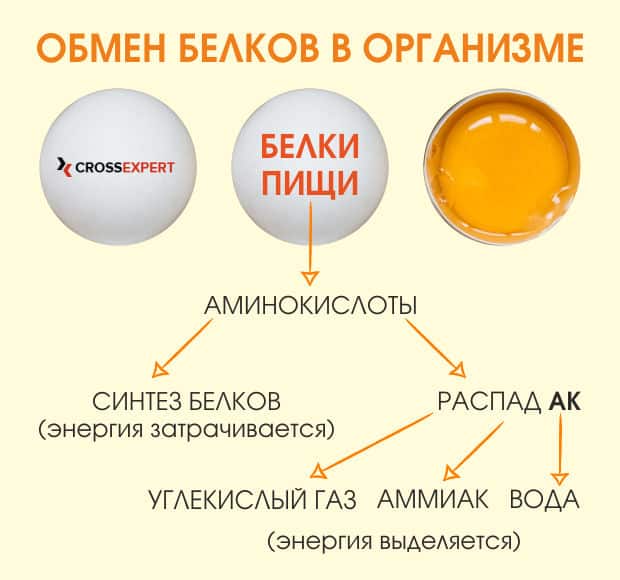
Процесс, при котором белки организма непрерывно разрушаются и ресинтезируются, называют кругооборотом белка. Этот термин, используемый в собирательном значении, обозначает как синтез белка, так и его распад. В дополнение к обмену аминокислот, который происходит при образовании и распаде белков, аминокислоты также необратимо утрачиваются, распадаясь в процессе метаболизма. В организме, в котором сохраняется белковый баланс, количество аминокислот, утраченных в результате распада, эквивалентно количеству аминокислот, полученных с пищей.
Деградация белков заключается в удалении азота, главным образом в виде мочевины и аммиака, а также в расщеплении оставшихся углеродов, относящихся к углеродному скелету. Конечным результатом деградации углеродного скелета является обеспечение организма энергией либо непосредственно, либо через формирование простых соединений, например глюкозы и жирных кислот, которые затем могут быть сохранены или метаболизированы для получения энергии. Потребности организма регулируют интенсивность подачи (потока) аминокислот с помощью метаболических путей.
Энергетический баланс и баланс азота влияют на то, используются ли для синтеза аминокислот и/или углеводов аминокислоты и их углеродный скелет или же они окисляются для выработки энергии. Следует отметить, что, если бы продукты, образовавшиеся в результате распада содержащихся в организме белков, были на 100% утилизированы повторно для образования 20 классических аминокислот, необходимость потреблять белок в рационе сводилась бы к минимуму. Тем не менее отдельные аминокислоты не могут быть синтезированы в человеческом организме даже при наличии достаточного количества азота. Эти аминокислоты называют незаменимыми (основными) аминокислотами.
Аминокислоты в организме также преобразуются в конечные небелковые продукты. Небелковые производные включают в себя такие соединения, как пуриновые и пиримидиновые основания, медиаторы (например, серотонин), а также непептидные гормоны (например, катехоламины). Количество аминокислот, участвующих в этих небелковых путях превращения, гораздо меньше общего количества аминокислот, участвующих в синтезе белков и их распаде.
Поскольку аминокислот, необратимо используемых для синтеза небелковых соединений, как правило, гораздо меньше, чем тех аминокислот, которые были использованы либо для синтеза белков, либо для окисления аминокислот, при оценке кругооборота белка и баланса азота эти пути часто игнорируют. Тем не менее количество некоторых из этих синтезированных соединений может быть значительным (например, при образовании гема, нуклеиновых кислот), поэтому уменьшение числа этих соединений может стать значимым для некоторых аминокислот в продолжительные периоды недостаточного потребления белков.
Как происходит обмен белков в организме человека?
Мы подошли к наиважнейшему аспекту в планировании питания спортсмена. Тема нашей статьи – белковые обменные процессы. В новом материале вы найдёте ответы на вопросы: что такое обмен белков, какую роль протеины и аминокислоты играют в организме и что бывает, если нарушается белковый метаболизм.
Общая суть
Из белка (протеина) состоит большая часть наших клеток. Это основа жизнедеятельности организма и его строительный материал.
Белки регулируют следующие процессы:
Примечание: наличие белка напрямую связано с синтезом инсулина. Без достаточного количества аминокислот, из которых синтезируется этот элемент, повышение сахара в крови становится лишь вопросом времени.
И еще десятки различных функций. Фактически белок – это мы. Поэтому люди, которые отказываются от употребления мяса и других животных продуктов, все равно вынуждены искать альтернативные источники белка. В противном случае, их вегетарианская жизнь будет сопровождаться дисфункциями и патологическими необратимыми изменениями.
Как бы это странно не звучало, но небольшой процент белка есть во многих продуктах. Например, крупы (все, за исключением манной) имеют в своем составе до 8% белка, пусть и с неполным аминокислотным составом. Это частично компенсирует дефицит белка, если вы хотите сэкономить на мясе и спортивном питании. Но помните, что организму нужны разные белки – одной гречкой не удовлетворить потребности в аминокислотах. Не все белки расщепляются одинаково и все по разному влияют на деятельность организма.
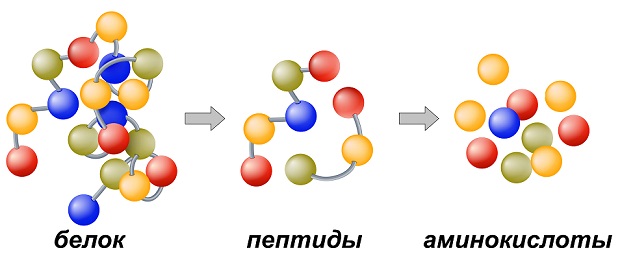
В пищеварительном тракте белок расщепляется под воздействием специальных ферментов, которые тоже состоят из белковых структур. Фактически, это замкнутый круг: если в организме есть длительный дефицит белковых тканей, то и новые белки не смогут денатурировать до простых аминокислот, что вызовет еще больший дефицит.
Важный факт: белки могут участвовать в энергетическом обмене наравне с липидами и углеводами. Дело в том, что глюкоза – необратимая и самая простейшая структура, которая превращается в энергию. В свою очередь белок, пускай и со значительными энергетическими потерями в процессе окончательной денатурации, может быть превращен в гликоген. Другими словами, организм в критической ситуации способен использовать белок в качестве топлива.
В отличие от углеводов и жиров, белки усваиваются ровно в том количестве, которое необходимо для функционирования организма (включая поддержание постоянного анаболического фона). Никаких протеиновых излишков организм не откладывает. Единственное, что может изменить этот баланс – это прием тестостероновых стимуляторов и аналогов гормона тестостерона (анаболических стероидов). Первичная задача таких препаратов – вовсе не повышение силовых показателей, а увеличение синтеза АТФ и белковых структур, за счет чего и растут мышцы.
© edesignua — depositphotos.com. Расщепление белков
Этапы белкового обмена
Белковые обменные процессы гораздо сложнее углеводных и липидных. Ведь если углеводы – это всего лишь энергия, а жирные кислоты поступают в клетки практически в неизменном виде, то главный строитель мышечной ткани претерпевает в организме целый ряд изменений. На некоторых этапах по белок и вовсе может метаболизироваться в углеводы и, соответственно, в энергию.
Рассмотрим основные этапы обмена белков в организме человека, начиная с их поступления и запечатывания слюной денатурата будущих аминокислот и заканчивая конечными продуктами жизнедеятельности.
Примечание: мы поверхностно рассмотрим биохимические процессы, которые позволят понять сам принцип переваривания белков. Для достижения спортивных результатов этого будет достаточно. Однако при нарушениях белкового обмена лучше обратится к врачу, который определит причину патологии и поможет устранить её на уровне гормонов или синтеза самих клеток.
| Этап | Что происходит | Суть |
| Первичное попадание белков | Под воздействием слюны расщепляются основные гликогеновые связи, превращаясь в простейшую глюкозу, остальные фрагменты запечатываются для последующей транспортировки. | На этом этапе основные белковые ткани в составе продуктов питания выделяются в отдельные структуры, которые затем будут перевариваться. |
| Переваривание белков | Под воздействием панкреатина и других ферментов происходит дальнейшая денатурация до белков первого порядка. | Организм настроен таким образом, что может получать аминокислоты только из простейших цепочек белков, для чего он воздействует кислотой, чтобы сделать белок более расщепляемым. |
| Расщепление на аминокислоты | Под воздействием клеток внутренней слизистой оболочки кишечника, денатурированные белки всасываются в кровь. | Уже упрощенный белок организм расщепляет на аминокислоты. |
| Расщепление до энергии | Под воздействием огромного количества инсулиновых заменителей и ферментов для переваривания углеводов белок распадается до простейшей глюкозы | В условиях, когда организму не хватает энергии, он не денатурирует белок, а при помощи специальных веществ расщепляет его сразу до уровня чистой энерги. |
| Перераспределение аминокислотных тканей | Циркулируя в общем кровотоке, белковые ткани под воздействием инсулина транспортируются по всем клеткам, отстраивая необходимые аминокислотные связи. | Белки, путешествуя по организму, восстанавливают недостающие части, как в мышечных структурах, так и в структурах связанных с гормоностимуляцией, мозговой активностью или последующей ферментацией. |
| Составление новых белковых тканей | В мышечных тканях аминокислотные структуры, связываясь с микроразрывами, составляют новые ткани, вызывая гипертрофию мышечных волокон. | Аминокислоты в нужном составе превращаются в мышечную-белковую ткань. |
| Вторичный белковый обмен | При наличии переизбытка белковых тканей в организме, они под вторичным воздействием инсулина снова попадают в кровоток для превращения их в другие структуры. | При сильном мышечном напряжении, долгом голоде или во время болезни организм использует мышечные белки для компенсации аминокислотного недостатка в других тканях. |
| Транспортировка липидных тканей | Свободно циркулирующие белки, соединенные в фермент липазу, помогают транспортировать и переваривать вместе с желчью полинасыщенные жирные кислоты. | Белок участвует в транспортировке жиров и синтезе холестерина из них. В зависимости от аминокислотного состава белка синтезируются как полезный, так и вредный холестерин. |
| Выведение окисленных элементов (конечных продуктов) | Отработанные аминокислоты в процессе катаболизма выводятся с продуктами жизнедеятельности организма. | Мышечные ткани, поврежденные в результате нагрузок, транспортируются из организма. |
Нарушение метаболизма белков
Нарушения белкового обмена опасны для организма не менее, чем патологии метаболизма жиров и углеводов. Белки участвуют не только в формировании мышц, но практически во всех физиологических процессах.
Что может пойти не так? Как мы все знаем, важнейший энергетический элемент в организме – это молекулы АТФ, которые, путешествуя по крови, раздают клеткам необходимые нутриенты. При нарушении обмена белков “ломается” синтез АТФ и нарушаются процессы, которые косвенно или напрямую влияют на синтезирование из аминокислот новых белковых структур.
В числе наиболее вероятных последствий метаболических нарушений:
Это далеко не полный список того, что может произойти с организмом в случае, если будет нарушен белковый обмен. Однако не все так страшно. Чтобы вывести из строя механизм белкового обмена, нужно, чтобы одновременно совпало хотя бы несколько факторов из перечисленных:
Что такое метаболизм: почему он бывает быстрым и медленным
Метаболизм — слово, которое на слуху у каждого, кто худеет. Считается, что его нужно «разогнать» на полную мощность, и тогда вы сможете обмануть организм и сжигать больше калорий за то же время. Почти как секретная кнопка, на которую нужно нажать. Поэтому так привлекательны разгоняющие метаболизм продукты питания, диеты и тренировки. Читайте в этой статье про то, что такое метаболизм вообще и почему он бывает быстрым и медленным.
Что такое метаболизм?
Эволюционно организм человека стремится поддерживать идеальный с точки зрения выживания вес и процент жира, которые задает генетика. Это защищает человека от любых крайностей: как от истощения, так и от ожирения. И то, и другое снижает шансы передать свои гены потомству в дикой природе.
«Идеальным» для выживания весом управляет отдел мозга — гипоталамус. Именно он замедляет или ускоряет обмен веществ, если видит какие-то отклонения от нормы для конкретного человека. С помощью самых разных веществ — гормонов, уровня глюкозы и аминокислот в крови и многого другого — он собирает информацию о том, что происходит в организме: достаточно ли жира запасено, регулярно ли поступает еда, насколько она калорийная.
Сравнивая данные с «идеальной» генетической установкой, гипоталамус подкручивает метаболизм то вверх, то вниз, в зависимости от ситуации. Посмотрим на примерах, как выглядит идеальный метаболизм.
Если человек ел непривычно много для себя в течение одного или нескольких дней, его аппетит сам по себе снижается в последующие дни. Человек будет есть меньше, сам того не замечая. Заодно он будет более подвижным и активным. И даже если он все же наберет лишний вес за отпуск или праздники, он быстро от него избавится, как только вернется к обычной жизни, ничего специального для похудения не делая. Гипоталамус отрегулирует аппетит и уровень активности так, чтобы вернуть систему в равновесие.
И обратная ситуация. Тот же человек вдруг стал есть непривычно мало для себя: сел на диету, перестал есть из-за стресса, занятости. В ответ на это гипоталамус в следующие дни увеличивает аппетит, чтобы наверстать среднюю калорийность. Заодно он снижает активность — человек становится более вялым, сонным, двигается меньше и при первой возможности хочет посидеть или полежать.
Выходит, что человек со здоровым обменом веществ может иметь примерно один и тот же вес долгие годы, ничего специального не делая.
Как гипоталамус делает это?
Аппетитом мозг управляет с помощью самых разных механизмов.
Усиливают голод и толкают человека на поиски еды и тягу к определенным продуктам, особенно калорийным, следующие химические вещества: грелин, нейропептид Y, орексин, галанин, ноницептин, мотилин, В-эндорфины и др. А так же низкий уровень глюкозы и аминокислот, пустой желудок.
Человек начинает получать большее наслаждение от еды — от ее вкуса, запаха. Еда становится источником удовольствия. За это отвечают дофамин и эндорфины, которые выбрасываются каждый раз, когда человек поел.
Это отличный механизм защиты от голодания и истощения: если бы мы были равнодушны к еде и не замотивированы ее искать, не могли бы получать от нее почти наркотическое удовольствие, дела с выживанием были бы плохи. Хотя, сегодня это играет против нас: еду больше не нужно искать. Самая вкусная, жирная и сладкая еда — в избытке на расстоянии вытянутой руки. Из-за этого дофаминовые и эндорфиновые рецепторы бомбардируются чаще, сильнее и больше, чем заложено природой. Это сбивает все внутренние настройки организма в плане пищевого поведения.
Быстрый и медленный метаболизм
Описанная выше ситуация с обменом веществ — идеальная. В жизни же иногда все как-будто наоборот: чем больше человек ест и меньше двигается, тем меньше хочется двигаться и больше есть. А кто-то — худой, очень мало ест и больше есть не может.
Чтобы понять про быстрый и медленный обмен веществ, нужно знать вот что. Нервная система человека состоит из двух отделов. Первый — центральная нервная система. Она состоит из головного и спинного мозга. Второй — вегетативная нервная система. Это главный регулятор метаболизма. Она контролирует работу желез, органов, пищеварение, управляет питательными веществами, поступившими с едой, и делает другие важные для жизни вещи.
Вегетативная нервная система имеет две ветви: симпатическую и парасимпатическую.
В зависимости от ситуации — стресс или восстановление — у любого человека включается либо та, либо другая ветвь. Но у некоторых людей каждая из них может доминировать большую часть времени. Это и определяет скорость метаболизма.
Важно понимать: говоря про быстрый и медленный метаболизм, мы не говорим о заболеваниях обмена веществ, которые нужно лечить у врача. Все остальное — пределы нормы здорового человека, но с отклонениями в одну или другую сторону.
Быстрый обмен веществ
Люди с доминирующей симпатической нервной системой, — счастливчики для тех, кто всю жизнь пытается худеть. Они стройные и не имеют проблем с лишним весом.
Это обычно живые, активные, эмоциональные люди, с быстрыми, резкими движениями. Пульс их более частый, а давление — повышенное. У них более активно работает щитовидная желез. Они всегда немного нервные, возбужденные по жизни и тратят много энергии в течение дня. Они не толстеют, но и с трудом набирают мышцы.
Медленный обмен веществ
Люди с доминирующей парасимпатической нервной системой набирают вес легко, а худеют — с трудом. Это малоподвижные, спокойные, расслабленные, а в крайних проявлениях — апатичные, вялые люди. Они быстро усваивают питательные вещества, что на фоне очень хорошего аппетита создает проблемы с лишним весом.
В ответ на лишнюю еду гипоталамус может не снижать аппетит в следующие дни, как могло быть в идеальной ситуации. Одна из проблем обмена веществ — плохая чувствительность мозга к лептину.
Лептин — гормон, который вырабатывает жировая ткань. С его помощью гипоталамус видит количество запасенной энергии (жира) в организме. Много жира = много лептина. Гипоталамус снижает аппетит и повышает активность, ведь бояться голодной смерти не нужно. Мало жира = мало лептина, значит энергии мало, аппетит нужно увеличить, а желание двигаться — снизить.
Но иногда гипоталамус не видит лептин, даже если и его, и жира много. А это означает постоянный голод и снижение активности. Человек начинает есть со временем все больше и больше.
Иногда плохая чувствительность к лептину — приобретенная, из-за плохого образа жизни и лишнего веса. А иногда — генетическая, когда мутация в самой структуре гормона или в рецепторах гипоталамуса мешает правильно принимать сигнал.
Если человек с медленным обменом веществ решит вдруг сесть на голодную диету, его ждут большие мучения: аппетит становится просто зверским. Начинает тянуть на все самое жирное, сладкое или соленое. Активность падает очень сильно и переводит его в режим амебы с постоянными мыслями о еде, плохим настроением, отсутствием сил и либидо. Работа щитовидной железы еще больше ухудшается.
К этому добавляется низкая чувствительность мышечных клеток к инсулину, что делает отложение жира более легким.
С эволюционной точки зрения выживали именно те, кто мог запасать больше жира, чтобы пережить голод, долгие зимы и передать свои гены потомству. Теперь это уже больше не эволюционное преимущество, но многие из нас носят эти гены и всю жизнь борются с лишним весом.
Изменение скорости метаболизма
До этого речь шла о вещах отчасти генетических. Но человек — система не замкнутая. На нас очень влияет окружающая среда. Еще сто лет назад метаболизм был менее зависим от нее. Но сегодня у нас изобилие еды — жирной, сладкой, калорийной, всегда доступной. Мы двигаемся меньше — у нас есть машины, метро, самолеты, а всякая техника упрощает жизнь.
Малоподвижный образ жизни, плохое питание, стрессы, недостаток сна – все это сбивает систему саморегуляции веса, нарушает пищевое поведение. Гипоталамус перестает правильно воспринимать сигналы организма, мышцы теряют чувствительность к инсулину. В худшем сценарии развивается метаболический синдром — диабет 2 типа, гипертония и атеросклероз, которые часто идут вместе и усиливают друг друга.
И если с генетикой бороться трудно, с образом жизни можно сделать многое. Даже самый безнадежный с точки зрения генетики человек способен на большие перемены.
«Разгон» метаболизма
Говорить о «разгоне» метаболизма не правильно. Вместо этого нужно думать о том, как вернуть его в норму. Сильно ускоренный метаболизм — это серьезное заболевание (например, Базедова болезнь).
Что снижает метаболизм? Малоподвижный образ жизни, отсутствие силовых тренировок, мышц, увлечение сахаром и насыщенными жирами, нарушение пищевого поведения. И «лечится» это изменением образа жизни.
Вы похудеете, восстановите чувствительность клеток к инсулину с помощью диеты и силовых тренировок, и обмен веществ придет в норму, насколько это возможно. Вы научитесь есть, когда голодны и не есть, когда сыты, перестанете бомбардировать мозг эндорфинами от калорийной еды, улучшите чувствительность к лептину.
А совсем не наоборот: сначала «разогнать» обмен веществ, а потом похудеть на этих скоростях. Совершенно бессмысленно ускорять метаболизм, чтобы худеть. Он возвращается к своему нормальному состоянию в процессе похудения.
Алгоритм метаболизма

Решение организационных вопросов питания у лиц старших возрастов, разработка и назначение индивидуализированных рационов рационального, профилактического и лечебного питания в существенной степени зависит от правильной оценки врачом нутриционного статуса пожилого человека, особенностей состояния обменных процессов. Именно поэтому профессионально грамотный клиницист, участвующий в решении проблем лечебно-профилактического питания у лиц пожилого и старческого возраста, должен быть достаточно хорошо ориентирован в области основ клинической биохимии и физиологии питания стареющего организма.
Белковый обмен
Белки — сложные азотсодержащие биополимеры, мономерами которых служат аминокислоты (органические соединения, содержащие карбоксильные и аминные группы). Их биологическая роль многообразна. Белки выполняют в организме пластические, каталитические, гормональные, транспортные и другие функции, а также обеспечивают специфичность. Значение белкового компонента питания заключается прежде всего в том, что он служит источником аминокислот.
Аминокислоты делятся на эссенциальные и неэссенциальные в зависимости от того, возможно ли их образование в организме из предшественников. К незаменимым аминокислотам относятся гистидин, лейцин, изолейцин, лизин, метионин, фенилаланин, триптофан и валин, а также цистеин и тирозин, синтезируемые соответственно из метионина и фенилаланина. Девять заменимых аминокислот (аланин, аргинин, аспарагиновая и глутамовая кислоты, глутамин, глицин, пролин и серин) могут отсутствовать в рационе, так как способны образовываться из других веществ. В организме также существуют аминокислоты, которые продуцируются путем модификации боковых цепей вышеперечисленных (например, компонент коллагена — гидроксипролин — и сократительных белков мышц — 3-метилгистидин).
Большинство аминокислот имеют изомеры (D- и L-формы), из которых только L-формы входят в состав белков человеческого организма. D-формы могут участвовать в метаболизме, превращаясь в L-формы, однако утилизируются гораздо менее эффективно.
Взаимоотношение аминокислот
По химическому строению аминокислоты делятся на двухосновные, двухкислотные и нейтральные с алифатическими и ароматическими боковыми цепями, что имеет большое значение для их транспорта, поскольку каждый класс аминокислот обладает специфическими переносчиками. Аминокислоты с аналогичным строением обычно вступают в сложные, часто конкурентные взаимоотношения.
Так, ароматические аминокислоты (фенилаланин, тирозин и триптофан) близкородственны между собой. Хотя фенилаланин является незаменимой, а тирозин — синтезируемой из него заменимой аминокислотой, наличие тирозина в рационе как будто бы «сберегает» фенилаланин. Если фенилаланина недостаточно или его метаболизм нарушен (например, при дефиците витамина С) — тирозин становится незаменимой аминокислотой. Подобные взаимоотношения характерны и для серосодержащих аминокислот: незаменимой — метионина — и образующегося из него цистеина.
Триптофан в ходе превращений, для которых необходим витамин В 6 (пиридоксин), включается в структуру НАД и НАДФ, то есть дублирует роль ниацина. Приблизительно половина обычной потребности в ниацине удовлетворяется за счет триптофана: 1 мг ниацина пищи эквивалентен 60 мг триптофана. Поэтому состояние пеллагры может развиваться не только при недостатке витамина РР в рационе, но и при нехватке триптофана или нарушении его обмена, в том числе вследствие дефицита пиридоксина.
Аминокислоты также делятся на глюкогенные и кетогенные, в зависимости от того, могут ли они при определенных условиях становиться предшественниками глюкозы или кетоновых тел (см. табл. 1).
Таблица 1. Классификация аминокислот
| Виды | Эссенциальные аминокислоты | Неэссенциальные аминокислоты |
| Алифатические | Валин (Г), лейцин (К), изолейцин (Г, К) | Глицин (Г), аланин (Г) |
| Двухосновные | Лизин (К), гистидин (Г, К)* | Аргинин (Г)* |
| Ароматические | Фенилаланин (Г, К), триптофан (Г, К) | Тирозин (Г, К)** |
| Оксиаминокислоты | Треонин (Г, К) | Серин (Г) |
| Серосодержащие | Метионин (Г, К) | Цистеин (Г)** |
| Дикарбоновые и их амиды | Глутамовая кислота (Г), глутамин (Г), аспарагиновая кислота (Г), аспарагин (Г) | |
| Иминокислоты | Пролин (Г) |
Обозначения: Г — глюкогенные, К — кетогенные аминокислоты; * — гистидин незаменим у детей до года; ** — условно-незаменимые аминокислоты (могут синтезироваться из фенилаланина и метионина).
Необходимые азотсодержащие соединения
Поступление азотсодержащих веществ с пищей происходит в основном за счет белка и в менее значимых количествах — свободных аминокислот и других соединений. В животной пище основное количество азота содержится в виде белка. В продуктах растительного происхождения большая часть азота представлена небелковыми соединениями, также в них содержится множество аминокислот, которые не встречаются в организме человека и зачастую не могут метаболизироваться им.
Синтез пуриновых оснований
Человек не нуждается в поступлении с пищей нуклеиновых кислот. Пуриновые и пиримидиновые основания синтезируются в печени из аминокислот, а избыток этих оснований, поступивших с пищей, выводится в виде мочевой кислоты.
Прием белка
Обычный (но не оптимальный) ежедневный прием белка у среднестатистического человека составляет приблизительно 100 г. К ним присоединяется примерно 70 г белка, секретируемого в полость желудочно-кишечного тракта. Из этого количества абсорбируется около 160 г. Самим организмом в сутки синтезируется в среднем 240–250 г белка. Такая разница между поступлением и эндогенным преобразованием свидетельствует об активности процессов обратного восстановления исходного сложного химического соединения из «осколков», образовавшихся при его метаболизме (ресинтеза белков из аминокислот, а аминокислот из аммиака и «углеродных скелетов» аминокислот).
Азотное равновесие
Для здорового человека характерно состояние азотного равновесия, когда потери белка (с мочой, калом, эпидермисом и т. п.) соответствуют его количеству, поступившему с пищей. При преобладании катаболических процессов возникает отрицательный азотный баланс, который характерен для низкого потребления азотсодержащих веществ (низкобелковых рационов, голодания, нарушения абсорбции белка) и многих патологических процессов, вызывающих интенсификацию распада (опухолей, ожоговой болезни и т. п.). При доминировании синтетических процессов количество вводимого азота преобладает над его выведением, и возникает положительный азотный баланс, характерный для детей, беременных женщин и реконвалесцентов после тяжелых заболеваний.
После прохождения энтерального барьера белки поступают в кровь в виде свободных аминокислот. Следует отметить, что клетки слизистой оболочки желудочно-кишечного тракта могут метаболизировать некоторые аминокислоты (в том числе глутамовую кислоту и аспарагиновую кислоту в аланин). Способность энтероцитов видоизменять эти аминокислоты, возможно, позволяет избежать токсического эффекта при их избыточном введении.
Аминокислоты, как поступившие в кровь при переваривании белка, так и синтезированные в клетках, в крови образуют постоянно обновляющийся свободный пул аминокислот, который составляет около 100 г.
Путь белка
75 % аминокислот, находящихся в системной циркуляции, представлены аминокислотами с ветвящимися цепями (лейцином, изолейцином и валином). Из мышечной ткани в кровоток выделяются аланин, который является основным предшественником синтеза глюкозы, и глутамин. Многие свободные аминокислоты подвергаются трансформации в печени. Часть свободного пула инкорпорируется в белки организма и при их катаболизме вновь поступает в кровоток. Другие непосредственно подвергаются катаболическим реакциям. Некоторые свободные аминокислоты используются для синтеза новых азотсодержащих соединений (пурина, креатинина, адреналина) и в дальнейшем деградируют, не возвращаясь в свободный пул, в специфичные продукты распада.
Роль печени
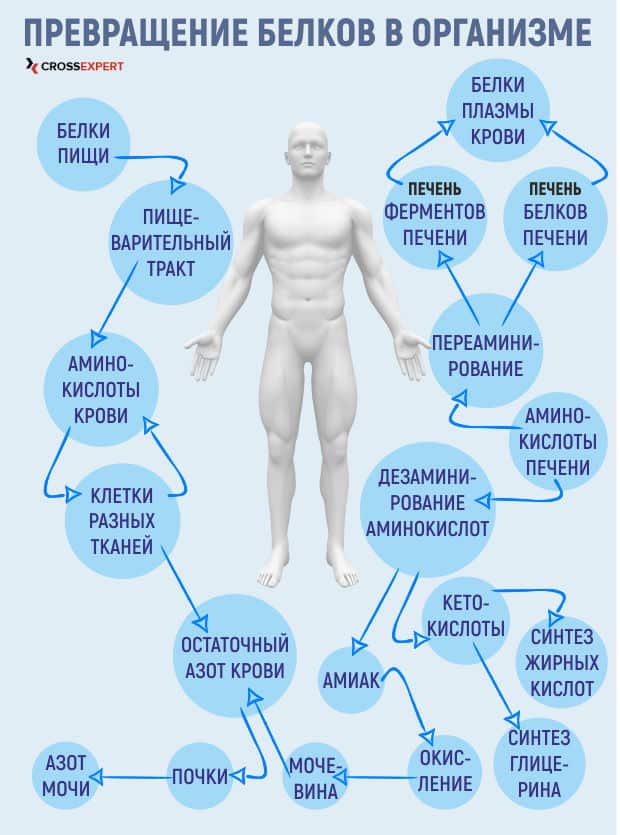
Постоянство содержания различных аминокислот в крови обеспечивает печень. Она утилизирует примерно ⅓ всех аминокислот, поступающих в организм, что позволяет предотвратить скачки в их концентрации в зависимости от питания.
Первостепенная роль печени в азотном и других видах обмена обеспечивается ее анатомическим расположением — продукты переваривания попадают по воротной вене непосредственно в этот орган. Кроме того, печень непосредственно связана с экскреторной системой — билиарным трактом, что позволяет выводить некоторые соединения в составе желчи. Гепатоциты — единственные клетки, обладающие полным набором ферментов, участвующих в аминокислотном обмене. Здесь выполняются все основные процессы азотного метаболизма: распад аминокислот для выработки энергии и обеспечения глюконеогенеза, образование заменимых аминокислот и нуклеиновых кислот, обезвреживание аммиака и других конечных продуктов. Печень является основным местом деградации большинства незаменимых аминокислот (за исключением аминокислот с ветвящимися цепями).
Инсулиновый ответ
Синтез азотсодержащих соединений (белка и нуклеиновых кислот) в печени весьма чувствителен к поступлению их предшественников из пищи. После каждого приема пищи наступает период повышенного внутрипеченочного синтеза белков, в том числе альбумина. Аналогичное усиление синтетических процессов происходит и в мышцах. Эти реакции связаны прежде всего с действием инсулина, который секретируется в ответ на введение аминокислот и/или глюкозы.
Некоторые аминокислоты (аргинин и аминокислоты с ветвящимися цепями) усиливают продукцию инсулина в большей степени, чем остальные. Другие (аспарагин, глицин, серин, цистеин) стимулируют секрецию глюкагона, который усиливает утилизацию аминокислот печенью и воздействует на ферменты глюконеогенеза и аминокислотного катаболизма. Благодаря этим механизмам происходит снижение уровня аминокислот в крови после поступления их с пищей. Действие инсулина наиболее выражено для аминокислот, содержащихся в кровотоке в свободном виде (аминокислот с ветвящимися цепями), и малозначимо для тех, которые транспортируются в связанном виде (триптофана). Обратное инсулину влияние на белковый метаболизм оказывают глюкокортикостероиды.
Аминокислоты на «экспорт»
Печень обладает повышенной скоростью синтеза и распада белков по сравнению с другими тканями организма (кроме поджелудочной железы). Это позволяет ей синтезировать «на экспорт», а также быстро обеспечивать лабильный резерв аминокислот в период недостаточного питания за счет распада собственных белков.
Особенность внутрипеченочного белкового синтеза заключается в том, что он усиливается под действием гормонов, которые в других тканях производят катаболический эффект. Так, при голодании белки мышц, для обеспечения организма энергией, подвергаются распаду, а в печени одновременно усиливается синтез белков, являющихся ферментами глюконеогенеза и мочевинообразования.
Избыток белка и голодание
Прием пищи, содержащей избыток белка, приводит к интенсификации синтеза в печени и в мышцах, образованию избыточных количеств альбумина и деградации излишка аминокислот до предшественников глюкозы и липидов. Глюкоза и триглицериды утилизируются как горючее или депонируются, а альбумин становится временным хранилищем аминокислот и средством их транспортировки в периферические ткани.
При голодании уровень альбумина прогрессивно снижается, а при последующей нормализации поступления белка медленно восстанавливается. Поэтому хотя альбумин и является показателем белковой недостаточности, он низкочувствителен и не реагирует оперативно на изменения в питании.
7 из 10 эссенциальных аминокислот деградируют в печени — либо образуя мочевину, либо впоследствии используясь в глюконеогенезе. Мочевина преимущественно выделяется с мочой, но часть ее поступает в просвет кишечника, где подвергается уреазному воздействию микрофлоры. Аминокислоты с ветвящимися цепями катаболизируются в основном в почках, мышцах и головном мозге.
Роль мышц
Мышцы синтезируют ежедневно 75 г белка. У среднего человека они содержат 40 % от всего белка организма. Хотя белковый метаболизм происходит здесь несколько медленнее, чем в других тканях, мышечный белок представляет собой самый большой эндогенный аминокислотный резерв, который при голодании может использоваться для глюконеогенеза.
Мышцы являются основной мишенью воздействия инсулина: здесь под его влиянием усиливается поступление аминокислот, увеличивается синтез мышечного белка и снижается распад.
В процессе превращений в мышцах образуются аланин и глутамин, их условно можно считать транспортными формами азота. Аланин непосредственно из мышц попадает в печень, а глутамин вначале поступает в кишечник, где частично превращается в аланин. Поскольку в печени из аланина происходит синтез глюкозы, частично обеспечивающий мышцу энергией, получающийся круго- оборот получил название глюкозо- аланинового цикла.
К азотсодержащим веществам мышц также относятся высокоэнергетичный креатин-фосфат и продукт его деградации креатинин. Экскреция креатинина обычно рассматривается как мера мышечной массы. Однако это соединение может поступать в организм с высокобелковой пищей и влиять на результаты исследования содержания его в моче. Продукт распада миофибриллярных белков — 3-метилгистидин — экскретируется с мочой в течение короткого времени и является достаточно точным показателем скорости распада в мышцах — при мышечном истощении скорость его выхода пропорционально снижается.
Механизм голодания
В отсутствие пищи синтез альбумина и мышечного белка замедляется, но продолжается деградация аминокислот. Поэтому на начальном этапе голодания мышцы теряют аминокислоты, которые идут на энергетические нужды. В дальнейшем организм адаптируется к отсутствию новых поступлений аминокислот (снижается потребность в зависящем от белка глюконеогенезе за счет использования энергетического потенциала кетоновых тел) и потеря белка мускулатуры уменьшается.
Хотите больше новой информации по вопросам диетологии?
Оформите подписку на информационно-практический журнал «Практическая диетология»!
Роль почек
Почки не только выводят конечные продукты азотного распада (мочевину, креатинин и др.), но и являются дополнительным местом ресинтеза глюкозы из аминокислот, а также регулируют образование аммиака, компенсируя избыток ионов водорода в крови.
Глюконеогенез и функционирование кислотно-щелочной регуляции тесно скоординированы, поскольку субстраты этих процессов появляются при дезаминировании аминокислот: углерод для синтеза глюкозы и азот — для аммиака. Существует даже мнение, что именно производство глюкозы является основной реакцией почек на ацидоз, а образование аммиака происходит вторично.
Белок в нервной ткани
Для нервной ткани характерны более высокие концентрации аминокислот, чем в плазме. Это позволяет обеспечить мозг достаточным количеством ароматических аминокислот, являющихся предшественниками нейромедиаторов.
Некоторые заменимые аминокислоты, такие как глутамат (из которого при участии пиридоксина образуется гамма-аминомасляная кислота) и аспартат, также обладают влиянием на возбудимость нервной ткани. Их концентрация здесь высока, при этом заменимые аминокислоты способны синтезироваться и на месте.
Сон после еды
Специфическую роль играет триптофан, являющийся предшественником серотонина. Именно с повышением концентрации триптофана (а следовательно, и серотонина) связана сонливость после еды. Такой эффект особенно выражен при приеме больших количеств триптофана совместно с углеводистой пищей. Повышенная секреция инсулина снижает уровень в крови аминокислот с ветвящимися цепями, которые при преодолении барьера «кровь — мозг» обладают конкурентными взаимоотношениями с ароматическими аминокислотами, но в то же время не оказывает влияния на концентрацию связанного с альбумином триптофана. Благодаря подобным эффектам препараты триптофана могут использоваться в психиатрической практике.
При заболеваниях печени
Ограничение ароматических аминокислот в рационе, в связи с их влиянием на центральную нервную систему, имеет профилактическое значение при ведении пациентов с печеночной энцефалопатией. Элементные аминокислотные диеты с преимущественным содержанием лейцина, изолейцина, валина и аргинина помогают избежать развития белковой недостаточности у гепатологических больных и в то же время не приводят к возникновению печеночной комы.
Основные пластические функции протеиногенных аминокислот перечислены в таблице 2.
Таблица 2. Основные функции аминокислот
| Аланин | Предшественник глюконеогенеза, переносчик азота из периферических тканей в печень |
| Аргинин | Непосредственный предшественник мочевины |
| Аспарагиновая кислота | Предшественник глюконеогенеза, предшественник пиримидина, используется для синтеза мочевины |
| Глутаминовая кислота | Донор аминогрупп для многих реакций, переносчик азота (проникает через мембраны легче, чем глутамин), источник аммиака, предшественник ГАМК |
| Глицин | Предшественник пуринов, глютатиона и креатинина, входит в состав гемоглобина и цитохромов, нейротрансмиттер |
| Гистидин | Предшественник гистамина, донор углерода |
| Лизин | Предшественник карнитина (транспорт жирных кислот), составляющая коллагена |
| Метионин | Донор метальных групп для многих синтетических процессов (в т. ч. холина, пиримидинов), предшественник цистеина, участвует в метаболизме никотиновой кислоты и гистамина |
| Фенилаланин | Предшественник тирозина |
| Серин | Составляющая фосфолипидов, предшественник сфинголипидов, предшественник этаноламина и холина, участвует в синтезе пуринов и пиримидинов |
| Триптофан | Предшественник серотонина и никотинамида |
| Тирозин | Предшественник катехоламинов, допамина, меланина, тироксина |
| Цистеин | Предшественник таурина (желчные кислоты), входит в состав глютатиона (антиоксидантная система) |
Нормы потребления белка
Современные рекомендации по обеспечению пожилых людей и стариков основными питательными веществами, в первую очередь белками, свидетельствуют о целесообразном некотором снижении суточного количества белковых продуктов в пищевом рационе до 0,75–0,8 г/кг веса. Это связано с тем, что интенсивность основных физиологических функций с каждым десятилетием жизни человека после 50 лет снижается почти на 10 % (Rogers J., Jensen G., 2004), потребность белка уменьшается за счет инволюции синтетических и пластических процессов и ферментообразования, продукции гормонов, ряда биологически активных веществ, обеспечения мышечной деятельности и т. д.
Рекомендуемые нормы потребления для белка с учетом приведенных выше показателей составляют 55–62 г/сут (для мужчины весом 77 кг в возрасте 60–70 лет) и 45–52 г/сут (для женщины весом 65 кг в возрасте 60–70 лет) по выводам IV Американского национального исследования по оценке здоровья и питания (2006).
Вместе с тем установлено, что при сохранении физической активности пожилых людей (профессиональной физической нагрузки, занятий физкультурой, работы на дачном участке и т. п.) для поддержания азотного равновесия организма требуется повышение белкового обеспечения пожилого человека в количестве 1–1,25 г/кг в день. Эта же квота пищевого белка полностью обеспечит потребности пожилого человека, находящегося в состоянии стресса, болезни или ранения (Lowenthal D. T., 1990).
Рис. 1. Влияние пищевых веществ на развитие болезней избыточного питания (по А. А. Покровскому)
Дефицит белка = старение
Важно отметить, что организм пожилого человека очень чувствителен как к дефициту экзогенно поступающих белков, так и к их избытку. В условиях белкового дефицита прогрессирующе развиваются процессы дистрофии и атрофии клеточных структур, в первую очередь мышечной ткани, слизистых оболочек (желудочно-кишечного тракта, дыхательной системы и др.), паренхиматозных органов (поджелудочной железы, печени, эндокринных желез и др.), структур иммунной системы. Белковый дефицит питания активизирует процессы старения организма.
Механизмы патологического действия на организм пожилого и старого человека пищевой белковой перегрузки связаны в первую очередь с белковой «агрессией» печени и связанной с этим несостоятельностью ферментных систем, неполной деполимеризацией всех фракций белка, накоплением в крови токсических продуктов незавершенных окислительно-восстановительных реакций и т. д.
Белковая перегрузка
Интоксикационный процесс метаболического генеза при избыточном белковом питании пожилых и старых людей многократно усиливается по причине развития процессов гнилостной кишечной диспепсии в условиях относительной ферментной недостаточности желудка, поджелудочной железы, тонкой кишки и развития синдромов мальдигестии и мальабсорбции, а также кишечного дисбиоза (Барановский А. Ю., Кондрашина Э. А., 2008).
Белковая пищевая перегрузка в рамках интоксикационного синдрома способствует перевозбуждению центральной нервной системы, иногда — состояниям, близким к неврозам. При этом наблюдается повышенный расход витаминов в организме с формированием витаминной недостаточности.
При длительном высокобелковом питании вначале наблюдается компенсаторное усиление, а затем угнетение секреторной функции желудка и поджелудочной железы, повышается риск развития таких заболеваний, как подагра, мочекаменная болезнь.
В следующем выпуске журнала «Практическая диетология» мы продолжим рассказ о геронтологических особенностях основных видов обмена веществ пациентов пожилого и старческого возраста — углеводном и жировом обмене.
// ПД
Хотите больше новой информации по вопросам диетологии?
Оформите подписку на информационно-практический журнал «Практическая диетология»!