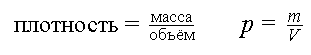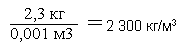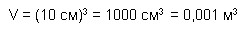Что такое оптическая плотность раствора
Оптическая плотность
Полезное
Смотреть что такое «Оптическая плотность» в других словарях:
оптическая плотность — оптическая плотность: Мера почернения (окраски) фотографического слоя, равная десятичному логарифму обратной величины коэффициента пропускания или коэффициента отражения. Источник … Словарь-справочник терминов нормативно-технической документации
ОПТИЧЕСКАЯ ПЛОТНОСТЬ — мера непрозрачности вещества, равная десятичному логарифму отношения потока излучения Fо, падающего на слой вещества, к потоку прошедшего излучения F, ослабленного в результате поглощения и рассеяния: D=lg(Fо/F). Оптическая плотность логарифм… … Большой Энциклопедический словарь
ОПТИЧЕСКАЯ ПЛОТНОСТЬ — (D), мера непрозрачности слоя в ва толщиной l для световых лучей; характеризует ослабление оптического излучения в слоях разл. в в (красителях, светофильтрах, р рах, газах и т. п.). Для неотражающего слоя О. п. равна: D = lgI0/I=kll, где I… … Физическая энциклопедия
Оптическая плотность — мера непрозрачности к. л. среды (напр., бумаги, пленки, оттиска на бумаге, фотоотпечатка), равная десятичному логарифму отношения падающего на среду потока излучения к потоку, прошедшему через эту среду, или, что то же, логарифму величины,… … Издательский словарь-справочник
Оптическая плотность — степень пропускания света для прозрачных объектов и отражения для непрозрачных. В полиграфии используется для качественной оценки издательских оригиналов, промежуточных изображений (фотоформ) и оттисков … Реклама и полиграфия
ОПТИЧЕСКАЯ ПЛОТНОСТЬ — физ. характеристика и мера непрозрачности слоя вещества для прохождения световых лучей; равна десятичному логарифму отношения потока излучения (плоской монохроматической волны), падающего на слой вещества, к потоку прошедшего излучения,… … Большая политехническая энциклопедия
оптическая плотность — мера непрозрачности вещества, равная десятичному логарифму отношения потока излучения F0, падающего на слой вещества, к потоку прошедшего излучения F, ослабленного в результате поглощения и рассеяния: D = lg(F0/F). Оптическая плотность логарифм… … Энциклопедический словарь
Оптическая плотность — У этого термина существуют и другие значения, см. Плотность (значения). Оптическая плотность мера ослабления света прозрачными объектами (такими, как кристаллы, стекла, фотоплёнка) или отражения света непрозрачными объектами (такими, как… … Википедия
оптическая плотность — optical dense оптическая плотность. Определяемая уровнем поглощения света количественная характристика раствора, которая, в соответствии с законом Бира Ламберта, прямо пропорциональна концентрации растворенного вещества, E=lgIo/I=kcb (где Io… … Молекулярная биология и генетика. Толковый словарь.
Оптическая плотность — 2.22. Оптическая плотность десятичный логарифм величины, обратной коэффициенту пропускания. Источник: Санитарные нормы и правила устройства и эксплуатации лазеров (утв. Главным государственным санитарным врачом СССР 31.07.1991 N 5804 91) … Официальная терминология
оптическая плотность — optinis tankis statusas T sritis Standartizacija ir metrologija apibrėžtis Į sugeriančiąją sistemą kritusios ir per ją perėjusios šviesos intensyvumų dalmens dešimtainis logaritmas, t. y. D(λ) = –lg(τ(λ)); čia τ(λ) – spektrinis praleidimo… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
Оптическая плотность раствора
Колориметрия
Из оптических методов анализа в практике аналитических лабораторий наиболее широко применяются колориметрические методы (от лат. color — цвет и греч. μετρεω — измеряю). Колориметрические методы основаны на измерении интенсивности светового потока, прошедшего через окрашенный раствор.
В колориметрическом методе используются химические реакции, сопровождающиеся изменением цвета анализируемого раствора. Измеряя светопоглощение такого окрашенного раствора или сравнивая полученную окраску с окраской раствора известной концентрации, определяют содержание окрашенного вещества в испытуемом растворе.
Существует зависимость между интенсивностью окраски раствора и содержанием в этом растворе окрашенного вещества. Эта зависимость, называемая основным законом светопоглощения (или законом Бугера—Ламберта—Бера), выражается уравнением:
Физический смысл этого закона можно выразить следующим образом. Растворы одного и того же окрашенного вещества при одинаковой концентрации этого вещества и толщине слоя раствора поглощают равное количество световой энергии, т. е. светопоглощение таких растворов одинаковое.
Для окрашенного раствора, заключенного в стеклянную кювету с параллельными стенками, можно сказать, что по мере увеличения концентрации и толщины слоя раствора его окраска увеличивается, а интенсивность света I, прошедшего через поглощающий раствор, уменьшается по сравнению с интенсивностью падающего света I0.
Рис.1 Прохождение света через кювету с исследуемым раствором.
Оптическая плотность раствора.
Если прологарифмировать уравнение основного закона светопоглощения и изменить знаки на обратные, то уравнение принимает вид:
Величина 
A = ε C l
Из этого уравнения вытекает, что оптическая плотность раствора прямо пропорциональна концентрации окрашенного вещества и толщине слоя раствора.
Другими словами, при одинаковой толщине слоя раствора данного вещества оптическая плотность этого раствора будет тем больше, чем больше в нем содержится окрашенного вещества. Или, наоборот, при одной и той же концентрации данного окрашенного вещества оптическая плотность раствора зависит только от толщины его слоя. Отсюда может быть сделан следующий вывод: если два раствора одного и того же окрашенного вещества имеют различную концентрацию, одинаковая интенсивность окраски этих растворов будет достигнута при толщинах их слоев, обратно пропорциональных концентрациям растворов. Этот вывод очень важен, так как на нем основаны некоторые методы колориметрического анализа.
Таким образом, чтобы определить концентрацию (С) окрашенного раствора, необходимо измерить его оптическую плотность (A). Чтобы измерить оптическую плотность, следует измерить интенсивность светового потока.
Интенсивность окраски растворов можно измерять различными методами. Различают субъективные (или визуальные) методы колориметрии и объективные (или фотоколориметрические).
Визуальными называются такие методы, при которых оценку интенсивности окраски испытуемого раствора делают невооруженным глазом.
Визуальные методы
К визуальным методам относятся:
1) метод стандартных серий;
2) метод дублирования (колориметрическое титрование);
3) метод уравнивания.
Метод стандартных серий. При выполнении анализа методом стандартных серий интенсивность окраски анализируемого окрашенного раствора сравнивают с окрасками серии специально приготовленных стандартных растворов (при одинаковой толщине поглощающего слоя).
Растворы в колориметрии обычно имеют интенсивную окраску, поэтому имеется возможность определять весьма небольшие концентрации или количества веществ. Однако это может сопровождаться определенными трудностями: так навески для приготовления серии стандартных растворов могут быть очень малы. Для преодоления этих трудностей готовят стандартный раствор А достаточно высокой концентрации, например 1 мг/мл. После этого путем разбавления из раствора А готовят стандартный раствор В значительно меньшей концентрации, а из него в свою очередь готовят серию стандартных растворов.
Для этого в пробирки или кюветы одинакового размера и одинакового цвета стекла пипеткой добавляются необходимые объемы растворов реагентов в нужной последовательности. Порции растворов определяемого вещества целесообразно добавлять из бюретки, т.к. их объемы будут различны для обеспечения различных концентраций в серии стандартных растворов. При этом начальный раствор должен содержать все компоненты, кроме определяемого вещества (нулевой раствор). В исследуемый раствор добавляют растворы необходимых реагентов. Все растворы доводят до постоянного объема, а затем визуально сравнивают интенсивность окраски исследуемого раствора с растворами серии стандартных растворов. Возможно совпадение интенсивности окраски с каким-либо раствором серии. Тогда считается, сто исследуемый раствор имеет такую же концентрацию или содержит столько же определяемого вещества. Если же интенсивность окраски покажется промежуточной между соседними растворами серии, концентрация или содержание определяемого компонента считают средним арифметическим между растворами серии.
Колориметрическое титрование (метод дублирования). Этот метод основан на сравнении окраски анализируемого раствора с окраской другого раствора— контрольного. Для приготовления контрольного раствора готовят раствор, содержащий все компоненты исследуемого раствора, за исключением определяемого вещества, и все употреблявшиеся при подготовке пробы реактивы, и к нему добавляют из бюретки стандартный раствор определяемого вещества. Когда этого раствора будет добавлено столько, что интенсивности окраски контрольного и анализируемого раствора уравняются, считают, что в анализируемом растворе содержится столько же определяемого вещества, сколько его было введено в контрольный раствор.
Метод уравнивания.Этот метод основан на уравнивании окрасок анализируемого раствора и раствора с известной концентрацией определяемого вещества — стандартного раствора. Существуют два варианта выполнения колориметрического определения этим методом.
По первому варианту уравнивание окрасок двух растворов с разной концентрацией окрашенного вещества проводят путем изменения толщины слоев этих растворов при одинаковой силе проходящего через растворы светового потока. При этом, несмотря на различие концентраций анализируемого и стандартного растворов, интенсивность светового потока, проходящего через оба слоя этих растворов, будет одинакова. Соотношение между толщинами слоев и концентрациями окрашенного вещества в растворах в момент уравнивания окрасок будет выражаться уравнением:
В момент равенства окрасок отношение толщин слоев двух сравниваемых растворов обратно пропорционально отношению их концентраций.
На основании приведенного уравнения, измерив толщину слоев двух одинаково окрашенных растворов и зная концентрацию одного из этих растворов, легко можно рассчитать неизвестную концентрацию окрашенного вещества в другом растворе.
Для измерения толщины слоя, через который проходит световой поток, можно применять стеклянные цилиндры или пробирки, а при более точных определениях специальные приборы — колориметры.
По второму варианту, для уравнивания окрасок двух растворов с различной концентрацией окрашенного вещества, через слои растворов одинаковой толщины пропускают световые потоки различной интенсивности.
В этом случае оба раствора имеют одинаковую окраску, когда отношение логарифмов интенсивностей падающих световых потоков равно отношению концентраций.
В момент достижения одинаковой окраски двух сравниваемых растворов, при равной толщине их слоев, концентрации растворов прямо пропорциональны логарифмам интенсивностей падающего на них света.
По второму варианту определение может быть выполнено только с помощью колориметра.
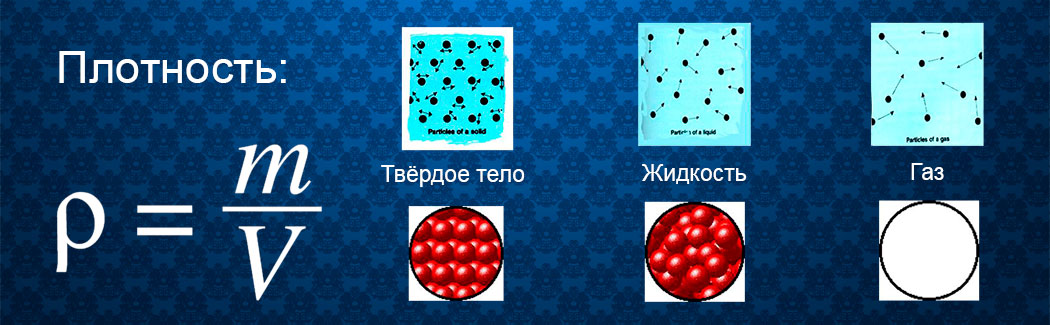
Плотность
Плотность — это интенсивность распределения одной величины по другой.
Термин объединяет несколько различных понятий, таких как: плотность вещества; оптическая плотность; плотность населения; плотность застройки; плотность огня и многие другие. Рассмотрим два понятия, касающихся неразрушающего контроля.
1. Плотность вещества.
В физике плотностью вещества называют массу этого вещества, содержащуюся в единице объёма при нормальных условиях. Тела одинакового объёма, изготовленные из различных веществ, обладают различной массой, что и характеризует их плотность. К примеру, два куба одинаковых размеров, изготовленные из чугуна и алюминия, будут отличаться весом и плотностью.
Чтобы вычислить плотность какого-либо тела, нужно точно определить его массу и разделить её на точный объём этого тела.
кг/м 3
— Единицы измерения
плотности в международной
системе единиц (СИ)
г/см 3
— Единицы измерения
плотности в системе СГС
Выведем формулу вычисления плотности.
Для примера определим плотность бетона. Возьмём бетонный кубик весом 2,3 кг со стороной 10 см. Подсчитаем объём кубика.
Подставляем данные в формулу.

От чего зависит плотность вещества
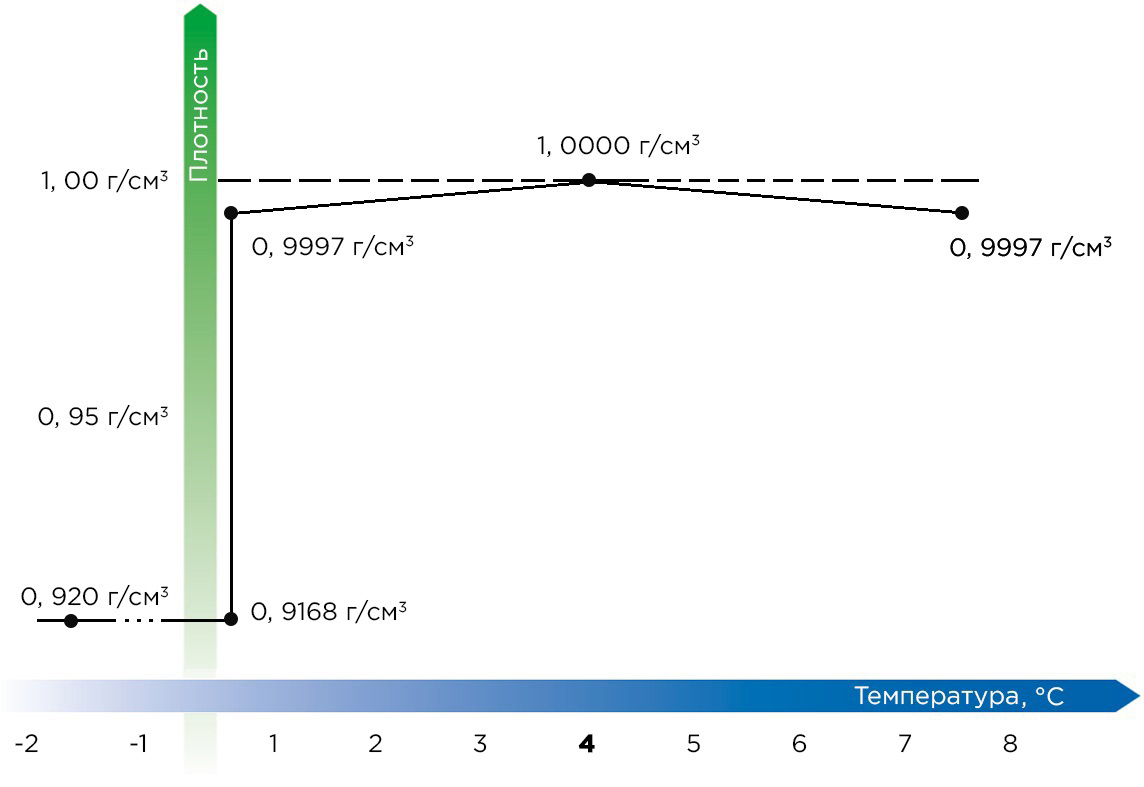
Плотность вещества меняется и при изменении его агрегатного состояния. Она скачкообразно растёт при переходе вещества из газообразного в жидкое состояние, и далее — в твёрдое. Здесь также есть исключения: плотность воды, висмута, кремния и некоторых других веществ снижается при затвердевании.
Чем измеряется плотность вещества
Для измерения плотности различных веществ применяются специальные приборы и приспособления. Так, плотность жидкостей и концентрация растворов измеряется различными ареометрами. Несколько разновидностей пикнометров предназначены для измерения плотности твёрдых тел, жидкостей и газов.

2. Оптическая плотность.
В физике оптической плотностью называют способность прозрачных материалов поглощать свет, а непрозрачных — отражать его. Это понятие в большинстве случаев характеризует степень ослабления светового излучения при прохождении его через слои и плёнки различных веществ.
Оптическую плотность принято выражать десятичным логарифмом отношения падающего на объект потока излучения к потоку, прошедшему через объект или отражённому от него:
Оптическая плотность=логарифм (поток излучения, падающий на объект 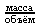
В радиографическом методе контроля оптическая плотность является одним из основных параметров, определяющих пригодность снимков для их расшифровки. Допустимые значения этого параметра обусловлены требованиями ГОСТ 7512-82 (раздел 6 – расшифровка снимков).
Оптическая плотность измеряется в Беллах, сокращённое обозначение — «Б». Для измерения оптической плотности используется денситометр. Прибор сравнивает яркость негатоскопа и яркость точки на плёнке. По этим двум значениям прибор определяет оптическую плотность. Чем выше плотность, тем темнее изображение.

Оптическая плотность растворов при прочих равных условиях прямо пропорциональна концентрации вещества и толщине поглощаемого слоя



Такая формулировка известна как закон Бугера-Ламберта-Бера, или основного закона фотометрии. Графическое выражение закона Бугера-Ламберта-Бера:
 |

Рис. 1.1.6. С
Из основного закона колориметрии вытекает важное в практическом смысле следствие.
Нальем в узкий стеклянный цилиндр с плоским дном раствор, какого- либо окрашенного вещества и будем наблюдать интенсивность окраски сверху при условии, что пучок света падает на раствор снизу, через дно цилиндра.
При толщине поглощающего слоя l1, концентрация вещества будет C1 и мощность выходящего потока света W1. Тогда, согласно закону Бугера-Ламберта-Бера
Затем с помощью растворителя увеличим объем раствора в два раза, до толщины слоя l2.
При разбавлении концентрация вещества уменьшилась в два раза, т.е. C2=C1/C2, но число частиц во всем объеме раствора по пути проходящего света осталось тем же, поэтому доля во втором случае равна доле поглощенного света в первом случае, а тогда и оптические свойства будут равны:
Из уравнения (7) следует:
при одинаковой интенсивности окраски двух растворов данного вещества их концентрации обратно пропорциональные толщинам поглощающих свет слоев.
Если в уравнении А=ECL, С имеет размерность моль/л, L выражается в см, величина E является молярным коэффициентом погашения или молярным коэффициентом абсорбции и обозначается символом Eµ
Молярный коэффициент поглощения не зависит от концентрации раствора и является мерой чувствительности определений.
Разберем, что это значит на примере. Пусть мы имеем два раствора (окрашенные) меди: гексааммиакат меди с Eµ = 500, дитизонат меди Eµ=50000.При каких концентрациях меди реакциями с аммиаком и дитизоном можно получить одинаковые оптические плотности при одинаковой толщине слоя?
Согласно основному закону фотометрии для гексааммиакат меди:
Для дитизоната меди:
ВЫВОД: чем больше молярный коэффициент поглощения, тем чувствительней определение.
Молярный коэффициент поглощения можно рассчитать из уравнения:
Для характеристики цветовых растворов веществ строятся кривые светопоглощения. Кривая спектра поглощения:
A= f(λ)
 |
 |
Рис. 1.1.7.
Пользуясь кривыми светопоглощения, выбирают длину волны для измерения оптической плотности. Наибольшая величина молярного коэффициента поглощения, а, следовательно, и наибольшая чувствительность достигается при максимуме светопоглощения.
1. Для того чтобы правильно подобрать окрашенное соединение, необходимо по справочнику выбрать такое соединение данного иона, при котором молярный коэффициент поглощения будет наибольшим.
2. Для правильного выбора светофильтра (λ) необходимо построить кривую светопоглощения (кривая абсорбции). По максимуму определить необходимую длину волны.
3. Выбираем толщину кювет такой, чтобы оптическая плотность уложилась в интервал 0,2-0,8.
|
|
|
|
|





|
|


РрррРис. 1.1.8.
Максимум светопоглощения для меди наблюдается при светофильтре №2, при этом для соли Ni 2+ наблюдается минимум светопоглощения, следовательно, соль Ni 2+ не мешает определению меди.
2. Измерения ведут при той длине волны, где наблюдается максимум светополощения на кривой светопоглощения для данного иона и минимума для мешающих ионов.
Лекция №3 Фотометрический метод анализа.
1. Условия образования окрашенных соединений.
Качественное обнаружение отклонения от закона Б-Л-Б.
Количественное определение отклонений от закона Б-Л-Б.
Влияние прочности комплексных соединений на отклонения.
Влияние посторонних комплексообразующих ионов.
Влияние концентрации водородных ионов.
Влияние температуры и времени.
2. Экстракция в фотометрическом методе анализа.
3. Фотометрический анализ многокомпонентных растворов.
4. Определение высоких концентраций веществ методом дифференциальной фотометрии.
При выводе закона Б-Л-Б предполагается, что частицы при разбавлении раствора остаются неизмененными, т.е. не взаимодействуют с молекулами растворителя и ионами других веществ, присутствующих в растворе.
В реальных условиях окрашенные вещества при разбавлении или при действии посторонних веществ, часто разрушаются. Вследствие этого нарушается прямо пропорциональная зависимость между концентрацией и оптической плотностью раствора – наблюдаются отклонения от закона Бугера-Ламберта-Бера.
1.1 Качественно эти отклонения можно обнаружить при построении графиков A=f(c) и A=f (ℓ).

Рис. 1.1.9. С
Отклонение от основного закона поглощения называется положительными или отрицательными в зависимости от расположения экспериментальной линии на графике выше или ниже теоретической прямой.
1.2. Для количественного определения отклонения от закона Б-Л-Б измеряют оптическую плотность исходного раствора A0 с концентрацией вещества C1 при толщине слоя ℓ1. Затем разбавляют исходный раствор в n раз и снова измеряют оптическую плотность An, раствора с концентрацией C2=C1/n при
толщине слоя nℓ1, если при разбавлении не увеличивается диссоциация
комплексного соединения, то A0=An, а дельта =0, т.е. закон Б-Л-Б выполняется, если A0 не равна An, то дельта =A0-An/A0, закон Б-Л-Б не выполняется, т.е. наблюдаются отклонения.
1.3. В первую очередь отклонения могут наблюдаться из-за непрочности комплексных соединений, т.к. практическое большинство окрашенных веществ – комплексные. Чем больше прочен комплекс, тем больше образуется окрашенных частиц и тем больше устойчивость. Если при разбавлении интенсивность окраски раствора уменьшается сильнее, чем следует ожидать, это свидетельствует о малой прочности окрашенного комплекса.
1.5 Кислотность раствора, при которой осуществляется реакция, в фотометрическом анализе имеет большое значение.
а) рассмотрим окрашенные комплексы с анионами сильных кислот:
Образование окрашенного комплекса идет по уравнению:
При этом происходит разрушение окрашенного комплекса.
ВЫВОД (1): Если комплексное соединение образовано анионами сильных кислот – работать необходимо в кислых средах.
б) Комплексы с анионами слабых кислот. К этой группе относятся большинство органических реагентов. В общем, виде такие кислоты можно изобразить следующим образом:
Увеличение концентрации R можно добиться повышения pH раствора, при этом:
и равновесие реакции:
Увеличение концентрации ионов H + приведет к сдвигу равновесия вправо, что будет способствовать разрушению комплексного соединения.
ВЫВОД(2):Если комплексное соединение образовано анионами слабых кислот – работать необходимо в щелочных средах.
в) При использовании комплексов следует предусматривать возможность образования поочередно комплексов с различным числом координированных частиц реагента
Реактив обладает индикаторными свойствами.
Среди реактивов, являющихся слабыми органическими кислотами, много соединений обладающих индикаторными свойствами. Такие реактивы способны изменять свою окраску с изменением концентрации ионов водорода.
Например: при pH >4,5 образует с ализарином соединения, растворы которых окрашены в красный цвет. Растворы ализарина при этом значении pH желтого цвета, но при pH >5,5 ализарин изменяет окраску на красно-фиолетовую, т.е. даже в отсутствии алюминия получается красная окраска раствора. Поэтому определение алюминия с ализарином рекомендуется проводить в интервале значений pH 4,5-5,0.
д) Температура и время
При стоянии растворы выцветают. Температура влияет по–разному, в зависимости от природы раствора.