Что такое орбиталь определенный энергетический уровень
Энергетический уровень, подуровень, орбиталь, типы орбиталей.



Энергетический уровень – совокупность всех орбиталей с одним и тем же значением n. Число уровней, на котором находятся электроны в основном состоянии атома, совпадает с номером периода, в котором располагается элемент: 1, 2, 3 …
Энергетический подуровень – совокупность энергетических состояний электрона в атоме, характеризующихся одними и теми же значениями квантовых чисел n и l. Подуровни обозначаются: s, p, d, f …
I энергетический уровень – 1 подуровень
II энергетический уровень – 2 подуровеня
III энергетический уровень – 3 подуровеня
Орбиталь – область пространства, наиболее вероятного пребывания электрона в электр. Поле ядра атома. Орбитали характеризуются квантовыми числами.
Принцип Паули и следствие из него:
В атоме не может быть 2-х электронов, которые бы имели одинаковый набор всех 4-х квантовых чисел.
Следствием этого принципа является тот факт, что в атоме последовательно заполняются все орбитали.
Принцип наименьшей энергии:
Принцип определяет последовательность заполнения орбиталей электронами, в основном состоянии атома каждый электрон располагается так, чтобы его энергия была минимальной.
Основное состояние – это наиболее устойчивое состояние атома, в котором электроны занимают орбитали с наименьшей энергией.
Правило Гунда:
В основном состоянии атом имеет максимально возможное число неспаренных электронов в пределах определенного подуровня. Например, если на 2p-подуровне находятся три электрона. То они должны находиться на 3-х разных орбиталях:
 |  |  |
В этом случае суммарный спин максимален и равен 3/2.
Электронные формулы (конфигурации) атомов:
Электронная конфигурация – формула расположения электронов по различным электронным оболочкам атома химического элемента или молекулы.
Для легких орбиталей любой период начинается с s-орбитали, а заканчивается p-орбиталью (кроме 1-го). Если присутствуют несколько тяжелых орбиталей, то сначала заполняется та, чья pi меньшая.
Последовательность заполнения орбиталей электронами определяется принципом наименьшей энергии: в основном состоянии атома каждый электрон располагается так, чтобы его энергия была минимальной.
Физический смысл периодического закона состоит в том, что при последовательном возрастании зарядов ядер главного квантового числа, периодически повторяется сходные валентные электронные структуры атомов, и как следствие, периодически повторяются химические свойства элементов
Периодическая система элементов:
Периодическая система элементов – классификация химических элементов, графически изображаемая в виде периодической таблицы. Она состоит из семи периодов (десяти рядом) и восьми групп.
В этой системе Менделеев разделил все элементы на периоды и расположил один период под другим так, чтобы сходные по свойствам и типу образуемых соединений элементы приходились друг под другом.
Разница между орбиталями и уровнями энергии
Каждый атом состоит из ядра, состоящего из протонов и нейтронов, которые окружены электронами. Эти электроны находятся в постоянном движении вокруг ядра. Поэтому мы не можем дать конкретное местополо
Содержание:
Каждый атом состоит из ядра, состоящего из протонов и нейтронов, которые окружены электронами. Эти электроны находятся в постоянном движении вокруг ядра. Поэтому мы не можем дать конкретное местоположение для электрона в атоме. Вместо определения точного положения электрона ученые ввели понятие «вероятность». Другими словами, определяется наиболее вероятный путь, по которому электрон, скорее всего, движется. Этот путь называется орбитальным. Эти орбитали расположены в соответствии с количеством энергии, из которой состоят электроны на этих орбиталях. Это так называемые энергетические уровни. Основное различие между орбиталями и уровнями энергии состоит в том, что орбитали показывают наиболее вероятный путь движения электрона вокруг ядра, тогда как энергетические уровни показывают относительное расположение орбиталей в соответствии с количеством энергии, которой они обладают.
Ключевые области покрыты
1. Что такое орбитали
— Формирование, свойства и расположение
2. Что такое уровни энергии
— Формирование, свойства и расположение
3. Какова связь между орбиталями и уровнями энергии
— орбитали и уровни энергии
4. В чем разница между орбиталями и уровнями энергии
— Сравнение основных различий
Ключевые слова: атом, d орбиталь, электрон, уровни энергии, орбитали, вероятность, p орбиталь, s орбиталь
Какие орбитали
Есть несколько типов орбиталей, которые можно найти вокруг ядра. Немногие из них описаны ниже.
с орбитальной
Это орбитали сферической формы. На том же уровне энергии орбитали s имеют самую низкую энергию. Максимальное количество электронов, которое может удерживать орбиталь, равно двум. Эти два электрона находятся в противоположном спине, так что отталкивание между двумя электронами сведено к минимуму.
орбитальный
Это орбитали в форме гантелей, энергия которых выше, чем у орбитали. Максимальное количество электронов, которое может удерживать орбиталь, равно 6. Это связано с тем, что одна орбиталь состоит из трех суборбиталей, называемых рИкс, пY и рZ, Каждая из этих орбиталей может содержать максимум 2 электрона.
орбитальный
Эти орбитали выглядят как две гантели в одной плоскости. Однако это более сложная трехмерная структура, чем s и p-орбитали. Одна орбиталь состоит из 5 суборбиталей. Каждая суборбиталь может содержать до 2 электронов. Следовательно, максимальное число электронов, которое может удерживать d-орбиталь, равно 10.
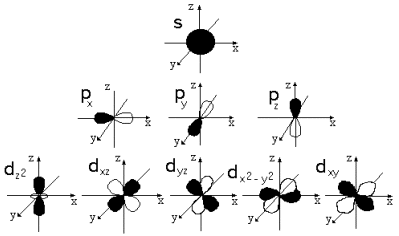
Рисунок 1: Формы атомных орбиталей
Согласно теории молекулярных орбиталей, когда две атомные орбитали перекрываются, образуется молекулярная орбиталь. Эта молекулярная орбиталь указывает на образование ковалентной связи. Поэтому орбитали непосредственно участвуют в химической связи.
Что такое уровни энергии
Есть фиксированные числа электронов, которые может удерживать каждый энергетический уровень. Эти цифры приведены ниже. Это число зависит от количества орбиталей, из которых состоит каждый энергетический уровень.
Это указывает на то, что все другие уровни энергии, кроме 1 улица Уровень энергии может содержать до 8 электронов.
Рисунок 2: Уровни энергии в атоме. Символ «n» обозначает уровень энергии.
Электроны могут перемещаться между этими уровнями энергии, либо поглощая, либо выделяя энергию. Когда энергия передается атому, электрон с более низким энергетическим уровнем может быть перемещен на более высокий энергетический уровень. Это новое состояние называется возбужденным состоянием. Однако это возбужденное состояние не является стабильным. Следовательно, этот электрон может вернуться на уровень земли, высвободив энергию. Эти процессы называются электронными переходами.
Взаимосвязь между орбиталями и уровнями энергии
Разница между орбиталями и уровнями энергии
Определение
Именование
орбитали: Орбитали называются s, p, d и f.
Уровни энергии: Уровни энергии называются K, L, M, N.
Количество электронов
орбитали: Орбитали могут содержать максимальное количество электронов в соответствии с орбиталью, например, s = 2, p = 6 и d = 10.
Уровни энергии: Первый энергетический уровень состоит из 2 электронов, а все остальные энергетические уровни могут содержать до 8 электронов.
Заключение
Орбитали состоят из электронов. Уровни энергии показывают расположение орбиталей вокруг атома в соответствии с энергией этих орбиталей. Основное различие между орбиталями и энергетическими уровнями состоит в том, что орбитали показывают наиболее вероятный путь движения электрона, который движется вокруг ядра, тогда как энергетические уровни показывают относительное расположение орбиталей в соответствии с количеством энергии, которую они имеют.
Строение электронных оболочек атомов элементов первых четырёх периодов: s-, p-, d-элементы
Содержание:
Тема строения атома – это место встречи химии и квантовой физики. В атоме всё подчиняется строгим законам, но в то же время атом не совсем понятен для человеческого ума. Например, количество электронов строго равно количеству протонов, но невозможно точно сказать, в каком месте атома находится электрон. Шрёдингер рассматривал электрон как облако с отрицательным зарядом. Большинство своего времени электрон в отдельном участке атома – орбитали.
Все электроны в атоме расположены на своём расстоянии от ядра – в электронной оболочке. Электрон не может приблизиться к ядру, но и отдалиться тоже не может. Дело в том, что у электрона есть свой запас энергии. Чем её меньше, тем ближе от ядра располагается электрон. Электроны с одинаковым уровнем энергии группируются в один слой – энергетический уровень.
Главное квантовое число и энергетический уровень
Квантовые числа — это своеобразный код записи положения электрона в атоме. Если сравнить атом с домом, то квантовые числа – это адрес электрона: этаж, квартира, комната.
Электроны в атоме сосредоточены на энергетических уровнях – «этажах». Их нумеруют числами 1, 2, 3, … или буквами K, L, M, N, O, P, Q. Главное квантовое число n – это и есть номер энергетического уровня.
С удалением от ядра число электронов возрастает. Чем выше энергетический уровень, тем больше электронов на нём находится. Их максимальное число для каждого уровня определяется по формуле:
На внешнем энергетическом уровне не может находиться больше 8 электронов.
В энергетических уровнях также выделяют подуровни. Их количество также соответствует главному квантовому числу. Это напоминает расположение квартир в доме: на первом этаже располагается одна квартира, на втором – две, на третьем – три и т.д.
| Номер уровня (n) и его буквенное обозначение | Количество подуровней | Максимальное количество электронов на уровне |
| 1 К | 1 (s) | 2 |
| 2 L | 2 (s, p) | 8 |
| 3 M | 3 (s, p, d) | 18 |
| 4 N | 4 (s, p, d, f) | 32 |
Орбитальное (побочное), магнитное квантовые числа и форма орбитали
Конкретное место в атоме, «комната», в которой почти постоянно находится электрон, называется орбиталью. Орбитали напоминают облака разной формы из электронов. Подуровни и форму орбиталей обозначают латинскими буквами: s, p, d, f.
Эту схему предложил Бор, она помогает разобраться в строении атома, но не отражает реальной картины. Наши представления об атоме расходятся с реальностью. И выглядит это примерно так:
На первом энергетическом уровне есть только сферическая s-орбиталь. На втором энергетическом уровне появляются три p-орбитали. Их форма напоминает гантель или восьмёрку. На третьем энергетическом уровне уже есть пять d-орбиталей, которые как бы состоят из нескольких лепестков. На четвёртом уровне возникают семь f-орбиталей.
Форму орбиталей обозначают орбитальным (побочным) квантовым числом l (эль). Оно на единицу меньше главного квантового числа, то есть l = n – 1. Тогда получается, что орбитальное число единственной s-орбитали первого энергетического уровня равно нулю. Орбиталь p имеет число 1, орбиталь d – 2, f – 3.
Но как же располагаются орбитали внутри одного подуровня? Дело в том, что движущийся электрон создаёт магнитное поле, в котором по осям x, y, z ориентируются орбитали.
Сферическая s-орбиталь не имеет ориентации в пространстве. Три p-орбитали располагаются в трёх различных проекциях, d – в пяти, f – в семи проекциях. Другими словами, сколько орбиталей одного типа, столько и проекций.
Магнитное квантовое число ml показывает, какие проекции есть у орбитали. Количество таких вариантов определяется по формуле 2l+1.
Для s-орбитали l = 0 и ml = 0, так и получается, что сфера принимает только одно положение в пространстве.
Спин электрона
Еще два квантовых числа – спиновое и проекция спина – характеризуют уникальное квантовое свойство электрона. Спин не имеет аналогов в классической механике. Можно представить, что электрон вращается вокруг своей оси в одну или другую сторону.
Квантовые числа
В атомах первого периода таблицы Менделеева есть один энергетический уровень. В нём один или два электрона движутся по s-единственной орбитали.
В атомах второго периода появляется второй уровень. Он состоит из s-и p-подуровней. Второй s-подуровень – это тоже s-орбиталь, на p-подуровне есть три орбитали, которые по-разному расположены в пространстве. Каждая p-орбиталь вмещает 1 или 2 электрона, поэтому максимально на p-подуровне их может быть 6.
В атомах третьего периода появляется d-подуровень с пятью d-орбиталями, в атомах четвёртого периода – f-подуровень с семью f-орбиталями.
Как заполняются орбитали?
Электроны заполняют орбитали в соответствии с 3 принципами (правилами).
Атомная орбиталь
Волновая функция рассчитывается по волновому уравнению Шрёдингера в рамках одноэлектронного приближения (метод Хартри — Фока) как волновая функция электрона, находящегося в самосогласованном поле, создаваемым ядром атома со всеми остальными электронами атома.
Сам Э.Шрёдингер рассматривал электрон в атоме как отрицательно заряженное облако, плотность которого пропорциональна квадрату значения волновой функции в соответствующей точке атома. В таком виде понятие электронного облака было воспринято и в теоретической химии.
Однако большинство физиков не разделяли убеждений Э.Шрёдингера — доказательства существования электрона как «отрицательно заряженного облака» не было. Макс Борн обосновал вероятностную трактовку квадрата волновой функции. В 1950 г. Э.Шрёдингер в статье «Что такое элементарная частица?» вынужден согласиться с доводами М.Борна, которому в 1954 году присуждена Нобелевская премия по физике с формулировкой «За фундаментальное исследование в области квантовой механики, особенно за статистическую интерпретацию волновой функции».
Название «орбиталь» (а не орбита) отражает геометрическое представление о стационарных состояниях электрона в атоме; такое особое название отражает тот факт, что состояния электрона в атоме описывается законами квантовой механики и отличается от классического движения по траектории. Совокупность атомных орбиталей с одинаковым значением главного квантового числа n составляют одну электронную оболочку.
Содержание
Квантовые числа и номенклатура орбиталей
Буквенные обозначения атомных орбиталей произошли от описания спектральных линий в атомных спектрах: s (sharp) — резкая серия в атомных спектрах, p (principal)— главная, d (diffuse) — диффузная, f (fundamental) — фундаментальная.
В литературе орбитали обозначают комбинацией квантовых чисел, при этом главное квантовое число обозначают цифрой, орбитальное квантовое число — соответствующей буквой (см. таблицу ниже) и магнитное квантовое число — выражением в нижнем индексе, показывающем проекцию орбитали на декартовы оси x, y, z, например 2px, 3dxy, 4fz(x²-y²). Для орбиталей внешней электронной оболочки, то есть в случае описания валентных электронов, главное квантовое число в записи орбитали, как правило, опускают.
Геометрическое представление
Геометрическое представление атомной орбитали — область пространства, ограниченная поверхностью равной плотности (эквиденситной поверхностью) вероятности или заряда. Плотность вероятности на граничной поверхности выбирают исходя из решаемой задачи, но, обычно, таким образом, чтобы вероятность нахождения электрона в ограниченной области лежала в диапазоне значений 0,9-0,99.
Поскольку энергия электрона определяется кулоновским взаимодействием и, следовательно, расстоянием от ядра, то главное квантовое число n задаёт размер орбитали.
Для линейных комбинаций Ylm приняты следующие обозначения:
| Значение орбитального квантового числа | 0 | 1 | 1 | 1 | 2 | 2 | 2 | 2 | 2 |
|---|---|---|---|---|---|---|---|---|---|
| Значение магнитного квантового числа | 0 | 0 |  |  | 0 |  |  |  |  |
| Линейная комбинация |  |  |  |  |  |  |  |  |  |
| Обозначение |  |  |  |  |  |  |  |  |  |
Заполнение орбиталей электронами и электронная конфигурация атома
На каждой орбитали может быть не более двух электронов, отличающихся значением спинового квантового числа s (спина). Этот запрет определён принципом Паули. Порядок заполнения электронами орбиталей одного уровня (орбиталей с одинаковым значением главного квантового числа n) определяется правилом Клечковского, порядок заполнения электронами орбиталей в пределах одного подуровня (орбиталей с одинаковыми значениями главного квантового числа n и орбитального квантового числа l) определяется Правилом Хунда.
Краткую запись распределения электронов в атоме по различным электронным оболочкам атома с учётом их главного и орбитального квантовых чисел n и l называют электронной конфигурацией атома.
Атомы и электроны
Атомно-молекулярное учение
Описываемая модель атома называется «планетарной» и была предложена в 1913 году великими физиками: Нильсом Бором и Эрнестом Резерфордом
Запомните, что в невозбужденном состоянии атом содержит одинаковое число электронов и протонов. Так у кальция (порядковый номер 20) в ядре находится 20 протонов, а вокруг ядра на электронных орбиталях 20 электронов.
Я еще раз подчеркну эту важную деталь. На данном этапе будет отлично, если вы запомните простое правило: порядковый номер элемента = числу электронов. Это наиболее важно для практического применения и изучения следующей темы.
Электронная конфигурация атома
Электроны атома находятся в непрерывном движении вокруг ядра. Энергия электронов отличается друг от друга, в соответствии с этим электроны занимают различные энергетические уровни.
Состоит из s-подуровня: одной «s» ячейки (2s 2 ) и p-подуровня: трех «p» ячеек (2p 6 ), на которых помещается 6 электронов
Состоит из s-подуровня: одной «s» ячейки (3s 2 ), p-подуровня: трех «p» ячеек (3p 6 ) и d-подуровня: пяти «d» ячеек (3d 10 ), в которых помещается 10 электронов
Состоит из s-подуровня: одной «s» ячейки (4s 2 ), p-подуровня: трех «p» ячеек (4p 6 ), d-подуровня: пяти «d» ячеек (4d 10 ) и f-подуровня: семи «f» ячеек (4f 14 ), на которых помещается 14 электронов
Зная теорию об энергетических уровнях и порядковый номер элемента из таблицы Менделеева, вы должны расположить определенное число электронов, начиная от уровня с наименьшей энергией и заканчивая к уровнем с наибольшей. Чуть ниже вы увидите несколько примеров, а также узнаете об исключении, которое только подтверждает данные правила.
Подуровни: «s», «p» и «d», которые мы только что обсудили, имеют в определенную конфигурацию в пространстве. По этим подуровням, или атомным орбиталям, движутся электроны, создавая определенный «рисунок».
Правила заполнения электронных орбиталей и примеры
Должно быть, вы обратили внимание на некоторое несоответствие: после 3p подуровня следует переход к 4s, хотя логично было бы заполнить до конца 4s подуровень. Однако природа распорядилась иначе.
Запомните, что, только заполнив 4s подуровень двумя электронами, можно переходить к 3d подуровню.
Теперь мы располагаем указанное количество электронов на энергетических уровнях, руководствуясь правилами заполнения.
Обращаю ваше особе внимание: на 2p-подуровне углерода мы расположили 2 электрона в разные ячейки, следуя одному из правил. А на 3p-подуровне у серы электронов оказалось много, поэтому сначала мы расположили 3 электрона по отдельным ячейкам, а оставшимся одним электроном дополнили первую ячейку.
Внешний уровень и валентные электроны
Тренировка
Потренируйтесь и сами составьте электронную конфигурацию для магния и скандия. Определите число электронов на внешнем (валентном) уровне и число неспаренных электронов. Ниже будет дано наглядное объяснение этой задаче.