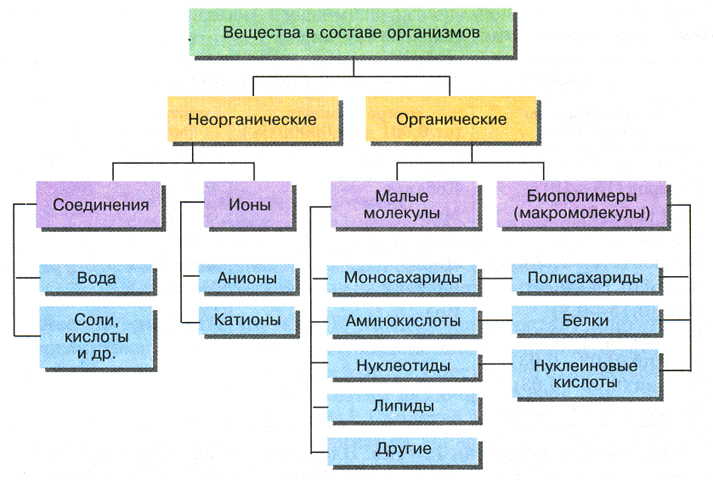
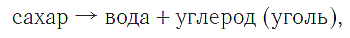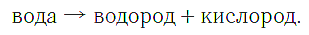Что такое органические и неорганические соединения
Урок 4. Сложные вещества
В уроке 4 «Сложные вещества» из курса «Химия для чайников» дадим определение химическим соединениям, рассмотрим различия органических и неорганических соединений, а также выясним, что означает качественный и количественный состав. Напоминаю, что в прошлом уроке «Молекулы и простые вещества» мы рассмотрели, что такое молекулы, простые вещества, а также металлы и неметаллы.
Химические элементы существуют не только в виде свободных атомов и простых веществ. Они также могут входить в состав самых различных химических соединений.
Вещества, состоящие из атомов разных химических элементов, называются сложными веществами или химическими соединениями.
Органические и неорганические вещества
Органические вещества
Все органические вещества объединяет главный признак: в их состав обязательно входят атомы углерода. Кроме углерода, в состав органических веществ чаще всего входят атомы водорода, кислорода, а также азота, фосфора, серы. Почти все органические вещества горючи и легко разлагаются при нагревании. Практически все они имеют молекулярное строение (рис. 41).
Неорганические вещества
Неорганические вещества являются соединениями всех остальных элементов. К неорганическим традиционно относят также несколько веществ, содержащих углерод: углекислый и угарный газы, мел, соду и некоторые другие. Неорганических веществ около 700 тыс., но их общая масса многократно превышает массу органических веществ. Почти все они — твердые вещества немолекулярного строения (рис. 42), входят в состав минералов, почв, горных пород.
Качественный и количественный состав веществ
Каждое вещество характеризуется определенным качественным и количественным составом.
Качественный состав вещества показывает, из атомов каких элементов оно состоит. Например, вода состоит из атомов водорода и кислорода, а метан— из атомов углерода и водорода. Число атомов каждого элемента в составе мельчайшей частицы вещества характеризует его количественный состав. Например, молекула воды состоит из двух атомов водорода и одного атома кислорода, а молекула метана — из одного атома углерода и четырех атомов водорода.
Сложное вещество можно с помощью различных химических методов разложить на несколько новых веществ, и так до тех пор, пока не получатся вещества, каждое из которых будет являться простым. Например, сахар при нагревании разлагается на воду и уголь (углерод):
а воду можно разложить с помощью электрического тока на водород и кислород:
Свойства простых веществ, которые при этом получаются (углерода, кислорода и водорода), совершенно не похожи на свойства сложных веществ — сахара и воды. Это разные вещества с разными свойствами. Свойства сложного вещества не являются суммой свойств простых веществ, которые образуются при его разложении.
Вещества немолекулярного строения при обычных условиях — твердые кристаллы, например поваренная соль, мел. Конечно, при нагревании (иногда до нескольких тысяч градусов) такие вещества плавятся, а затем переходят и в парообразное состояние.
Отличия между сложными веществами и смесями веществ
Необходимо различать сложные вещества и смеси веществ:
| Сложное вещество (химическое соединение) | Смесь веществ |
| Образуется в результате соединения атомов различных элементов между собой (химический процесс) | Образуется в результате смешивания различных веществ (физический процесс) |
| Свойства сложного вещества отличаются от свойств простых веществ, из которых оно получено | Свойства веществ, из которых составлена смесь, не изменяются |
| Имеет определенный качественный и количественный состав | Состав произвольный |
| Разлагается на составные части только в результате химических процессов | Разделяется на составные части с помощью различных физических методов |
Краткие выводы урока:
Надеюсь урок 4 «Сложные вещества» был понятным и познавательным. Если у вас возникли вопросы, пишите их в комментарии.
9 различий между органическими и неорганическими соединениями
но, Какие различия существуют не между типами химии, а непосредственно между типами соединений, которые они изучают? В этой статье мы анализируем основные различия между органическими и неорганическими соединениями.
Химические соединения
Прежде чем увидеть, в чем различия между ними, мы кратко определим каждое из понятий.
Во-первых, под химическим соединением мы понимаем весь этот материал или продукт, возникающий в результате взаимодействия и комбинации двух или более элементов. Существует много различных типов химических соединений, которые могут быть классифицированы в соответствии с различными критериями, такими как элементы, которые его конфигурируют, или способ их объединения. Среди них одно из самых основных разделений происходит между органическими и неорганическими соединениями.
Что касается неорганических соединений, это те, которые не являются частью живых организмов Хотя в них можно найти любой элемент таблицы Менделеева (в том числе в некоторых случаях углерод). В обоих случаях они представляют собой соединения, которые присутствуют в природе или синтезируются из нее в лаборатории (особенно неорганические).
Различия между органическими и неорганическими соединениями
Органическое вещество и неорганическое вещество имеют большое сходство, но они также имеют отличительные элементы, которые позволяют их различать. Ниже приведены некоторые из основных отличий.
1. Элементы, которые обычно настраивают каждый тип соединения
Одним из различий между органическими и неорганическими соединениями, более заметными и в то же время более простыми для понимания, является тип элементов, которые являются их частью.
В случае органических соединений они основаны главным образом на углероде и его сочетании с другими элементами. Они обычно образуются из углерода и водорода, кислорода, азота, серы и / или фосфора.
С другой стороны, неорганические соединения могут быть образованы любым элементом периодической таблицы, хотя они не будут основаны на углероде (хотя в некоторых случаях они могут содержать углерод, например, окись углерода).
2. Тип главной ссылки
Как правило, считается, что все или почти все органические соединения образуются путем объединения атомов через ковалентные связи. В неорганических соединениях, однако, преобладают ионные или металлические связи, хотя могут также появляться другие типы связей.
3. Стабильность
Другое различие между органическими и неорганическими соединениями обнаруживается в стабильности соединений. Хотя неорганические соединения имеют тенденцию быть стабильными и не претерпевать серьезных модификаций, если в игру не вступают более или менее мощные химические реакции, органические соединения легко дестабилизируются и разлагаются.
4. Сложность
Хотя неорганические соединения могут образовывать сложные структуры, они обычно имеют тенденцию поддерживать простую организацию. Однако органические соединения имеют тенденцию образовывать длинные цепи различной сложности.
5. Теплостойкость
Другое различие между органическими и неорганическими соединениями заключается в количестве тепла, необходимого для изменения, такого как плавление. Температура на органические соединения легко воздействует, поэтому для их плавления требуются относительно низкие температуры. Однако неорганические соединения, как правило, требуют очень высокого уровня нагрева, чтобы войти в процесс плавления (например, вода не кипит до ста градусов Цельсия).
6. Растворимость
Растворение органического соединения обычно очень сложно, если не доступен конкретный растворитель (такой как спирт) из-за его ковалентных связей. Однако большинство неорганических соединений, поскольку в них преобладают связи ионного типа, легко растворимы.
7. Электропроводность
Как правило, органические соединения, как правило, не являются электропроводящими и изолирующими, в то время как неорганические компоненты (особенно металлы) делают это с большой легкостью.
8. Изомер
Изомерия относится к способности соединений появляться с различными химическими структурами, несмотря на то, что они имеют одинаковый состав (например, другой порядок в цепи, которая образует соединение, приведет к соединениям с различными характеристиками). Хотя это может происходить как в органических, так и в неорганических соединениях, оно гораздо более распространено в первом из-за его тенденции создавать цепочки связанных атомов.
9. Скорость реакции
Химические реакции в неорганических соединениях имеют тенденцию быть быстрыми и не требуют вмешательства других элементов, кроме реагентов. Напротив, химические реакции неорганических соединений имеют переменную скорость и могут требовать присутствия внешних элементов для инициирования или продолжения реакции, например, в форме энергии.
12. Органические и неорганические вещества (December 2021).
Органические и неорганические вещества – что это и отличия
Органические и неорганические вещества – эти термины знакомы каждому человеку из школьной программы по биологии или химии. Также о них слышали садоводы. Что представляют собой и чем отличаются подобные вещества, способны объяснить не все. Для того чтобы лучше разобраться в особенностях и понять нюансы, рекомендуется сначала дать определение для каждого из рассматриваемых понятий, а затем провести сравнение по ключевым характеристикам.
Определение понятий
Органические вещества – соединения, которые имеют сложную химическую структуру (молекулярное строение). Они имеют невысокую температуру плавления, при воздействии высоких температур распадаются на несколько простых компонентов. Реакция протекает с выделением углекислого газа и воды. В молекулах присутствуют углерод и водород. Происхождение природное.
Неорганические вещества – химические соединения, имеющие простое молекулярное строение и небольшую массу. Температуры плавления высокие. Разложение происходит длительное время. Природа происхождения как биологическая, так и искусственная (промышленность).
Сравнение
Некоторые отличия между органикой и неорганическими веществами стала понятна из приведенных определений, но для более подробного разбора и выявления отличий, следует провести сравнение. Органика распадается за короткий промежуток времени на простые составные элементы – белки, углеводы, липиды. Разнообразие органики – результат наличия в ее молекулах углерода. Органические вещества способны к процессу изометрии. В результате образуются соединения, которые имеют одинаковый набор атомов в молекулах. Достичь разнообразия в этом случае позволяет различное положение атомов в молекулах образовавшихся веществ. Самыми распространенными являются такие соединения, как фруктоза и глюкоза. В них находится одинаковый набор атомов, но расположение отличается, поэтому свойства этих компонентов и их работа в химических реакциях различаются.
Неорганические вещества, самым распространенным из которых является вода, обладают небольшой молекулярной массой. Неорганики по современной классификации насчитывается всего около 100 тысяч, против органических соединений, которых представлено более 18 млн. Неорганические составляющие не способы к процессам изометрии. К неорганике также относятся различные металлы, соли, оксиды, различные смеси и простые вещества.
Выводы
Проведя сравнение, можно с уверенностью сказать, что различия между органическими и неорганическими веществами выражены в особенностях молекулярной структуры. Температура плавления и скорость разложения также являются факторами, указывающими на различия между рассматриваемыми понятиями. Наличие таких составляющих как водород и углерод характерны для органических соединений. Происхождение неорганики не всегда природное, многие компоненты являются плодом технических, производственных и научных изысканий. Общее количество неорганических веществ составляет по современной классификации 100 тысяч. Органика же превосходит числом, таких элементов в классификации представлено более чем в 10 раз больше. Органика имеет сложную структуру молекулярной сетки, неорганика — простую. Для того чтобы запустить процессы разложения в первом случае не требуется нагрева до высоких температур (например, мясо портиться при комнатной температуре, а для плавления металлов требуется длительный нагрев).
В состав молекул всех органических веществ входит углерод, но нужно учитывать и особенности этой группы компонентов. Так в карбидах или цианидах нет этого элемента. Уникальным свойством углерода является способность образовывать цепочки из атомов. Благодаря подобной способности соединений из одного и того же атомного набора может появляться очень много.
Неорганические и органические соединения
Из 112 достоверно известных к настоящему времени химических элементов 22 относятся к неметаллам (C, S, N, Cl и др.), большинство же элементов – металлы (Na, Fe, Cu, Au и др.). Химические элементы образуют около 1 млн. неорганических и свыше 20 млн. органических веществ. Ежегодно в лабораториях синтезируется 200–250 тыс. новых соединений.
Неорганические соединения
Неорганическая химия изучает свойств и превращения неорганических (минеральных) соединений.
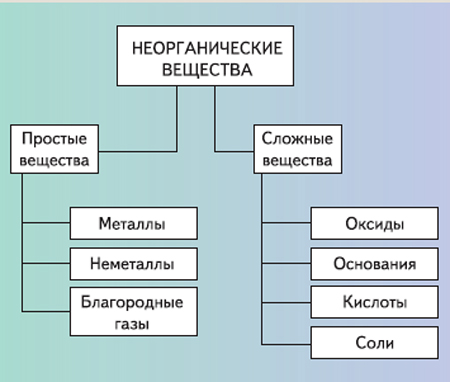
Все вещества делятся на простые и сложные. Простое вещество представляет собой гомоатомное (из атомов одного элемента) химическое соединение (С, O2, N2, Na).
Сложные вещества состоят из двух или более элементов (H2O, Н2SO4) и по составу разделяются на бинарные (двухатомные) и многоэлементные соединения.
Все простые вещества подразделяются на металлы и неметаллы. Металлы и неметаллы различаются по физическим свойствам, которые проявляются у соответствующих простых веществ. Для металлов характерны высокая тепло- и электрическая проводимость, специфический металлический блеск, ковкость, пластичность и т.п. Физические свойства неметаллов существенно отличаются: они хрупкие, обладают низкой тепло- и электрической проводимостью и т.п. Различия между металлами и неметаллами проявляются в их химических свойствах: для металлов характерны оснóвные свойства оксидов и гидроксидов, восстановительное действие; для неметаллов – кислотный характер оксидов и гидроксидов, окислительная активность. Деление химических элементов на металлы и неметаллы относительно, т. к. существуют амфотерные элементы.
К важнейшим неорганическим веществам относятся соединения элементов с кислородом (оксиды), галогенами (галогениды или галиды), азотом (нитриды), углеродом (карбиды), основания, кислоты, соли и др.
Основания – сложные вещества, в состав которых входят атомы металла и гидроксогруппыOH – . Щелочи – растворимые основания: NaOH – гидроксид натрия, KOH – гидроксид калия, Сa(OH)2 – гиброксид кальция; нерастворимые основания: Zn(OH)2 – гидроксид цинка, Fe(OH)3 – гидроксид железа (III) и др.
Соли – соединения, образующие при диссоциации в водном растворе положительно заряженные ионы металлов и отрицательно заряженные ионы кислотных остатков, а иногда, кроме них, ионы водорода Н + и гидроксид-ионы ОН – . Например, NaCl – хлорид натрия (поваренная соль), СаСО3 карбонат кальция (мел), NaHСО3 – гидрокарбонат натрия (пищевая сода) и др.
Органические соединения
Органическая химия – химия соединений углерода (А.М. Бутлеров). Помимо атомов углерода в состав органических соединений входят Н, О, N, S, Р, F, Сl, Вr, I и другие химические элементы.
Алканы – предельные (насыщенные) углеводороды, все свободные валентности атомов углерода заняты (полностью «насыщены») атомами водорода: СН4 – метан (основа природного газа), С2Н6 – этан, С3Н8 – пропан, С8Н18 – октан (основа бензина).
Алкены – непредельные углеводороды, молекулы которых содержат одну двойную связь: СН2=СН2 – этилен (из него синтезируют этиловый спирт, полиэтилен, полистирол.
Алкины– непредельные углеводороды, молекулы которых содержат одну тройную связь:НС≡СН – ацетилен (из него синтезируют синтетический каучук и др. вещества, используют для сварки).
Ароматические углеводороды (арены) – вещества, в молекулах которых содержится одно или несколько бензольных колец – циклических групп атомов углерода с особым характером связей: СбН6 – бензол (важнейшее сырье для синтеза фенолформальдегидных смол, красителей, полистирола и многих др. важных продуктов).
Карбонильные соединения (оксосоединения) – органические соединения, в молекуле которых имеется карбонильная группа С=О, их делятся на две родственные группы – альдегиды и кетоны: СН2О – формальдегид (применяется в качестве дезинфицирующего средства для обработки зерно- и овощехранилищ, для протравливания семян, для консервации анатомических препаратов; получают фенолформальдегидные смолы и формалин); ацетон (используют как растворитель лаков, красок, в производстве ацетатного волокна, бездымного пороха).
Карбоновые кислоты – соединения, содержащие карбоксильную группу –СООН. Важнейшие кислоты. НСООН – муравьиная кислота (применяется в фармацевтической и пищевой промышленности); СН3СООН – уксусная кислота (используют для производства искусственных волокон на основе целлюлозы и в пищевой промышленности); С6Н5СООН – бензойная кислота (применяют в фармацевтической промышленности для синтеза душистых веществ и красителей, а также в качестве консерванта для пищевых продуктов), С17Н35СООН – стеариновая кислота (основа твердых животных жиров).
Углеводы (сахара) – это природные органические соединения, имеющие общую формулу Сm(Н2О)n. Моносахариды: С6Н12О6 – глюкоза и фруктоза (энергетическая функция в живых организмах); олигосахариды: С12Н22О11 – сахароза (главный источник углеводов в пище человека), мальтоза, лактоза; полисахариды: (С6Н10О5)n – крахмал (запасной сахар растений), целлюлоза (основное вещество растительных клеток), хитин (основа наружного скелета членистоногих), гликоген (запасной сахар животных).
Белки – природные полипептиды с высокими значениями молекулярной массы, состоящие из аминокислот. В составе белков 20 аминокислот. Белки входят в состав всех живых организмов и выполняют разнообразные биологические функции (строительную, ферментативную, транспортную, защитную, рецепторную и др.).
Нуклеиновые кислоты – природные высокомолекулярные соединения (полинуклеотиды), которые играют огромную роль в хранении и передаче наследственной информации в живых организмах: ДНК – дезоксирибонуклеиновая кислота (главная молекула в живом организме, хранит генетическую информацию и передает от одного поколения к другому), РНК – рибонуклеиновая кислота (посредника между ДНК и местом синтеза белка).
Полимеры – соединения с большой молекулярной массой, молекулы которых состоят из большого числа повторяющихся фрагментов. Пластмассы (полиэтилен, полипропилен, полистирол, фенолформальдегидные смолы и др.), волокна (лавсан, найлон и др.), каучуки и соединения на их основе (резина).
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Органические и неорганические вещества: что это и в чем разница
Каждая наука насыщена понятиями, при не усвоении которых основанные на этих понятиях или косвенные темы могут даваться очень трудно. Одними из понятий, которые должны быть хорошо усвоены каждым человеком, который считает себя более-менее образованным, есть разделение материалов на органические и неорганические. Не важно, сколько человеку лет, эти понятия в списке тех, с помощью которых определяют общий уровень развития на любом этапе человеческой жизни. Для того чтобы понять, в чем отличия этих двух терминов, сначала нужно выяснить, что собой являет каждый из них.
Органические соединения – что это
Органические вещества – группа химических соединений с неоднородной структурой, в состав которых входят элементы углерода, ковалентно связанных между собой. Исключение составляют карбиды, угольные, карбоновые кислоты. Также одними из составляющих веществ, кроме углерода, есть элементы водорода, кислорода, азота, серы, фосфора, галогена.
Такие соединения формируются благодаря способности атомов углерода перебывать в одинарных, двойных и тройных связях.
Сферой обитания органических соединений являются живые существа. Они могут быть как в составе живых существ, так и появится в результате их жизненной деятельности (молоко, сахар).
Неорганические вещества – что это
Неорганические вещества – группа химических соединений, которые в своем составе не имеют элементов углерода, водорода или химических соединений, составляющим элементом которых является углерод. Как органические, так и неорганические являются составляющими клеток. Первые в виде дающих жизнь элементов, другие в составе воды, минеральных веществ и кислот, а также газов.
Что общего между органическими и неорганическими веществами
Что может быть общего между двумя, казалось бы, такими понятиями-антонимами? Оказывается, общее и у них имеется, а именно: