Что такое осмотическое состояние клеток
фЕНБ: пУНПФЙЮЕУЛЙЕ СЧМЕОЙС Ч ЛМЕФЛЕ
нБФЕТЙБМЩ. мЙУФШС ЬМПДЕЙ ЛБОБДУЛПК (Elodea canadensis); 6-8% ТБУФЧПТ УЕМЙФТЩ ( KNO 3 ).
цЙЪОЕДЕСФЕМШОПУФШ ЛМЕФЛЙ ИБТБЛФЕТЙЪХЕФУС ОЕРТЕТЩЧОП РТПФЕЛБАЭЙНЙ Ч ОЕК РТПГЕУУБНЙ ПВНЕОБ ЧЕЭЕУФЧ, РТЙЮЕН ГЙФПРМБЪНБ ЙЪВЙТБФЕМШОП ТЕБЗЙТХЕФ ОБ ЧПЪДЕКУФЧЙЕ ТБЪОЩИ ЖБЛФПТПЧ ЧОЕЫОЕК УТЕДЩ. ч РПЗМПЭЕОЙЙ Й ЧЩДЕМЕОЙЙ ЧЕЭЕУФЧ ВПМШЫХА ТПМШ ЙЗТБАФ РТПГЕУУЩ ДЙЖЖХЪЙЙ Й ПУНПУБ. пУНПФЙЮЕУЛЙНЙ ОБЪЩЧБАФ СЧМЕОЙС, РТПЙУИПДСЭЙЕ Ч УЙУФЕНЕ, УПУФПСЭЕК ЙЪ ДЧХИ ТБУФЧПТПЧ, ТБЪДЕМЕООЩИ РПМХРТПОЙГБЕНПК НЕНВТБОПК. ч ТБУФЙФЕМШОПК ЛМЕФЛЕ ТПМШ РПМХРТПОЙГБЕНЩИ РМЕОПЛ ЧЩРПМОСАФ РПЗТБОЙЮОЩЕ УМПЙ ГЙФПРМБЪНЩ: РМБЪНБМЕННБ Й ФПОПРМБУФ.
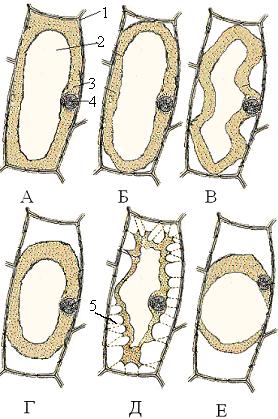
ч ИПДЕ РМБЪНПМЙЪБ ЖПТНБ РМБЪНПМЙЪЙТПЧБООПЗП РТПФПРМБУФБ НЕОСЕФУС. чОБЮБМЕ РТПФПРМБУФ ПФУФБЕФ ПФ ЛМЕФПЮОПК УФЕОЛЙ МЙЫШ Ч ПФДЕМШОЩИ НЕУФБИ, ЮБЭЕ ЧУЕЗП Ч ХЗПМЛБИ. рМБЪНПМЙЪ ФБЛПК ЖПТНЩ ОБЪЩЧБАФ ХЗПМЛПЧЩН (ТЙУ. 10, в).
ъБФЕН РТПФПРМБУФ РТПДПМЦБЕФ ПФУФБЧБФШ ПФ ЛМЕФПЮОЩИ УФЕОПЛ, УПИТБОСС УЧСЪШ У ОЙНЙ Ч ПФДЕМШОЩИ НЕУФБИ, РПЧЕТИОПУФШ РТПФПРМБУФБ НЕЦДХ ЬФЙНЙ ФПЮЛБНЙ ЙНЕЕФ ЧПЗОХФХА ЖПТНХ. оБ ЬФПН ЬФБРЕ РМБЪНПМЙЪ ОБЪЩЧБАФ ЧПЗОХФЩН (ТЙУ. 10, ч).
рПУФЕРЕООП РТПФПРМБУФ ПФТЩЧБЕФУС ПФ ЛМЕФПЮОЩИ УФЕОПЛ РП ЧУЕК РПЧЕТИОПУФЙ Й РТЙОЙНБЕФ ПЛТХЗМХА ЖПТНХ. фБЛПК РМБЪНПМЙЪ ОПУЙФ ОБЪЧБОЙЕ ЧЩРХЛМПЗП (ТЙУ. 10, з ).
еУМЙ Х РТПФПРМБУФБ УЧСЪШ У ЛМЕФПЮОПК УФЕОЛПК Ч ПФДЕМШОЩИ НЕУФБИ УПИТБОСЕФУС, ФП РТЙ ДБМШОЕКЫЕН ХНЕОШЫЕОЙЙ ПВЯЕНБ Ч ИПДЕ РМБЪНПМЙЪБ РТПФПРМБУФ РТЙПВТЕФБЕФ ОЕРТБЧЙМШОХА ЖПТНХ. рТПФПРМБУФ ПУФБЕФУС УЧСЪБООЩН У ПВПМПЮЛПК НОПЗПЮЙУМЕООЩНЙ ОЙФСНЙ зЕИФБ. фБЛПК РМБЪНПМЙЪ ОПУЙФ ОБЪЧБОЙЕ УХДПТПЦОПЗП (ТЙУ. 10, д).
рТЙ ДМЙФЕМШОПН ОБИПЦДЕОЙЙ ЛМЕФПЛ Ч ТБУФЧПТЕ ОЙФТБФБ ЛБМЙС (15 НЙО. Й ВПМЕЕ) ГЙФПРМБЪНБ ОБВХИБЕФ Ч ХДМЙОЕООЩИ ЛМЕФЛБИ, ФБН, ЗДЕ РТПФПРМБУФ ОЕ ЛБУБЕФУС ЛМЕФПЮОЩИ УФЕОПЛ, ПВТБЪХАФУС ФБЛ ОБЪЩЧБЕНЩЕ ЛПМРБЮЛЙ ГЙФПРМБЪНЩ. фБЛПК РМБЪНПМЙЪ ОПУЙФ ОБЪЧБОЙЕ ЛПМРБЮЛПЧПЗП (ТЙУ. 10, е).
тЙУ. 10. рМБЪНПМЙЪ ТБУФЙФЕМШОПК ЛМЕФЛЙ:
ъБДБОЙЕ 1. тБУУНПФТЕФШ ЛМЕФЛЙ МЙУФБ ЬМПДЕЙ, ОБИПДСЭЙЕУС Ч УПУФПСОЙЙ ФХТЗПТБ Й ЪБТЙУПЧБФШ.
ъБДБОЙЕ 2. рТПОБВМАДБФШ СЧМЕОЙЕ РМБЪНПМЙЪБ Ч ЛМЕФЛБИ МЙУФБ ЬМПДЕЙ. пРТЕДЕМЙФШ ЖПТНЩ РМБЪНПМЙЪБ. уДЕМБФШ ТЙУХОЛЙ.
ъБДБОЙЕ 3. рТПОБВМАДБФШ СЧМЕОЙЕ ДЕРМБЪНПМЙЪБ Ч ЛМЕФЛБИ ЬМПДЕЙ, Ф.Е. ЧЕТОХФШ Ч РЕТЧПОБЮБМШОПЕ УПУФПСОЙЕ РМБЪНПМЙЪЙТПЧБООХА ЛМЕФЛХ.
рПУМЕДПЧБФЕМШОПУФШ ТБВПФЩ. уМЕДХЕФ ЪБНЕОЙФШ ТБУФЧПТ УЕМЙФТЩ ЧПДПК, ПФФСОХЧ ТБУФЧПТ ЖЙМШФТПЧБМШОПК ВХНБЗПК. пФНЕФЙФШ ЧПЪЧТБЭЕОЙЕ ГЙФПРМБЪНЩ Л ПВПМПЮЛЕ ЛМЕФЛЙ, Ф.Е. Ч ЕЕ ОПТНБМШОПЕ УПУФПСОЙЕ. дЕРМБЪНПМЙЪ РТПЙУИПДЙФ НЕДМЕООЕЕ, ЮЕН РМБЪНПМЙЪ. пВЯСУОЙФШ СЧМЕОЙЕ ДЕРМБЪНПМЙЪБ.
лПОФТПМШОЩЕ ЧПРТПУЩ
1. у ЛБЛЙНЙ УЧПКУФЧБНЙ ГЙФПРМБЪНЩ Й ЧБЛХПМЙ УЧСЪБОЩ ПУНПФЙЮЕУЛЙЕ СЧМЕОЙС ЛМЕФЛЙ?
2. юФП ФБЛПЕ ФХТЗПТ, РМБЪНПМЙЪ, ДЕРМБЪНПМЙЪ?
3. нПЦЕФ МЙ РТПЙУИПДЙФШ РМБЪНПМЙЪ Ч НЕТФЧПК ЛМЕФЛЕ?
4. лБЛ НПЦОП ЧЩЪЧБФШ РМБЪНПМЙЪ Ч ЛМЕФЛБИ МЙУФБ ЬМПДЕЙ?
5. дБФШ ПРТЕДЕМЕОЙС РПОСФЙСН ПУНПУ Й ДЙЖЖХЪЙС.
Что такое осмотическое состояние клеток
Поддержание адекватного объема одной или обеих (внутри- и внеклеточной) жидких сред организма является частой проблемой при лечении тяжелобольных. Распределение внеклеточной жидкости между плазмой и межклеточным пространством в основном зависит от уравновешивания сил гидростатического и коллоидно-осмотического давления, которые действуют на мембрану капилляров.
Распределение жидкости между внутри- и внеклеточной средами в основном определяется осмотическими силами мелких молекул растворенных веществ, преимущественно натрия, хлора и других электролитов, действующих по разные стороны мембраны. Причина этого распределения обусловлена свойствами мембран, проницаемость которых для воды высока, а для ионов даже очень небольшого диаметра, таких как натрий и хлор, практически равна нулю. Следовательно, вода быстро проникает через мембрану, а внутриклеточная жидкость, тем не менее, остается изотоничной по отношению к внеклеточной.
В следующем разделе рассмотрим взаимосвязь между внутри- и внеклеточной жидкостями и причины осмотического характера, способные влиять на перенос жидкости между этими средами.
В статье мы рассмотрим только наиболее важные теоретические положения, касающиеся регуляции объемов жидкости.
Теоретические основы осмоса и осмотического давления
Основы осмоса и осмотического давления изложены в отдельной статье на сайте (просим вас пользоваться формой поиска выше). В этой статье мы рассмотрим только наиболее важные теоретические положения, касающиеся регуляции объемов жидкости.
Осмос — процесс диффузии воды через полупроницаемую мембрану. Он происходит из области с высокой концентрацией воды в область с ее низкой концентрацией. Растворение вещества в воде приводит к снижению концентрации воды в данном растворе. Следовательно, чем больше концентрация вещества в растворе, тем ниже в нем содержание воды. Кроме того, вода диффундирует из области с низкой концентрацией вещества (высоким содержанием воды) в область с высокой концентрацией вещества (низким содержанием воды).
Поскольку проницаемость мембраны клеток избирательна (она относительно низка для большинства растворенных веществ, но высока для воды), то при повышении концентрации вещества с одной стороны мембраны вода проникает в эту область путем диффузии. Если растворенное вещество, такое как NaCl, добавить во внеклеточную жидкость, вода будет быстро выходить из клетки до тех пор, пока концентрации молекул воды по обе стороны мембраны не уравняются. Если, напротив, концентрация NaCl во внеклеточной жидкости снизится, вода из внеклеточной жидкости устремится в клетки. Интенсивность, с которой вода диффундирует в клетку, называют осмотической силой.
а) Соотношение молей и осмолей. Поскольку концентрация воды в растворе зависит от количества в нем частиц вещества, под термином «концентрация вещества» (независимо от его химического состава) понимают общее число частиц вещества в растворе. Это число измеряют в осмолях. Один осмоль (осм) соответствует одному молю (1 моль, 6,02×10 23 ) частиц растворенного вещества. Следовательно, каждый литр раствора, содержащий 1 моль глюкозы, соответствует концентрации 1 осм/л. Если молекула диссоциирует на 2 иона, т.е. возникают две частицы (например, NaCl распадается на ионы Na+ и Сl-), то одномолярный раствор (1 моль/л) будет иметь осмолярность 2 осм/л. Аналогично раствор, содержащий 1 моль вещества, которое диссоциирует на 3 иона, например сульфат натрия Na2SО4, будет содержать 3 осм/л. Поэтому термин «осмоль» определяют, ориентируясь не на молярную концентрацию вещества, а на число растворенных частиц.
В целом осмоль — слишком большая величина, чтобы использовать ее в качестве единицы измерения осмотической активности жидких сред организма. Обычно используют 1/1000 осмоли — миллиосмолъ (моем).
б) Осмоляльность и осмолярность. Осмолялъностью называют осмоляльную концентрацию вещества в растворе, которая выражается в количестве осмолей на килограмм растворителя. Когда же речь идет о количестве осмолей в литре раствора, эту концентрацию называют осмолярностью. Для сильно разведенных растворов, которыми являются жидкие среды организма, справедливо использовать оба термина, т.к. разница значений невелика. Во многих случаях сведения о жидких средах организма легче выражать в литрах, чем в килограммах, поэтому в большинстве расчетов, используемых в клинике, а также в следующих главах, за основу принята не осмоляльность, а осмолярность.
в) Осмотическое давление. Осмос молекул воды через избирательно проницаемую мембрану может быть уравновешен силой, приложенной в направлении, обратном осмосу. Величину давления, необходимую для прекращения осмоса, называют осмотическим давлением. Таким образом, осмотическое давление является непрямой характеристикой содержания воды и концентрации веществ в растворе. Чем оно выше, тем меньше в растворе содержание воды и выше концентрация растворенного вещества.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Физиология и нарушения водно-солевого обмена (методические материалы к практическим и семинарским занятиям)
Информация
Справочное пособие содержит информацию о физиологии водно-солевого обмена (ВСО). Также представлена информация о методах клинической и лабораторной диагностики нарушений ВСО. Перечислены варианты дисгидрий и методы лечения. Предназначается для врачей всех специальностей, курсантов ФПК и студентов медвузов.
Вода организма
Электролитный состав организма
Факторы, влияющие на перемещение внеклеточной воды в организме
Как уже упоминалось выше, вода является транспортной средой, переносящей питательные вещества и кислород к клеткам и уносящей продукты метаболизма от клеток через интерстициальное пространство в кровоток. Возникает вопрос – каким образом вода «знает» куда и что переносить?
Физиология рассматривает три фактора, определяющих целенаправленное движение воды при транскапиллярном обмене:
2. Часть осмотического давления, создаваемую в биологических жидкостях белками, называют коллоидно-осмотическим (онкотическим) давлением (КОД).
Оно составляет примерно 0,7% осмотического давления (или осмотической концентрации), т. е. около 25 мм рт. ст. (2 мосмоль/кг), но имеет исключительно большое функциональное значение в связи с высокой гидрофильностью белков и неспособностью их свободно проходить через полупроницаемые биологические мембраны.
Механизмы поддержания внутриклеточного объема жидкости и внутриклеточного ионного состава
«Натриевый насос». Мембранная проницаемость Na+ в общем в 10-20 раз меньше, чем К+. Однако наличие градиента концентраций Na+ во вне- и внутриклеточном пространствах и отрицательный внутриклеточный заряд могли бы обеспечить силу, способную двигать Na+ в сторону клетки.
В действительности этого не происходит, поскольку такая сила оказывается сбалансированной другой, действующей в обратном направлении и называемой натриевым насосом. Энергия натриевого насоса, являющегося специфическим свойством клеточной мембраны, обеспечивается гидролизом аденозинтрифосфата (АТФ) и направлена на выталкивание Na+ из клетки [Whittman R., Wheeler К. Р., 1970].
Эта же энергия способствует движению К+ внутрь клетки. Установлено, что противоположно направленные движения К+ и Na+ осуществляются в пропорции 2:3. По мнению М. W. В. Bradbury (1973), с физиологической точки зрения для К+ этот механизм не столь существен, так как последний в норме обладает высокой способностью проникать через клеточную мембрану. Описанный механизм является основным для обеспечения постоянства концентрации клеточных и внеклеточных компонентов. Принципиально важен тот момент, что осмолярность внутриклеточной воды величина достаточно постоянная и не зависящая от осмолярности внеклеточного пространства. Это постоянство обеспечивается энергозависимым механизмом.
Что такое осмотическое состояние клеток
Известно, что одним из продуктов реакции медного купороса и желтой кровяной соли является полупроницаемая мембрана ферроцианида меди (II), которая хорошо пропускает молекулы воды и не пропускает молекулы CuSO4. Такая избирательная проницаемость мембраны способствует протеканию процесса осмоса, характерного, в том числе и для жизнедеятельности растительной клетки [4, c.306]. А сам эксперимент, проведенный в XIX веке Морицем Траубе, продемонстрировал, что в неживой природе неорганических веществ можно найти такие химические соединения, которые при взаимодействии образуют совершенное подобие растительной клеточки, способной вбирать в себя одни вещества из окружающей среды и выделять другие. По теории Траубе, рост полученных им искусственных клеточек происходит вследствие внутреннего гидростатического давления (тургор), которое играет важную роль в жизни растений. Таким образом, клеточки Траубе принято считать моделям живой клетки [9].
Еще в 1750г. русский ученный М.В. Ломоносов получал с помощью желтой кровяной соли удивительные по окраске малорастворимые в воде соединения, которые иногда называют «ферроцианидными солями Ломоносова», или «ферроцианидные кустарники Ломоносова». Эти изумительные растения, похожие на нитевидные водоросли формируются благодаря образованию на поверхности кристалликов желтой кровяной соли полупроницаемой пленки [1, c.126-127].
2. Теоретическая часть
Явление осмоса наблюдается при наличии двух систем с различной концентрацией веществ, где подвижность растворителя больше подвижности растворённых веществ. Важным частным случаем осмоса является осмос через полупроницаемую мембрану, когда они сообщаются с помощью полупроницаемой мембраны. В этом случае по законам термодинамики выравнивание концентраций происходит за счет вещества, для которого мембрана проницаема.
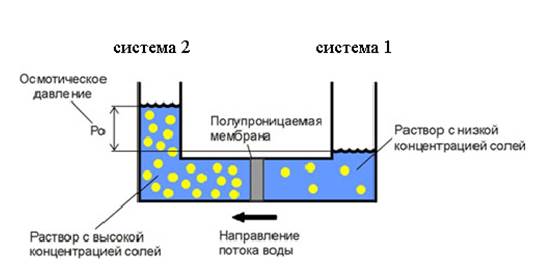
Полупроницаемыми называют мембраны, которые имеют достаточно высокую проницаемость не для всех, а лишь для некоторых веществ, в частности, для растворителя [13, с.228]. (Подвижность растворённых веществ в мембране относительно мала). Как правило, это связано с размерами и подвижностью молекул, например, молекула воды меньше большинства молекул растворённых веществ. Если такая мембрана разделяет раствор и чистый растворитель, то концентрация растворителя в растворе оказывается менее высокой, поскольку там часть его молекул замещена на молекулы растворённого вещества. Вследствие этого переходы частиц растворителя из отдела, содержащего чистый растворитель, в раствор, будут происходить чаще, чем в противоположном направлении. Соответственно, объём раствора будет увеличиваться (а концентрация вещества уменьшаться), тогда как объём чистого растворителя будет, соответственно, уменьшаться (рис.1).
При рассмотрении двух систем с различной концентрацией по сторонам полупроницаемой мембраны выравнивание концентраций в системе 1 и 2 возможно только за счет перемещения воды. В системе 1 концентрация воды выше, поэтому поток воды направлен от системы 1 к системе 2. По достижении равновесия реальный поток будет равен нулю [12, с.188]
Рис. 1 Схема формирования осмотического давления
В случаях, когда мембрана проницаема не только для растворителя, но и для некоторых растворённых веществ, перенос последних из раствора в растворитель позволяет осуществить диализ, применяемый как способ очистки полимеров и коллоидных систем от низкомолекулярных примесей, например электролитов [15, c.38-56].
Осмос играет важную роль во многих биологических процессах. Мембрана, окружающая нормальную клетку крови, проницаема лишь для молекул воды, кислорода, некоторых из растворённых в крови питательных веществ и продуктов клеточной жизнедеятельности; для больших белковых молекул, находящихся в растворённом состоянии внутри клетки, она непроницаема. Поэтому белки, столь важные для биологических процессов, остаются внутри клетки.
Осмос участвует в переносе питательных веществ в стволах высоких деревьев, где капиллярный перенос не способен выполнить эту функцию [3,с. 117].
Клетки растений используют осмос также для увеличения объёма вакуоли, чтобы она распирала стенки клетки (тургорное давление). Клетки растений делают это путём запасания сахарозы. Увеличивая или уменьшая концентрацию сахарозы в цитоплазме, клетки могут регулировать осмос [6, с.66]. За счёт этого повышается упругость растения в целом. С изменениями тургорного давления связаны многие движения растений (например, движения усов гороха и других лазающих растений).
Таким образом, осмос играет важную роль в жизни растительной клетки.
Б) Растительная клетка как осмотическая система
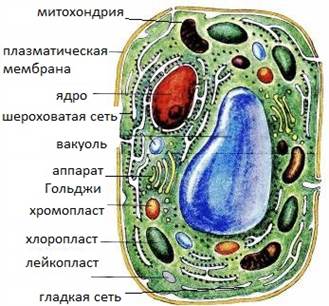
Рис.2 Растительная клетка
Растительную клетку можно рассматривать как осмотическую систему. Клеточная стенка обладает определенной эластичностью и может растягиваться. В вакуоли накапливаются растворимые в воде вещества (сахара, органические кислоты, соли), которые обладают осмотической активностью. Клеточный сок вакуоли является высококонцентрированным раствором. Тонопласт (от греч. tonos – натяжение, напряжение и plastos – оформленный, вылепленный) – мембрана, ограничивающая вакуоль растительной клетки [12, с.138].
Тонопласт и клеточная мембрана выполняют в данной системе функцию полупроницаемой мембраны, поскольку эти структуры избирательно проницаемы, и вода проходит через них значительно легче, чем вещества, растворенные в клеточном соке и цитоплазме [17, c.98].
Чтобы попасть в вакуоль, вода должна пройти через клеточную стенку, плазмалемму, цитоплазму и тонопласт. Клеточная стенка хорошо проницаема для воды [8, c.65]. Плазмалемма и тонопласт обладают избирательной проницаемостью, являются полупроницаемой мембраной, а вакуоль с клеточным соком – концентрированным раствором. Поэтому, если клетку поместить в воду, то вода по законам осмоса начнет поступать внутрь клетки.
Тургорное давление – внутреннее давление, которое развивается в растительной клетке, когда в неё в результате осмоса входит вода, и цитоплазма прижимается к клеточной стенке; это давление препятствует дальнейшему проникновению воды в клетку [6, с.66].
Эластическое растяжение ткани благодаря тургорному давлению ее клеток придает твердость неодревесневшим частям растений. Завядающие побеги становятся дряблыми, так как при потере воды тургорное давление падает. Тургорное давление противодействует притоку воды в клетку. Давление, с которым вода осмотически притекает в клетку, равно, таким образом, разности осмотического давления и тургорного давления.
В связи с этим, если клетка попадает в окружающую среду, где концентрация осмотически активных веществ (электролиты, неэлектролиты, белки) будет меньше по сравнению с концентрацией внутри клетки (или клетка помещена в воду), вода по законам осмоса должна поступать внутрь клетки.
Наблюдения за явлениями плазмолиза и тургора позволяют ученым изучать многие свойства клетки. Явление плазмолиза показывает, что клетка жива и протоплазма сохранила полупроницаемость. По скорости и форме плазмолиза можно судить о вязкости протоплазмы. Также явление плазмолиза позволяет определить величину осмотического давления (плазмолитический метод) [7, с. 135].
Осмотическое давление различно у разных жизненных форм. У древесных пород оно выше, чем у кустарников, а у кустарников выше, чем у травянистых растений. Разные экологические группы различаются по величине осмотического давления. Особенное значение имеет снабжение растений водой. У растений пустынь осмотическое давление больше, чем у степных растений. У степных — больше, чем у луговых. Еще меньше осмотическое давление у растений болотных и водных местообитаний. У светолюбивых растений осмотическое давление больше, чем у теневыносливых. Растение в определенной степени регулирует величину осмотического давления. Ферментативное превращение сложных нерастворимых веществ в растворимые (крахмала в сахара, белков в аминокислоты) приводит к возрастанию концентрации клеточного сока и повышению осмотического давления.
Однако, говоря о поступлении воды в клетку, надо учитывать, что наряду с осмотическим давлением в клетках существует давление набухания. Давление набухания связано со способностью гидрофильных коллоидов притягивать к себе молекулы воды. Сила, с которой коллоиды притягивают воду, и представляет собой давление набухания. Большое значение давление набухания имеет для молодых меристематических клеток, в которых отсутствуют вакуоли и которые заполнены коллоидным веществом [2, с.407].
В) Мориц Траубе, изучение тургорного давления
По окончании гимназии занимался в Берлине естественными науками и специально химией под руководством Е. Митчерлиха, Г. Розе и Раммельсбурга. Из Берлина Траубе перешел в Гиссен, где занимался в лаборатории Либиха. В 1846 г. Траубе. снова вернулся в Берлин, и через род получил степень доктора философии за химическую диссертацию «De nonnullis Chromii connubiis». Чтобы приобрести практические сведения. Траубе поступил на одну берлинскую красильню, но вскоре вернулся в Ратибор.
После смерти отца, он продолжал его дело (виноторговля) и досуги посвящал любимым занятиям теоретической химией. Его работы, сделанные в маленьком Ратиборе, вдали от общения с учеными, поразительны, отличаясь замечательной ясностью, логичностью мышления и новизной идей.
С 1851 по 1894 г. Траубе опубликованы 42 монографии, в которых он высказал совершенно новые взгляды на процессы брожения, нашедшие блестящее подтверждение в работах последних десятилетий. Процессы брожения вызываются, по мнению Траубе, не самими организмами брожения (дрожжами), но теми ферментами, которые эти организмы вырабатывают и выделяют в окружающую среду.
Громадное влияние на общую физиологию оказало открытие Траубе, касающееся образования растительных клеток. До того существовало представление, что в образовании, питании и росте клеток играют главную роль исключительно жизненные процессы.
Опыты Траубе показали, что можно найти такие неорганические химические соединения, которые при взаимодействии образуют совершенное подобие растительной клеточки, способной вбирать в себя одни вещества из окружающей среды и выделять другие. По теории Траубе, рост клеточек происходит вследствие внутреннего гидростатического давления (тургор).
Во внимание к трудам Траубе университет в Галле преподнес ему в день празднования своего 300-летнего юбилея в 1874 г., диплом на степень Dr. med. et chir. Не занимая никогда профессорского места, числясь корреспондентом Берлинской академии наук в течение всей своей жизни, Траубе не прерывал занятий наукой и умер среди начатых работ [5].
3. Практическая часть
А) Эксперимент с медным купоросом и желтой кровяной солью
Данный эксперимент имеет недостаток – в нём используются редкий, токсичный реактив – желтая кровяная соль [10, c.90]. Поэтому этот эксперимент ученики не смогут при желании повторить дома.
Используемые реактивы и оборудование:
В химическом стакане приготовим 5% раствор CuSO4. Для этого растворим при помешивании 15 г соли в 285 мл дистиллированной воды при комнатной температуре. Наблюдаем появление голубого мутного раствора CuSO4 в воде. Для подавления гидролиза сульфата меди по катиону в водном растворе, добавляем в стакан несколько крупинок лимонной кислоты. Наблюдаем, что раствор стал прозрачным. Это очень удобно для наблюдения процессов формирования клеточек Траубе.
После этого пинцетом поместим небольшой кристаллик желтой кровяной соли на дно стакана. Наблюдаем рост клеточки Траубе.
Рис.4. Рост клеток Траубе в растворе медного купороса.
Объяснение наблюдаемых процессов:
2 CuSO4 + K4[Fe(CN)6] ®Cu2[Fe(CN)6] + 2 K2SO4
Концентрация желтой кровяной соли внутри клетки больше, чем концентрация сульфата меди снаружи. В результате вода проникает в клетку, тем самым увеличивая ее до тех пор, пока концентрации желтой кровяной соли и сульфата меди не уравняются. За счет давления мембрана из гексацианоферрата(II) меди постоянно разрывается. На месте разрыва опять взаимодействуют сульфат меди и желтая кровяная соль, и пленка образуется снова. Поэтому клеточка Траубе растет неравномерно.
Б) Эксперимент с хлоридом железа (III) и силикатным клеем
Данный эксперимент еще называется «Силикатный сад» и имеет преимущество перед предыдущим в плане большей доступности реактивов. Так силикатный клей можно приобрести в канцелярском магазине, а реактив FeCl3 в магазине для радиолюбителей (он используется при пайке радиодеталей). Поэтому этот эксперимент ученики смогут при желании повторить у себя дома неограниченное количество раз, наблюдая, как на скорость и размер «водорослей» влияет разная концентрация силикатного клея в воде и размеры кристаллов хлорида железа (III).
Реактивы и оборудование:
Смешиваем силикатный клей и воду в соотношении 1:1. Насыпаем в полученный раствор немного соли FeCl3. Наблюдаем, как из кристалликов соли постепенно вырастают красивые «водоросли».
Рис.5. Рост клеток Траубе в силикатном растворе.
Объяснение наблюдаемых процессов:
Силикаты многих металлов плохо растворить в воде. Клей содержит относительно хорошо растворимые силикаты калия и натрия. В реакции обмена образуются силикаты железа, которые в водном растворе сразу же подвергаются гидролизу с образованием нерастворимого гидроксида железа (III)
2FeCl3 +3Na2SiO3 ® Fe2(SiO3)3 + 6NaCl
Fe2(SiO3)3 + 6H2O ® 2Fe(OH)3¯ + 3H2SiO3
Клеточная мембрана живой клетки обладает свойством полупроницаемости. Это явление демонстрируется в опыте с искусственной клеткой Траубе.
Изучена сущность осмотических процессов и проведены эксперименты по воздействию гипертонических, гипотонических и изотонических растворов на живые клетки с применением модельной клеточки Траубе.
Сделано заключение о том, что получение клеточки Траубе с применением силикатного водного раствора и хлорида железа (III) более доступно и безопасно для школьников, чем способ с использованием медного купороса и желтой кровяной соли при проведении подобного эксперимента в домашних условиях.