Что такое основание льюиса
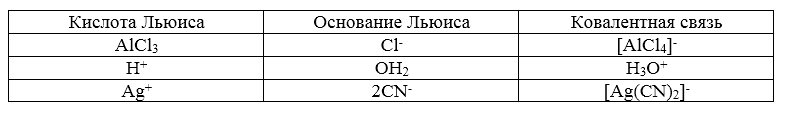
Кислоты и основания Льюиса
Вы будете перенаправлены на Автор24
Критерии определения кислот и оснований Льюиса
В качестве основы своих определений кислот и оснований Льюис выбрал четыре экспериментальных критерия:
Нейтрализация. Как быстро и в какой степени кислоты и основания могут соединяться друг с другом.
Титрование с индикаторами. Способность кислот и оснований титровать друг друга при помощи индикаторов.
Вытеснение. Способность кислот и оснований вытеснять из соединений более слабую кислоту или основание.
Катализ. Способность кислот и оснований выступать в качестве катализатора.
Для того чтобы определить, к какому классу, кислот или оснований, относится вещество, необходимо, чтобы оно характеризовалось всеми четырьмя критериями. При этом нейтрализации и титрованию с индикаторами Льюис придавал особое значение. Согласно этому, он дал следующие определения.
Вещества, способные реагировать в обоих направлениях, Льюис отнес к амфотерным веществам.
Теория Льюиса
Готовые работы на аналогичную тему
В реакции взаимодействия аммиака с трифторидом бора аммиак отдает электронную пару (выступает в роли основания), а трифторид бора принимает (выступает в роли кислоты)
$NH_3 + BF_3 > NH_3BF_3$
Кислоты Льюиса ($L$-кислоты) и основания могут не содержать протонов, и тогда их называют апротонными.
Теория Льюиса не позволяет количественно определить силу кислот.
К основаниям по Льюису относятся следующие соединения:
вещества, содержащие аминный азот (алифатические и ароматические амины, аммиак, пиридин и др.);
Кислотами по Льюису являются:
галогениды алюминия, бора, кремния, мышьяка, олова, сурьмы, фосфора и др.;
Классификация кислот и оснований Льюиса
Жесткие кислоты характеризуются малым радиусом и высоким положительным зарядом. Они имеют высокую электроотрицательность, низкую поляризуемость, хорошие акцепторы электронных пар.
Мягкие кислоты имеют меньший заряд по сравнению с жесткими кислотами, обладают большей поляризуемостью и невысокой электроотрицательностью.
Промежуточные кислоты проявляют средние значения зарядов ядер, электроотрицательности и поляризуемости между жесткими и мягкими кислотами.
Жесткие основания имеют высокую электроотрицательность, плохо поляризуются и окисляются.
Мягкие основания имеют малую электроотрицательность, легко поляризуются, проявляют свойства сильных восстановителей.
Понятие кислотно- основного катализа
Например: по механизму специфического кислотного катализа протекают гидратация ненасыщенных альдегидов, гидролиз эфиров, ацеталей; специфический основный катализ характерен для гидратации альдегидов, альдольной конденсации и др.
Например: каталитическое превращение углеводородов нефти (каталитический крекинг, алкилирование, изомеризация) протекает по механизму общего кислотного катализа.
Электрофильный ( или нуклеофильный) катализ. Происходит под действием кислот или оснований Льюиса.
Электронная теория Льюиса рассматривает кислоты и основания более углубленно и широко, чем другие теории кислот и оснований.
А Кислота Льюиса это химический вид, содержащий пустой орбитальный который способен принять электронная пара от Льюиса основание сформировать Льюис аддукт. А База Льюиса, то есть любой вид, у которого есть заполненная орбиталь, содержащая электронная пара который не участвует в связь но может образовать дательная облигация с кислотой Льюиса с образованием аддукта Льюиса. Например, NH3 это база Льюиса, потому что она может пожертвовать одинокая пара электронов. Триметилборана (Мне3B) является кислотой Льюиса, поскольку она способна принимать неподеленную пару. В аддукте Льюиса кислота и основание Льюиса имеют общую электронную пару, предоставленную основанием Льюиса, образуя дательную связь. [1] В контексте конкретной химическая реакция между NH3 и я3B, одинокая пара из NH3 образует дательную связь с пустой орбиталью Меня3B с образованием аддукта NH3• BMe3. Терминология относится к вкладам Гилберт Н. Льюис. [2]
Условия нуклеофил и электрофил более или менее взаимозаменяемы с основанием Льюиса и кислотой Льюиса соответственно. Однако эти термины, особенно их абстрактные формы существительных нуклеофильность и электрофильность, подчеркивают кинетический аспект реакционной способности, в то время как основность Льюиса и кислотность Льюиса подчеркивают термодинамический аспект образования аддукта Льюиса. [3]
Содержание
Изображение аддуктов
Во многих случаях взаимодействие между основанием Льюиса и кислотой Льюиса в комплексе показано стрелкой, указывающей на то, что основание Льюиса отдает электроны в сторону кислоты Льюиса, используя обозначение дательная облигация-Например, Мне3B ← NH3. Некоторые источники указывают на основание Льюиса парой точек (явные передаваемые электроны), что позволяет согласованно представить переход от самого основания к комплексу с кислотой:
Центральная точка также может использоваться для обозначения аддукта Льюиса, такого как Мне3B • NH3. Другой пример диэтилэфират трифторида бора, BF3• Et2О. (В несколько ином использовании центральная точка также используется для обозначения гидратная координация в различных кристаллах, как в MgSO4• 7H2O для гидратированного сульфат магния, независимо от того, образует ли вода дативную связь с металлом.)
Примеры
Кислоты Льюиса разнообразны. Самыми простыми являются те, которые напрямую реагируют с базой Льюиса. Но чаще встречаются те, которые подвергаются реакции до образования аддукта.
Опять же, описание кислоты Льюиса часто используется нечетко. Например, в растворе голых протонов не существует.
Простые кислоты Льюиса
В этом аддукте все четыре фторидных центра (точнее, лиганды) эквивалентны.
Оба BF4 − и BF3OMe2 являются аддуктами основания Льюиса трифторида бора.
Во многих случаях аддукты нарушают Правило октета, такой как трииодид анион:
Вариабельность окраски растворов йода отражает переменную способность растворителя образовывать аддукты с кислотой Льюиса I.2.
В некоторых случаях кислота Льюиса способна связывать два основания Льюиса, известным примером является образование гексафторсиликат:
Комплексные кислоты Льюиса
В этом случае промежуточный B2ЧАС7 − можно изолировать.
Многие комплексы металлов служат кислотами Льюиса, но обычно только после диссоциации более слабосвязанного основания Льюиса, часто воды.
ЧАС + как кислота Льюиса
В протон (ЧАС + ) [7] является одной из самых сильных, но также и одной из самых сложных кислот Льюиса. Принято игнорировать тот факт, что протон сильно сольватирован (связан с растворителем). Имея в виду это упрощение, кислотно-основные реакции можно рассматривать как образование аддуктов:
Применение кислот Льюиса
Типичный пример действия кислоты Льюиса находится в Алкилирование Фриделя – Крафтса реакция. [5] Ключевым шагом является принятие AlCl3 неподеленной пары хлорид-иона, образуя AlCl4 − и создавая сильно кислый, то есть электрофильный, ион карбония.
Базы Льюиса
Наиболее распространенными основаниями Льюиса являются анионы. Сила основности Льюиса коррелирует с pKа исходной кислоты: кислоты с высоким pKа Дадим хорошие базы Льюиса. Как обычно, более слабая кислота имеет более сильный сопряженное основание.
Сила оснований Льюиса была оценена для различных кислот Льюиса, таких как I2, SbCl5, и BF3. [8]
| База Льюиса | Донор атом | Энтальпия комплексообразования (кДж / моль) |
|---|---|---|
| Et3N | N | 135 |
| хинуклидин | N | 150 |
| пиридин | N | 128 |
| Ацетонитрил | N | 60 |
| Et2О | О | 78.8 |
| THF | О | 90.4 |
| ацетон | О | 76.0 |
| EtOAc | О | 75.5 |
| DMA | О | 112 |
| ДМСО | О | 105 |
| Тетрагидротиофен | S | 51.6 |
| Триметилфосфин | п | 97.3 |
Приложения баз Льюиса
Многие основания Льюиса являются «мультидентатными», то есть они могут образовывать несколько связей с кислотой Льюиса. Эти мультидентатные основания Льюиса называются хелатирующие агенты.
Жесткая и мягкая классификация
Кислоты и основания Льюиса обычно классифицируются по их твердости или мягкости. В этом контексте жесткий означает малые и неполяризуемые, а мягкий означает более поляризуемые атомы большего размера.
Количественная оценка кислотности Льюиса
Для оценки и прогнозирования кислотности Льюиса было разработано множество методов. Многие из них основаны на спектроскопических сигнатурах, например сдвиги в 31 Сигналы P ЯМР или ИК-диапазоны. Включены методы, разработанные Гутманном, Чайлдсом, [9] и Беккет.
Термин W представляет собой постоянный вклад энергии для кислотно-основной реакции, такой как расщепление димерной кислоты или основания. Уравнение предсказывает изменение силы кислот и оснований. Графическое представление уравнения показывает, что не существует единого порядка концентраций оснований Льюиса или кислот Льюиса. [10]
Не существует единого порядка концентраций оснований Льюиса или концентраций кислоты Льюиса.
Графики Крамера – Боппа показывают графически с использованием параметров E и C Модель ECW что не существует единого порядка концентраций оснований Льюиса (или кислотных сил). [11] Одно свойство или переменные масштабы ограничены небольшим диапазоном кислот или оснований.
История
Переформулировка теории Льюиса
Сравнение с теорией Бренстеда – Лоури.
База Льюиса часто является базой Бренстеда – Лоури, поскольку она может отдавать пару электронов H + ; [7] протон является кислотой Льюиса, поскольку он может принимать пару электронов. Конъюгированное основание кислоты Бренстеда-Лоури также является основанием Льюиса, поскольку потеря H + из кислоты уходит те электроны, которые использовались для связи A — H, как неподеленная пара на сопряженном основании. Однако базу Льюиса может быть очень сложно протонировать, но все еще реагирует с кислотой Льюиса. Например, монооксид углерода является очень слабым основанием Бренстеда – Лоури, но образует сильный аддукт с BF3.
В другом сравнении кислотности Льюиса и Бренстеда – Лоури, проведенного Брауном и Каннером, [14] 2,6-ди-т-бутилпиридин реагирует с образованием гидрохлоридной соли с HCl, но не реагирует с BF3. Этот пример демонстрирует, что стерические факторы, в дополнение к факторам электронной конфигурации, играют роль в определении силы взаимодействия между громоздкими ди-т-бутилпиридин и крошечный протон.
Физические свойства



АЛКАНЫ
Жесткие и мягкие кислоты и основания.
Кислоты и основания Льюиса.
Согласно теории Льюиса, кислотно-основные свойства соединений определяются их способностью принимать или отдавать пару электронов с образованием новой связи.
Кислоты Льюиса – акцепторы пары электронов, основания Льюиса – доноры пары электронов.
Кислотами Льюиса могут быть молекулы, атомы или катионы, обладающие вакантной орбиталью и способные принимать пару электронов с образованием ковалентной связи. К кислотам Льюиса относятся галогениды элементов II и III групп периодической системы, галогениды других металлов, имеющих вакантные орбитали, протон. Кислоты Льюиса в реакциях участвуют в качестве электрофильных реагентов.
Основаниями Льюиса являются молекулы, атомы или анионы, имеющие неподеленную пару электронов, которую они предоставляют для образования связи с вакантной орбиталью. К основаниям Льюиса относятся спирты, простые эфиры, амины, тиоспирты, тиоэфиры, а также соединения, имеющие p-связи. В реакциях основания Льюиса проявляют себя как нуклеофильные частицы.
Развитие теории Льюиса привело к созданию принципа жестких и мягких кислот и оснований (принцип ЖМКО или принцип Пирсона). Согласно принципа Пирсона, кислоты и основания подразделяются на жесткие и мягкие.
Суть принципа ЖМКО состоит в том, что жесткие кислоты реагируют с жесткими основаниями, мягкие кислоты – с мягкими основаниями
План описания органических соединений:
3. Нахождение в природе.
4. Физические и химические свойства.
5. Способы получения.
(предельные, насыщенные углеводороды, парафины)
Общая формула алканов СnH2n+2.
В соответствии с общей формулой алканы образуют гомологический ряд, в котором гомологи отличаются друг от друга на гомологическую разность СН2.
Соединения этого класса рассматриваются как родоначальные структуры для многих классов органических соединений.
Изомерия. Для алканов характерна структурная изомерия или изомерия углеродного скелета. Она появляется у бутана:
н-бутан СН3 изобутан (2-метилпропан)
Линейные алканы называют нормальными и перед названием ставят букву «н». Для обозначения разветвленных алканов часто используют приставки изо-, нео- и т.д.
Атомы углерода могут быть соединены с различным числом других атомов углерода. В зависимости от этого различают первичные, вторичные, третичные и четвертичные атомы углерода. Например:
Для алканов еще характерна конформационная изомерия, которая представляет собой один из видов пространственной изомерии:
С1 – С4 – газы без цвета и запаха.
С5 – С15 – жидкости без цвета с «бензиновым» запахом.
С16 – твердые бесцветные вещества.
Все алканы практически нерастворимы в воде, но хорошо растворимы в углеводородах, простых и сложных эфирах.
Кислота Льюиса
Из Википедии — свободной энциклопедии
В рамках электронной теории химических соединений Льюиса химическая связь образуется обобществлённой электронной парой, достраивающей электронные оболочки атомов, образующих связь, до завершенной электронной конфигурации инертного газа (правило октетов).
В качестве кислот Льюиса могут выступать как нейтральные молекулы, так и катионы: так, катионы водорода выступают в роли кислоты Льюиса при взаимодействии с водой либо аммиаком, с образованием ионов гидроксония либо аммония.
Кислотами Льюиса являются также координационно ненасыщенные соединения — как металлов, так и неметаллов, например, BF3, AlCl3, образующие аддукты с различными основаниями Льюиса:
A l C l 3 + C l − → [ A l C l 4 ] − <\displaystyle <\mathsf 
Энциклопедичный YouTube
Субтитры
Сегодня поговорим о кислотах и основаниях с точки зрения органической химии, то есть согласно теории Брёнстеда и Лоури. Согласно ей кислота — донор протонов, а основание — акцептор протонов. Протон — это ядро наиболее распространённого изотопа водорода, лишённое электрона. У атома водорода всего 1 электрон. Это выглядит так. Из-за этого атом водорода в целом нейтрален. Разноимённые заряды нейтрализуют друг друга. Но если каким-то образом убрать электрон, останется только протон. Лишив атом отрицательного заряда, мы оставляем только положительно заряженное ядро атома, состоящее из единственного протона. Так выглядит протон с точки зрения органической химии. Вещества обмениваются протонами, и мы рассмотрим эти механизмы на примере химической реакции. Начнём с электронно-точечной формулы молекулы воды, имеющей 2 неподелённые электронные пары. Допустим, вода реагирует с хлороводородом, имеющим следующую электронно-точечную формулу. Связь между водородом и хлором образована электронами, один из которых отдаёт атом водорода, а другой — атом хлора. Согласно теории Брёнстеда-Лоури хлороводород является кислотой, потому что эта молекула отдаёт протон. А вода забирает протоны, становясь основанием согласно концепции Брёнстеда-Лоури. Неподелённая электронная пара кислорода, в свою очередь, присоединяет вот этот протон. А вот электрон этой связи переходит к атому хлора. Для наглядности выделю его голубым цветом. Вы видите их на электронно- точечной формуле. Давайте запишем продукты этой реакции вот здесь. Кислород присоединяет протон с помощью неподелённой электронной пары, приобретая положительный заряд. И у него остаётся ещё одна неподелённая пара. Считается, что в результате кислород получает формальный заряд +1. Вот так. Вторым продуктом будет хлорид-анион. Атом хлора получил дополнительный электрон. Снова покажу его голубым цветом. Этот электрон принадлежал атому водорода, а теперь принадлежит хлорид-аниону. Получив дополнительный электрон, атом хлора приобрёл отрицательный заряд. Его также можно считать формальным зарядом −1. Состоялся перенос протона от хлороводорода воде с образованием гидроксония и хлорид-аниона. Теоретически реакция равновесная, но хлороводород является сильной кислотой, и равновесие сильно смещается вправо. Вероятность обратной реакции мала, и я показал это стрелками разного размера. Хлороводород практически полностью диссоциирует в воде. В обратной реакции гидроксоний отдаёт протон, а хлорид-анион его присоединяет. Гидроксоний выступает в роли кислоты, а хлорид-анион — основания, присоединяя протон. Образуются вода и хлороводород. Так происходит в действительности. Кислотно-основные реакции находятся в равновесии, в них участвуют кислотно-основные пары. Слева хлороводород является брёнстедовской кислотой и отдаёт протон, превращаясь в сопряжённое основание — хлорид-анион. Хлороводород и хлорид — кислотно-основная пара. Друг от друга они отличаются только протоном. Есть и вторая кислотно-основная пара. Вода слева является брёнстедовским основанием, а гидроксоний справа — сопряжённой кислотой. Это также кислотно-основная пара. Они также отличаются только протоном. Чем сильнее кислота, тем слабее сопряжённое основание. Хлороводород на самом деле — сильная кислота, следовательно, хлорид-анион является крайне слабым основанием и очень слабо отнимает протон. Это общий принцип. Хлороводород — очень сильная кислота, хлорид — слабое основание. В органической химии есть и другая концепция кислот и оснований — теория Льюиса. Кислота Льюиса — акцептор электронной пары, основание — донор электронной пары. Это проще запомнить по первым буквам английских слов: acid и acceptor. Начальные буквы в обоих случаях — a. Я думаю, это понятно. Во втором случае начальные буквы b и d, тоже не сложно. Маленькая мнемограмма для лучшего запоминания. Рассмотрим на примере химической реакции с использованием концепции Льюиса для кислот и оснований. У кислорода 2 неподелённые электронные пары. А вот формула борана. BH3. Вот его формула. У атома бора нет октета электронов, их всего 6. Бор не имеет октетов электронов. Но согласно периодической таблице октет возможен, поэтому боран очень активен. Атом бора находится в состоянии sp2-гибридизации, что означает наличие свободной p-орбитали. Эта орбиталь пустая. В этом причина высокой реакционной способности молекулы борана. Вернёмся к нашим реагентам. Вот они. Пустая орбиталь атома бора способна принять пару электронов вот этого самого атома кислорода. Давайте рассмотрим это чуть более подробно. Орбиталь будет заполнена, образуется связь. Изобразим это. Итак, в результате реакции у кислорода остаётся 1 неподелённая пара электронов. Вторая образует связь с атомом бора, который по-прежнему связан с водородом. Что насчёт формальных зарядов молекул? Давайте подумаем об этом. +1 на кислороде и −1 на боре. Это кислотно-основная реакция, потому что оксолан отдаёт пару электронов, являясь основанием Льюиса как донор. Оксолан отдаёт пару электронов, являясь основанием Льюиса как донор. Боран принимает пару электронов, являясь, таким образом, кислотой. Концепция кислот и оснований Льюиса лежит в основе органической химии, важно знать её. Теория Брёнстеда-Лоури используется довольно часто, её нужно знать очень хорошо.