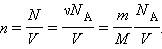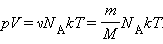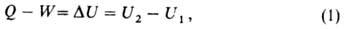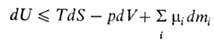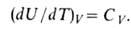Что такое параметры тд системы привести примеры интенсивных и экстенсивных параметров
Что такое параметры тд системы привести примеры интенсивных и экстенсивных параметров
Термодинамическая система характеризуется определенными значениями ее свойств. Эти свойства термодинамического тела (системы) называются параметрами состояния.
Параметры состояния – любая величина, присущая телу, изменение которой определяется только начальным и конечным состоянием тела и не зависит от характера процесса изменения его состояния, при переходе его из первого состояния во второе. Параметры можно разделить на две группы:
Интенсивные – которые не зависят от количества вещества и при взаимодейтсвии тел выравниваются (температура, давление и т.п.);
Экстенсивные – зависящие от количества вещества, следующие закону сложения или, как говорят математики, закону аддитивности (масса, обьем, внутренняя энергия и т.п.).
Измерение экстенсивной величины производится сравнением ее с такой же по природе величиной, выбранной за единицу – эталон (метр, килограмм и т.п.). Измерение интенсивной величины основано на использовании объективной связи между изменениями этой интенсивной величины и какой-либо экстенсивной величины. Например, связь температуры и объема жидкости в термометре приводит к измерению температуры с помощью длины столбика жидкости в термометре.
Некоторые экстенсивные величины приобретают свойства интенсивных, если их рассматривают применительно к единице массы данного вещества (удельные объем, энтальпия и т.п.).
Все термодинамические параметры введены человеком для удобства изучения окружающего мира. Однако не все параметры поддаются измерению приборами. Ряд параметров, не поддающихся измерению, человек ввел для удобства расчета термодинамических процессов. Эти параметры получаются расчетным путем и имеют в размерности величину работы (энергии) Дж или кал. Например, к ним относятся энтальпия и энтропия. Такие параметры получили название – энергетических или калорических параметров, или функций состояния. Параметры, которые возможно измерить приборами, называются термическими. Например, к этим параметрам относятся температура и давление.
Общая схема разделения термодинамических параметров состояния на основые виды дана на рис. 2.4.
Функция состояния термодинамической системы: внутренняя энергия. Первый закон термодинамики.
Основные понятия термодинамики: система, элемент системы. Классификация систем: по фазовому состоянию (гетерогенные и гомогенные); по способу обмена с окружающей средой массой и энергией (изолированные, закрытые, открытые)
Термодинамическая система – это тело или группа тел, взаимодействующих между собой, и отделѐнных от окружающей среды реальной или воображаемой поверхностью раздела.
Гомогенные – это такие системы, внутри которых свойства изменяются непрерывно при переходе от одного места к другому.
Гетерогенными называются системы, которые состоят из нескольких физически однородных, или гомогенных, тел, так что внутри систем имеются разрывы непрерывности в изменении их свойств.
Изолированная система – это система, которая не обменивается с окружающей средой ни веществом, ни энергией.
Закрытая система – это система, которая не обменивается со средой веществом, но обменивается энергией.
Открытая система – это система, которая обменивается со средой и веществом, и энергией. Примером открытой системы является живая клетка.
Параметры состояния термодинамической системы. Интенсивные и экстенсивные параметры. Примеры
Экстенсивные параметры – это параметры, которые зависят от количества вещества системы и суммируются при объединении систем (объѐм, масса, энергия, площадь и т.д.).
Интенсивные параметры – это параметры, которые не зависят от количества вещества и выравниваются при объединении систем (температура, давление, концентрация, плотность, поверхностное натяжение).
Функция состояния термодинамической системы: внутренняя энергия. Первый закон термодинамики.
Первый закон термодинамики (первое начало термодинамики): энергия не возникает из ничего и не исчезает бесследно, а переходит из одного вида энергии в другой. ∆U=Q+A
4. Функции состояния термодинамической системы: энтальпия. Определения: тепловой эффект реакции, стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Закон Гесса и его следствие.
Энтальпия-это функция состояния, приращение которой равно тепловому эффекту процесса, протекающего при постоянном давлении.
Стандартная энтальпия (теплота) образования вещества – это тепловой эффект реакции образования 1 моль химического соединения из простых веществ в стандартных условиях: Т=289 К, Р=1 атм=101325 Па
Стандартная энтальпия (теплота) сгорания вещества – это тепловой эффект реакции полного сгорания 1 моль химического соединения в стандартных условиях.
Закон Гесса: теплота химической реакции, протекающей при постоянном давлении или объѐме, не зависит от пути процесса, а только от начального и конечного состояний системы.
Следствия из закона Гесса
Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции.
Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции иисходных веществ, умноженных на стехиометрические коэффициенты
Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ ипродуктов реакции, умноженных на стехиометрические коэффициенты
Если начальное и конечное состояния химической реакции (реакций) совпадают, то её (их) тепловой эффект равен нулю.
Функция состояния термодинамической системы: энергия Гиббса. Прогнозирование направления самопроизвольно протекающих процессов в изолированной и закрытой системах; роль энтальпийного и энтропийного факторов.
Энергия Гиббса (или потенциал Гиббса) — это величина, показывающая изменение энергии в ходе химической реакции.
В ходе самопроизвольного процесса в закрытых системахG уменьшается до определенной величины, принимая минимально возможное для данной системы значение Gmin. Система переходит в состояние химического равновесия (ΔG= 0).
В изолированных системахэнтропия максимально возможное для данной системы значение Smax; в состоянии равновесия ΔS= 0
Энтальпийный и энтропийный фактор действуют независимо друг от друга и могут направлять процесс в противоположные стороны.
эннтальпийный и энтропийный факторы. Процессы могут протекать самопроизвольно (ΔG 0).
Диффузия
диффузией является перемешивание молекул вещества при их беспорядочном тепловом движении.
процесс взаимного проникновения молекул или атомов одного вещества между молекулами или атомами другого, приводящий к самопроизвольному выравниванию их концентраций по всему занимаемому объёму
примеры: 1)растворение молока в кофе;
2)заваривание чая;
3)распространение запахов;
Осмос. Эндо- экзоосмос
Осмос — результат неравенства химических потенциалов воды по разные стороны мембраны. Идеальная полу24проницаемая мембрана пропускает молекулы воды и не пропускает молекулы растворенного вещества.
Односторонняя диффузия растворителя через полупроницаемую мембрану, отделяющую раствор от чистого растворителя.
наблюдаются, когда жидкости приходят во взаимодействие через перепонки.
ЭНДООСМОС биол. процесс просачивания (диффузии) жидкостей и нек-рых растворенных веществ из внешней среды внутрь клетки
ЭКЗООСМОС биол. процесс просачивания (диффузии) жидкостей и нек-рых растворенных веществ из клетки в окружающую внешнюю среду
Осмос, направленный внутрь ограниченного объёма жидкости, называется эндосмосом, наружу — экзосмосом.
22. Осмотичекое давление (закон Вант-Гоффа)
Осмотическое давление равно тому давлению, которое имело бы растворенное вещество, будучи в газообразном состоянии в объеме раствора
Основные понятия термодинамики: система, элемент системы. Классификация систем: по фазовому состоянию (гетерогенные и гомогенные); по способу обмена с окружающей средой массой и энергией (изолированные, закрытые, открытые)
Термодинамическая система – это тело или группа тел, взаимодействующих между собой, и отделѐнных от окружающей среды реальной или воображаемой поверхностью раздела.
Гомогенные – это такие системы, внутри которых свойства изменяются непрерывно при переходе от одного места к другому.
Гетерогенными называются системы, которые состоят из нескольких физически однородных, или гомогенных, тел, так что внутри систем имеются разрывы непрерывности в изменении их свойств.
Изолированная система – это система, которая не обменивается с окружающей средой ни веществом, ни энергией.
Закрытая система – это система, которая не обменивается со средой веществом, но обменивается энергией.
Открытая система – это система, которая обменивается со средой и веществом, и энергией. Примером открытой системы является живая клетка.
Параметры состояния термодинамической системы. Интенсивные и экстенсивные параметры. Примеры
Экстенсивные параметры – это параметры, которые зависят от количества вещества системы и суммируются при объединении систем (объѐм, масса, энергия, площадь и т.д.).
Интенсивные параметры – это параметры, которые не зависят от количества вещества и выравниваются при объединении систем (температура, давление, концентрация, плотность, поверхностное натяжение).
Функция состояния термодинамической системы: внутренняя энергия. Первый закон термодинамики.
Первый закон термодинамики (первое начало термодинамики): энергия не возникает из ничего и не исчезает бесследно, а переходит из одного вида энергии в другой. ∆U=Q+A
4. Функции состояния термодинамической системы: энтальпия. Определения: тепловой эффект реакции, стандартная энтальпия образования вещества, стандартная энтальпия сгорания вещества. Закон Гесса и его следствие.
Энтальпия-это функция состояния, приращение которой равно тепловому эффекту процесса, протекающего при постоянном давлении.
Стандартная энтальпия (теплота) образования вещества – это тепловой эффект реакции образования 1 моль химического соединения из простых веществ в стандартных условиях: Т=289 К, Р=1 атм=101325 Па
Стандартная энтальпия (теплота) сгорания вещества – это тепловой эффект реакции полного сгорания 1 моль химического соединения в стандартных условиях.
Закон Гесса: теплота химической реакции, протекающей при постоянном давлении или объѐме, не зависит от пути процесса, а только от начального и конечного состояний системы.
Следствия из закона Гесса
Тепловой эффект прямой реакции равен по величине и противоположен по знаку тепловому эффекту обратной реакции.
Тепловой эффект химической реакции равен разности сумм теплот образования продуктов реакции иисходных веществ, умноженных на стехиометрические коэффициенты
Тепловой эффект химической реакции равен разности сумм теплот сгорания (ΔHc) исходных веществ ипродуктов реакции, умноженных на стехиометрические коэффициенты
Если начальное и конечное состояния химической реакции (реакций) совпадают, то её (их) тепловой эффект равен нулю.
Термодинамические параметры
Что такое термодинамические параметры
Термодинамические параметры — явления, описывающие макроскопические движения системы. С греческого слово «parametron» переводится как «отмеривающий» или «соразмеряющий». Таким образом, термодинамические параметры это то, что измеряет систему.
Для описания обычно достаточно трех величин. К примеру, чтобы определить состояние газа, необходимо знать его давление, температуру и удельный объём. Параметры состояния термодинамической системы не зависят от того, каким образом она пришла в данное положение.
Осторожно! Если преподаватель обнаружит плагиат в работе, не избежать крупных проблем (вплоть до отчисления). Если нет возможности написать самому, закажите тут.
Если оно равновесное, то это описывается строго определенным набором величин. Зависимость между ними определяется уравнением состояния, которое и позволяет классифицировать системы.
Классификация величин
Явления, которые характеризируют всю систему целиком, называют макроскопическими. В разных источниках классификация величин отличается, но основные группы все же можно выделить.
В некоторых случаях в литературе используются также такие определения, как внешние и внутренние величины. К первым относят экстенсивные свойства, а ко вторым — внутреннюю энергию, температуру или химсостав.
Термодинамическими параметрами называют и величины, которые поддаются и не поддаются измерению приборами. Давление, температура и объем легко измеряется, а внутреннюю энергию уже нужно вычислять по формулам.
Наряду с термическими параметрами свойств в термодинамике также широко используются и калорические. К ним относятся, в частности энтальпия и энтропия.
Основные величины
К основным термодинамическим параметрам относятся: удельный объем, давление и температура. Если меняется хотя бы одна из этих величин, происходит процесс. Совокупность генеральных свойств системы соответственно определяет ее состояние.
Основные термодинамические параметры состояния:
Основным термодинамическим параметром являются также удельная теплоемкость вещества (объем теплоты, поглощаемой в процессе нагревания на 1 кельвин).
Интенсивные и экстенсивные параметры
Термодинамические параметры состояния делятся на две группы: экстенсивные (суммирующиеся) и интенсивные (выравнивающиеся). В первом случае свойство прямо пропорционально массе системы и обладает аддитивностью. Во втором: параметры таким свойством не обладают и не зависят от массы.
Экстенсивные или аддитививные параметры при фиксированных значениях интенсивных параметров пропорциональны числу частиц в системе (или ее массе). Интенсивные параметры принимают одинаковые значения для любой части равновесной системы, даже когда она не является пространственно однородной.
Экстенсивные величины — величины, значения которых для всей системы равны аналогичному показателю для отдельных ее частей.
Интенсивные величины — величины, которые не изменяются при разделении системы на части.
В отличие от них экстенсивные величины зависят от размеров системы и ее массы.
Интенсивные термодинамические параметры:
Разновидности по свойствам веществ, вступающих в реакцию
Любая химическая реакция сопровождается изменениями функций состояния системы, определяющихся переменными состояниями системы (объемом, давлением и температурой, количеством молей химических компонентов). Реакция возможна, если вещества имеют более низкую свободную энергию, чем реагенты.
К характеристикам параметров состояния термодинамической системы относятся разные величины (в том числе температура, состав или плотность и многое другое). Именно они описывают ее в определенный момент времени в зависимости от набора состояний.
Макроскопическое состояние. Термодинамические функции состояния. Уравнение состояния. Внутренняя энергия. Интенсивные и экстенсивные параметры
макроскопическое состояние-(макросостояние) системы, определяется значениями её термодинамических параметров: давления р, температуры Т, удельного объёма v, внутренней энергии U и т. п. Для определения макроскопического состояния однокомпонентной, однофазной системы достаточно знать значения любых 2 независимых параметров (например, Т и р или Т и v).
Функция состояния в термодинамике — функция независимых параметров, определяющих равновесное состояние термодинамической системы; не зависит от пути (характера процесса), следуя которому система пришла в рассматриваемое равновесное состояние (т.е. не зависит от предыстории системы); к функциям состояния относят, в частности, характеристические функции системы:
Термодинамическая работа и количество теплоты не являются функциями состояния, так как их значение определяется видом процесса, в результате которого система изменила своё состояние.
Уравнение состояния идеального газа. Изопроцессы
Соотношение p = nkT, связывающее давление газа с его температурой и концентрацией молекул, получено в §3.2 для модели идеального газа, молекулы которого взаимодействуют между собой и со стенками сосуда только во время упругих столкновений. Это соотношение может быть записано в другой форме, устанавливающей связь между макроскопическими параметрами газа – объемом V, давлением p, температурой T и количеством вещества ν. Для этого нужно использовать равенства
Здесь N – число молекул в сосуде, NА – постоянная Авогадро, m – масса газа в сосуде, M – молярная масса газа. В итоге получим:
Произведение постоянной Авогадро NА на постоянную Больцмана k называется универсальной газовой постоянной и обозначается буквой R. Ее численное значение в СИ есть: R = 8,31 Дж/моль·К.
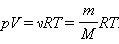
называется уравнением состояния идеального газа.
Для одного моля любого газа это соотношение принимает вид: pV=RT.
Если температура газа равна Tн = 273,15 К (0 °С), а давление pн = 1 атм = 1,013·105 Па, то говорят, что газ находится при нормальных условиях. Как следует из уравнения состояния идеального газа, один моль любого газа при нормальных условиях занимает один и тот же объем V0, равный V0 = 0,0224 м3/моль = 22,4 дм3/моль.
Это утверждение называется законом Авогадро.
где ν1, ν2, ν3 и т. д. – количество вещества каждого из газов в смеси.
Уравнение, устанавливающее связь между давлением, объемом и температурой газа было получено в середине XIX века французским физиком Б. Клапейроном, в форме (*) оно было впервые записано Д. И. Менделеевым. Поэтому уравнение состояния газа называется уравнением Клапейрона–Менделеева.
Следует отметить, что задолго до того, как уравнение состояния идеального газа было теоретически получено на основе молекулярно-кинетической модели, закономерности поведения газов в различных условиях были хорошо изучены экспериментально. Поэтому уравнение (*) можно рассматривать как обобщение опытных фактов, которые находят объяснение в молекулярно-кинетической теории.
термодинамич. ф-ция состояния системы, ее энергия, определяемая внутр. состоянием. В. э. складывается в осн. из кинетич. энергии движения частиц (атомов, молекул, ионов, электронов) и энергии взаимод. между ними (внутри- и межмолекулярной). На В. э. влияет изменение внутр. состояния системы под действием внеш. поля; во В. э. входит, в частности, энергия, связанная с поляризацией диэлектрика во внеш. электрич. поле и намагничиванием парамагнетика во внеш. магн. поле. Кинетич. энергия системы как целого и потенциальная энергия, обусловленная пространств. расположением системы, во В. э. не включаются. В термодинамике определяется лишь изменение В. э. в разл. процессах. Поэтому В. э. задают с точностью до нек-рого постоянного слагаемого, зависящего от энергии, принятой за нуль отсчета.
В. э. Uкак ф-ция состояния вводится первым началом термодинамики, согласно к-рому разность между теплотой Q, переданной системе, и работой W, совершаемой системой, зависит только от начального и конечного состояний системы и не зависит от пути перехода, т. е. представляет изменение ф-ции состояния
В. э. системы как ф-ция ее энтропии S, объема V и числа молей mi i-того компонента представляет собой термодинамический потенциал. Это является следствием первого и второго начал термодинамики и выражается соотношением:
Зависимость В. э. равновесной системы от т-ры и объема U =f(T, V )наз. калорическим уравнением состояния. Производная В. э. по т-ре при постоянном объеме равна изохорной теплоемкости:
В. э. идеального газа от объема не зависит и определяется только т-рой.
Экспериментально определяют значение В. э. в-ва, отсчитываемое от ее значения при абс. нуле т-ры. Определение В. э. требует данных о теплоемкости С V (Т),> теплотах фазовых переходов, об ур-нии состояния. Изменение В. э. при хим. р-циях (в частности, стандартная В. э. образования в-ва) определяется по данным о тепловых эффектах р-ций, а также по спектральным данным. Теоретич. расчет В. э. осуществляется методами статистич. термодинамики, к-рая определяет В. э. как среднюю энергию системы в заданных условиях изоляции (напр., при заданных Т, V,mi). В. э. одноатомного идеального газа складывается из средней энергии поступат. движения молекул и средней энергии возбужденных электронных состояний; для двух- и многоатомных газов к этому значению добавляется также средняя энергия вращения молекул и их колебаний около положения равновесия. В. э. 1 моля одноатомного идеального газа при т-рах порядка сотен К составляет 3RT/2, где R-газовая постоянная; она сводится к средней энергии поступат. движения молекул. Для двухатомного газа мольное значение В. э.-ок. 5RT/2 (сумма поступат. и вращат. вкладов). Указанные значения отвечают закону равнораспределения энергии для названных видов движения и вытекают из законов классич. статистич. механики. Расчет колебат. и электронного вкладов во В. э., а также вращат. вклада при низких т-рах требует учета квантовомех. закономерностей. В. э. реальных систем включает помимо вкладов, учитываемых для идеального газа, также среднюю энергию межмолекулярных взаимодействии.
«Термодинамическое состояние — это состояние вещества с точки зрения его давления, температуры, внутренней энергии, плотности, удельного объема, энтальпии и энтропии. Любые два параметра вещества определяют его термодинамическое состояние. Существует две категории термодинамических параметров: интенсивные и экстенсивные. Интенсивный параметр — это свойство, которое не зависит от количества или размера системы. Температура и давление — интенсивные параметры веществ и систем. Экстенсивные параметры зависят от количества или размера вещества или системы. Масса и объем — экстенсивные параметры.»
Параметры состояния системы



I. Основные понятия термодинамики
Тема : Термодинамика химического равновесия.
Цель лекции : изучение вопросов по термодинамике химического равновесия
План:
Содержание лекции:
Химическая термодинамика – это раздел физической химии, изучающий взаимопревращение теплоты и энергии при протекании химической реакции.
Термодинамика основана на ряде понятий: система, состояние системы, параметры состояния системы, функции состояния системы, внутренняя энергия системы и т. д.
Термодинамическая система – это тело или группа тел, взаимодействующих между собой, и отделённых от окружающей среды реальной или воображаемой поверхностью раздела.
Изолированная система – это система, которая не обменивается с окружающей средой ни веществом, ни энергией.
Закрытая система – это система, которая не обменивается со средой веществом, но обменивается энергией.
Открытая система – это система, которая обменивается со средой и веществом, и энергией.
Примером открытой системы является живая клетка.
Состояние системы – это набор свойств системы, позволяющих описать систему с точки зрения термодинамики.
Например, для оценки состояния человеческого организма, как термодинамической системы, врач должен оценить некоторые его свойства (температура, давление, концентрация биологических жидкостей).
Физические свойства, характеризующие состояние системы, называют параметрами состояния системы.
Взаимодействие системы с окружающей средой заметно по изменению параметров системы.
Экстенсивные параметры – это параметры, которые зависят от количества вещества системы и суммируются при объединении систем (объём, масса, энергия, площадь и т.д.).
Интенсивные параметры – это параметры, которые не зависят от количества вещества и выравниваются при объединении систем (температура, давление, концентрация, плотность, поверхностное натяжение).
Параметры состояния связаны уравнением состояния.
Переход системы из одного состояния в другое с изменением хотя бы одного параметра называется термодинамическим процессом.
Внутренняя энергия является одной из таких функций.
В XIX веке немецкий судовой врач Майер Ю.Р. и английский ученый Джоуль Д. показали, что теплота и работа способны к взаимопревращениям, являясь разными способами передачи энергии.
Наблюдая за людьми в разных климатических зонах, Майер сделал вывод, что теплота сгорания пищи используется на поддержание постоянной температуры тела и на выполнение мускульной работы. Это наблюдение легло в основу 1 закона термодинамики.