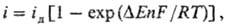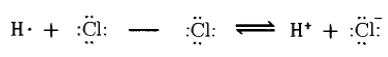Что такое поляризация в химии
Поляризация химической связи
Поляризация химической связи — асимметрия (смещение) электронной плотности, связывающей молекулярной орбитали ковалентной связи.
Если атомы, образующие ковалентную связь, одинаковы и несут одинаковые или близкие по электроотрицательности заместители, распределение электронной плоскости симметрично относительно плоскости, перпендикулярной связи и пересекающей связь на равных расстояниях от атомов; такие связи называют неполярными.
В случае, когда атомы, образующие ковалентную связь различны (C-F, O-H) или несут различные заместители (H3C-CN, H3CC-CF3), электронная плотность смещается в сторону более электроотрицательного атома; такие связи называются поляризованными (полярная связь).
Полярная связь — химическая связь, обладающая постоянным электрическим дипольным моментом вследствие несовпадения центров тяжести отрицательного заряда электронов и положительного заряда ядер. Большинство ковалентных, а также донорно-акцепторные связи являются полярными. Молекулы с полярной связью обычно гораздо более реакционноспособны, чем неполярные молекулы. Полярность связи не следует отождествлять с полярностью молекул, которая зависит также от геометрического расположения атомов в молекуле. Поляризация связей вносит существенный вклад в электрический дипольный момент молекулы.
Дипольный момент поляризованной связи может вызывать поляризацию соседних связей в молекуле (индуктивный или I-эффект), однако такой эффект быстро слабеет по цепи σ-связей. В случае наличия в молекуле системы сопряженных π-связей возможно сильное влияние мезомерного или M-эффекта делокализации электронов на поляризацию связи — вплоть до обращения поляризации. В качестве иллюстрации такого влияния можно привести распределение электронной плотности в молекулах пирролидина и пиррола: если в первом случае дипольный момент составляет 1.6 D и направлен к более электроотрицательному атому азота, то во втором — 1.8 D и направлен от азота к циклу (см. Рис.).
См. также
Полезное
Смотреть что такое «Поляризация химической связи» в других словарях:
Поляризация — (франц. polarisation, первоисточник: греч. pólos ось, полюс) процессы и состояния, связанные с разделением каких либо объектов, преимущественно в пространстве. Поляризация вакуума Поляризация волн Поляризация электромагнитных волн… … Википедия
поляризация диэлектриков — 1) смещение электрических зарядов в диэлектрике под действием приложенного электрического поля. Может осуществляться благодаря сдвигу ионов относительно друг друга, деформации электронных оболочек отдельных атомов, молекул, ионов либо ориентации… … Энциклопедический словарь
Ковалентные связи — Ковалентная связь на примере молекулы метана: законченный внешний энергетический уровень у водорода (H) 2 электрона, а у углерода (C) 8 электронов. Ковалентная связь связь, образованная направленными валентными электронными облаками. Нейтральные… … Википедия
Поляризации — Поляризация (франц. polarisation, первоисточник: греч. pólos ось, полюс) процессы и состояния, связанные с разделением каких либо объектов, преимущественно в пространстве. Поляризация вакуума Поляризация волн Поляризация диэлектриков Поляризация… … Википедия
Ковалентная связь — Рис.1. Модель одинарной ковалентной связи (электронная плотность выделена красным цветом) Ковалентная связь (атомная связь, гомеополярная связь) химическая связь, образованная перекрытием (обобществлением) пары … Википедия
Ковалентная химическая связь — Ковалентная связь на примере молекулы метана: законченный внешний энергетический уровень у водорода (H) 2 электрона, а у углерода (C) 8 электронов. Ковалентная связь связь, образованная направленными валентными электронными облаками. Нейтральные… … Википедия
Бинарные соединения — Бинарные соединения химические вещества, образованные, как правило, двумя химическими элементами. Термин «бинарные соединения» обычно не применяется в отношении основных и кислотных оксидов. При этом несолеобразующие оксиды включают в… … Википедия
Ионная связь — В этой статье не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете … Википедия
Атом — (от греч. atomos неделимый) частица вещества микроскопических размеров и очень малой массы (микрочастица), наименьшая часть химического элемента, являющаяся носителем его свойств. Каждому элементу соответствует определённый род А.,… … Большая советская энциклопедия
Химия — I Химия I. Предмет и структура химии Химия одна из отраслей естествознания, предметом изучения которой являются химические элементы (Атомы), образуемые ими простые и сложные вещества (молекулы (См. Молекула)), их превращения и… … Большая советская энциклопедия
ПОЛЯРИЗАЦИЯ
ПОЛЯРИЗАЦИЯ в электрохимии, отклонение значения электродного потенциала от равновесного при пропускании электрич. тока. Величина поляризации зависит от плотности тока i, т.е. силы тока, отнесенной к единице пов-сти электрода, и обычно тем больше, чем больше i. При одном и том же значении i поляризация зависит от природы электрода и типа протекающей на его пов-сти р-ции, состава р-ра, т-ры и др. факторов и может колебаться от долей мВ до неск. В. Знак поляризации зависит от направления протекания тока и при изменении направления меняется на обратный.
Если электродный процесс осложнен хим. р-цией, к-рая предшествует электрохим. стадии или следует за ней, то поляризация может быть обусловлена конечной скоростью этой р-ции (хим. стадии). При зарождении новой фазы на пов-сти электрода возникновение поляризации связано со стадиями образования двухмерных или трехмерных зародышей, поверхностной диффузией адсорбир. атомов или ионов, встраиванием их в кристаллич. решетку и т.п.
П оляризация приводит к бесполезной трате электрич. энергии, т.к. снижает полезное напряжение химического источника тока и повышает напряжение, к-рое необходимо приложить к электролизеру при проведении электролиза. Однако в не-к-рых случаях благодаря поляризации исключается возможность протекания нежелат. побочных процессов. Так, из-за поляризации, затрудняющей электролитич. выделение Н 2 и O 2 из Н 2 О, можно в водных р-рах достичь эдс источников тока 2,0-2,2 В, что существенно превышает термодинамически равновесное значение 1,23 В.
Лит.: Дамаскин Б. Б., Петрий О. А., Введение в электрохимическую кинетику, 2 изд., М., 1983; их же, Электрохимия, М., 1987. О. А. Петрий.
Поляризуемость
Вы будете перенаправлены на Автор24
Процесс поляризации
Поляризующее действие катиона. Зависит от электронной структуры иона, величины заряда и радиуса. Поляризующее действие будет тем значительнее, чем меньше радиус, главное квантовое число внешних электронных орбиталей и больше величина заряда.
Например: сильное поляризующее действие характерно катионам первых рядов Периодической системы.
Поляризуемость анионов. Зависит от тех же факторов, что и поляризующее действие катионов. Чем больше у аниона радиус и заряд, тем сильнее он поляризуется.
Поляризующее действие катиона заключается в оттягивании на себя электронного облака от аниона. В результате степень ковалентности увеличивается, ионность связи уменьшается, то есть связь становится ковалентной полярной.
Поляризация ионов по своему эффекту противоположна поляризации ковалентной связи.
Поляризуемость и ее свойства
Поляризуемость характеризует способность молекулы становиться полярной в результате действия внешнего электрического поля. Соединение поляризуется также при действии молекул друг на друга, например, во время химических реакций.
Результатом поляризации может стать полный разрыв связи. При этом осуществляется переход связывающей электронной пары к одному из атомов и образуются разноименные ионы. Ассиметричный разрыв связи с образованием таких ионов называется гетеролитическим:
Готовые работы на аналогичную тему
Поляризуемость может быть вызвана:
смещением электронов или атомных ядер под действием электрического поля;
изменением геометрии молекулы;
смещением иона в соседнюю свободную кристаллографическую позицию (поляризуемость Сканави) и др.
Поляризуемость ионов зависит от электронной структуры иона, его заряда и размера. В каждой подгруппе периодической системы поляризуемость ионов элементов растет с увеличением их порядкового номера.
Поляризующее действие ионов тем значительнее, чем:
устойчивее электронная оболочка иона;
меньше радиус иона.
при увеличении размеров молекулы (атома);
с возрастанием атомного номера;
увеличении легкости возбуждения атома.
Поляризуемость влияет на:
кислотность и основность молекул в газовой фазе;
жесткость кислот и оснований Льюиса;
Расчет поляризуемости молекул
Индуцированный дипольный момент является пропорциональным напряженности внешнего электрического поля:
$\mu_ <инд>= \alpha \cdot \varepsilon_0 \cdot Е$,
Для ионов поляризуемость пропорциональна кубу их радиуса.
В электрическом поле у полярной молекулы с постоянным дипольным моментом появляется еще индуцированный дипольный момент. Тогда учитывается суммарная относительная диэлектрическая проницаемость. Это выражается уравнением Дебая:
При очень высоких температурах диполь вращается так быстро, что его величина обнуляется и остается только индуцированный диполь. Он располагается в направлении индуцирующего его поля и может сохраняться при самых высоких температурах.
Влияние поляризации на свойства веществ.
Поляризуемость может объяснить некоторые особенности свойств веществ:
Температура плавления. Взаимная поляризация ионов способствует разрушению кристаллов. При этом понижается температура плавления, и тем больше, чем сильнее деформируется кристаллическая решетка.
Поляризация химической связи
Если атомы, образующие ковалентную связь, одинаковы и несут одинаковые или близкие по электроотрицательности заместители, распределение электронной плоскости симметрично относительно плоскости, перпендикулярной связи и пересекающей связь на равных расстояниях от атомов; такие связи называют неполярными.
В случае, когда атомы, образующие ковалентную связь различны (C-F, O-H) или несут различные заместители (H3C-CN, H3CC-CF3), электронная плотность смещается в сторону более электроотрицательного атома; такие связи называются поляризованными (полярная связь).
Полярная связь — химическая связь, обладающая постоянным электрическим дипольным моментом вследствие несовпадения центров тяжести отрицательного заряда электронов и положительного заряда ядер. Большинство ковалентных связей являются полярными. Молекулы с полярной связью обычно гораздо более реакционноспособны, чем неполярные молекулы. Полярность связи не следует отождествлять с полярностью молекул, которая зависит также от геометрического расположения атомов в молекуле. Поляризация связей вносит существенный вклад в электрический дипольный момент молекулы.
Дипольный момент поляризованной связи может вызывать поляризацию соседних связей в молекуле (индуктивный или I-эффект), однако такой эффект быстро слабеет по цепи σ-связей. В случае наличия в молекуле системы сопряженных π-связей возможно сильное влияние мезомерного или M-эффекта делокализации электронов на поляризацию связи — вплоть до обращения поляризации. В качестве иллюстрации такого влияния можно привести распределение электронной плотности в молекулах пирролидина и пиррола: если в первом случае дипольный момент составляет 1.6 D и направлен к более электроотрицательному атому азота, то во втором — 1.8 D и направлен от азота к циклу (см. Рис.).
Поляризация химической связи
Из Википедии — свободной энциклопедии
Поляризация химической связи — асимметрия (смещение) электронной плотности, связывающей молекулярной орбитали ковалентной связи.
Если атомы, образующие ковалентную связь, одинаковы и несут одинаковые или близкие по электроотрицательности заместители, распределение электронной плоскости симметрично относительно плоскости, перпендикулярной связи и пересекающей связь на равных расстояниях от атомов; такие связи называют неполярными.
В случае, когда атомы, образующие ковалентную связь различны (C-F, O-H) или несут различные заместители (H3C-CN, H3CC-CF3), электронная плотность смещается в сторону более электроотрицательного атома; такие связи называются поляризованными (полярная связь).
Полярная связь — химическая связь, обладающая постоянным электрическим дипольным моментом вследствие несовпадения центров тяжести отрицательного заряда электронов и положительного заряда ядер. Большинство ковалентных связей являются полярными. Молекулы с полярной связью обычно гораздо более реакционноспособны, чем неполярные молекулы. Полярность связи не следует отождествлять с полярностью молекул, которая зависит также от геометрического расположения атомов в молекуле. Поляризация связей вносит существенный вклад в электрический дипольный момент молекулы.
Дипольный момент поляризованной связи может вызывать поляризацию соседних связей в молекуле (индуктивный или I-эффект), однако такой эффект быстро слабеет по цепи σ-связей. В случае наличия в молекуле системы сопряженных π-связей возможно сильное влияние мезомерного или M-эффекта делокализации электронов на поляризацию связи — вплоть до обращения поляризации. В качестве иллюстрации такого влияния можно привести распределение электронной плотности в молекулах пирролидина и пиррола: если в первом случае дипольный момент составляет 1.6 D и направлен к более электроотрицательному атому азота, то во втором — 1.8 D и направлен от азота к циклу (см. Рис.).