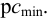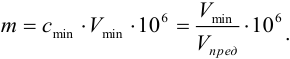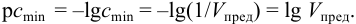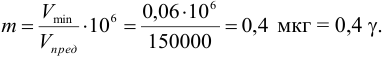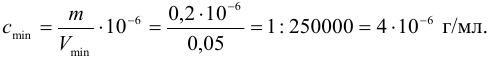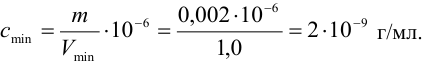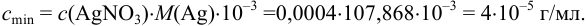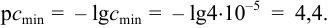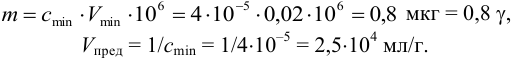Что такое предельная чувствительность реакции
Чувствительность аналитических реакций с примерами решения
Чувствительность аналитических реакций
Аналитическими реакциями, пригодными для качественного анализа, являются реакции, сопровождающиеся каким-нибудь внешним эффектом: выпадением и растворением осадка, выделением газообразных веществ, изменением окраски. Выбирая реакции для химического анализа, руководствуются законом действующих масс и представлениями о химическом равновесии в растворах. Для успешного проведения аналитической реакции необходимо соблюдать ряд тех или иных условий, обеспечивающих получение достоверных результатов. Такими условиями являются pH раствора, температура, маскирование или удаление мешающих ионов. Однако даже при соблюдении всех этих условий аналитическая реакция может не дать положительного эффекта, если недостаточна концентрация обнаруживаемого иона в растворе. С концентрацией обнаруживаемого иона в растворе связано понятие «чувствительность» аналитической реакции.
Чувствительность аналитических реакций характеризуется пределом обнаружения 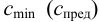
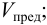
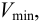
Предел обнаружения 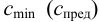
Предел обнаружения m (мкг) — открываемый минимум; это наименьшая масса определяемого компонента, с заданной доверительной вероятностью обнаруживаемая данной аналитической реакцией в минимальном объеме предельно разбавленного раствора.
Предельное разбавление, 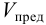
Минимальный объем предельно разбавленного раствора, 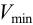
Эти характеристики чувствительности связаны между собой соотношением:
В качественном анализе обычно используют реакции с 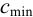
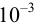
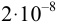
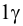
Показатель чувствительности, 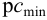
В количественном химическом анализе показателем чувствительности является нижняя граница определяемых содержаний 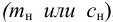
Пример 1.6.
Предельное разбавление ионов 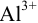
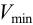
Решение:
По формуле (1.1) находим:
Пример 1.7.
Для обнаружения ионов меди действием раствора аммиака 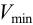
Решение:
С учетом формулы (1.1) рассчитываем 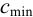
Пример 1.8.
Предельно допустимая концентрация (ПДК) иона аммония в питьевой воде 2,0 мг/л. Предел обнаружения его по реакции с реактивом Несслера составляет 0,002 мкг. Проверьте расчетами возможность обнаружения иона аммония в 1,0 мл воды при содержании, равном ПДК.
Решение:
Рассчитаем минимальную концентрацию иона аммония в растворе, при которой реакция с реактивом Несслера дает положительный эффект:
Сравнивая полученное значение 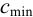
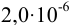
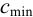
Пример 1.9.
Катионы серебра 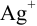
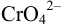
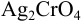
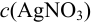
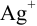
Решение:
Найдем 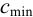
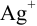
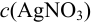
Вычислим показатель чувствительности:
Используя формулу (1.1), найдем 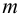
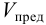
Эти примеры взяты со страницы примеров решения задач по аналитической химии:
Возможны вам будут полезны эти страницы:
Образовательный сайт для студентов и школьников
Копирование материалов сайта возможно только с указанием активной ссылки «www.lfirmal.com» в качестве источника.
© Фирмаль Людмила Анатольевна — официальный сайт преподавателя математического факультета Дальневосточного государственного физико-технического института
Характеристики чувствительности аналитических реакций
Аналитические реагенты и аналитические реакции позволяют обнаруживать определяемое вещество в анализируемом растворе только тогда, когда это вещество содержится в растворе при достаточной концентрации, превышающей некоторый минимальный предел. Если концентрация определяемого вещества ниже этого предела, то и концентрация продуктов аналитической реакции окажется настолько незначительной, что их невозможно будет определить. Указанный минимальный концентрационный предел неодинаков для разных аналитических реакций, что обусловливаетих чувствительность.
Чувствительность аналитических реакций определяет возможность обнаружения вещества (ионов, молекул) в растворе. Она характеризуется предельным разбавлением Vlim, предельной концентрацией Clim(cmin), минимальным объемом предельно разбавленного раствора Vmin, пределом обнаружения (открываемым минимумом) m, показателем чувствительности p сmin.
Предельное разбавлениеVlim– максимальный объем раствора, в котором может быть однозначно (больше чем в 50% опытов) обнаружен один грамм данного вещества при помощи данной аналитической реакции. Предельное разбавление выражается в мл/г.
Так, например, при реакции ионов меди Сu 2+ с аммиаком в водном растворе
Предельная концентрацияClim(или сmin) – наименьшая концентрация, при которой определяемое вещество может быть обнаружено в растворе данной аналитической реакцией. Предельная концентрация выражается в г/мл.
Предельная концентрация и предельное разбавление связаны соотношением
Иногда (особенно в старой литературе) предельную концентрацию называют чувствительностью реакции и выражают в мкг/мл.
Так, например, ионы калия K + в водном растворе открывают аналитической реакцией с гексанитрокобальтатом(Ш) натрия Nа3[Со(N03)б]
Минимальный объем предельно разбавленного раствора Vmin – наименьший объем анализируемого раствора, необходимый для обнаружения открываемого вещества данной аналитической реакцией. Выражается в мл.
Так, минимальный объем предельно разбавленного раствора при открытии ионов меди(П) в виде аммиачного комплекса (см. реакцию, приведенную выше) равен
Vmin = 0,05 мл при clim = 4-10 –6 г/мл. Это означает, что в объеме предельно разбавленного раствора, меньшем 0,05 мл, нельзя открыть ионы Сu 2+ реакцией с аммиаком.
Предел обнаружения (открываемый минимум) m (в мкг) – наименьшая масса определяемого вещества, однозначно открываемого данной аналитической реакцией в минимальном объеме предельно разбавленного раствора. Выражается в мкг (1 мкг = 10 –6 г), иногда обозначаемых греческой буквой γ (гамма): 1 мкг = 1 γ.
Нетрудно видеть, что
m = clim • Vmin • 10 6 = Vmin •10 6 /Vlim
Так, предел обнаружения (открываемый минимум) ионов меди(П) в виде аммиачного комплекса [Cu(NH3)4] 2+ при предельной концентрации ионов меди Clim = 4-10 –6 г/мл и минимальном объеме предельно разбавленного раствора Vmin = 0,05 мл равен:
m = clim • Vmin • 10 6 = 4 • 10 –6 • 0,05 • 10 6 = 0,2 мкг = 0,2 γ
Это означает, что если масса ионов меди(П), содержащаяся в 0,05 мл предельно разбавленного раствора при концентрации 4-10 –6 г/мл, меньше 0,2 мкг, то невозможно открыть эти ионы указанной аналитической реакцией.
Показатель чувствительности аналитической реакции определяется как
Аналитическая реакциятем чувствительнее, чем меньше ее открываемый минимум, минимальный объем предельно разбавленного раствора и чем больше предельное разбавление. Чувствительность аналитической реакции зависит от природы открываемого вещества и аналитического реагента, температуры, рН среды, присутствия других (особенно – мешающих) веществ.
Необходимо заметить, что в отечественной Государственной Фармакопее чувствительность фармакопейных аналитических реакций обычно характеризуют, указывая предельную чувствительность реакции (в мг или мкг) в 1 мл раствора, т.е. приводя, в сущности, значение clim (cmin) в мг/мл или в мкг/мл. Так, например, чувствительность открытия катионов кальция Са 2+ реакцией с оксалатом аммония
характеризуется фразой: «Предельная чувствительность реакции 0,0035 мг (3,5 мкг) кальций-иона в 1 мл раствора». Это означает, что clim = 3,5 мкг/мл = 3,5.10 –6 г/мл,
Vlim = 1/clim = 1/(3,5.10 –6 ) = 2,9.10 5 мл/г.
Дата добавления: 2016-01-09 ; просмотров: 9606 ; ЗАКАЗАТЬ НАПИСАНИЕ РАБОТЫ
ХАРАКТЕРИСТИКА АНАЛИТИЧЕСКИХ РЕАКЦИЙ
Качественный химический анализ большей частью основан на реакциях, которые сопровождаются каким-либо характерным внешним эффектом. При этом не имеет большого значения количественная сторона химического процесса и стехиометрическое соотношение элементов, входящих в состав образующихся соединений. Существенными являются две характеристики химических реакций: чувствительность и избирательность.
Чувствительность реакций
Чувствительность реакции выражается двумя взаимно связанными величинами: чувствительностью определения (минимальная концентрация, или предельное разбавление) и абсолютной чувствительностью (открываемый минимум):
где m — открываемый минимум, мкг, с — минимальная концентрация, т. е. та наименьшая концентрация, которую еще удается обнаружить данным методом, мкг/мл, мкг/г, % и т. п.; V—объем пробы, мл; g — масса пробы, г.
Предельное разбавление характеризуется отношением одной весовой части обнаруживаемого иона или вещества к числу весовых частей анализируемого вещества (основы) или указывается как отношение числа весовых частей обнаруживаемого иона или вещества к 106 весовых частей анализируемого вещества (млн-1, международное обозначение, ррт.). Чувствительность выражается также в %
Значения тис могут изменяться в широких пределах в зависимости от условий реакции. Чувствительность реакции может быть повышена изменением концентрации реагентов, рН среды, порядка смешивания реагентов, экстракцией, флотацией, соосаждением, образованием смешанных соединений, а также путем использования различных методов проведения реакций (капельный анализ, пирохимический анализ и др.) и способов наблюдения продуктов реакции (в обычном световом или электронном микроскопе, в потоке ультрафиолетового света и т. д.). Ниже приведены границы чувствительности различных методов качественного анализа (в %):
Качественный анализ. Понятия, чувствительность реакции
» data-shape=»round» data-use-links data-color-scheme=»normal» data-direction=»horizontal» data-services=»messenger,vkontakte,facebook,odnoklassniki,telegram,twitter,viber,whatsapp,moimir,lj,blogger»>
Качественный анализ
1. Основные понятия качественного анализа
Несмотря на возросшую роль теоретических и инструментальных аспектов в курсе химии, изучение химических свойств по-прежнему составляет неотъемлемую основу любого химического образования. Важную роль в изучении свойств веществ играет курс качественного неорганического анализа. В настоящее время качественный анализ рассматривается не столько как часть аналитической химии, сколько как введение в общую химию.
Качественный анализ заключается в обнаружении отдельных элементов (или ионов), из которых состоит анализируемое вещество.
Исследуя какое-нибудь новое соединение, прежде всего, определяют из каких элементов (или ионов), оно состоит, а затем уже количественные отношения, в которых они содержатся. Поэтому качественный анализ вещества, как правило, предшествует количественному.
2. Аналитические реакции и способы их выполнения
Анализируемые вещества могут находиться в различных агрегатных состояниях (твердом, жидком и газообразном). Соответственно этому и качественные аналитические реакции могут быть выполнены „сухим” или „мокрым” путем.
Анализ сухим путем осуществляют с помощью таких приемов, как проба на окрашивание пламени, получение цветных стекол („перлов”) и рассмотрение металлических “корольков”. Эти приемы называют пирохимическими (от греч. „пир” – огонь).
Окрашенные стекла, или перлы, приготовляют сплавлением исследуемого вещества с бурой Na2B407•10H2O (или с гидрофосфатом натрия-аммония NaNH4HPO4•4Н2О) в ушке платиновой проволочки над пламенем. Окраска перла указывает на присутствие того или иного металла. Например, хром окрашивает перл буры в зеленый цвет, кобальт – в синий, марганец – в фиолетовый.
Металлические корольки получаются при прокаливании анализируемых минералов на древесном угле с помощью паяльной трубки. По внешнему виду их также можно судить о составе испытуемого материала.
Анализ „сухим” путем используют главным образом в полевых условиях для качественного или полуколичественного исследования минералов и руд.
В лабораторных условиях обычно применяют анализ „мокрым” путем, который основан на реакциях в растворах. Естественно, что при этом исследуемое вещество должно быть сначала переведено в раствор. Если оно не растворяется в дистиллированной воде, то используют уксусную, соляную, азотную и другие кислоты. Химически взаимодействуя с кислотами, анализируемое вещество (соль, гидроксид или оксид) превращается в легко растворимое соединение:
В полученном растворе обнаруживают те или иные ионы.
Не все химические реакции пригодны для качественного анализа. Аналитическими являются только те реакции, которые сопровождаются каким-нибудь внешним эффектом, позволяющим установить, что химический процесс происходит: выпадением или растворением осадка, изменением окраски анализируемого раствора, выделением газообразных веществ.
Кислотно-основные реакции
Выделение свободной уксусной кислоты (обозначение г. — газ) при добавлении сильной кислоты (например, соляной или серной) используется для обнаружения ацетат-ионов. Партнером ацетат-иона в этой реакции является ион водорода, существующий в воде и гидратированной форме, формулу которой записывают обычно как Н3О + (правильнее было бы записывать (H2O)4H + или H9O4 + ). Аналогичным образом (по выделению свободного аммиака при действии сильных щелочей, например гидроксида натрия) можно обнаружить и ион аммония:
Реакции комплексообразования
Растворение малорастворимого хлорида серебра (см. ниже, «реакции осаждения») при действии аммиака происходит вследствие образования диаминного комплекса серебра.
В гидратированном ионе Cu 2+ происходит обмен молекул воды на молекулы аммиака с образованием интенсивно окрашенного синего аммиаката меди. Используются также реакции комплексообразования с органическими реагентами 8-оксихинолином, ализарином S и др.
Реакции осаждения
Ионы Ag + (или Сl – ) осаждаются в виде малорастворимого хлорида серебра (о его растворении см. выше).
Ионы Ba 2+ (или SO4 2- ) осаждаются в виде малорастворимого сульфата бария.
Реакции полимеризации
Многие вещества в водных растворах способны образовывать димеры или полимеры линейного или циклического строения. Простейшим примером может служить димеризация хромат-иона с образованием бихромат-иона, сопровождающаяся изменением желтой окраски на оранжевую:
Еще одной важной в аналитическом отношении реакцией является взаимодействие ионов двух различных типов с образованием смешанного полимерного соединения, так называемого гетерополисоединения. Примером может служить взаимодействие молибдат- и фосфат-ионов:
Эта реакция применяется для обнаружения фосфат-иона по образованию желтого осадка гетерополисоединения.
Окислительно-восстановительные реакции
Эти реакции связаны с переносом электронов и могут протекать в различных формах.
1. Простой обмен электронами:
Ce 4+ + Fe 2+ ↔ Ce 3+ + Fe 3+
2. Гетерогенные реакции между ионами в растворе и твердыми веществами:
Cu 2+ + Fe (тв.) ↔ Cu(тв.) + Fe 2+
3. Реакции диспропорционирования:
4. Реакции компропорционирования (синпропорционирования):
Реакции с выделением газов
Для обнаружения ионов часто используют реакции с выделением газов (например, см. приведенные выше кислотно-основные реакции). Выделяющийся газ затем обычно вступает в другую реакцию, которая, собственно, и используется для обнаружения. Например, для обнаружения карбонат-ионов используют выделе- ние диоксида углерода при действии кислот. Выделяющийся газ можно затем обнаружить при помощи реакции образования малорастворимого карбоната бария:
В аналитическом отношении важное значение имеет также реакция диоксида кремния и плавиковой кислоты (HF), сопровождающаяся образованием летучих соединений кремния с фтором:
В зависимости от количества плавиковой кислоты образуется либо тетрафторид кремния, либо летучая кремнефтороводородная кислота. Чтобы равновесия указанных реакций сместить вправо, необходимо связать выделяющуюся воду путем добавления концентрированной серной кислоты. Смещение этих равновесий в обратном направлении можно использовать для обнаружения выделившихся газов по выпадению осадка диоксида кремния.
С точки зрения наблюдаемых эффектов все реакции обнаружения можно разделить на четыре группы:
3. Качественные реакции как реакции между ионами
В качественном анализе имеют дело преимущественно с водными растворами электролитов, т. е. солей, оснований и кислот, диссоциирующих на ионы. Можно сказать, что каждый ион обладает определенными свойствами, которые он сохраняет независимо от присутствия в растворе других ионов. Например, катион водорода, присутствующий в водном растворе любой кислоты, независимо от ее аниона окрашивает синий лакмус в красный цвет и проявляет другие, характерные для него свойства.
Поскольку сильные электролиты практически полностью ионизированы, при смешении растворов в реакцию могут вступать только ионы. Проиллюстрируем это положение несколькими примерами взаимодействия веществ, дающих при диссоциации ионы Ва 2+ и SО4 2- :
Продуктом всех этих реакций является белый мелкокристаллический осадок сульфата бария, не растворимый в кислотах и щелочах.
Получение одного и того же продукта при взаимодействии трех пар различных соединений легко объясняется ионной теорией. Ведь сущность приведенных трех реакций может быть выражена следующим ионным уравнением:
Таким образом, реакции, происходящие в растворах между электролитами, это реакции между ионами. Поэтому аналитическими реакциями обнаруживают не химические вещества, а образуемые ими катионы и анионы.
4. Условия выполнения аналитических реакций, их чувствительность, специфичность и селективность
Выполняя аналитическую реакцию, нужно строго соблюдать определенные условия, которые зависят от свойств получающегося продукта. При несоблюдении этих условий результат не может считаться достоверным.
Одним из условий выполнения реакций является среда анализируемого раствора. Например, нельзя обнаруживать ион Са 2+ действием оксалата аммония (NH4)2C2O4 в присутствии сильной кислоты, так как оксалат кальция СаС2О4 растворим в сильных кислотах. Осадок хлорида серебра AgCl, растворимого в аммиаке NH4OH, не может быть получен в аммиачной среде. Если осадок какого-либо вещества выпадает только в нейтральной среде, то анализируемый раствор предварительно нейтрализуют кислотой или щелочью. Например, осадок гидротартрата калия KHC4H406 может быть получен только в нейтральной среде.
Другим условием выполнения реакций является поддержание необходимой температуры раствора. Большинство аналитических реакций выполняют „на холоду”, т. е. при комнатной температуре или даже при охлаждении пробирки водой под краном. Это необходимо, например, при осаждении гексагидроксостибиата (V) натрия Na[Sb(ОН)6] или гидротартрата калия. Некоторые реакции требуют нагревания до определенной температуры. Так, обнаружение иона NH4 + действием щелочи на исследуемый раствор выполняют при нагревании.
Не менее важна достаточно высокая концентрация обнаруживаемого иона в растворе. Если образующееся соединение малорастворимо и выпадает в осадок при очень небольшой концентрации открываемого иона, то говорят, что реакция высокочувствительна. Если же образующееся соединение заметно растворимо в воде, то реакцию считают малочувствительной. Такие реакции удаются лишь при сравнительно высокой концентрации обнаруживаемого иона в анализируемом растворе (или при образовании в растворе окрашенного соединения).
Чувствительность реакций характеризуют количественно при помощи двух величин – обнаруживаемого минимума и минимальной концентрации.
Обнаруживаемый минимум – это наименьшее количество иона, которое удается обнаружить с помощью данной реакции (при соблюдении необходимых условий).
Минимальная концентрация показывает, при каком разбавлении раствора реакция еще дает положительный результат.
При обнаружении иона К + в виде гексахлороплатината (IV) калия минимальная концентрация выражается отношением 1:10 000. Следовательно, катион К + можно обнаружить, если на 1 г его в растворе приходится не более 10 000 мл воды.
Чувствительность реакций на катионы меди (II)
| Реагент | Образующееся соединение | Эффект реакции | Обнаруживаемый минимум, мкг | Минимальная концентрация |
| НС1 | Н[СuСl3] | 3еленое окраши- вание раствора | 1 | 1:50 000 |
| NН3 | [Сu(NН3)4]Cl2 | Синее окрашивание раствора | 0,2 | 1:250 000 |
| К4[Fe(CN)6] | Cu2[Fe(CN)6] | Коричневый осадок | 0,02 | 1:2 500 000 |
Из приведенных данных видно, что чувствительность реакции с гексациано-ферратом (II) калия в 10 раз выше, чем реакции с аммиаком, и в 50 раз выше, чем с соляной кислотой.
В качественном анализе применяют только те реакции, обнаруживаемый минимум которых не превышает 50 мкг, а минимальная концентрация ниже, чем 1:1000.
Чувствительность реакций сильно зависит от условий их выполнения: концентрации реактивов, продолжительности их действия, способа наблюдения внешнего эффекта, температуры, присутствия посторонних веществ и т.д
Помимо чувствительности, большое значение для анализа имеет специфичность реакции.
Специфической называют такую реакцию, которая позволяет обнаружить ион в присутствии любых других ионов.
Например, специфична реакция обнаружения иона NH4 + действием щелочи при нагревании, так как в этих условиях аммиак NH3 может выделяться только из солей аммония:
Специфична и широко известная реакция на иод с крахмалом. Однако специфических реакций сравнительно немного.
Чтобы устранить влияние посторонних ионов, иногда пользуются так называемыми маскирующими средствами, которые переводят мешающие ионы в малодиссоциирующие или комплексные соединения. Концентрация посторонних ионов в растворе сильно понижается и помехи устраняются.
5. Методы повышения чувствительности реакций
Чувствительность реакции зависит от многих факторов и может быть повышена, если тем или иным способом увеличить концентрацию обнаруживаемого иона в растворе.
Обогатить раствор обнаруживаемым ионом и, следовательно, повысить чувствительность реакции можно с помощью ионного обмена, экстрагирования соединений органическими растворителями, путем соосаждения, а также некоторыми другими способами (дистилляция, электролиз, удаление примесей, мешающих выполнению реакции и т. п.).
Метод ионного обмена. Для концентрирования ионов этим методом в качественном анализе используют так называемые ионообменные смолы (иониты). Одни из них поглощают из раствора катионы и называются катионитами, другие сорбируют анионы и именуются анионитами.
Процесс ведут либо в статических условиях, внося зерна ионита в исследуемый раствор, либо в динамических, пропуская анализируемый раствор через “колонку” – трубку, наполненную ионитом. При этом каждое зерно ионита накапливает в себе обнаруживаемый ион.
Концентрирование ионов в статических условиях несложно. Переносят 2-3 мл испытуемого раствора в маленький фарфоровый тигель. Для поглощения катионов прибавляют 35-40 набухших зерен катионита (КУ-2, KУ-l или СБС) в виде двух капель суспензии, а для извлечения анионов – такое же количество зерен анионита (AB-l7, AB-16 или ЭДЭ-10П). Перемешивают содержимое тигля стеклянной палочкой 5 мин, сливают жидкость, а зерна ионита, адсорбировавшие обнаруживаемый ион, помещают в каплю реактива и наблюдают форму и цвет образовавшихся кристаллов.
Этот метод позволяет повысить чувствительность многих реакций в десятки и сотни раз.
Метод экстрагирования. Экстрагирование – это один из видов фазового разделения веществ. Оно основано на том, что некоторые органические растворители, не смешивающиеся с водой, обладают способностью извлекать из водных растворов отдельные компоненты смесей.
Для экстрагирования подбирают такой органический растворитель, в котором определяемое вещество растворяется хорошо, а другие компоненты смеси практически не растворяются.
Смесь двух жидкостей и растворенного вещества встряхивают, после чего оставляют стоять до появления резкой границы раздела между жидкостями. Из полученного экстракта определяемое вещество выделяют выпариванием, высушиванием, перегонкой или кристаллизацией.
Например, ионы железа (III) из солянокислых водных растворов чаще всего экстрагируют диэтиловым эфиром в виде железохлористоводородной кислоты Н[FeC14] желтого цвета. Это позволяет отделить железо от других элементов, не образующих хлоридных комплексов.
Метод соосаждения. Это один из наиболее простых и эффективных способов концентрирования ионов.
В раствор, содержащий следы определяемого иона, вводят посторонний катион (или анион), который и осаждают подходящим реактивом в виде малорастворимого соединения. При этом соосаждаются и следы определяемого иона. Таким образом, получающийся осадок играет роль коллектора, т. е. собирателя определяемых ионов. Установлено, что чем меньше концентрация определяемого иона в растворе, тем полнее он сорбируется коллектором.
Причины соосаждения определяемых ионов с коллекторами различны. К ним относятся адсорбция соосаждаемых ионов (или соединений) на поверхности коллектора, ионный обмен, образование твердых растворов.
Следует помнить, что несоблюдение оптимальных условий выполнения той или иной реакции (температура, рН раствора, количество реагента) ведет к понижению ее чувствительности.