Что такое реакция изомеризации
ИЗОМЕРИЗАЦИЯ
ИЗОМЕРИЗАЦИЯ – превращение одного изомера в другой (см. ИЗОМЕРИЯ). Изомеризация приводит к получению соединения с иным расположением атомов или групп, но при этом не происходит изменение состава и молекулярной массы соединения. В литературе изомеризацию часто называют перегруппировкой, в некоторых случаях, в соответствии с традицией, это именные реакции.
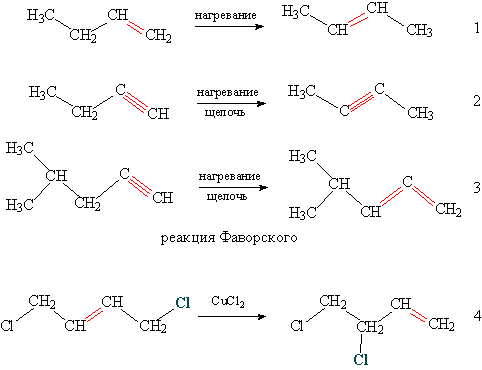
Наиболее известный катализатор перестройки углеводородного скелета – AlCl3, в присутствии этого катализатора осуществляют превращение линейных углеводородов в разветвленные (см. рис. 1, реакция 1), проводят перестройку циклических углеводородов (см. рис. 1, реакция 2), получают из полициклических соединений углеводородные каркасы (см. рис. 1, реакция 3). Этот же катализатор приводит к перемещению функциональных групп в молекуле (см. рис. 1, реакция 4)
Рис. 1. Изомеризация углеводородного скелета и перемещение функциональных групп
Изменение положения кратных связей проходит при нагревании, часто в присутствии щелочи (см. рис. 2, реакции 1, 2), возможно также перераспределение кратных связей, когда тройная связь переходит в две двойные связи – реакция Фаворского (см. рис. 2, реакция 3). У галогенированных ненасыщенных соединений происходит одновременное перемещение кратной связи и атома галогена (см. рис. 2, реакция 4).
Рис. 2. Перемещение кратных связей и атомов галогена
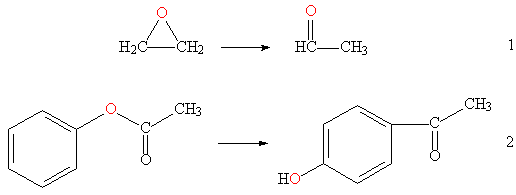
Изомеризация кислородсодержащих соединений часто приводят к изменению природы функциональной группы, например, превращение простой эфирной связи в альдегидную группу (см. рис. 3, реакция 1), или в гидроксильную (см. рис. 3, реакция 2).
Рис. 3. Изомеризация О-содержащих соединений.
Существуют примеры изомеризации N- и Р-содержащих соединений, проходящей обычно с участием атома кислорода. В подобных перестройках молекул помимо перемещения O, N и P-атомов происходит изменение положения некоторых атомов водорода или органических групп.
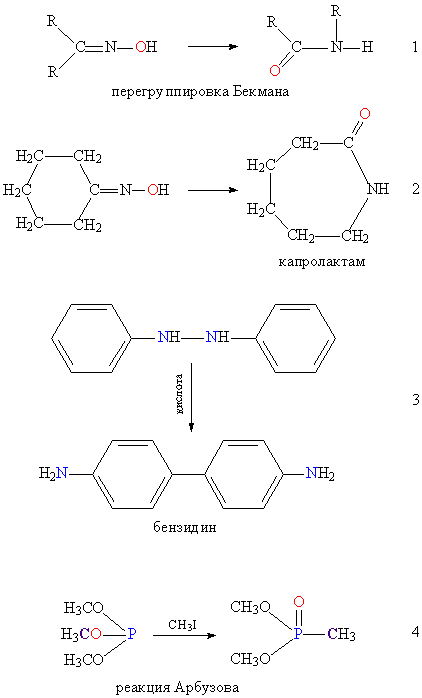
При перегруппировке Бекмана (см. рис. 4, реакция 1) гидроксильная группа превращается в карбонильную. Другой вариант перегруппировки Бекмана (см. рис. 4, реакция 2) сопровождается расширением цикла.
При бензидиновой перегруппировке происходит миграция атомов азота и водорода (см. рис. 4, реакция 3)
Реакция Арбузова превращает трехвалентный атом фосфора в пятивалентный, одновременно происходит образование Р-С – связи (см. рис. 4, реакция 4).
Рис. 4. Изомеризация O, N и Р-содержащих соединений
Изомеризация обычно идет в том направлении, которое приводит к соединению, более стабильному в условиях данного опыта. Некоторые изомеризационные процессы при изменении типа катализатора или условий опыта обратимы.
Изомеризацию оптических изомеров изучает специальный раздел химии – динамическая стереохимия (См. также ВАЛЬДЕНОВСОЕ ОБРАЩЕНИЕ.).
Применение изомеризации.
Переработка нефтяных продуктов (пиролиз, крекинг) обычно сопровождается изомеризацией линейных углеводородов в соединения с разветвленной цепью, которые имеют более высокое октановое число. Из продукта изомеризации хлорированного бутена (см. рис. 2, реакция 4) получают бензостойкий каучук хлоропрен.
Перегруппировку Бекмана применяют для промышленного синтеза капролактама (см. рис. 4, реакция 2), из которого получают поликапролактам (капрон). Бензидиновую перегруппировку (см. рис. 4, реакция 3) используют для получения соединений, применяемых в производстве азокрасителей. Реакция Арбузова (см. рис. 4, реакция 4) позволяет получать соединения со связью С-Р, на основе которых производят пестициды.
Реакции и методы исследования органических соединений. М., 1954
Олехнович Л.П. Многообразие строения и форм молекул органических соединений. Соросовский Образовательный Журнал. 1997, № 2
Что такое реакция изомеризации
Классификацию органических реакций проводят на основе общих для всех реакций признаков: строение и состав исходных и конечных продуктов; изменение степеней окисления реагирующих частиц; тепловой эффект реакции; ее обратимость и т.п.
Наиболее часто органические реакции классифицируют по следующим признакам:
· по конечному результату реакции (на основе сопоставления строения исходных и конечных продуктов);
· по минимальному числу частиц, участвующих в элементарной реакции;
· по механизму разрыва ковалентных связей в реагирующих молекулах.
Тип многостадийных реакций определяют по самой медленной (лимитирующей) стадии. Различные способы классификации часто сочетаются друг с другом.
1. Классификация реакций по конечному результату
В основе этой классификации лежит сопоставление числа, состава и строения исходных и конечных продуктов по уравнению реакции. В соответствии с конечным результатом различают следующие типы органических реакций:
Если процесс сопровождается изменением степени окисления атома углерода в органическом соединении, то выделяют также реакции окисления и восстановления. Окисление и восстановление органических веществ может проходить по какому-либо из названных выше типов реакций.
Атом или атомная группировка в молекуле органического соединения замещается на другой атом (или атомную группировку):
Реакции этого типа можно рассматривать как реакции обмена, но в органической химии предпочтительней термин «замещение», поскольку в обмене участвует (замещается) лишь меньшая часть органической молекулы.
C2H6 + Cl2 (на свету) → CH 3 CH 2 Cl + HCl хлорирование этана
CH 3 CH 2 Cl + KOH (водн. р-р) → CH 3 CH 2 OH + KCl щелочной гидролиз хлорэтана
В реакциях присоединения молекула органического соединения и молекула простого или сложного вещества соединяются в новую молекулу, при этом другие продукты реакции не образуются:
К реакциям присоединения относятся также реакции полимеризации:
В реакции отщепления (элиминирования) происходит отрыв атомов или атомных групп от молекулы исходного вещества при сохранении ее углеродного скелета.
· отщепление хлороводорода (при действии на хлоралкан спиртовым раствором щёлочи)
· отщепление воды (при нагревании спирта с серной кислотой)
CH3-CH2OH → CH 2 =CH 2 + H 2 O дегидратация этанола
· отщепление водорода от алкана (в присутствии катализатора)
Реакции изомеризации или перегруппировки
В органическом соединении происходит переход (миграция) отдельных атомов или групп атомов от одного участка молекулы к другому без изменения ее качественного и количественного состава:
В этом случае исходное вещество и продукт реакции являются изомерами (структурными или пространственными).
Например, в результате перегруппировки может изменяться углеродный скелет молекулы:
В результате реакции разложения из молекулы сложного органического вещества образуется несколько менее сложных или простых веществ:
К этому типу реакций относится процесс крекинга – расщепление углеродного скелета крупных молекул при нагревании и в присутствии катализаторов:
Реакции разложения при высокой температуре называют пиролизом, например:
СН4 → C + 2H2 пиролиз метана (1000 o C)
Реакции окисления и восстановления
Если атом углерода в органической молекуле окисляется (отдает электроны более электроотрицательному атому), то этот процесс относят к реакциям окисления, т.к. продукт восстановления окислителя (обычно неорганическое вещество) не является конечной целью данной реакции. И наоборот, реакцией восстановления считают процесс восстановления атома углерода в органическом веществе.
Часто в органической химии ограничиваются рассмотрением реакций окисления и восстановления как реакций, связанных с потерей и приобретением атомов водорода и кислорода.
Вещество окисляется, если оно теряет атомы H и (или) приобретает атомы O. Кислородсодержащий окислитель обозначают символом [O]:
Вещество восстанавливается, если оно приобретает атомы H и (или) теряет атомы O. Восстановитель обозначают символом [H]:
Классификация реакций по числу частиц, участвующих в элементарной стадии
По этому признаку все реакции можно разделить на диссоциативные (мономолекулярные) и ассоциативные (бимолекулярные, тримолекулярные).
· Мономолекулярные реакции – реакции, в которых участвует только одна молекула (частица):
К этому типу относятся реакции распада и изомеризации. Процессы электролитической диссоциации также соответствуют этому типу, например:
Это самый распространенный тип элементарных реакций.
· Тримолекулярные реакции – реакции типа
в которых происходит столкновение трех молекул.
Тримолекулярные реакции встречаются довольно редко. Одновременное соударение большего числа частиц маловероятно.
Классификация реакций по механизму разрыва связей
В зависимости от способа разрыва ковалентной связи в реагирующей молекуле органические реакции подразделяются нарадикальные и ионные реакции. Ионные реакции в свою очередь делятся по характеру реагента, действующего на молекулу, наэлектрофильные и нуклеофильные.
Разрыв ковалентной связи может происходить двумя способами, обратными механизмам ее образования.
Разрыв связи, при котором каждый атом получает по одному электрону из общей пары, называется гомолитическим:
В результате гомолитического разрыва образуются сходные по электронному строению частицы, каждая из которых имеет неспаренный электрон. Такие частицы называются свободными радикалами.
Если при разрыве связи общая электронная пара остается у одного атома, то такой разрыв называется гетеролитическим:
Электрофильной называется реакция, в которой молекула органического вещества подвергается действию электрофильного реагента.
Электрофильные («любящие электроны») реагенты или электрофилы – это частицы (катионы или молекулы), имеющие свободную орбиталь на внешнем электронном уровне.
CH2=CH2 + HCl → CH3CH2Cl (электрофил – H + в составе HCl)
Механизм электрофильного присоединения обозначается символом AdE (по первым буквам английских терминов: Ad – addition [присоединение], E – electrophile [электрофил]).
Катион NO2 + образуется в смеси конц. кислот HNO3 и H2SO4.
Обозначение механизма – SE (S – substitution [замещение]).
Нуклеофильной называется реакция, в которой молекула органического вещества подвергается действию нуклеофильного реагента.
Строение некоторых нуклеофильных реагентов
Благодаря подвижности π-электронов, нуклеофильными свойствами обладают также молекулы, содержащие π-связи:
(Между прочим, это объясняет, почему этилен CH2=CH2 и бензол C6H6, имея неполярные углерод-углеродные связи, вступают в ионные реакции с электрофильными реагентами).
Примеры нуклеофильных реакций
Механизм нуклеофильного замещения обозначается символом SN (по первым буквам английских терминов: S – substitution [замещение], N – nucleophile [нуклеофил]).
Обозначение механизма – AdN (Ad – addition [присоединение]).
Изомерия в органической химии
Изомеры – это вещества, имеющие одинаковый состав (число атомов каждого типа), но разное взаимное расположение атомов – разное строение.
Изомерия – это явление существования веществ с одинаковым составом, но различным строением.
Например, формуле C4H10 соответствуют два изомерных соединения н-бутан с линейным углеродным скелетом и изобутан (2-метилбутан) с разветвленным скелетом:
При этом температура кипения н-бутана –0,5 о С, а изобутана –11,4 о С.
Виды изомерии
Структурные изомеры отличаются друг от друга взаимным расположением атомов в молекуле; стереоизомеры — расположением атомов в пространстве.
Структурная изомерия
Структурные изомеры – соединения с одинаковым составом, но различным порядком связывания атомов, т.е. с различным химическим строением. Молекулярная формула у структурных изомеров одинаковая, а структурная различается.
1. Изомерия углеродного скелета: вещества различаются строением углеродной цепи, которая может быть линейная или разветвленная.
Например, молекулярной формуле С5Н12 соответствуют три изомера:
2. Изомерия положения обусловлена различным положением кратной связи, функциональной группы или заместителя при одинаковом углеродном скелете молекул.
2.2. Изомерия положения кратной связи может быть вызвана различным положением кратной (двойной или тройной) связи в непредельных соединениях. Например, в бутене-1 и бутене-2:
2.3. Межклассовая изомерия – ещё один вид структурной изомерии, когда вещества из разных классов веществ имеют одинаковую общую формулу.
Например, формуле С2Н6О соответствуют: спирт (этанол) и простой эфир (диметиловый эфир):
Пространственная изомерия
Пространственные изомеры – это вещества с одинаковым составом и химическим строением, но с разным пространственным расположением атомов в молекуле. Виды пространственной изомерии – геометрическая (цис—транс) и оптическая изомерия.
1. Геометрическая изомерия (или цис-транс-изомерия).
Геометрическая изомерия характерна для соединений, в которых различается положение заместителей относительно плоскости двойной связи или цикла. Например, для алкенов и циклоалканов.
Двойная связь не имеет свободного вращения вокруг своей оси.
Поэтому заместители у атомов углерода при двойной связи могут быть расположены либо по одну сторону от плоскости двойной связи (цис-изомер), либо по разные стороны от плоскости двойной связи (транс-изомер). При этом никаким вращением нельзя получить из цис-изомера транс-изомер, и наоборот.
Например, бутен-2 существует в виде цис— и транс-изомеров
1,2-Диметилпропан также образует цис-транс-изомеры:
Геометрические изомеры различаются по физическим свойствам (температура кипения и плавления, растворимость, дипольный момент и др.). Например, температура кипения цис-бутена-2 составляет 3,73 о С, а транс-бутена-2 0,88 о С.
При этом цис—транс-изомерия характерна для соединений, в которых каждый атом углерода при двойной связи С=С (или в цикле) имеет два различных заместителя.
Таким образом, для соединений вида СH2=СHR и СR2=СHR’ цис—транс-изомерия не характерна.
2. Оптическая изомерия
Оптические изомеры – это пространственные изомеры, молекулы которых соотносятся между собой как предмет и несовместимое с ним зеркальное изображение.
Оптическая изомерия свойственна молекулам веществ, имеющих асимметрический атом углерода.
Асимметрический атом углерода — это атом углерода, связанный с четырьмя различными заместителями.
Такие молекулы обладают оптической активностью — способностью к вращению плоскости поляризации света при прохождении поляризованного луча через раствор вещества.
Например, оптические изомеры образует 3-метилгексан:
Изомеризация
Изомеризация — превращение химического соединения в изомер. Процесс изомеризации направлен на получение высокооктановых компонентов товарного бензина из низкооктановых фракций нефти путем структурного изменения углеродного скелета. Источником детонации в двигателях внутреннего сгорания является образование свободных радикалов по цепному механизму. Нормальные неразветвленные алканы при горении образуют наиболее активные первичные радикалы, чем вторичные или третичные радикалы при горении разветвленных алканов с изостроением. Поэтому чем разветвление молекула, тем выше её детонационная стойкость, октановое число.
Таблица октановых чисел некоторых алканов.
| Алкан | октановое число И.М. |
|---|---|
| нормальный пентан | 61,8 |
| изопентан | 93 |
| нормальный гексан | 24,8 |
| 2,2-диметилбутан | 91,8 |
Однопроходная изомеризация позволяет повысить октановое число И.М. фракции с 70 до 83 пунктов. Смесь улеводородов до и после однопроходной изомеризации.
| КОМПОНЕНТЫ (% ОБ.) И ИОЧ СМЕСИ | СЫРЬЕ | ПРОДУКТ |
|---|---|---|
| изопентан | 10,3 | 26,9 |
| нормальный пентан | 24,8 | 8,4 |
| изогексан | 23,2 | 47,8 |
| нормальный гексан | 25,6 | 5,7 |
| циклические у/в | 5,6 | 11,2 |
| бензол | 10,5 | 0 |
| Октановое число И.М. | 69 | 83 |
Изомеризация с рециклом позволяет повысит октановое число фракции с 70 до 92 пунктов, за счет выделения из смеси низкооктановых компонентов и возвращение их на рециркуляцию. Возможные схемы организации процесса: 1. Схема с рециклом малоразветвленных гексанов. 2. Схема с деизопентанизацией сырья и рециклом малоразветвленных гексанов. 3. Схема с рециклом н-пентана и малоразветвленных гексанов.
Изомеризация C5-C6 фракций
Процесс и катализаторы пентан-гексановых фракций
Изомеризация – превращение одного изомера в другой.
Процесс изомеризации направлен на получение высокооктановых компонентов товарного бензина из низкооктановых фракций нефти путем структурного изменения углеродного скелета.
Историческая справка изомерации алканов
Термин «изомерия» введен в органическую химию Берцелиусом в 1830 году.
Это явление впервые объяснил А.М. Бутлеров. Первая монография «Об изомерии органических соединений» В.В. Марковникова опубликована в 1865 году. Изомеризация циклоалканов изучалась В.В. Марковниковым, Н.М. Кижнером и Н.Д. Зелинским в конце XIX века. Впервые реакция изомеризации алкилароматических углеводородов описана Фриделем и Крафтсом (1882 г.), а каталитическая изомеризация бутиленов — в начале XX века В.Н. Ипатьевым. Каталитическая изомеризация бутана описана Неницеску и Драганом (1933 г.), а также Б.Л. Молдавским.
Реакции изомеризации углеводородов возможны благодаря изомерии, т. е. явлению, заключающемуся в существовании нескольких соединений с одинаковыми молекулярной массой, количественным и качественным составом, но различающимися физическими и химическими свойствами. Такие соединения называют изомерами. Например, существует 5 основных изомеров гексана, 3 конформационных изомера циклогексана, не считая метилциклопентана, 17 изомеров гексена. У октана насчитывается 18 изомеров, а у тетрадекана — уже 1818.
Известны два основных вида изомерии: структурная и пространственная (стереоизомерия).
Частным случаем изомеризации углеродного скелета является кольчато-цепная изомеризация, например пропилена в циклопропан или метилциклопентана в циклогексан. Изомеризация бутена-1 в цис-бутен-2 может служить примером изомеризации положения двойной связи между атомами углерода. Превращение цис-бутена-2 в транс-бутен-2 иллюстрирует пример геометрической (пространственной или конфигурационной) изомеризации. К этому типу изомеризации можно отнести превращение цис-1,2-диметилциклопентана в транс-1,2-диметилциклопентан. Одним из случаев пространственной изомерии является наличие стереоизомеров, называемых также оптическими, т. е. по-разному вращающих плоскость поляризованного света, например 3-метилгексан. Даже н-алканы, строение молекул которых не является линейным, а «зигзагообразным», могут существовать также в виде поворотных (конформационных) изомеров. Конформационная изомеризация происходит в результате вращения в молекуле атомов (групп атомов) вокруг простых (ординарных С—С-связей). Так, например, н-бутан имеет 4 конформационных изомера, из которых энергетически наиболее устойчивой является трансоидная форма.
Реакции изомеризации алканов
широко используются для получения дефицитных изомеров низших и высших парафинов (изомерация алканов).
Разветвленные парафины С5–С6 имеют высокие октановые числа и являются хорошими компонентами автомобильных бензинов. Изопентан и изобутан являются ценным сырьем для получения синтетических каучуков. Изобутан используется также для получения алкилбензина, высокооктановых эфиров, наиболее распространенным из которых является метил-трет-бутиловый эфир (МТБЭ). Изомеризация алканов (пентана) способствует снижению температуры застывания дизельного топлива, моторных масел.
Изомерация алканов, для процесса характерны следующие типы реакций:
Реакции изомеризации парафиновых углеводородов являются равновесными и проходят без изменения объема, поэтому термодинамическое равновесие зависит только от температуры:
низкая температура благоприятствует образованию более разветвленных изопарафиновых углеводородов, однако, с повышением температуры скорость изомеризации возрастает.
Кроме реакций изомеризации парафинов, протекают несколько других важных реакций.
В процессе изомеризации бензинов реакция размыкания колец ускоряется при повышении температуры. Для типичных условий в реакторе установки изомеризации, глубина превращения при размыкании нафтеновых колец с образованием парафиновых углеводородов составляет около 20÷40%.
Нафтеновые углеводороды – метилциклопентан и циклогексан находятся в равновесии. При увеличении температуры равновесие смещается в сторону образования метилциклопентана.
Реакция гидрирования бензола протекает очень быстро и при очень низких температурах, с выделением тепла. Количество выделяющегося при протекании этой реакции тепла ограничивает содержание бензола в сырье, поступающем на установку. В сырье, подаваемом в реакторный блок изомеризации, должно содержаться не более 1% вес.бензола.
На протекание процесса изомеризации бензинов влияют следующие параметры:
Актуальность установок изомеризации легких бензиновых фракций
Процесс изомеризации пентана является одним из самых рентабельных способов получения высокооктановых компонентов бензинов с улучшенными экологическими свойствами. Актуальность установок изомеризации также возросла с введением новых сверхжестких ограничений на экологические свойства автомобильных бензинов, включая ограничение по фракционному составу, содержанию ароматических соединений и бензола. Установки изомеризации позволяют получить топливо с характеристиками, отвечающими жестким стандартам ЕВРО-4 и ЕВРО-5. Интенсивное наращивание мощностей процесса изомеризации осуществляется за счет реконструкции существующих и строительства новых установок. Одновременно проводятся модернизация и интенсификация действующих установок изомеризации под процессы с рециркуляцией непревращенных нормальных парафинов. Сырьём изомеризации являются легкие бензиновые фракции с концом кипения от 62°С до 85°C. Повышение октанового числа достигается за счёт увеличения доли изопарафинов. Процесс осуществляется, как правило, в одном или двух реакторах при температуре, в зависимости от применяемой технологии, от 110 до 380°C и давлении до 35 атм.
Установка изомеризации представляет собой технологическую систему, состоящую из взаимосвязанных технологическими потоками блоков:
Процесс гидроочистки – каталитический процесс, протекающий в среде водородсодержащего газа с использованием специально подобранного катализатора. Целью процесса предварительной гидроочистки сырья для установки изомеризации пентана является удаление из него веществ, дезактивирующих катализатор. К этим веществам относятся: соединения серы, кислорода и азота; металлорганические соединения, содержащие мышьяк, медь и др., а также непредельные соединения.
Иногда установки риформинга и установки изомеризации объединяют в единый комплекс по производству высокооктановых бензинов. Технологическая схема конкретной установки изомеризации будет зависеть непосредственно от типа катализатора изомеризации, планируемого к загрузке в реакторный блок.
Цеолитные катализаторы
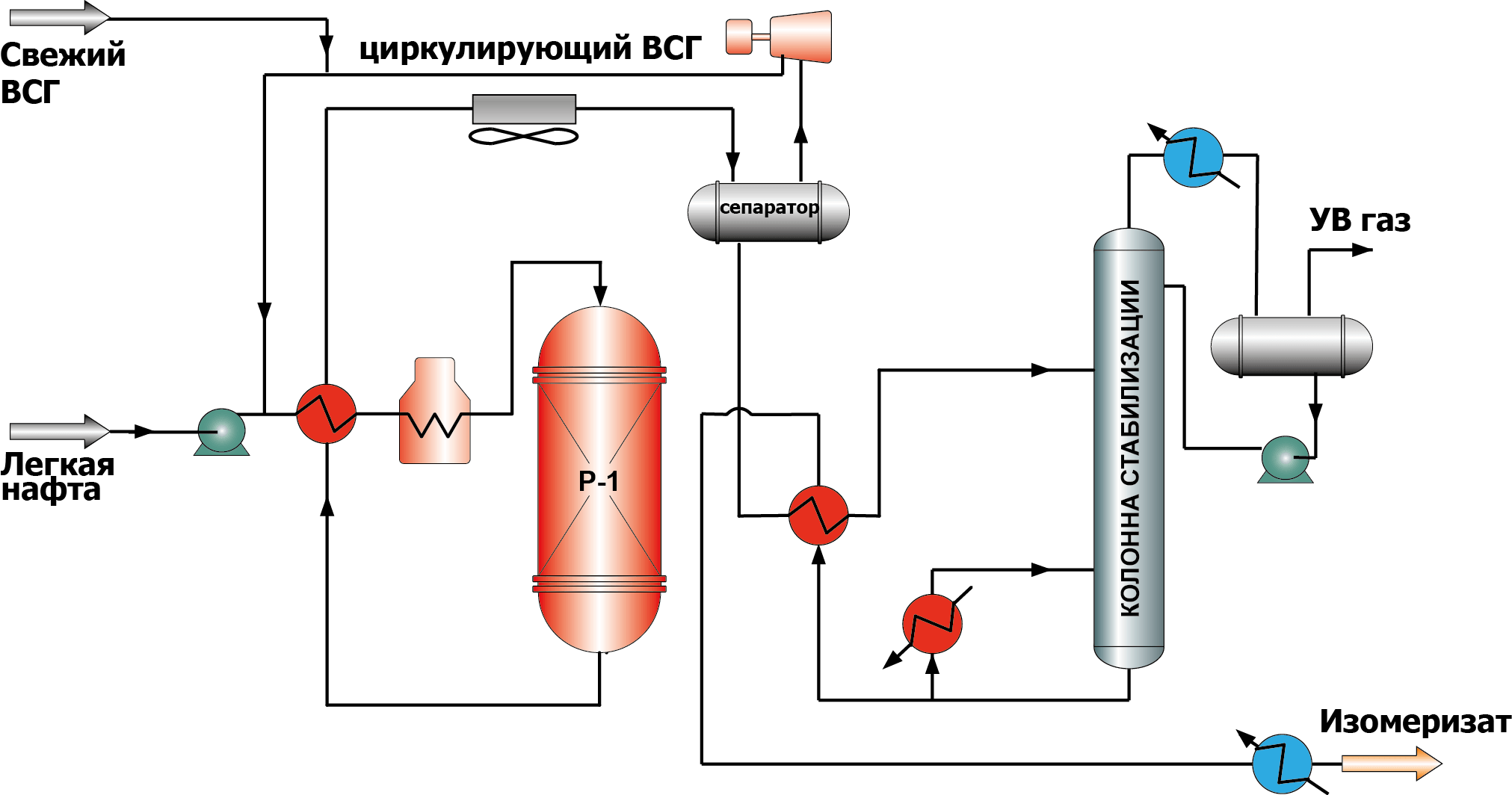
проявляют активность при более высоких температурах по сравнению с катализаторами других типов, и как следствие – низкие октановые числа изомеризата (76-78 по исследовательскому методу). Однако они обладают высокой устойчивостью к отравляющим примесям в сырье и способностью к полной регенерации в реакторе установки. В технологической схеме данного процесса предусматриваются огневые подогреватели для нагрева газо-сырьевой смеси до температуры реакции. Требуется достаточно высокое отношение водорода к углеводородному сырью (наряду с изомеризацией водород тратиться на деароматизацию сырья), поэтому необходим компрессор для подачи циркулирующего ВСГ и сепаратор для отделения ВСГ (рис.1).
Рисунок 1. Схема процесса изомеризации пентана на цеолитных катализаторах
Катализаторы на основе хлорированной окиси алюминия
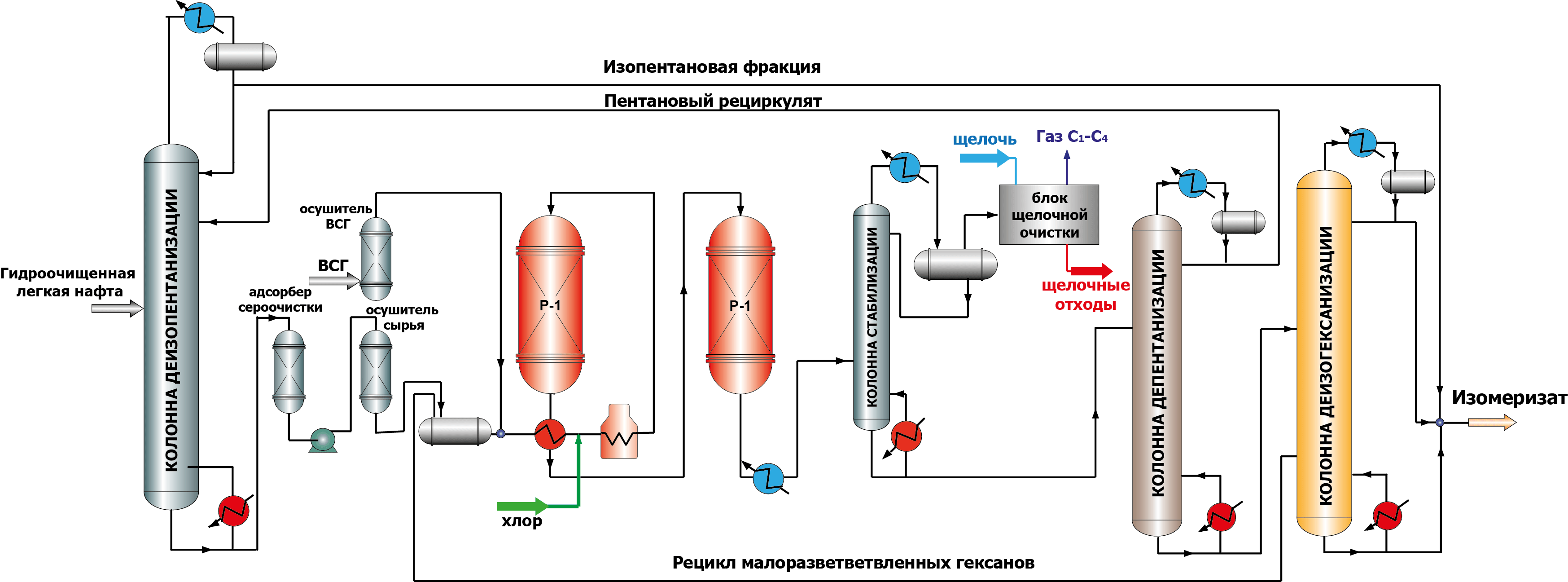
Катализаторы на основе хлорированной окиси алюминия наиболее активны и обеспечивают высокий выход и октановое число изомеризата. Следует отметить, что в ходе изомеризации такие катализаторы теряют хлор, в результате активность снижается. Поэтому, предусматривается введение в сырье хлорсодержащих соединений (обычно CCl4) для поддержания высокой активности катализатора, после чего необходима щелочная промывка от органического хлора в специальных скубберах. Существенным недостатком является то, что данный тип катализатора очень чувствителен к каталитическим ядам (кислородсодержащие соединения, вода, азот, сера, металлы) и требует очень тщательной подготовки сырья (рис.2). Хлорированные катализаторы не регенерируются, а срок их службы составляет 3-5 лет.
Рисунок 2. Схема процесса изомеризации на хлорированных катализаторах с рециклом пентанов и гексанов
Катализаторы на основе сульфатированных оксидов металлов
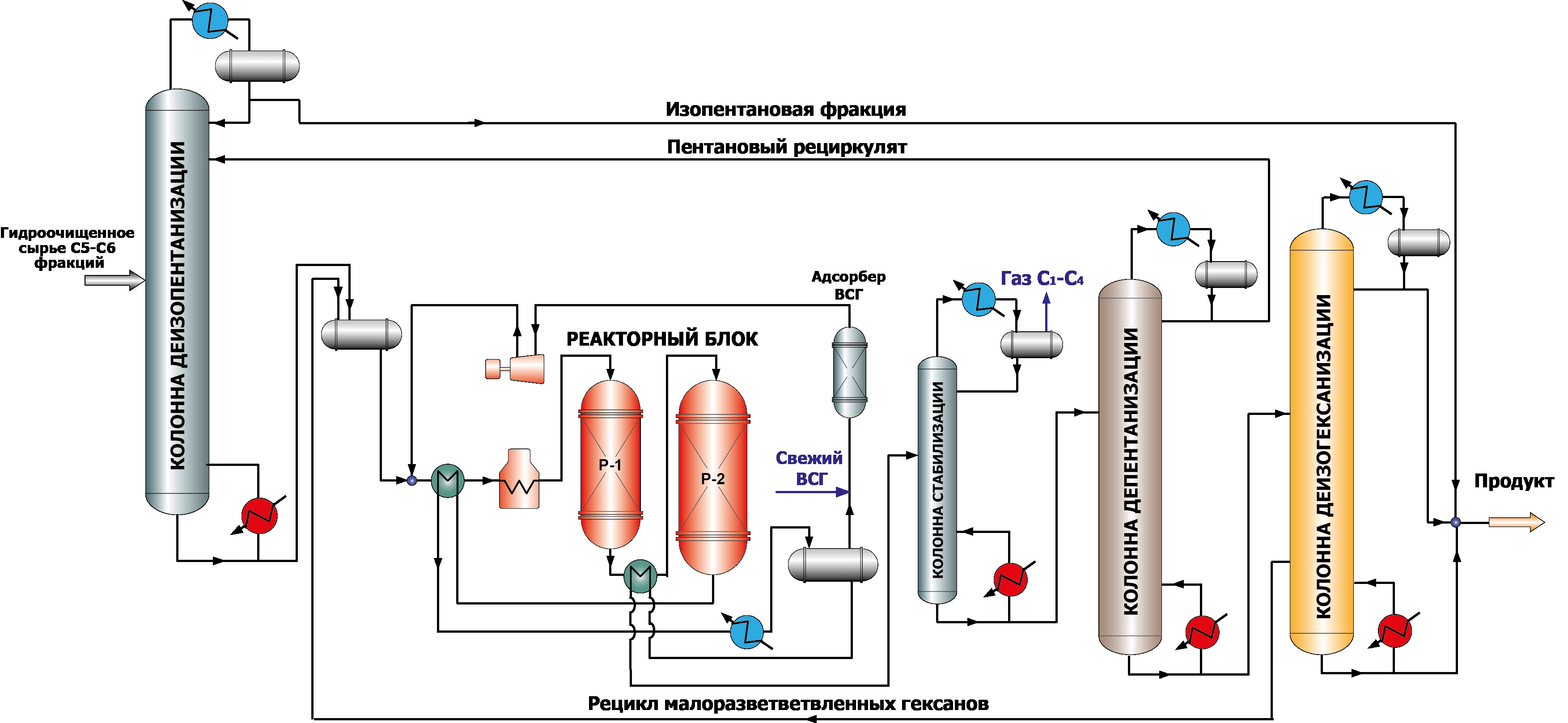
Катализаторы, содержащие сульфатированные оксиды металлов (оксидные катализаторы), в последние годы получили повышенный интерес, так как они сочетают в себе высокую активность и устойчивы к действию каталитических ядов, способны к регенерации. Так же как и для цеолитных катализаторов, существует необходимость в компрессоре для подачи циркулирующего ВСГ (рис.3), однако отсутствует потребность в подаче хлора, адсорбционной осушке сырья и защелачивании УВ газов. Оксидные катализаторы характеризуются способностью к регенерации и длительным сроком службы.
Рисунок 3. Схема процесса изомеризации пентана на оксидных катализаторах с рециклом пентанов и гексанов