Что такое рск в микробиологии
Что такое рск в микробиологии
61. Реакции с участием комплемента. Реакция связывания комплемента. Механизм, компоненты, способы постановки, применение. Реакция радиального гемолиза
Реакции с участием комплемента
Реакции с участием комплемента основаны на активации комплемента комплексом антиген—антитело (реакция связывания комплемента, радиального гемолиза и др.).
РСК применяют для диагностики многих инфекционных болезней, в частности сифилиса (реакция Вассермана).
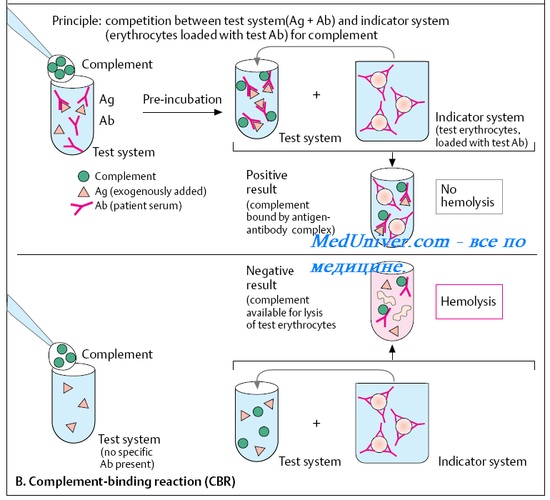
Эту реакцию применяют для обнаружения антител в сыворотке крови больных при бактериальных, вирусных, протозойных инфекциях, а также для определения и типирования вирусов, выделенных у больных. РСК относится к сложным серологическим реакциям, в которых, кроме антигена, антитела и комплемента, участвует еще и гемолитическая система, выявляющая результаты реакции. РСК протекает в две фазы: первая — взаимодействие антигена с антителом при участии комплемента и вторая — выявление степени связывания комплемента при помощи гемолитической системы. Эта система состоит из эритроцитов барана и гемолитической сыворотки, полученной путем иммунизации лабораторных животных, эритроцитами. Эритроциты обрабатывают — сенсибилизируют, присоединяя к ним сыворотку при температуре 37°С, в течение 30 мин. Лизис сенсибилизированных эритроцитов барана наступает только в случае присоединения к гемолитической системе комплемента. В отсутствие его эритроциты не изменяются. Результаты РСК зависят от наличия в исследуемой сыворотке антител. Если сыворотка содержит антитела, гомологичные антигену, используемому в реакции, то образующийся комплекс антиген — антитело присоединяет, связывает комплемент. При добавлении гемолитической системы в этом случае гемолиза не произойдет, так как весь комплемент расходуется на специфическую связь комплекса антиген — антитело. Эритроциты остаются не измененными, поэтому отсутствие гемолиза в пробирке регистрируют как положительную РСК. При отсутствии в сыворотке антител, соответствующих антигену, специфический комплекс антиген — антитело не образуется и комплемент остается свободным. При добавлении гемолитической системы комплемент присоединяется к ней и вызывает гемодиз эритроцитов. Разрушение эритроцитов, их гемолиз характеризует отрицательную реакцию.
Для постановки РСК необходимы: сыворотка больного, комплемент, гемолитическая система, состоящая из эритроцитов барана и гемолитической сыворотки, а также изотонический раствор хлорида натрия. Реакцию ставят в серологических пробирках. Эритроциты барана получают из дефибринированной крови барана путем троекратного отмывания их изотоническим раствором хлорида натрия. Гемолитическую сыворотку выпускают в готовом виде в ампулах, на этикетке которых указан ее титр, т. е. максимальное разведение сыворотки, которое еще вызывает гемолиз при добавлении к эритроцитам в присутствии комплемента. Гемолитическую сыворотку получают путем иммунизации животных, например кролика эритроцитами барана. При постановке реакции сыворотку используют в тройном титре. Например, титр гемолитической сыворотки 1 : 1200, а рабочее разведение 1 : 400. В качестве комплемента используют свежую сыворотку крови морской свинки (в течение 24—48 ч) или сухой комплемент в ампулах. Предварительно перед постановкой РСК комплемент разводят 1 : 10 и титруют для установления титра — наименьшего количества комплемента, которое дает гемолиз эритроцитов при соединении с гемолитической системой, используемой в данной реакции. Учитывая возможные антикомплементарные свойства антигена, при постановке реакции к установленному рабочему титру комплемента делают 20—30% надбавку.
Антигеном для РСК являются взвеси убитых бактерий, экстракты, приготовленные из этих взвесей, отдельные химические фракции микробов. Основное требование к антигену — отсутствие угнетения активности комплемента. Он не должен обладать антикомплементарными свойствами. Для выявления этих свойств антигена комплемент дополнительно титруют в присутствии используемого в реакции антигена. Существуют определенные схемы постановки РСК. Результаты реакции учитывают по наличию или отсутствию гемолиза эритроцитов в гемолитической системе. РСК применяют при диагностике сифилиса (реакция Вассермана), гонореи (реакция Борде—Жангу), токсоплазмоза, риккетсиозных и вирусных заболеваний.
Реакцию радиального гемолиза (РРГ) ставят в лунках геля из агара, содержащего эритроциты барана и комплемент. После внесения в лунки геля гемолитической сыворотки (антител против эритроцитов барана) вокруг них (в результате радиальной диффузии антител) образуется зона гемолиза. Таким образом можно определить активность комплемента и гемолитической сыворотки, а также антитела в сыворотке крови у больных гриппом, краснухой, клещевым энцефалитом. Для этого на эритроцитах адсорбируют соответствующие антигены вируса, а в лунки геля, содержащего данные эритроциты, добавляют сыворотку крови больного. Противовирусные антитела взаимодействуют с вирусными антигенами, адсорбированными на эритроцитах, после чего к этому комплексу присоединяются компоненты комплемента, вызывая гемолиз.
Что такое рск в микробиологии
Реакция связывания комплемента (РСК) предложена Ж. Борде и О. Жангу. Реакция включает две фазы (рис. 10-18).
В фазе I (специфической) реакции связывания комплемента ( РСК ) искомый Аг (или AT) реагирует с диагностической антисывороткой (или Аг-диагностикумом) и комплементом. Образующийся комплекс Аг-АТ связывает комплемент.
Если в фазе I реакции связывания комплемента ( РСК ) AT и Аг соответствуют друг другу, то образующиеся иммунные комплексы связывают комплемент, разрушения эритроцитов после внесения гемолитической системы не наблюдают и реакцию считают положительной. Основные недостатки РСК: сложность (включает 5 компонентов), лабильность некоторых компонентов [их необходимо готовить прямо перед постановкой реакции (комплемент) либо за несколько суток (эритроциты барана)] и возможные антикомплементарные свойства у сывороток и Аг. Тем не менее РСК применяют в диагностике многих заболеваний, например при диагностике сифилиса (реакция Вассерманна).
РЕАКЦИЯ СВЯЗЫВАНИЯ КОМПЛЕМЕНТА
РЕАКЦИЯ СВЯЗЫВАНИЯ КОМПЛЕМЕНТА (РСК; син.: реакция потребления, реакция фиксации, реакция отклонения комплемента, реакция фиксации алексина, активация системы комплемента, реакция Борде—Жангу) — иммунологическая реакция определения антител по известному антигену или антигенов по известному антителу, основанная на способности антител, входящих в состав иммунных комплексов, связывать комплемент. РСК впервые описана в 1901 г. Ж. Борде и Жангу (О. Gengou).
РСК нашла преимущественное применение при серодиагностике бактериальных и вирусных инфекций, а также в суд.-мед. экспертизе. Количественные методы РСК применяют в научных исследованиях для изучения реакции антиген — антитело (см. Антиген — антитело реакция).
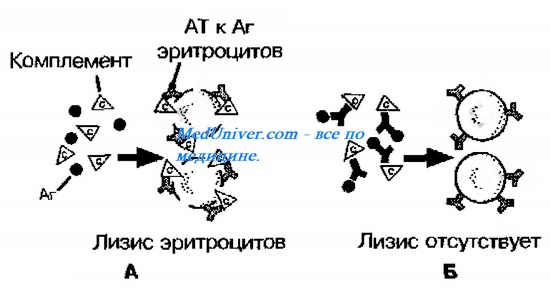
Согласно современным представлениям комплемент (см.) — многокомпонентная биологическая система, находящаяся в сыворотках крови в неактивном состоянии. Антитела IgG и IgM (см. Антитела), включаясь в состав иммунного комплекса, приобретают способность связывать Clq — субкомпонент первого компонента комплемента, что вызывает последовательную активацию остальных компонентов комплемента, завершающуюся образованием литической единицы (С5—С9). Последствия связывания комплемента, а по современной терминологии активации системы комплемента иммунным комплексом, определяются природой входящего в него антигена. Так, литическая единица комплемента обусловливает лизис эритроцитов — гемолиз (см.) и лизис нек-рых грамотрицательных бактерий— бактериолиз (см.), сенсибилизированных гомологичными антителами. По данным Карпентера (Ph. Carpenter, 1975), напротив, связывание комплемента иммунными комплексами, антиген в к-рых представлен растворимыми соединениями, а также грамположительными бактериями, не приводит к видимым последствиям. Однако в результате активации компоненты комплемента претерпевают необратимые изменения и теряют первоначальные свойства, в частности способность лизиро-вать сенсибилизированные эритроциты. РСК основана на этих закономерностях активации комплемента.
РСК — двухфазная реакция. В первой фазе реакции искомый антиген (или антитело) смешивают с диагностической сывороткой крови (или антигеном-диагностикумом) в присутствии комплемента и смесь выдерживают нек-рое время для завершения реакции. Во второй (индикаторной) фазе реакции смесь инкубируют с гемолитической системой, состоящей из эритроцитов барана, сенсибилизированных анти-эритроцитарной (гемолитической) сывороткой. Если в первой фазе реакции образуется иммунный комплекс, т. е. искомые антиген или антитело присутствуют в смеси, то происходит связывание комплемента и прибавленные к смеси во второй фазе реакции сенсибилизированные эритроциты не лизируются. Если иммунный комплекс не образовался, то оставшийся свободным комплемент обусловливает лизис сенсибилизированных эритроцитов. Т. о., гемолиз во второй фазе реакции свидетельствует об отсутствии искомых антигена или антитела.
РСК имеет преимущества перед другими серологическими реакциями. С ее помощью можно зарегистрировать образование иммунного комплекса в тех случаях, когда видимые проявления реакции антиген — антитело, такие как преципитация (см.), агглютинация (см.) или флоккуляция (см.), отсутствуют. В РСК могут быть использованы как растворимые, так и нерастворимые антигены (см.). Благодаря высокой чувствительности, в 100—200 раз превышающей чувствительность реакции преципитации, в РСК анализируют системы с низким содержанием антигенов и антител.
В РСК участвуют пять компонентов: антиген (неизвестный или диагностический), сыворотка (испытуемая или диагностическая), комплемент, эритроциты, гемолитическая сыворотка. Объем, концентрация и соотношение этих компонентов оказывают существенное влияние на связывание комплемента в первой фазе РСК и на его гемолитическую активность во второй фазе реакции. Функциональная активность комплемента определяется также рядом факторов окружающей среды: температурой, концентрацией водородных ионов в р-ре, содержанием в нем одно- и двухвалентных катионов и анионов. Установлены оптимальные условия для проведения РСК: изотонический р-р хлорида натрия, доведенный до pH 7,4 вероналом или три-этиленамином, с ионной силой 0,147, содержащий 0,15 ммоль хлорида кальция и 0,5 ммоль хлорида магния; показано, что наиболее полно комплемент фиксируется иммунными комплексами при t° ок. 4° в течение 18—20 час. Этот прием широко используется в научных исследованиях и при серодиагностике бактериальных и вирусных инфекций.
Существуют многочисленные модификации РСК. Основным методическим требованием при использовании каждой из методик является точное соблюдение выбранных условий реакции, стандартизация компонентов реакции в предлагаемых условных единицах и соблюдение определенных количественных отношений между компонентами реакции.
Компоненты реакции связывания комплемента и принципы их стандартизации
Обычно используют эритроциты барана. Для их получения кровь барана берут стерильно в равный объем модифицированного р-ра Олсвера или консерванта крови 7Б. В день опыта отобранную стерильно из консерванта и отмытую буфером порцию эритроцитов используют для приготовления стандартной суспензии. Кабат и Мейер (E. A. Kabat, М. М. Мауег, 1968) предлагают использовать в качестве стандартной суспензию, содержащую в 1 мл 1*10 9 эритроцитов. Оптическая плотность (OD) лизата, приготовленного путем разведения в 15 раз стандартной суспензии 0,1% р-ром Na2CO3, определенная на спектрофотометре при длине волны 541 нм в кювете с оптическим ходом 1 см, оказывается равной 0,700. Для доведения заранее приготовленной 5% суспензии эритроцитов до стандартной концентрации проводят расчет по формуле:
где OD — оптическая плотность лизата приготовленной 5% суспензии, V1 — объем приготовленной 5% суспензии, V2 — объем, к к-рому должна быть приведена 5% суспензия для получения стандартной концентрации эритроцитов.
Гемолитическая сыворотка (гемолизин, амбоцептор) — сыворотка крови кроликов, иммунизированных суспензией эритроцитов или стромой эритроцитов барана. Перед употреблением гемолитическая сыворотка для инактивации содержащегося в ней комплемента должна быть прогрета при f 56° в течение 30 мин. За титр сыворотки принимают ее наибольшее разведение, дающее полный гемолиз определенной дозы стандартной суспензии эритроцитов в присутствии постоянного количества комплемента в стандартных условиях опыта.
Гемолитическую систему готовят, приливая к стандартной суспензии эритроцитов равный объем гемолитической сыворотки в разведении, превышающем ее титр в три-четыре раза. Гемолитическую систему употребляют в день опыта.
Комплемент. Источником комплемента служит обычно сыворотка крови морских свинок. Для предотвращения инактивации комплемента свежеприготовленную сыворотку крови следует лиофилизировать или хранить при t° ниже —50°. Активность комплемента сохраняется в течение нескольких недель при t° 3—5° в присутствии борной к-ты и сернокислого натрия.
В РСК используют дозированное количество комплемента, к-рое принято измерять в условных 100% или 50% гемолитических единицах (СН100, СН50), равных количеству комплемента, обусловливающему соответственно 100% или 50% лизис определенной порции стандартной гемолитической системы в стандартных условиях опыта. Зависимость гемолиза от количества введенного в реакцию комплемента графически выражается S-образной кривой. При этом 100% гемолиз находится в зоне, где сенсибилизированные эритроциты недостаточно чувствительны к прибавлению новых порций комплемента; 50% гемолиз соответствует средней части кривой, где степень лизиса сенсибилизированных эритроцитов резко изменяется при изменении количества использованного в реакции комплемента. На основании этих данных для количественного выражения гемолитической активности комплемента целесообразно использовать СН50. Активность комплемента в СН50 может быть вычислена но одной экспериментальной точке в зоне частичного гемолиза с помощью таблицы, составленной с использованием формулы Крога. Формула Крога отражает зависимость между количеством фиксированного в опыте комплемента (X) и процентом гемолиза (у):
Процент гемолиза определяют по шкале гемолиза, приготовленной из лизата стандартной суспензии эритроцитов, лизированной тройным объемом воды.
Антигены. Используемые в РСК антигены должны быть проверены на отсутствие антикомплементарности и гемотоксичности, т. е. не должны связывать комплемент в отсутствие антител и лизировать эритроциты.
Антисыворотки перед употреблением должны быть прогреты при t 56° в течение 30 мин. для инактивации содержащегося в них комплемента и сорбированы эритроцитами для удаления естественных гемолизинов.
Методы определения антигенов и антител
Методы определения антигенов и антител могут быть условно разделены на две основные группы — серологические и количественные. Серологические методы РСК используют для диагностики различных инфекционных заболеваний. В целях диагностики в исследуемых сыворотках крови можно определять антиген с помощью диагностической сыворотки. Однако чаще в сыворотке крови больных или реконвалес-центов определяют специфические антитела, используя антигены-диагностикумы (см. Диагностикумы).
При постановке РСК с целью стандартизации условий реакции используют так наз. рабочие дозы комплемента и антигена, к-рые подбирают непосредственно перед постановкой основного опыта. В качестве рабочей дозы комплемента употребляют обычно 1,25—1,5 СН100 или 3—5 СН50 комплемента. В качестве рабочей дозы антигена в нек-рых методиках используют его максимальное количество, к-рое не обладает антикомплементарностью. Ряд исследователей выявили зональный характер РСК и установили, что титр антисыворотки зависит от взятого в реакцию количества антигена. Избыток его, как и недостаток, приводит к занижению титра антисыворотки. Поэтому для каждой серологической системы необходимо определить оптимальную дозу (или диапазон доз) антигена, при к-рой реакция с исследуемой сывороткой выявляет ее максимальный титр. Обычно ее подбирают, титруя разведения антигена с постоянным количеством заведомо положительной сыворотки и рабочей дозой комплемента. Максимальное разведение антигена, связывающее комплемент, называют антигенной единицей. В качестве рабочей дозы при титровании сывороток используют 2—4 антигенные единицы.
При постановке основного опыта равные объемы увеличивающихся разведений титруемой сыворотки крови смешивают с рабочими дозами антигена и комплемента. Одновременно с опытными пробами ставят контроли антигена и сыворотки на антикомилементарность и контроль комплемента. Опытные и контрольные пробы инкубируют при t° 37° в течение 60 мин. или при t° 4° — 18—20 час., после чего ко всем пробам приливают одинаковое количество гемолитической системы и пробы вновь инкубируют при t° 37° в течение 60 мин. При наличии специфических антител в исследуемой сыворотке крови в опытных пробах по сравнению с контрольными наблюдается задержка гемолиза. За титр исследуемой сыворотки крови принимается ее наибольшее разведение, при к-ром наблюдается задержка гемолиза. При определении в РСК антигена серию его разведений смешивают с диагностической антисывороткой (неразведенной или разведенной в незначительной степени) и рабочей дозой комплемента. Рабочую дозу диагностической сыворохки предварительно не подбирают, т. к. показано, что титр антигена не определяется использованным разведением диагностической сыворотки.
Введение СН50 комплемента позволило разработать количественные методы РСК, по точности не уступающие методу количественной преципитации. В основе количественной модификации РСК лежит прием обратного титрования комплемента, предложенный независимо Мейером с соавт. в 1948 г. и А. Кониковым в 1953 г. Сущность его заключается в том, что при постановке РСК во все опытные и контрольные пробы вносят одинаковое заведомо избыточное количество комплемента. После завершения фазы связывания комплемента (60 мин. при t° 37° пли 18—20 час. при t° 4°) в опытных и контрольных пробах титруют оставшийся несвязанным комплемент, выражая его количество в CH50. Количество специфически связанного серологической системой комплемента определяют по разнице между свободным комплементом в контрольных и опытных пробах. Прием обратного титрования позволяет работать с антикомплементарными препаратами антигенов и иммунных сывороток при условии, что их антикомп-лементарность будет перекрыта избытком вводимого в реакцию комплемента. При постоянном количестве антител зависимость связывания комплемента от количества введенного в реакцию антигена, выраженная графически, напоминает кривую образования специфического преципитата. Максимум связывания комплемента, как и максимум образования специфического преципитата, лежит в области оптимальных отношений антитела и антигена. В области избытка антигена наблюдается задержка связывания комплемента. Отношение антител к антигену в точке максимального связывания комплемента — величина постоянная для каждой серологической системы. На основании этой закономерности И. А. Тархановой, А. П. Кониковым и В. В. Акимовой (1957) был предложен количественный метод титрования антигенов в РСК по точке максимального связывания комплемента, аналогичный методам оптимальных пропорций для титрования антигенов и антител в реакциях преципитации и флоккуляции.
В области большого избытка антител обнаружена прямая зависимость между количеством связанного системой комплемента и количеством участвующего в реакции антигена, что было использовано рядом исследователей для количественного определения нек-рых антигенов в РСК.
Уодсворт и Молтейнер (Е. A. Wadsworth, F. Maltaner) и др. в 1938 г. и Райс (С. Е. Rice) в 1942 г. сообщили об обнаружении линейной зависимости между количеством связанного комплемента и содержанием антител в титруемой сыворотке в присутствии оптимального количества антигена. На этом основании было предложено выражать титр антисывороток отношением количества комплемента, необходимого для 50% гемолиза в присутствии иммунной сыворотки и оптимального количества антигена, к количеству комплемента, к-рое необходимо для 50% гемолиза в присутствии только иммунной сыворотки. Однако в более поздних работах была выявлена отчетливая гетерогенность антител одной и той же специфичности в отношении способности связывать комплемент, поэтому количество связанного иммунной сывороткой комплемента не может служить достаточно точной мерой содержания в ней антител.
Одной из модификаций РСК является непрямая РСК, или реакция задержки связывания комплемента, предложенная в 1948 г. Райсом для обнаружения антител в сыворотках крови птиц и нек-рых млекопитающих. Сыворотки крови этих животных после прогревания не связывают комплемент в обычной РСК, хотя, по данным других серологических тестов, содержат антитела, соединяющиеся с гомологичным антигеном. Принцип непрямой РСК состоит в конкурентном связывании антигена антителами, не обладающими компле-ментсвязывающей активностью, что препятствует его последующему связыванию комплементсвязывающими антителами той же специфичности, но от другого вида. Непрямая РСК применяется в ветеринарии для определения орнитоза у птиц и ящура у крупного рогатого скота.
Другой модификацией РСК являются активные методы РСК, в к-рых используют комплемент и естественные гемолизины, содержащиеся в исследуемых сыворотках крови. Преимущество активных методов перед обычной РСК — титрование непрогретых иммунных сывороток. Активные методы предназначены для определения антител, титры к-рых настолько низки, что они не определяются после температурной инактивации комплемента в исследуемых сыворотках. Впервые такой метод был описан в 1908 г. Н. А. Черногубовым. К активным методам можно причислить и реакцию потребления комплемента, в к-рой используют комплемент титруемой сыворотки, но в индикаторной фазе используют обычную гемолитическую систему. Активные методы применяют при диагностике сифилиса, определении ауто- и гомоантител.
Калинин В. С. и Гинзбург С. И. Модификация реакции связывания комплемента и ее применение, М., 1946; Коников А. П. Модификация реакции связывания комплемента для количественного определения антигенов и антител, Журн. микр., эпид. и иммун., № 1, с. 57, 1953; Кэбот Е. и Мейер М. Экспериментальная иммунохимия, пер. с англ., М., 1968; Резникова Л. С. Комплемент и его значение в иммунологических реакциях, М., 1967, библиогр.; Руководство по иммунологии, под ред. О. Е. Вязова и Ш. X. Ходжаева, с. 316, М., 1973; Bordet J. е. Gengou О. Sur I’existence de substances sensibilisatrices dans la plupart de serums antimicrobiens, Ann. Inst. Pasteur, p. 289, 1901; Rice С. E. Some factors influencing selection of complement-fixa-tion method, J. Immunol., v. 59, p. 95, 1948; Wallace A. L., Osier A. G. a. Mayer М. M. Quantitative studies of complement-fixation, estimation of complement-fixing potency of immune sera and its relation to antibody-nitrogen content, ibid., v. 65, p. 661, 1950.
Иммунологические методы исследования в лабораторной практике
Преимущества иммунологического метода исследования.
Серологические реакции различаются по способности выявлять отдельные классы антител. Реакция агглютинации, например, хорошо выявляет lgM-антитела, но менее чувствительна для определения lgG-антител. Реакции связывания комплемента и гемолиза, которые требуют участия комплемента, не выявляют антитела, не присоединяющие комплемент, например lgA-антитела и lgE-антитела. В реакции нейтрализации вирусов участвуют лишь антитела, направленные против антигенных детерминант поверхности вириона, связанных с патогенностью. Чувствительность иммунулогических методов превосходит все другие методы исследования антигенов и антител, в частности радиоиммунный и иммуноферментный анализы позволяют улавливать присутствие белка в количествах, измеряемых в нанограммах и даже в пикограммах.
С помощью предложенного способа определяют группу и проверяют безопасность крови (гепатит В и ВИЧ-инфекция). При трансплантации тканей и органов, иммунологический метод позволяет определять совместимость тканей и тестировать методы подавления несовместимости. В судебной медицине используют реакцию Кастеллани для определения видовой специфичности белка и реакцию агглютинации для определения группы крови.
Иммунологические методы широко применяют в лабораторной диагностике инфекционных болезней. Этиологию заболевания устанавливают также на основании прироста антител к возбудителю в сыворотке крови реконвалесцента по сравнению с пробой, взятой в первые дни болезни. На основе исследования изучают иммунитет населения по отношению к массовым инфекциям, например к гриппу, а также оценивают эффективность профилактических прививок.
Развитию иммунологических методов способствовало создание моноклональных антител, продуцируемых гибридомой, полученной в результате слияния иммунокомпетентной клетки В-лимфоцита и клетки миеломы мышей. Моноклональные антитела несут только одну химически однородную популяцию антител, комплементарную специфической детерминанте антигена, что позволяет осуществлять тонкую дифференциацию белков. Развитие иммунологического метода исследования идет как по линии совершенствования реагентов (чистоты антигенов и антител), так и по линии создания автоматизированных систем постановки реакций и их инструментального учета.
Виды реакций метода иммунологического исследования.
В зависимости от их механизма и учета результатов, иммунологический метод исследования можно подразделить на 5 видов реакции.
1.Реакции, основанные на феномене агглютинации.
Агглютинация представляет собой склеивание клеток или отдельных частичек — носителей антигена с помощью иммунной сыворотки к этому антигену.
Реакция агглютинации бактерий с использованием соответствующей антибактериальной сыворотки относится к наиболее простым серологическим реакциям. Взвесь бактерий добавляют к различным разведениям испытуемой сыворотки крови и через определенное время контакта при t 37° регистрируют, при каком наивысшем разведении сыворотки крови происходит агглютинация. Реакцию агглютинации бактерий используют для диагностики многих инфекционных болезней: бруцеллеза, туляремии, брюшного тифа и паратифов, бациллярной дизентерии, сыпного тифа.
Реакции агглютинации для определения группы крови и резус-фактора основаны на взаимодействии аллоантител (изоантител) и антигенов эритроцитов. Антитела против резус-фактора являются неполными, они не способны к прямой реакции с резус-положительными эритроцитами, поэтому для их обнаружения используют реакцию Кумбса, основанную на выявлении неполных антител с помощью антиглобулиновых сывороток. К эритроцитам известной специфичности добавляют исследуемую сыворотку крови, а вслед за этим антиглобулиновую сыворотку против lgG (непрямая реакция Кумбса). Fab-фрагменты неполных антител исследуемой сыворотки крови присоединяются к эритроцитам, а к свободным Fc-фрагментам этих антител присоединяются антитела против lgG, и происходит агглютинация эритроцитов.
Реакция пассивной или непрямой гемагглютинации (РПГА, РНГА). В ней используют эритроциты или нейтральные синтетические материалы (например, частицы латекса), на поверхности которых сорбированы антигены (бактериальные, вирусные, тканевые) или антитела. Их агглютинация происходит при добавлении соответствующих сывороток или антигенов. Эритроциты, сенсибилизированные антигенами, называют антигенным эритроцитарным диагностикумом и используют для выявления и титрования антител. Эритроциты, сенсибилизированные антителами, называют иммуноглобулиновыми эритроцитарными диагностикумами и применяют для выявления антигенов.
Реакцию пассивной гемагглютинации используют для диагностики заболеваний, вызванных бактериями (брюшной тиф и паратифы, дизентерия, бруцеллез, чума, холера и др.), простейшими (малярия) и вирусами (грипп, аденовирусные инфекции, вирусный гепатит В, корь, клещевой энцефалит, крымская геморрагическая лихорадка и др.), а также для определения некоторых гормонов, выявления повышенной чувствительности больного к лекарственным препаратам и гормонам, например пенициллину и инсулину.
Реакция торможения гемагглютинации (РТГА) основана на феномене предотвращения (торможения) иммунной сыворотки гемагглютинации эритроцитов вирусами, используется для выявления и титрования противовирусных антител. Она служит основным методом серодиагностики гриппа, кори, краснухи, эпидемического паротита, клещевого энцефалита и других вирусных инфекций, возбудители которых обладают гемагглютинирующими свойствами, например, для серодиагностики клещевого энцефалита, в лунки панели разливают двукратные разведения сыворотки больного на щелочном боратном буферном растворе. Затем добавляют определенное количество, обычно 8 АЕ (агглютинирующих единиц), антигена клещевого энцефалита и после 18 ч экспозиции при t 4° вносят взвесь гусиных эритроцитов, приготовленную на кислом фосфатно-буферном растворе. Если в сыворотке крови больного есть антитела к вирусу клещевого энцефалита, то антиген нейтрализуется и агглютинация эритроцитов не происходит.
2.Реакции, основанные на феномене преципитации.
Преципитация происходит в результате взаимодействия антител с растворимыми антигенами. Простейшим примером реакции преципитации является образование в пробирке непрозрачной полосы преципитации на границе наслоения антигена на антитело. Широко применяют различные разновидности реакции преципитации в полужидких гелях агара или агарозы (метод двойной иммунодиффузии по Оухтерлоню, метод радиальной иммунодиффузии, иммуноэлетрофорез), которые носят одновременно качественный и количественный характер. В результате свободной диффузии, в геле антигенов и антител в зоне оптимального их соотношения образуются специфические комплексы — полосы преципитации, которые выявляют визуально или при окрашивании. Особенностью метода является то, что каждая пара антиген-антитело формирует индивидуальную полосу преципитации, и реакция не зависит от наличия в исследуемой системе других антигенов и антител.
Для постановки двойной иммунодиффузии наливают слой растопленного геля на стеклянную пластинку и после затвердевания вырезают лунки диаметром 1,5–3 мм. В расположенные по кругу лунки помещают исследуемые антигены, а в центральную лунку — иммунную сыворотку известной специфичности. Диффундируя навстречу друг другу, гомологичные сыворотки и антигены образуют преципитат.
При радиальной иммунодиффузии (по методу Манчини), иммунную сыворотку вносят в агар. Антиген, помещенный в лунки, диффундирует через агар, и в результате преципитации с иммунной сывороткой, вокруг лунок образуются непрозрачные кольца, внешний диаметр которых пропорционален концентрации антигена. Метод используют для определения классов иммуноглобулинов, а модификации метода можно применять для определения противомикробных антител, относящихся к различным классам иммуноглобулинов.
Иммуноэлектрофорез основан на усилении миграции в геле антигенов и антител путем помещения пластины геля с реагентами в электрическое поле. При этом достигается разделение антигенов и антител на компоненты в соответствии с их подвижностью и зарядом.
Разновидностью иммуноэлектрофореза является радиоиммунофорез. В этом случае после электрофоретического разделения антигенов в канавку, вырезанную параллельно движению антигенов в геле, наливают сначала меченную радиоактивным йодом иммунную сыворотку против определяемых антигенов, а затем иммунную сыворотку против lgG-антител, которая преципитирует образовавшиеся комплексы антитела с антигеном. Все несвязавшиеся реагенты вымывают, а комплекс антиген-антитело обнаруживает методом авторадиографии.
3.Реакции с участием комплемента.
В качестве комплемента используют свежую сыворотку крови морской свинки, основанную на способности субкомпонента комплемента Clq и затем других компонентов комплемента присоединяться к иммунным комплексам.
Реакция связывания комплемента (РСК) позволяет титровать антигены или антитела по степени фиксации комплемента комплексом антиген-антитело. Эта реакция состоит из двух фаз: взаимодействия антигена с испытуемой сывороткой крови (исследуемая система) и взаимодействия гемолитической сыворотки с эритроцитами барана (индикаторная система). При положительной реакции в исследуемой системе происходит связывание комплемента, и тогда при добавлении сенсибилизированных антителами эритроцитов, гемолиза не наблюдается. Реакцию применяют для серодиагностики сифилиса (реакция Вассермана), вирусных и бактериальных инфекций.
Реакция радиального гемолиза эритроцитов может протекать в геле. Взвесь эритроцитов барана помещают в агарозный гель с комплементом; в застывшем на стекле слое делают лунки и вносят в них гемолитическую сыворотку. Вокруг лунок в результате радиальной диффузии антител образуется зона гемолиза, радиус которой прямо пропорционален титру сыворотки. Если сорбировать на эритроцитах какой-либо антиген, например гликопротеиновый гемагглютинин вируса гриппа, краснухи или клещевого энцефалита, то можно воспроизвести феномен гемолиза иммунными сыворотками к этим вирусам. Реакцию радиального гемолиза в геле применяют в диагностике вирусных инфекций. Она характеризуется простотой постановки, нечувствительностью к сывороточным ингибиторам, позволяет титровать сыворотки крови по диаметру зоны гемолиза, не прибегая к серийным разведениям.
Иммунное прилипание. Эритроциты, тромбоциты и другие клетки крови имеют на поверхности рецепторы к третьему компоненту комплемента (СЗ). Если к антигену (бактериям, вирусам и др.) добавить соответствующую иммунную сыворотку и комплемент, то образуется комплекс антиген-антитело, покрытый СЗ-компонентом комплемента. Эту реакцию применяют при изучении ряда вирусных инфекций (клещевого энцефалита, денге), которые сопровождаются иммунопатологическими процессами и циркуляцией в крови вирусных антигенов в комплексе с антителами.
Основана на способности антител нейтрализовать некоторые специфические функции макромолекулярных или растворимых антигенов, например активность ферментов, токсины бактерий, болезнетворность вирусов. В бактериологии эту реакцию используют для обнаружения антистрептолизинов, антистрептокиназы и антистафилолизинов. Реакцию нейтрализации токсинов можно оценивать по биологическому эффекту, так, например, титруют антистолбнячные и антиботулинические сыворотки. Смесь токсина с антисывороткой, введенная животным, не вызывает их гибели. Различные варианты реакции нейтрализации применяют в вирусологии. При смешивании вирусов с соответствующей антисывороткой и введении этой смеси животным или в клеточные культуры, патогенность вирусов нейтрализуется и при этом животные не заболевают, а клетки культур не подвергаются деструкции.
5.Реакции с использованием химических и физических меток (ИФА).
Иммунофлюоресценция заключается в использовании меченых флюорохромом антител, точнее, иммуноглобулиновой фракции антител lgG. Меченое флюорохромом антитело образует с антигеном комплекс антиген-антитело, который становится доступным наблюдению под микроскопом в УФ-лучах, возбуждающих свечение флюорохрома. Реакцию прямой иммунофлюоресценции используют для изучения клеточных антигенов, выявления вируса в зараженных клетках и обнаружения бактерий и риккетсий в мазках. Так, для диагностики бешенства, отпечатки кусочков мозга животных, подозреваемых на вирусоносительство, обрабатывают люминесцирующей антирабической сывороткой. При положительном результате, в цитоплазме нервных клеток выявляются глыбки ярко-зеленого цвета. На обнаружении антигенов вирусов в клетках отпечатков со слизистой оболочки носа основана экспресс-диагностика гриппа, парагриппа и аденовирусной инфекции.
Более широко применяют метод непрямой иммунофлюоресценции, основанный на выявлении комплекса антиген-антитело с помощью люминесцирующей иммунной сыворотки против lgG-антител и используемой для обнаружения не только антигенов, но и титрования антител. Метод нашел применение в серодиагностике герпеса, цитомегалии, лихорадки Ласса. Препараты с наслоенной исследуемой сывороткой крови помещают в термостат при t 37° для образования иммунных комплексов, а затем, после отмывания несвязавшихся реагентов, выявляют эти комплексы меченой люминесцирующей сывороткой против глобулинов человека. Применяя меченые иммунные сыворотки против lgM- или lgG-антител, можно дифференцировать тип антител и обнаруживать ранний иммунный ответ по наличию lgM-антител.
Иммунофлюоресценцию широко используют не только в бактериологии, вирусологии, паразитологии, но и в иммунопатологии для обнаружения антител к тканевым антигенам человека.
Иммуноферментные или энзим-иммунологические методы основаны на использовании антител, конъюгированных с ферментами, главным образом пероксидазой хрена или щелочной фосфатазой. Чтобы обнаружить соединение меченых антител с антигеном, добавляют субстрат, разлагаемый присоединенным к lgG ферментом, с окрашиванием в желто-коричневый (пероксидаза) или желто-зеленый (фосфатаза) цвет. Используют также ферменты, разлагающие не только хромогенный, но и люмогенный субстрат. В этом случае при положительной реакции появляется свечение. Подобно иммунофлюоресценции, иммуноферментный метод применяют для обнаружения антигенов в клетках или титрования антител на антигенсодержащих клетках.
Наиболее популярной разновидностью иммуноферментного метода является иммуносорбция. На твердом носителе, которым могут быть целлюлоза, полиакриламид, декстран и различные пластмассы, сорбируют антиген. Чаще носителем служит поверхность лунок микропанелей. В лунки с сорбированным антигеном вносят исследуемую сыворотку крови, затем меченую ферментом антисыворотку и субстрат. Положительные результаты учитывают по изменению цвета жидкой среды. Для обнаружения антигенов, на носитель сорбируют антитела, затем вносят в лунки исследуемый материал и проявляют реакцию меченой ферментом антимикробной сывороткой. Повышению чувствительности иммунофлюоресцентного и иммуноферментного методов способствует введение в систему реакции авидина и биотина.
Радиоиммунологический метод основан на применении радиоизотопной метки антигенов или антител. Является наиболее чувствительным методом определения антигенов и антител, используется для определения гормонов, лекарственных веществ и антибиотиков, для диагностики бактериальных, вирусных, риккетсиозных, протозойных заболеваний, исследования белков крови, тканевых антигенов. Первоначально он был разработан как специфический метод измерения уровня циркулирующих в крови гормонов. Тест-системой являлись меченый радионуклидом гормон (антиген) и антисыворотка к нему. Если к такой антисыворотке добавить материал, содержащий искомый гормон, то он свяжет часть антител, при последующем внесении меченого титрованного гормона с антителами свяжется уменьшенное по сравнению с контролем его количество. Результат оценивают по сопоставлению кривых связанной и несвязанной радиоактивной метки. Эта разновидность метода носит название конкурентной реакции. Существуют и другие модификации радиоиммунологического метода.
Иммуногистологические методы предназначены для определения антигенов на поверхности или внутри клетки, например для обнаружения маркеров лимфоцитов и иммунокомплексов при гломерулонефритах и других заболеваниях почек. В этой реакции для выявления антигенов пользуются или иммунофлюоресценцией, или иммуноферментными конъюгатами с пероксидазой. Количество специфических антигенов определяют по интенсивности окрашивания. Иногда используют автоматическую регистрацию с помощью спектрофотометра.