Что такое синдром ваньки встаньки
Что такое синдром ваньки встаньки
Нарушения ритма, частоты и глубины дыхания относятся к нередким симптомам повреждений паренхиматозных органов брюшной полости. По данным Л. Я. Стефаненко (1935), В. Н. Мешковой (1961), Ю. М. Хомякова (1961), И. В. Карамишева и соавт. (1967), Г. А. Баирова, А. П. Шапкиной (1969), D. V. Cacioppo, L. H. Stander (1960) и других хирургов, нарушения дыхания возникают в 25—30% случаев как у взрослых, так и у детей с подобными видами травмы.
Одышка, затрудненный вдох из-за болей могут указывать на раздражение диафрагмы. Подобные симптомы отмечены нами у 60 детей, имевших разрыв селезенки, и у 26 — печени. Эти признаки относятся к числу ранних проявлений повреждений органов, расположенных в непосредственной близости от диафрагмы, что в совокупности с другими симптомами может свидетельствовать о повреждении паренхиматозных органов.
Поведение ребенка нередко не соответствует тяжести повреждения и бывает неадекватно истинному состоянию (Звягинцев А. Е., 1946; Иванов А. А., 1948; Ивашко Л. М., 1964). Некоторые дети во время осмотра возбуждены, сопротивляются, отталкивают руку исследующего врача, другие угнетены и безучастны, третьи настойчиво стремятся сохранить наиболее удобное для них положение, чаще всего на правом (при повреждениях печени) или левом (при повреждении селезенки) боку. Наиболее объективным свидетельством повреждения паренхиматозных органов брюшной полости у детей является вынужденное положение. Больные находятся в характерной позе — на боку с поджатыми к животу коленями. При попытке вывести их из этого положения они быстро принимают его вновь.
Среди детей, госпитализированных с повреждениями паренхиматозных органов, вынужденное положение было отмечено у 63, в том числе симптом «Ваньки-встаньки» у И из них (у 10 с повреждением селезенки и у 1 с повреждением печени). Симптом «Ваньки-встаньки» выражается в следующем: пострадавший предпочитает сидеть, а не лежать и при попытке уложить его в момент обследования с криком поднимается, принимает сидячую или полусидячую позу, опираясь на локоть, объясняя при этом, что у него «так меньше болит».
Рвота при повреждениях паренхиматозных органов — один из наиболее частых симптомов. По данным А. Е. Звягинцева (1947), Э. И. Сусленниковой (1962), Г. А. Баирова, А. П. Шапкиной (1965), И. С. Гинзбурга, А. М. Али-Заде (1966), N. A. Anderson (1939), L. M. Knopp, H. N. Harkins (1954), подобный симптом наблюдался у 25—30% детей при различных видах повреждений печени и селезенки. Н. Г. Дамье (1960), Н. W. Scott, J. R. Bowman (1946) и другие полагают, что рвота возникает как рефлекторная реакция рвотного центра в ответ на чрезмерное раздражение периферических нервных окончаний брюшной полости.
H. W. Scott и J. R. Bowman считают рвоту не только результатом сопутствующего шока, но и следствием имевшего место паралитического илеуса.
У наблюдавшихся нами больных рвота при повреждении селезенки была у 140, печени —у 59 и поджелудочной железы— у 10 детей. Необходимо отметить, что у детей с изолированными повреждениями паренхиматозных органов рвота была несколько чаще, чем у детей с сочетанными повреждениями. Особое значение имеет так называемая поздняя рвота, которая, как правило, указывает на наличие патологического процесса в брюшной полости и обусловлена раздражением периферических окончаний вегетативных нервных волокон, ин-нервирующих брюшину и паренхиматозные органы, излившейся кровью. Нами отмечено, что «поздняя» рвота встречалась у детей с повреждением паренхиматозных органов значительно чаще «ранней», возникавшей у ребенка непосредственно после травмы.
У детей имеется определенная зависимость вида рвоты от степени и характера повреждения паренхиматозного органа. Так, при изолированных повреждениях селезенки во всех случаях «поздней рвоты» определялись повреждения в области ворот селезенки, чаще в виде глубоких разрывов, а также разрывы органа на части, отрыв от сосудистой ножки и т. д.
При повреждении печени «поздняя» рвота наблюдалась у 28 детей, из них у 23 имелись повреждения II и III степени. Аналогичная картина была и у детей с травмой поджелудочной железы, у которых в последующем на операции были выявлены повреждения II (4 детей) и III степени (1 ребенок).
Нередко рвота может быть обусловлена не только повреждением паренхиматозных органов, но и травмой черепа и головного мозга. В. И. Гребенюк, Р. И. Житнюк (1964), изучая особенности диагностики повреждений органов брюшной полости у больных с травмами головного мозга, указывают, что при повреждении внутренних органов рвоте предшествует тошнота с последующими мучительными рвотными позывами, как это было у нашего больного, описанного выше. При травме же черепа рвота возникает неожиданно, без предшествующих к ней позывов, нередко в виде «фонтана». Однако определить причину рвоты в этих условиях очень трудно.
Что такое синдром ваньки встаньки
Н.В. Федорова, О.А. Орехова
Российская медицинская академия последипломного образования, Центр экстрапирамидных заболеваний (Москва)
Среди постуральных нарушений можно выделить такие крайние проявления, как камптоцефалия (синдром «свисающей головы»), синдром «пизанской башни» (тоническое латеральное сгибание туловища) и камптокормия (синдром «согнутой спины»). Эти симптомы значительно инвалидизируют пациентов, приводят к нарушению передвижения и самообслуживания. Две первые формы более характерны для мультисистемной атрофии, в то время как камптокормия (КК) встречается в основном при болезни Паркинсона (БП). Камптокормия (КК) клинический феномен, проявляющийся значительным непроизвольным наклоном туловища кпереди. КК нарастает при ходьбе, исчезает в положении лежа, приводит к вынужденной позе, нарастанию постуральной нестабильности и увеличивает риск падений при БП. Вопросы патогенеза до конца не изучены. Изначально КК считали крайним вариантом характерной для БП сгорбленной позы, возникающей вследствие ригидности мышц туловища. В последующем предположили, что КК может быть связана с миопатическими изменениями или является одной из форм сегментарной дистонии при БП [33]. Целесообразно заметить, что различные концепции патогенеза КК при БП по своему содержанию не противоречат друг другу, а скорее отражают его отдельные звенья. Так, фокальная миопатия паравертебральных мышц может формироваться вторично на фоне первичной туловищной дистонии и ригидности, отражая хроническое напряжение мышц, задействованных в компенсаторном выпрямлении туловища.
Кроме того, КК часто сопровождается болевым синдромом. Данные о распространённости и частоте КК при БП противоречивы: от 3,5% (Wenhui Fan et al., 2009) до 27,3% (Weintraub. et al., 2006).
КК при БП обычно появляется по мере прогрессирования заболевания. По данным некоторых авторов, пациенты с БП и КК характеризуются более старшим возрастом, большей длительностью заболевания, более выраженной степенью тяжести БП, большей продолжительностью терапии препаратами леводопы, большей суточной дозой леводопы, ранним присоединением аксиальных симптомов и более частой сопутствующей деменцией. Другие авторы, напротив, не находят корреляции между степенью сгибания туловища и возрастом, длительностью БП, стадиями заболевания и продолжительностью лечения и дозами леводопы. Для клинической оценки степени выраженности КК используют гониометрическое измерение степени тораколюмбальной флексии, рассчитываемой как угол между вертикальной плоскостью и плоскостью, проходящей через край акромиона. Как правило, КК считают переднюю флексию, превышающую угол наклона 45°.
Для дифференциальной диагностики КК из лабораторно-инструментальных тестов важны определение СОЭ, С-реактивного белка, электролитов (кальций и фосфор), креатинфосфокиназы (КФК), витамина Д, пирувата и лактата для исключения миозитов и митохондриальной патологии. Данные лабораторных обследований при КК обычно показывают нормальный или повышенный уровень КФК. По данным ЭМГ поясничных и грудных паравертебральных мышц отмечаются обильные фибрилляции, положительные острые волны и патологические разряды высокой частоты.
При КК целесообразно проведение нейровизуализационных методов исследования (КТ и МРТ грудного и поясничного отделов позвоночника, паравертебральных мышц, головного мозга), позволяющих исключить скелетно-мышечные заболевания или структурные изменения базальных ганглиев, однако данные этих методов при БП с КК не обладают специфичностью. Гистологическое исследование паравертебральных мышц при КК выявляет обширный фиброз и наличие жировой ткани с дегенеративными волокнами. Возможности терапии КК при БП достаточно ограничены. При всей сложности терапии КК в ее основе всегда лежит лечение основного заболевания.
Лечение должно включать консервативные мероприятия, отмену медикаментов, способных вызвать КК, хирургическую коррекцию или глубокую стимуляцию мозга.
В настоящее время определено, что эффективная терапия для КК при БП не найдена. В большинстве описанных в литературе наблюдений КК оказывается нечувствительной к стандартной противопаркинсонической терапии. Только в редких случаях возможно некоторое уменьшение выраженности КК, или же, напротив, ее усиление, чаще при приеме АДР. Поэтому при возникновении КК, связанной с изменениями дофаминергической
Болезнь Паркинсона и расстройства движений
терапии, целесообразна попытка коррекции медикаментозного лечения, прежде всего, исключение или замена одного препарата АДР на другой. Стероиды, по данным различных авторов, являются эффективными лишь в редких случаях БП с КК [26].
Данные об эффективности противосудорожных препаратов при КК противоречивы. Назначение препаратов других фармакологических групп (миорелаксантов, антиконвульсантов) чаще всего не эффективно. Однако, по мнению некоторых авторов, применение противосудорожного препарата клоназепама снижает выраженность КК при БП.
В комплексной терапии при КК обязательным должно быть включение физиотерапевтических и психотерапевтических методик. Иногда аномальное положение туловища улучшается при использовании заплечного рюкзака. Некоторые авторы предлагают использование для облегчения КК классических поясничных корсетов, кожаных ортезов. В настоящее время предлагается использование новых специальных ортезов, изготовленных по принципу торако-тазовой передней фиксации, которые дают неплохие результаты в лечении КК.
Локальные инъекции ботулинистического токсина (БТ) в клинически заинтересованные мышцы (подвздошную мышцу, прямую мышцу живота) при КК, ассоциированной с БП, дают неоднозначные результаты. При этом часто необходимо применение высоких доз БТ, обусловливающих развитие побочных эффектов. Различные авторы отмечают как положительную динамику, так и практически полное отсутствие эффекта на фоне регулярных инъекций БТ.
Хирургическое лечение КК складывается из стабилизирующих вертебральных вмешательств, а также хронической стимуляции глубоких структур мозга (DBS). Среди спектра хирургических операций на позвоночнике применяют заднюю тораколюмбальную фиксацию в сочетании с передним межпозвонковым артродезом на уровне нескольких позвоночных сегментов. При этом почти всегда лечение сопряжено с необходимостью длительной иммобилизации, стационарного наблюдения, повторными хирургическими вмешательствами и связанным с ними высоким риском осложнений.
В современной литературе постепенно накапливаются данные об использовании DBS в лечении ассоциированной с БП КК. Однако результаты применения DBS в этих случаях остаются противоречивыми. Кроме того, среди исследователей не сложилось единого мнения относительно выбора оптимальной структуры для DBS.
Таким образом, КК встречается при многих неврологических заболеваниях, самым частым из которых является БП. КК проявляется патологической позой с насильственным наклоном туловища вперед. Она возникает в вертикальном положении, усиливается при длительном стоянии или ходьбе и уменьшается в горизонтальном положении. В качестве причин развития КК при БП предполагают сегментарную аксиальную дистонию или локальную миопатию паравертебральных мышц, однако точные механизмы патогенеза изучены недостаточно. КК, ассоциированная с БП, значительно инвалидизирует пациентов, приводит к нарушению передвижения и самообслуживания.
Цель исследования: Определить клинические проявления синдрома КК при БП и влияние его на качество жизни больных.
Пациенты и методы исследования
В исследование было включено 90 больных БП, разделенных на две группы. Основную группу составили 70 больных БП с КК, средний возраст пациентов составил 68,9 ± 7,8 лет (от 53 до 86). Группу сравнения составили 20 пациентов БП без КК. Группа сравнения соответствовала основной по возрасту, полу, продолжительности заболевания и степени тяжести. Средняя степень тяжести по шкале Хен–Яру составила 3,4 ± 0,7 баллов, средняя продолжительность БП – 9,9 ± 5,6 лет. У 46 больных отмечалась смешанная форма заболевания (66%), у 19 – акинетико-ригидная форма (27%), дрожательно-ригидная форма наблюдалась у 5 больных (7%). Для оценки степени тяжести БП использовалась шкала Хен–Яра в модификации Линдвалла (Hoehn, Jahr, 1967; Lindvall et al., 1987); для оценки выраженности основных симптомов БП – унифицированная рейтинговая шкала БП (Unifed Parkinsons Disease Rating Scale – UPDRS, Fahn. et al., 1987); для оценки постуральной нестабильности – шкала Берга (Berg et al., 1992), шкала Тиннети (Tinetti et al., 1986), шкала нарушений ходьбы и равновесия (Gait and Balanse Scale, Jancovic, 2002); для оценки повседневной активности больных – шкала Schwab и England (1967); для оценки качества жизни больных БП – шкала PDQ-39 (Peto et al., 1995); для оценки степени выраженности КК и степени выраженности болевого синдрома – опросник КК (Margraf et al., 2010); для оценки влияния дофаминергических препаратов на выраженность КК использовался дневник Хаузера (Hauser et al., 2004).
Результаты и обсуждение
Средняя длительность КК составила 3,6 ± 3,0 лет. В общей группе преобладали пациенты с возрастом дебюта БП от 51 до 60 лет, в то время как КК возникала преимущественно у пациентов в возрасте от 61 до 70 лет. У 55 больных (78,6%) отмечался наклон вперед, у 15 больных (21,4%) – сочетание наклона вперед с наклоном в стороны. Тораколюмбальный угол составил 63,5±17,2 градусов, цервикокраниальный угол – 43,2±22,5 градусов. Болевой синдром наблюдался у 62 больных (88,6%). У 53 больных (75,7%) отмечалась четкая связь между появлением болевого синдрома в позвоночнике и началом развития КК. Болевой синдром был представлен в виде корешковой симптоматики у 20 пациентов (32,2%), в виде мышечно-тонического синдрома – у 37 пациентов (59,7%), у 5 пациентов (8,1%) наблюдалось сочетание корешкового и мышечно-тонического синдромов. Выраженность болевого синдрома оценивалась по опроснику КК и составила 54,9 ± 24,5%. Предшествующий вертеброгенный анамнез был выявлен у 46 больных (66%) в виде компрессионных переломов тел поясничных позвонков на фоне остеопороза, протрузий и грыж дисков на пояснично-крестцовом уровне, подтвержденных на основании КТ или МРТ пояснично-крестцового отдела позвоночника; имелись также проявления остеопороза, остеохондроза, спондилоартроза, подтвержденные данными рентгенографии грудного и пояснично-крестцового отделов. У 44 пациентов КК возникала уже в положении сидя (62,9%), у 21 – сразу при приеме вертикального положения (30%), у 2 – после прохождения 50 м (2,9%), у 3 (4,3%) – только после значительной нагрузки в вертикальном положении. У 54 пациентов (77,1%) КК наблюдалась в течение всего дня, у 4 (5,7%) – только в течение нескольких часов в дневное время, у 12 (17,1%) – возникала только вечером. КК вызывала ограничение повседневной активности на 51,6±25,6%. Факторами, усиливающими проявления КК, были статические нагрузки (2,9%), в 10% – стрессовые ситуации; физические нагрузки провоцировали развитие КК у 40 больных (57,1%); стрессовые и физические нагрузки вместе вызывали ухудшение КК у 6 больных (8,6%).
Для коррекции КК 10 пациентов (14,3%) использовали корсет; одному пациенту (1,4%) помогало ношение заплечного рюкзака; применение рюкзака и корсета были эффективны в одном случае (1,4%), в то время как 58 пациентов (82,9%) не использовали корригирующие приемы для уменьшения выраженности КК. Тридцать шесть пациентов (37,1%) с КК использовали при ходьбе трость, 4 (5,7%) были вынуждены использовать ходунки; сочетание трости и ходунков использовали 4 пациента (5,7%), 26 пациентов (37%) не нуждались в помощи при ходьбе.
Падения наблюдались у 29 пациентов (41,4%).
У большинства больных (65,7%) преобладал медленно прогрессирующий тип течения КК – постепенное начало в течение 1–6 месяцев и нарастание КК на протяжении нескольких лет.
Общая сумма баллов по шкале повседневной активности Schwab и England составила 68,3±19,5 баллов в основной группе и 72,0±15,8 баллов в группе сравнения; по шкале выраженности основных симптомов БП (UPDRS) – 54,7 ±17,9 баллов в основной группе и 53,2±18,9 баллов в группе сравнения; по шкале оценки качества жизни больных БП PDQ-39 – 106,0±21,3 баллов в основной группе и 100,1±25,3 баллов в группе сравнения).
У 58 больных (82,9%) четкой связи между появлением КК и началом приема дофаминергических препаратов не отмечалось, только у 18 больных (25,7%) выявлена четкая связь появления КК с началом дофаминергической терапии.
У 27 больных (38,6%) отмечалось ухудшение позы в off-периоде, у 8 пациентов (11,4%) в утренние часы после ночного перерыва в приеме препаратов отмечалось явное ухудшение позы, нивелирующееся в дневное время. Тридцати пяти пациентам с БП, у которых отмечалось нарастание позных расстройств в период выключения и в утренние часы (дистонии периода выключения и раннего утра), для удлинения эффекта однократной дозы леводопы и стабилизации концентрации препарата в крови был назначен комбинированный препарат препарат леводопа/карбидопа/энтакапон (Сталево) в средней суточной дозе 610 мг. Применение такого препарата, включающего ингибитор фермента катехол-О-метилтрансферазы (КОМТ) – энтакапон, является одним из конструктивных подходов к улучшению эффективности леводопатерапии. Процесс метилирования леводопы происходит на периферии (в желудочно-кишечном тракте и в кровеносном русле) и в головном мозге. При этом КОМТ отвечает за 10% катаболизма леводопы на периферии. Метилирование может быть заторможено путем назначения ингибитора КОМТ периферического действия энтакапона (рис. 1).
Рисунок 1. Оптимизация фармакокинетики леводопы.
Ингибиторы КОМТ увеличивают биодоступность леводопы, уменьшая уровень ее неактивных метаболитов. Энтакапон не проходит ГЭБ и препятствует метилированию леводопы в желудочно-кишечном тракте и кровеносном русле, благодаря этому сохраняется более высокий уровень леводопы, которая после прохождения ГЭБ служит материалом для синтеза дофамина в головном мозге. На фоне приема энтакапона период полужизни леводопы удлиняется на 25–75% (рис. 2).
Назначение Сталево больным БП с ухудшением позных расстройств в период окончания действия дозы леводопы позволило снизить выраженность тораколюмбального угла на 10% и болевого синдрома – на 35%, и тем самым улучшить качество периода «выключения». Терапия Сталево позволила значительно уменьшить выраженность моторных флуктуаций.
Рисунок 2. Изменение периода полужизни леводопы в плазме при добавлении энтакапона.
Заключение. Таким образом, согласно клиническим наблюдениям, большинство пациентов страдали от КК даже в положении сидя (62,9%), КК наблюдалась в течение всего дня (77,1%), ухудшение КК отмечалось после физической нагрузки или стресса (57,1% и 10% соответственно). В основном пациенты использовали для передвижения трость (37,1%); некоторые из-за тяжести КК даже вынуждены были использовать ходунки (5,7%). Более отдаленным последствием КК являлись нарастание постуральной нестабильности и увеличение частоты падений. У большинства пациентов БП с КК наблюдались боли в спине (88,6%) и имелся предшествующий вертеброгенный анамнез (66%). В значительном большинстве случаев КК была более инвалидизирующим фактором для пациентов, чем классические двигательные симптомы БП. У 25,7% пациентов выявлена четкая связь между появлением КК и началом дофаминергической терапии. У 51,4% больных отмечалась четкая зависимость степени выраженности КК от моторных флюктуаций: ухудшение в период выключения действия дофаминергических препаратов зафиксировано у 38,6% больных; у 11,4% пациентов отмечалось ухудшение позы в утренние часы. В данном исследовании выявлена эффективность нового трехкомпонентного препарата леводопа/карбидопа/энтакапон (Сталево) в лечении позных расстройств (дистонии мышц туловища) периода окончания дозы за счет стабилизации концентрации леводопы в крови и удлинения периода ее полужизни в плазме.
Гемоперитонеум
МКБ-10
Общие сведения
Гемоперитонеум (лапарогеморрагия, кровотечение в брюшную полость, интраабдоминальное кровотечение) является часто встречающимся состоянием в абдоминальной хирургии, гастроэнтерологии, гинекологии, травматологии, медицине катастроф. При гемоперитонеуме происходит излитие и скопление свободной жидкости (крови) между висцеральным и париетальным листками брюшины. Подозрение на данную патологию требует неотложной госпитализации и оказания хирургического пособия. Гибель пациентов с интраабдоминальным внутренним кровотечением чаще всего наступает от травматического шока и острой кровопотери.
Причины гемоперитонеума
Гемоперитонеум может осложнять широкий круг состояний: закрытые повреждения живота, торакоабдоминальные травмы, патологические процессы в брюшной полости и забрюшинном пространстве, оперативные вмешательства, гинекологические заболевания и т. д. Гемоперитонеум развивается вследствие нарушения целостности сосудов брюшной полости и может иметь травматическое и нетравматическое происхождение.
Травматический гемоперитонеум возникает при тупых тупых травмах живота (ударах, падениях, ДТП, сдавлении), проникающих (огнестрельных, ножевых) ранениях живота, интраоперационной травме. При этом чаще всего повреждаются паренхиматозные органы – печень, селезенка, поджелудочная железа, а также сосуды, проходящие в связках, складках брюшины, брыжейках кишок, сальнике. Повреждение внутренних органов костными отломками может наблюдаться при переломе нижних ребер.
Нетравматический гемоперитонеум встречается при внематочной беременности, апоплексии яичника, разрыве аневризмы аорты, гемангиоме печени, заболеваниях, приводящих к снижению свертываемости крови (механической желтухе, малярии, болезнях крови, геморрагических диатезах), длительной терапии фибринолитиками и антикоагулянтами.
В хирургической практике патология может развиваться в результате повреждения органов при проведении инвазивной диагностики (ангиографии, пункционной биопсии), прорезывания или соскальзывания операционных лигатур после операций резекции желудка, аппендэктомии, грыжесечения, гемиколэктомии, холецистэктомии, надвлагалищной ампутации матки, нефрэктомии, спленэктомии, резекции печени и др.
Симптомы гемоперитонеума
Клинические проявления определяются характером повреждения, интенсивностью внутрибрюшного кровотечения и величиной кровопотери. Внезапно возникающий гемоперитонеум сопровождается признаками геморрагического шока и локальными симптомами. Острая кровопотеря проявляется головокружением, потемнением в глазах, бледностью кожных покровов и видимых слизистых, холодным потом, жаждой, адинамией, обморочным состоянием, иногда – двигательным возбуждением. Объективно определяется тахикардия (120-140 уд. в мин.) с пульсом слабого наполнения, артериальная гипотония.
Острая резкая боль в брюшной полости может носить локальный или диффузный, разлитой характер; при раздражении кровью диафрагмальной брюшины иррадиирует в надплечье и лопатку. Нарастающий или массивный гемоперитонеум может сопровождаться увеличением объема живота; иногда (обычно у детей) – синюшностью пупка, сквозь который просвечивает кровь. Наблюдается, так называемый, симптом «ваньки-встаньки», когда пациент стремится занять сидячее положение, уменьшающее боль в животе.
Диагностика
При осмотре пациента абдоминальный хирург обращает внимание на признаки травмы – ссадины, гематомы в области передней брюшной стенки. В ходе поверхностной пальпации определяется мягкий, умеренно болезненный живот, ограниченно участвующий в акте дыхания, положительный перитонеальный симптом Щеткина-Блюмберга, растяжение передней брюшной стенки и ригидность ее мышц. Глубокая пальпация позволяет выявить резкую болезненность в области травмы или поврежденного органа. При перкуссии живота отмечается притупление перкуторного звука, болезненность, при аускультации – ослабление или отсутствие кишечных шумов.
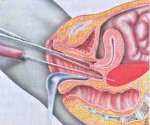
Пальцевое ректальное исследование позволяет определить нависание передней стенки прямой кишки. Данные гинекологического исследования характеризуются выявлением уплощения сводов влагалища, их болезненности, нависания заднего свода. При внематочной беременности важное диагностическое значение приобретает проведение пункции заднего свода влагалища (кульдоцентеза). В лабораторных анализах крови выявляются признаки кровотечения – снижение уровня гематокрита, нарастающее уменьшение количества эритроцитов и гемоглобина.
С помощью УЗИ органов малого таза, УЗИ брюшной полости и ретроперитонеального пространства диагностируется наличие анэхогенной жидкости или организованных гематом в брюшной полости. Обзорная рентгенография брюшной полости также позволяет выявить наличие свободной жидкости, провести дифференциальную диагностику гемоперитонеума с гематомой передней брюшной стенки, забрюшинной гематомой и прободной язвой желудка. Окончательная диагностика производится с помощью пункции брюшной полости и введения «шарящего» катетера либо лапароскопии.
Лечение гемоперитонеума
При подозрении на данную патологию показана экстренная госпитализация пациента в отделение абдоминальной хирургии. На этапе доврачебной помощи категорически запрещается введение обезболивающих, в т. ч. наркотических, препаратов. При массивном кровотечении для борьбы с гиповолемическим шоком осуществляется интенсивная терапия, включающая введение аналептиков, переливание растворов и кровезаменителей, проведение реанимационных мероприятий. При недавнем внутрибрюшном кровотечении может быть произведена реинфузия крови, излившейся в брюшную полость крови.
В условиях хирургического стационара пациентам с гемоперитонеумом показано проведение лапаротомии для выявления источника кровотечения и его остановки. При травматических повреждения внутренних органов может производиться резекция печени, спленэктомия, лигирование сосудов и др. вмешательства. При внематочной беременности или апоплексии яичника выполняется тубэктомия, удаление придатков. В постоперационном периоде проводится гемостатическая, антибактериальная терапия; осуществляется мониторинг показателей крови, АД, пульса; выполняется динамическое УЗИ, КТ органов брюшной полости и забрюшинного пространства.
Прогноз и профилактика
Прогноз при гемоперитонеуме всегда серьезный. Показатели смертности различаются в зависимости от возраста пациентов, причины кровотечения, наличия сопутствующих соматических патологий, объема кровопотери, своевременности доставки в медицинское учреждение. Наибольшее количество летальных исходов наблюдается при разрывах аневризмы аорты у пожилых пациентов (почти 30%). Профилактика включает предупреждение травматизма, соблюдение техники проведения операций и манипуляций, своевременное выявление и лечение заболеваний, которые могут стать причиной гемоперитонеума.