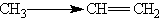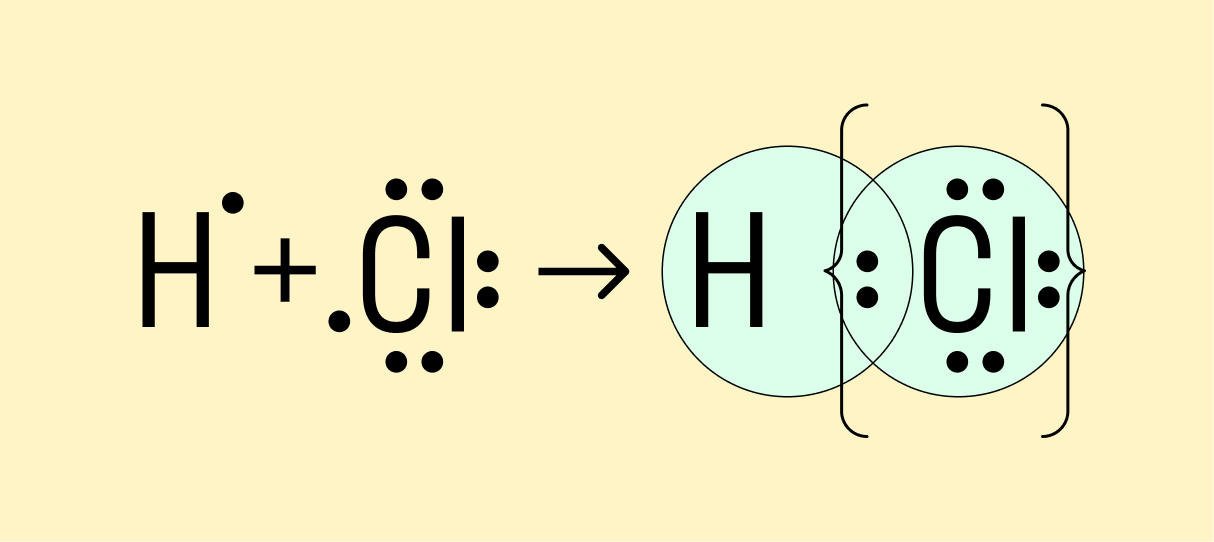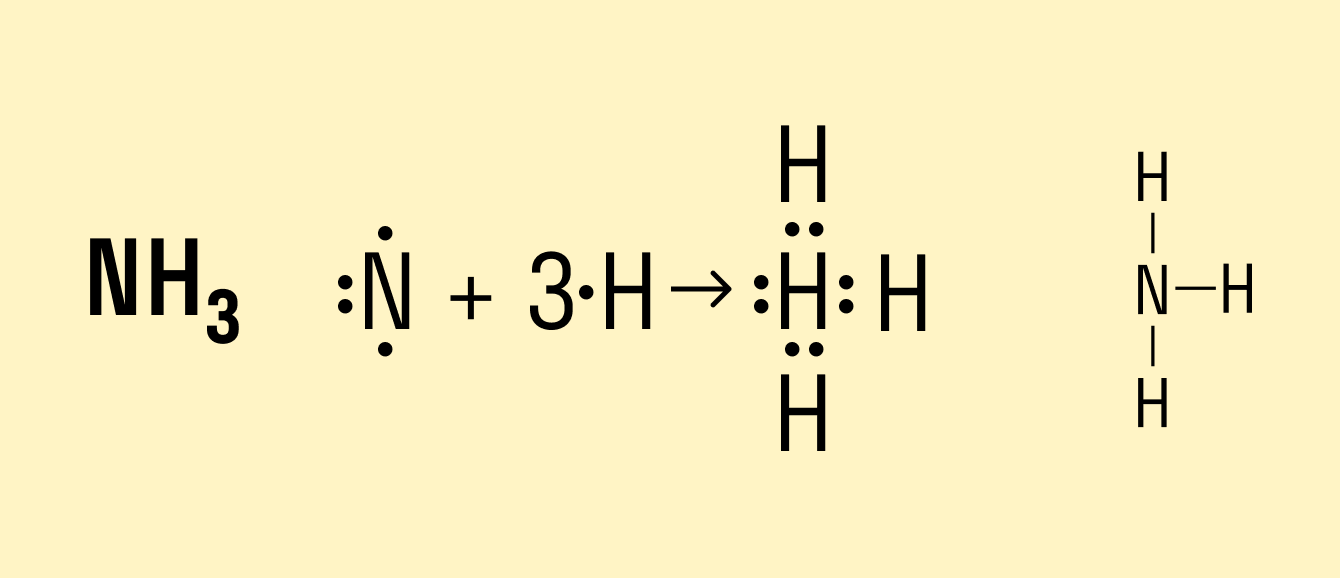Что такое смещение электронной плотности



Электронными эффектами называют смещение электронной плотности в молекуле под влиянием заместителей.
В зависимости от того, удаляется ли электронная плотность от рассматриваемого атома углерода или приближается к нему, индуктивный эффект называют отрицательным (-I) или положительным (+I). Знак и величина индуктивного эффекта определяются различиями в электроотрицательности между рассматриваемым атомом углерода и группой, его вызывающей.
Электронодонорные заместители, т. е. атом или группа атомов, смещающие электронную плотность к атому углерода, проявляют положительный индуктивный эффект (+I-эффект).
+I-эффект проявляют алифатические углеводородные радикалы, т. е. алкильные радикалы (метил, этил и т. д.).
Наличие электронных эффектов ведет к перераспределению электронной плотности в молекуле и появлению частичных зарядов на отдельных атомах. Это определяет реакционную способность молекулы.
Классификация органических реакций.В ходе реакции в молекулах реагирующих веществ разрываются одни химические связи и образуются другие. Органические реакции классифицируются по типу разрыва химических связей в реагирующих частицах. Из их числа можно выделить две большие группы реакций — радикальные и ионные.
Радикальные реакции — это процессы, идущие с гомолитическим разрывом ковалентной связи. При гомолитическом разрыве пара электронов, образующая связь, делится таким образом, что каждая из образующихся частиц получает по одному электрону. В результате гомолитического разрыва образуются свободные радикалы:
Органическая химия 2. Взаимное влияние атомов в молекулах органических соединений
Продолжаем разбирать основы органической химии. В теории Бутлерова сказано, что одна из особенностей строения веществ — взаимное влияние атомов друг на друга. Химические связи определяют свойства соединений. Например, в зависимости от радикалов и полярности связей в бензольном кольце новые атомы замещаются в разных положениях. Теория взаимного влияния атомов в молекуле — достаточно сложная тема. В статье мы разберем ее основы. Если вы хотите понимать химию лучше, запишитесь на курсы подготовки к ЕГЭ, где каждый раздел изучается подробно.
Химические связи в органических веществах
Прежде чем изучать влияние атомов друг на друга, нужно разобраться в природе связей в молекулах органических соединений. Вещества в органике образованы неметаллами — углеродом, кислородом, водородом, азотом, серой. Элементы связаны между собой ковалентными полярными связями. Они образуются в результате появления общих электронных пар. Рассмотрим на примере неорганического вещества — HCl. Водород имеет всего один электрон. Он и участвует в образовании соединений. У хлора на внешнем уровне 7 валентных электронов. Происходит объединение, при котором образуется общая плотность с 8 электронами. Хлор — более электроотрицательный элемент, поэтому он оттягивает на себя электронную плотность.
Это влияет на свойства органических соединений. Когда молекула HCl распадается (например, в водных растворах), хлор забирает себе электроны и становится анионом с зарядом —. Он будет взаимодействовать с электроположительными областями, то есть является нуклеофилом. Водород лишается электрона, поэтому становится катионом с зарядом +. В реакциях он выступает в роли электрофила, взаимодействуя с электроотрицательными участками. Напомним, что при распаде молекул с неполярной связью образуются радикалы — нейтральные частицы.
Смещение электронной плотности
Индуктивный эффект
Мезомерный эффект
Перед изучением мезомерного влияния атомов в молекулах органических веществ разберемся в таком понятии, как π-система. Как вам наверное известно, π-связь — часть кратной. Если в молекуле есть одна двойная или тройная связь, то она локализована, так как взаимодействует только с ядрами соседних атомов. Если же таких связей несколько и они разделены одним простым (сигма) переходом, то они делокализуются. Электронная плотность распределяется между всеми атомами, благодаря чему образуется сопряженная система. Простейшей π-системой является бутадиен-1,3. Кроме того, она реализуется в бензольном кольце. Сопряженные связи являются чем-то средним между одинарными и двойными. Они меняют свойства органических веществ.
Мезомерный эффект — это взаимное влияние атомов в молекуле с π-связями. В случае отрицательного эффекта электронная плотность притягивается атомом, в случае положительного — отталкивается.
Определение свойств веществ
Разберем примеры взаимного влияния атомов в молекулах. Сравним кислотные свойства фенола, этанола и азотной кислоты. Все три соединения можно описать общей формулой Х-О-Н. При этом электронная плотность смещается к более отрицательному кислороду, что обеспечивает отщепление водорода и, соответственно, кислотные свойства: Х-О←Н. Осталось определить, насколько сильно это взаимодействие:
У этанола вместо Х стоит углеводородный радикал. Он обладает положительным индуктивным эффектом, из-за чего полярность связи О-Н снижается. У вещества очень слабые кислотные свойства.
Особенность фенола — наличие бензольного кольца. У кислорода есть неподеленная электронная пара, которая вступает в сопряжение с π-системой. Благодаря этому электронная плотность стягивается в кольцо, водород становится более подвижным. Кислотные свойства фенола сильнее, чем у этанола, но слабее азотной кислоты.
Итак, мы разобрались с взаимным влиянием атомов в молекуле, узнали о мезомерном и индуктивном эффектах. Эти термины не встречаются в ЕГЭ по химии, но они позволяют лучше понимать природу соединений и предсказывать их химические свойства. Разберитесь с теорией из статьи, а также уделите время практике, определяя эффекты у разных веществ. Это можно делать самостоятельно, а можно записаться на курсы и решать задачи под руководством преподавателя. В любом случае мы уверены — при должной подготовке вы сможете набрать высокие баллы на ЕГЭ.
Ковалентные неполярные и полярные связи
Что такое ковалентная связь
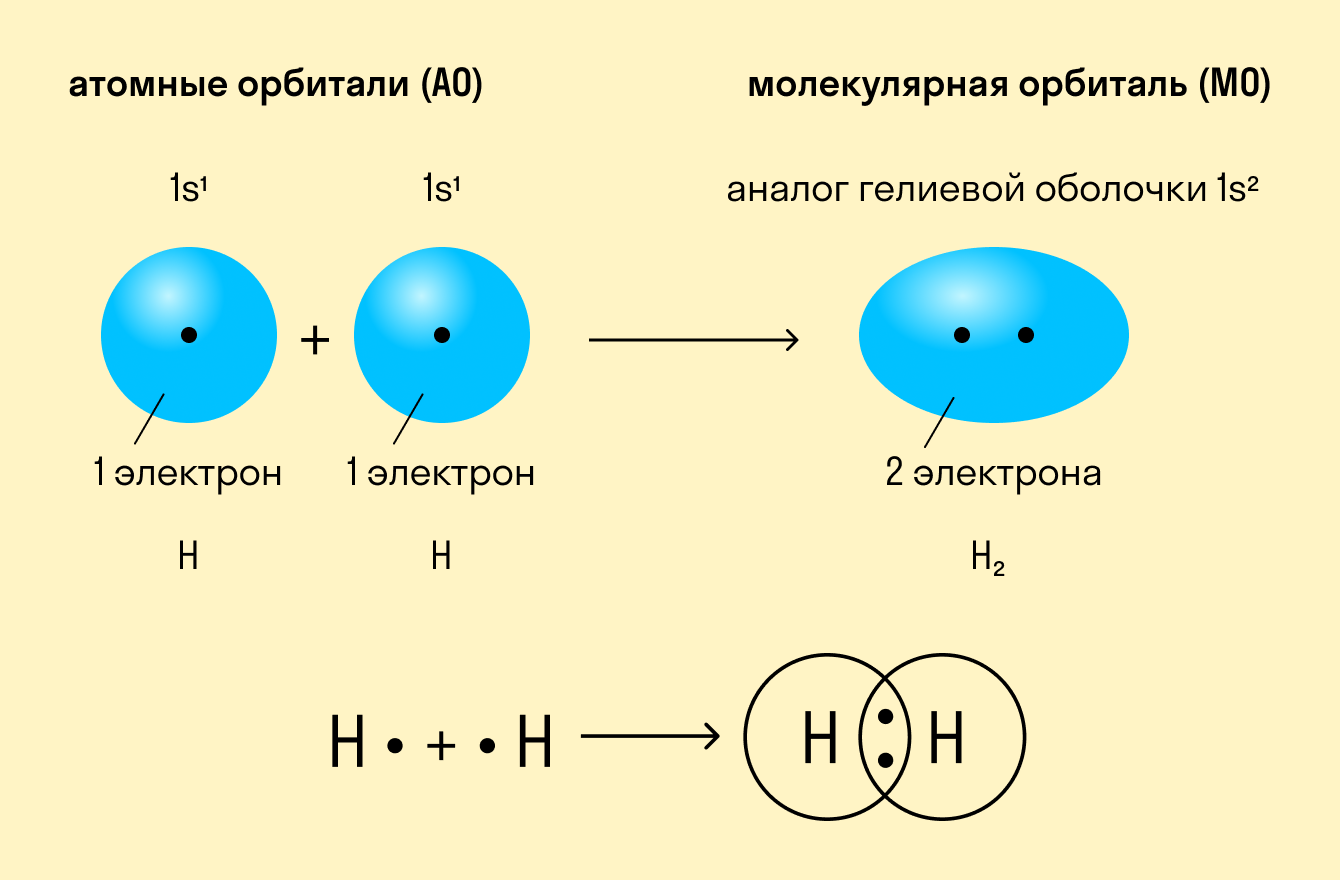
На примере ковалентных связей удобно описывать механизм химической связи в целом. Впервые это сделал американский ученый Гилберт Льюис, анализируя взаимодействие между частицами в молекулах водорода, азота, кислорода и других простых неметаллов.
Как происходит такое взаимодействие? Атом водорода отличается очень простым строением — его электронное облако или орбиталь содержит лишь один свободный (валентный) электрон. При сближении двух атомов водорода их орбитали пересекаются и начинают частично перекрывать друг друга.
Свободные электроны на этих орбиталях объединяются в пару, которая принадлежит обоим участникам взаимодействия. Это и есть процесс образования ковалентной связи. По ее итогам каждый атом имеет уже два электрона и приобретает устойчивую внешнюю оболочку.
Ковалентная связь — это образование общей электронной пары у двух атомов вещества при сближении ядер этих атомов.
В зависимости от того, будет ли пара принадлежать обоим атомам в равной мере или сместится к одному из них, ковалентная связь бывает полярной или неполярной.
Ковалентная неполярная связь
Приведенный выше пример с атомами водорода иллюстрирует ковалентную неполярную связь. Образованная пара электронов находится на общей молекулярной орбитали и принадлежит обоим атомам. Это происходит потому, что в простых веществах взаимодействуют атомы с одинаковой электроотрицательностью (ЭО), т. е. они имеют равную способность притягивать электроны.
Ковалентная неполярная связь — это такое взаимодействие двух атомов, при котором их общая пара электронов равноудалена от атомных ядер и одинаково принадлежит обоим атомам. Другими словами, электронная плотность (область, в которой наиболее вероятно нахождение электронов) распределена равномерно.
Ковалентная неполярная связь образуется между атомами элементарных веществ с одинаковой ЭО.
Интересный пример ковалентной связи этого типа — молекула ромбической серы S8. У атома серы есть 2 свободных электрона, поэтому он может образовать 2 связи. Это простое вещество, а значит, все атомы будут притягивать электроны с одинаковой силой.
Формула данного вещества с ковалентной неполярной связью:
Ковалентная полярная связь
Мы рассмотрели, как проходит ковалентная химическая связь в молекулах, где все частицы одинаковы. Но если сблизить два атома с разной ЭО — например, водорода и хлора, получится другая картина. Поскольку у хлора ЭО выше и он притягивает электроны немного сильнее, чем водород, общая пара смещается в его сторону. Другими словами, у такой химической связи есть полярность.
Атом, принимающий электроны (в данном случае хлор), приобретает условно отрицательный заряд. Второй же атом, отдающий валентные электроны, заряжается положительно.
Ковалентная полярная связь — это электронный обмен между двумя атомами в молекуле вещества, при котором общая пара электронов смещается к одному атому (более электроотрицательному). Электронная плотность распределена неравномерно.
Ковалентная полярная связь образуется между атомами неметаллов с разной ЭО в составе сложных веществ.
Проиллюстрируем все, о чем сказано в определении ковалентной полярной связи, на примерах.
В молекуле аммиака NH3 атом азота имеет 3 свободных электрона, т. е. может образовать 3 химические связи. Поскольку это сложное вещество, состоящее из атомов неметаллов, можно говорить о полярности. Атом азота имеет общие электронные пары с тремя атомами водорода. При этом азот обладает более высокой ЭО, чем водород, поэтому электронная плотность смещена в его сторону.
Формула данного вещества с ковалентной полярной связью:
Механизмы образования ковалентной связи
Не всегда взаимодействие атомов происходит так, как в молекуле водорода. Иногда один атом отдает оба электрона, а второй забирает их на свою свободную орбиталь. В зависимости от этого выделяют два механизма ковалентной связи:
Обменный механизм — объединение в пару свободных электронов от взаимодействующих атомов (по одному электрону от каждого).
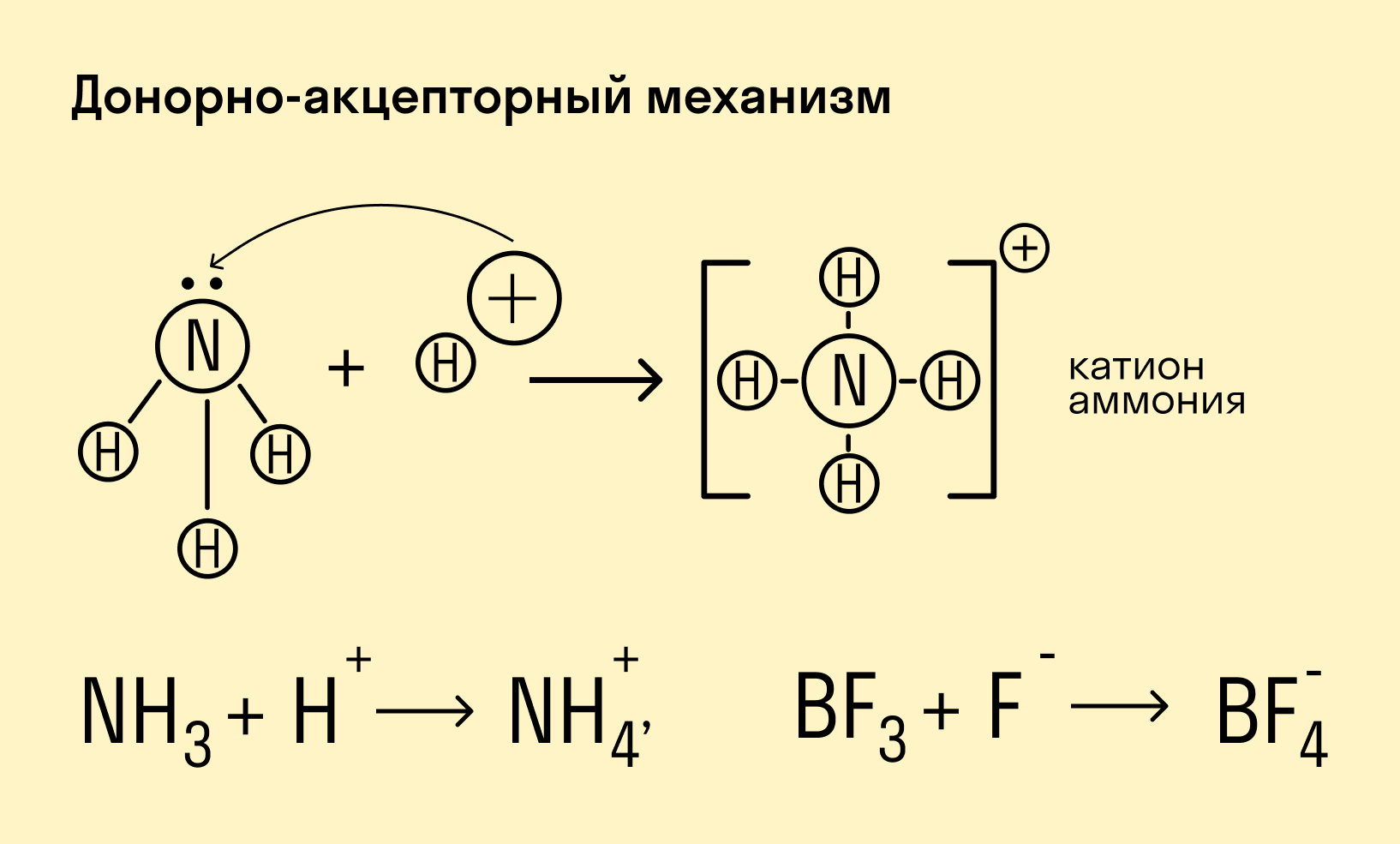
Донорно-акцепторный механизм — процесс, при котором атом-донор отдает два электрона, а атом-акцептор предоставляет для них орбиталь.
Химическую связь, образованную по донорно-акцепторному принципу, можно рассмотреть на примере молекулы катиона аммония. В данном случае атом азота, который содержится в аммиаке NH3, имеет неподеленную пару электронов и является донором. Он передает эти электроны на орбиталь атома водорода — акцептора. В результате такой связи образуется молекула NH4 + в форме тетраэдра, где углы представлены четырьмя атомами водорода.
Вещества, в молекулах которых есть хотя бы одна ковалентная химическая связь, осуществляемая по донорно-акцепторному принципу:
Электронными эффектами называют смещение электронной плотности в молекуле под влиянием заместителей.
В зависимости от того, удаляется ли электронная плотность от рассматриваемого атома углерода или приближается к нему, индуктивный эффект называют отрицательным (-I) или положительным (+I). Знак и величина индуктивного эффекта определяются различиями в электроотрицательности между рассматриваемым атомом углерода и группой, его вызывающей.
Электронодонорные заместители, т. е. атом или группа атомов, смещающие электронную плотность к атому углерода, проявляют положительный индуктивный эффект (+I-эффект).
+I-эффект проявляют алифатические углеводородные радикалы, т. е. алкильные радикалы (метил, этил и т. д.).
Наличие электронных эффектов ведет к перераспределению электронной плотности в молекуле и появлению частичных зарядов на отдельных атомах. Это определяет реакционную способность молекулы.
Классификация органических реакций.В ходе реакции в молекулах реагирующих веществ разрываются одни химические связи и образуются другие. Органические реакции классифицируются по типу разрыва химических связей в реагирующих частицах. Из их числа можно выделить две большие группы реакций — радикальные и ионные.
Радикальные реакции — это процессы, идущие с гомолитическим разрывом ковалентной связи. При гомолитическом разрыве пара электронов, образующая связь, делится таким образом, что каждая из образующихся частиц получает по одному электрону. В результате гомолитического разрыва образуются свободные радикалы:
Урок «Электронные эффекты в молекулах органических веществ». (10 класс)
Урок «Электронные эффекты в молекулах органических веществ».
учитель химии МАОУ «Лицей 29» г. Тамбов
Дегтярева Елена Эдуардовна.
Цель : расширить у учащихся представление о взаимном влиянии атомов в молекулах органических веществ, изучив индукционный и мезомерный эффекты.
дать представление о положительном и отрицательном индуктивном и мезомерном эффектах;
познакомить учащихся с электродонорными и электроакцепторными заместителями;
показать влияние электронных эффектов на строение и химические свойства молекул органических веществ;
сравнить индуктивный и мезомерный эффекты.
Тип урока : изучение нового материала.
Вступительное слово учителя: При изучении теории Бутлерова мы познакомились с положением о взаимном влиянии атомов: «Атомы и группы атомов, входящие в состав молекулы, оказывают друг на друга взаимное влияние. В наибольшей мере такое влияние проявляется для атомов и групп, непосредственно связанных между собой». Данное явление общее для всех веществ – неорганических и органических, в качестве иллюстрации к сформулированному положению рассмотрим примеры влияния атомов в неорганических веществах.
Учитель: Ребята, сравните силу кислот:
Учитель: В чем проявляется сила кислот?
Ученик : сила кислот проявляется в способности диссоциировать в водном растворе;
Учитель: Степень диссоциации кислоты зависит: а) от прочности связи между атомами водорода и галогена: чем слабее связь, тем легче происходит её разрыв;
б) от поляризуемости связи – способностью изменять свою полярность под действием внешних факторов (в данном случае – молекул Н 2 О)
Учитель: В ряду галогеноводородных кислот:
H → F ; H → Cl ; H → Br ; H → I
Увеличивается радиус атома галогена,
уменьшается прочность связи
Таким образом, природа галогена определяет силу кислот.
Следует отметить, что Н F (плавиковая кислота) относится к слабым кислотам, степень её диссоциации мала, так как между молекулами кислоты образуются водородные связи.
Учитель: Различают два типа взаимного влияния атомов в молекулах органических веществ: индуктивный эффект (обозначается I ) и эффект сопряжения или мезомерный эффект (обозначается М)
Учитель: Развивающаяся на основе современной квантовой механики электронная теория позволила глубже подойти к закономерностям взаимного влияния атомов в молекулах. Рассматривая проявления взаимного влияния атомов как результат различных типов смещения электронов межатомными связями, можно объяснить направление многих реакций и превращений молекул.
Взаимное влияние атомов обуславливает полярность и поляризуемость связей в органических молекулах. Электрическая асимметрия ковалентной связи в органических молекулах, построенных из атомов с различной электроотрицательностью (ЭО), изменяет состояние связей и заряды всех атомов молекулы.
Учитель: Что такое электроотрицательность?
Ученик: электроотрицательность элемента характеризует способность его атома в молекуле притягивать к себе общую электронную пару.
Учитель: Как меняется электроотрицательность элементов по Периодической системе?
Ученик: Элeктроотрицательность элементов подчиняется периодическому закону: она растет слева направо в периодах и снизу вверх в главных подгруппах периодической системы элементов Д.И. Менделеева.
Учитель: Если в органической молекуле атом водорода заменить на атом, обладающий большей электроотрицательностью, то этот атом не только оттягивает пару общих электронов непосредственно связанных углеродных атомов, но и вызывает смещение электронных пар у более удаленных атомов:
Этот тип взаимного влияния атомов называется индуктивным эффектом « J ». Индуктивным эффект ─ это смещение электронной плотности по σ-связи к атому углерода или от него – вследствие различия электроотрицательности связанных атомов.
Индуктивный эффект заместителя является отрицательным – J , если заместитель уменьшает электронную плотность на данном атоме углерода, индуцируя на нем частичный положительный заряд +, сам при этом приобретает частичный отрицательный заряд δ-.
Отрицательный индуктивный эффект – J проявляют заместители — электроноакцепторы, обладающие большей электроотицательностью, чем водород:
б) кислород-, азот-, сера- содержащие группы
в) группы с δ+ на ключевом атоме
В случае сложных заместителей отрицательный индуктивный эффект определяется природой атомов, составляющих заместитель. Кроме этого, индуктивный эффект зависит от характера гибридизации атомов. Так, электроотрицательность атомов углерода зависит от гибридизации электронных орбиталей и изменяется в следующем направлении:
a ) алкильные группы:
б) отрицательно заряженные атомы или группы: O — , COO — и др.
Таким образом, при индуктивном эффекте взаимное влияние атомов передается вдоль углеродной цепи с силой, затухающей по мере удаления от атома, притягивающего или отталкивающего электроны.
Учитель: Ребята, выделите основные признаки индукционного эффекта?
смещение электронной плотности по цепи σ-связей;
обусловлено различной электроотрицательностью атомов;
Мезомерный эффект (эффект сопряжения)
Мезомерный эффект (М) – перераспределение электронной плотности кратных связей в ненасыщенных сопряженных системах за счет взаимодействия π-электронных облаков с соседними π- или р- электронными облаками в результате которого образуется общее π-электронное облако. Электронная плотность выравнивается между всеми атомами в молекуле.
Отмечаем, что в отличие от индукционного эффекта, избыток электронной плотности частично (реже полностью) перемещается в октеты соседних атомов.
Перераспределение электронной плотности приводит к изменению кратности связей; одинарные приобретают частично (реже полностью) двойной характер и укорачиваются, двойные связи становятся длиннее или превращаются в одинарные.
Молекулы, содержащие две или несколько чередующихся двойных связей, разделенных -связью, называются сопряженными системами:
Положительным мезомерным эффектом +М обладают заместители, подающие электронную плотность в сопряженную систему (электронодоноры). К ним относятся группы, которые, как правило, связаны с сопряж е нной системой через атом, обладающий орбиталью с неподел ѐ нной парой электронов:
Мезомерный эффект или π- π-сопряжение, проявляется в молекулах, имеющих π- связи, разделенные одной σ-связью.
Например, в молекуле бутадиена-1,3 происходит перекрывание р-орбиталей не только в пространстве между атомами С1— С2 и С3— С4, но и в пространстве между атомами С2— С3 (рис. 1)..
Рис. 1. Эффект сопряжения в молекуле бутадиена-1,3.
При этом образуется единое 4-х электронное облако. Эффект сопряжения приводит к изменению длины связи:
• длина одинарной связи здесь – 0,146 нм ( в алканах 0,154 нм);
• длина двойной связи – 0,137 нм (в алкенах 0,133 нм).
Негибридные р-орбитали шести атомов углерода в молекуле бензола перекрываются в единую π-электронную систему (рис.2). Эффект сопряжения в молекуле бензола также приводит к выравниванию длины углерод-углеродных связей. Длина всех связей между атомами углерода в молекуле бензола равна 0,140 нм.
Рис. 2 Образование π-системы в молекуле бензола
Эффект сопряжения является важным фактором протекания химических реакций.
Особую роль элекронные эффекты играют в реакциях ароматических углеводородов.
В молекулах гомологов бензола имеет место взаимное влияние радикала, находящегося в боковой цепи, и бензольного ядра.
Рис. 3 р –π-сопряжение в молекуле фенола
Рис. 4 р –π-сопряжение в молекуле фенола
В качестве примера рассмотрим взаимное влияние атомов в молекуле фенола.
Учитель: Итак, напомним как показывается перераспределение электронной плотности в случае I- и М- эффектов:
Ученик: I : прямая стрелка
М: изогнутая стрелка
Стрелка означает смещение электронной пары. Поэтому начало стрелки должно быть либо на неподеленной паре электронов, либо на двойной связи, конец стрелки можно направить либо на атом, либо на связь.
Один и тот же заместитель может проявлять разные электронные эффекты в зависимости от того, с каким радикалом он связан.
Рассмотрим фенол и бензиловый спирт:
Таким образом, в сопряженных молекулах мезомерный эффект проявляется одновременно с индуктивным и может либо совпадать с ним по знаку, либо иметь противоположный знак. При несовпадении знаков индуктивного и мезомерного эффектов заместителей учитывают их суммарное действие (табл. 1).
Учитель: Для лучшего запоминания этой темы составляем опорный конспект (табл.2), отличия индуктивного и мезомерного эффектов:
Таблица 1
Перехода электронов от одного атома к другому не происходит
Возможен переход электронов из оболочки одного атома в оболочку другого
Быстро ослабляется (распространяется на 3-4 связи)
Передается по цепи сопряженных связей без ослабления