Что такое соли химия 8 класс определение
Что такое соли химия 8 класс определение
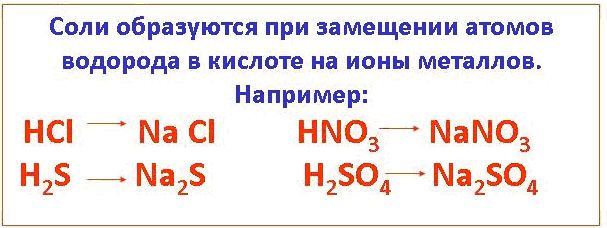
Соли – это такие сложные вещества, которые состоят из атомов металла и кислотных остатков. В некоторых случаях соли в своем составе могут содержать водород.
Если мы внимательно подойдем к рассмотрению этого определения, то заметим, что по своему составу соли чем-то похожи на кислоты, только с той разницей, что кислоты состоят из атомов водорода, а соли содержат ионы металла. Из этого следует, что соли являются продуктами замещения атомов водорода в кислоте на ионы металла. Так, к примеру, если взять известную каждому поваренную соль NaCl, то ее можно рассматривать как продукт замещения водорода в соляной кислоте НС1 на ион натрия.
Но бывают и исключения. Взять, например, соли аммония, в них кислотные остатки с частицей NH4+, а не с атомами металла.
Типы солей
А теперь давайте более подробно рассмотрим классификацию солей.
Физические свойства солей
Мы уже с вами знаем, что соли являются твердыми веществами, но следует знать, им свойственна различная растворимость в воде.
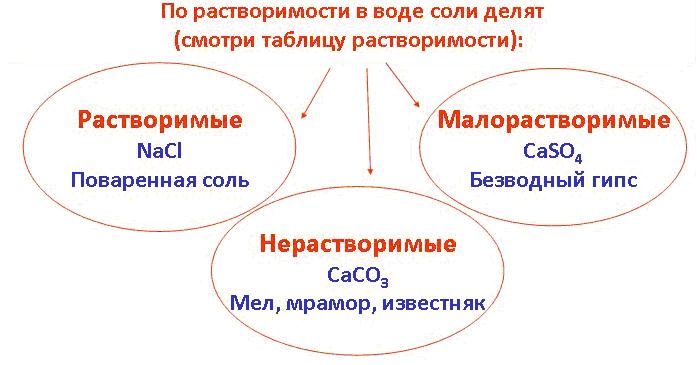
Если рассматривать соли с точки зрения растворимости в воде, то их можно поделить на такие группы, как:
— растворимые (Р),
— нерастворимые (Н)
— малорастворимые (М).
Номенклатура солей
Чтобы определить степень растворимости солей, можно обратиться к таблице растворимости кислот, оснований и солей в воде.
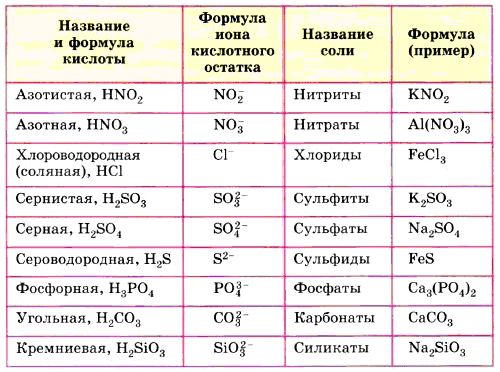
Как правило, все названия солее состоят из названий аниона, который представлен в именительном падеже и катиона, который стоит в родительном падеже.
Например: Na2SO4 — сульфат (И.п.) натрия (Р.п.).
Кроме того, для металлов в скобках указывают переменную степень окисления.
Возьмем для примера:
FeSO4 — сульфат железа (II).
Также следует знать, что существует международная номенклатура названия солей каждой кислоты, зависящая от латинского названия элемента. Так, например, соли серной кислоты, называются сульфатами. К примеру, СаSO4 – носит название сульфата кальция. А вот хлоридами называют соли соляной кислоты. Например, всем нам знакомая, NaCl называется хлоридом натрия.
Если же соли двухосновных кислот, то к их названию прибавляют частицу «би» или «гидро».
Например: Mg(HCl3)2 – будет звучать, как бикарбонат или гидрокарбонат магния.
Если в трехосновной кислоте один из атомов водорода заменить на металл, то следует еще добавить приставку «дигидро» и мы получим:
NaH2PO4 – дигидрофосфат натрия.
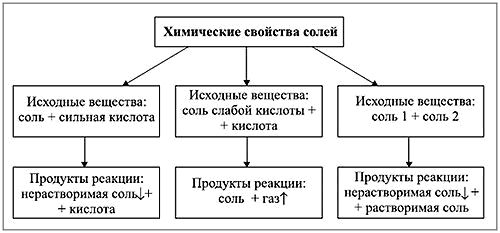
Химические свойства солей
А сейчас перейдем к рассмотрению химических свойств солей. Дело в том, что они определяются свойствами катионов и анионов, которые входят в их состав.
Значение соли для человеческого организма
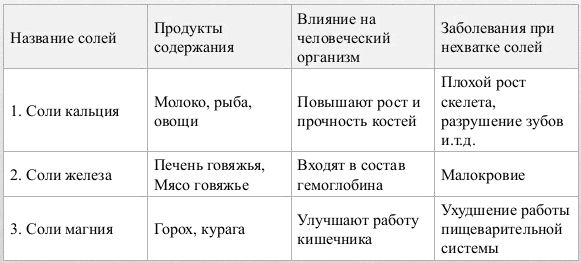
В обществе давно идут дискуссии о вреде и пользе соли, которую она оказывает на организм человека. Но какой бы точки зрения не придерживались оппоненты, следует знать, что поваренная соль это минеральное природное вещество, которое жизненно необходимо для нашего организма.
Также следует знать, что при хронической нехватке в организме хлорида натрия, можно получить летальный исход. Ведь, если вспомнить уроки биологии, то нам известно, что тело человека на семьдесят процентов состоит из воды. А благодаря соли происходят процессы регулирования и поддержки водного баланса в нашем организме. Поэтому исключать употребление соли ни в коем случае нельзя. Конечно же, безмерное употребление соли так же ни к чему хорошему не приведет. И тут напрашивается вывод, что все должно быть в меру, так как ее недостаток, также как и избыток могут привести к нарушению баланса в нашем рационе.
Применение солей
Соли нашли свое применение, как в производственных целях, так и в нашей повседневной жизни. А сейчас давайте рассмотрим более детально и узнаем, где и какие соли чаще всего применяются.
• Соли соляной кислоты
Из этого вида солей чаще всего используют хлорид натрия и хлорид калия. Поваренную соль, которую мы с вами употребляем в пищу добывают из морской, озерной воды, а также на соляных шахтах. И если хлорид натрия мы употребляем в пищу, то в промышленности его используют для получения хлора и соды. А вот хлорид калия незаменим в сельском хозяйстве. Его применяют, как калийное удобрение.
• Соли серной кислоты
Что же касается солей серной кислоты, то они нашли широкое применение в медицине и строительстве. С ее помощью изготавливают гипс.
• Соли азотной кислоты
Соли азотной кислоты, или как их еще называют нитраты, применяются в сельском хозяйстве в качестве удобрений. Самыми значимыми среди этих солей является нитрат натрия, нитрат калия, нитрат кальция и нитрат аммония. Их еще называют селитрами.
Среди ортофосфатов, одним из наиболее важных, является ортофосфат кальция. Эта соль входит в основу таких минералов, как фосфориты и апатиты, которые необходимы при изготовлении фосфорных удобрений.
• Соли угольной кислоты
Соли угольной кислоты или карбонат кальция можно встретит в природе, в виде мела, известняка и мрамора. Его используют для изготовления извести. А вот карбонат калия применяется, как составляющая сырья при производстве стекла и мыла.
Интересные факты
Конечно, о соли вы знаете много интересного, но есть и такие факты, о которых вы вряд ли догадывались.
Вам, наверное, известен тот факт, что на Руси гостей было принято встречать с хлебом и солью, но злили вы, что за соль даже платили налог.
Известно ли вам, что были такие времена, когда соль ценилась больше золота. В древние времена римским воинам даже жалование платили солью. А самым дорогим и важным гостям в знак уважения преподносили горсть соли.
А знаете ли вы, что такое понятие, как «заработная плата» произошло от английского слова salary.
Оказывается, что поваренную соль можно применять в медицинских целях, так как она является отличным антисептиком и обладает ранозаживляющим и бактерицидным свойством. Ведь, наверное, каждый из вас наблюдал, будучи на море, что ранки на коже и мозоли в соленой морской воде заживают намного быстрее.
А знаете, почему зимой в гололед принято посыпать дорожки солью. Оказывается, если на лед насыпать соли, то лед превращается в воду, так как температура ее кристаллизации снизится на 1-3 градуса.
А известно ли вам, сколько соли человек употребляет в течение года. Оказывается, что за год мы с вами съедаем около восьми килограммов соли.
Оказывается, что людям, живущим в жарких странах, нужно употреблять соли в четыре раза больше, чем тем, кто живет в холодных климатических зонах, потому что во время жары выделяется большое количество пота, а с ним и выводятся соли с организма.
Соли: виды, свойства и применение
Соли — органические и неорганические химические вещества сложного состава. 
— состоящие из анионов и катионов;
— получаемые в результате взаимодействия кислот и оснований;
— состоящие из кислотных остатков и ионов металлов.
Кислотные остатки могут быть связаны не с атомами металлов, а с ионами аммония (NH4)+, фосфония (РН4)+, гидроксония (Н3О)+ и некоторыми другими.
Виды солей
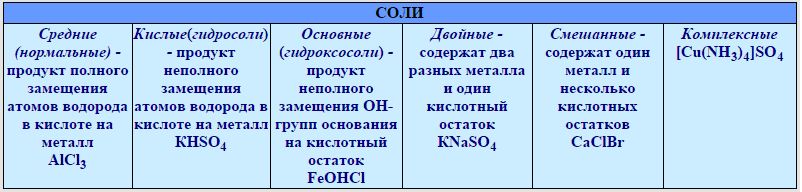
— Кислотные, средние, оснóвные. Если в кислоте все протоны водорода заменены ионами металла, то такие соли называют средними, например, NaCl. Если водород замещен лишь частично, то такие соли — кислые, напр. KHSO4 и NaH2PO4. Если гидроксильные группы (OH)– основания замещены кислотным остатком не полностью, то тогда соль — оснóвная, напр. CuCl(OH), Аl(OH)SO4.

— Органические и неорганические.
— Комплексные соли с комплексным ионом: K2[BeF4], [Zn(NH3)4]Cl2 и другие.
— Кристаллогидраты и кристаллосольваты.
— Кристаллогидраты с молекулами кристаллизационной воды. CaSO4*2H2O.
— Кристаллосольваты с молекулами растворителя. Например, LiCl в жидком аммиаке NH3 дает сольват LiCl*5NH3.
— Кислородосодержащие и не содержащие кислород.
— Внутренние, иначе называемые биполярными ионами.
Свойства
Большинство солей — твердые вещества с высокой температурой плавления, не проводящие ток. Растворимость в воде — важная характеристика, на ее основании реактивы делят на водорастворимые, малорастворимые и не растворимые. Многие соли растворяются в органических растворителях.
Соли реагируют:
— с более активными металлами;
— с кислотами, основаниями, другими солями, если в ходе взаимодействия получаются вещества, в дальнейшей реакции не участвующие, например, газ, нерастворимый осадок, вода. Разлагаются при нагревании, гидролизируются в воде.
В природе соли широко распространены в виде минералов, рассолов, залежей солей. Их добывают также из морской воды, горных руд.
Соли необходимы человеческому организму. Соли железа нужны для пополнения гемоглобина, кальция — участвуют в образовании скелета, магния — регулируют деятельность желудочно-кишечного тракта.
Применение солей
Соли активно используются в производстве, быту, сельском хозяйстве, медицине, пищепроме, химическом синтезе и анализе, в лабораторной практике. Вот лишь некоторые сферы их применения:
— Нитраты натрия, калия, кальция и аммония (селитры); кальций фосфорнокислый, 
— Хлорид натрия необходим для получения пищевой поваренной соли, применяется в химпроме для производства хлора, соды, едкого натра.
— Гипохлорит натрия — популярный отбеливатель и средство для обеззараживания воды.
— Соли уксусной кислоты (ацетаты) используются в пищевой индустрии как консерванты (калий и кальций уксуснокислый); в медицине для изготовления лекарств, в косметической отрасли (натрий уксуснокислый), для многих других целей.
— Алюмокалиевые и хромокалиевые квасцы востребованы в медицине, пищепроме; для окрашивания тканей, кож, мехов.
— Многие соли используются в качестве фиксаналов для определения химического состава веществ, качества воды, уровня кислотности и пр.
В нашем магазине в широком ассортименте представлены соли, как органические так и неорганические.
Химические свойства и способы получения солей
Перед изучением этого раздела рекомендую прочитать следующую статью:
Соли – это сложные вещества, которые состоят из катионов металлов и анионов кислотных остатков.
Классификация солей
Получение солей
1. Соли можно получить взаимодействием кислотных оксидов с основными.
кислотный оксид + основный оксид = соль
2. Взаимодействие кислот с основаниями и амфотерными гидроксидами. При этом щелочи взаимодействуют с любыми кислотами: и сильными, и слабыми.
Щелочь + любая кислота = соль + вода
HCl + NaOH → NaCl + H2O
При взаимодействии щелочей с избытком многоосновной кислоты образуются кислые соли.
Нерастворимые основания реагируют только с растворимыми кислотами.
Нерастворимое основание + растворимая кислота = соль + вода
Все амфотерные гидроксиды — нерастворимые. Следовательно, они ведут себя как нерастворимые основания при взаимодействии с кислотами:
Амфотерный гидроксид + растворимая кислота = соль + вода
Также соли образуются при взаимодействии аммиака с кислотами (аммиак проявляет основные свойства).
Аммиак + кислота = соль
3. Взаимодействие кислот с основными оксидами и амфотерными оксидами. При этом растворимые кислоты взаимодействуют с любыми основными оксидами.
Растворимая кислота + основный оксид = соль + вода
Растворимая кислота + амфотерный оксид = соль + вода
2HCl + CuO → CuCl2 + H2O
4. Взаимодействие оснований с кислотными оксидами. Сильные основания взаимодействуют с любыми кислотными оксидами.
Щёлочь + кислотный оксид → соль + вода
При взаимодействии щелочей с избытком кислотных оксидов, которым соответствуют многоосноосновные кислоты, образуются кислые соли.
NaOH + CO2 → NaHCO3
Нерастворимые основания взаимодействуют только с кислотными оксидами сильных кислот.
5. Соли образуются при взаимодействии кислот с солями. Нерастворимые соли взаимодействуют только с более сильными кислотами (более сильная кислота вытесняет менее сильную кислоту из соли). Растворимые соли взаимодействуют с растворимыми кислотами, если в продуктах реакции есть осадок, газ или вода или слабый электролит.
Например: карбонат кальция CaCO3 (нерастворимая соль угольной кислоты) может реагировать с более сильной серной кислотой.
Силикат натрия (растворимая соль кремниевой кислоты) взаимодействует с соляной кислотой, т.к. в ходе реакции образуется нерастворимая кремниевая кислота:
6. Соли можно получить окислением оксидов, других солей, металлов и неметаллов (в щелочной среде) в водном растворе кислородом или другими окислителями.
Ca + S → CaS
Кислоты-окислители реагируют с металлами с образованием продуктов восстановления азота и серы. Водород в таких реакциях не выделяется!
Минеральные кислоты реагируют по схеме:
металл + кислота → соль + водород
При этом с кислотами реагируют только металлы, расположенные в ряду активности левее водорода. А образуется соль металла с минимальной степенью окисления.
Fe + 2HCl → FeCl2 + H2
9. Соли образуются при взаимодействии щелочей с металлами в растворе и расплаве. При этом протекает окислительно-восстановительная реакция, в растворе образуется комплексная соль и водород, в расплаве — средняя соль и водород.
! Обратите внимание! С щелочами в растворе реагируют только те металлы, у которых оксид с минимальной положительной степенью окисления металла амфотерный!
2Al + 2NaOH + 6 H2 + O = 2Na[ Al +3 (OH)4] + 3 H2 0
10. Соли образуются при взаимодействии щелочей с неметаллами. При этом протекают окислительно-восстановительные реакции. Как правило, неметаллы диспропорционируют в щелочах. Не реагируют с щелочами кислород, водород, азот, углерод и инертные газы (гелий, неон, аргон и др.):
NaOH +О2 ≠
NaOH +N2 ≠
NaOH +C ≠
Сера, хлор, бром, йод, фосфор и другие неметаллы диспропорционируют в щелочах (т.е. самоокисляются-самовосстанавливаются).
2NaOH + Cl2 0 = NaCl — + NaOCl + + H2O
6NaOH + Cl2 0 = 5NaCl — + NaCl +5 O3 + 3H2O
Кремний окисляется щелочами до степени окисления +4.
2NaOH + Si 0 + H2 + O= Na2Si +4 O3 + 2H2 0
Фтор окисляет щёлочи:
Более подробно про эти реакции можно прочитать в статье Окислительно-восстановительные реакции.
11. Соли образуются при взаимодействии солей с неметалами. При этом протекают окислительно-восстановительные реакции. Один из примеров таких реакций — взаимодействие галогенидов металлов с другими галогенами. При этом более активный галоген вытесняет менее активный из соли.
2KBr + Cl2 = 2KCl + Br2
Но не реагирует с фторидом калия:
KF +Cl2 ≠
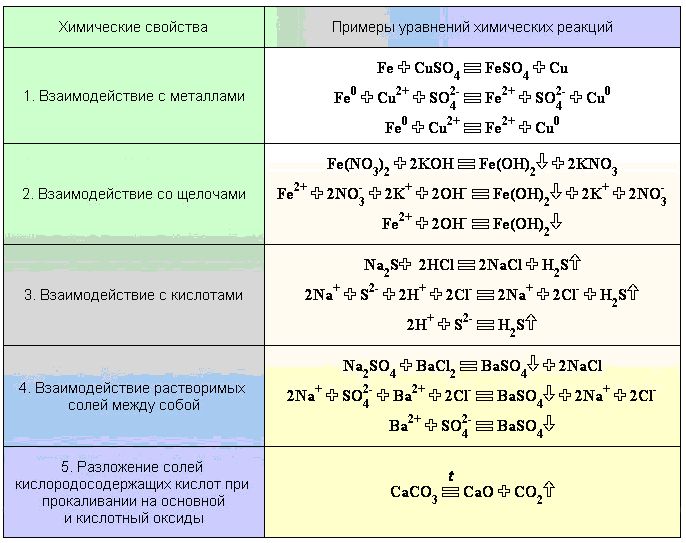
Химические свойства солей
1. В водных растворах соли диссоциируют на катионы металлов Ме + и анионы кислотных остатков. При этом растворимые соли диссоциируют почти полностью, а нерастворимые соли практически не диссоциируют, либо диссоциируют только частично.
CaCl2 → Ca 2+ + 2Cl –
Кислые и основные соли диссоциируют cтупенчато. При диссоциации кислых солей сначала разрываются ионные связи металла с кислотными остатком, затем диссоциирует кислотный остаток кислой соли на катионы водорода и анион кислотного остатка.
NaHCO3 → Na + + HCO3 –
HCO3 – → H + + CO3 2–
Основные соли также диссоциируют ступенчато.
CuOH + → Cu 2+ + OH –
Двойные соли диссоциируют в одну ступень.
Смешанные соли диссоциируют также одноступенчато.
CaCl(OCl) → Ca 2+ + Cl — + ClO –
Комплексные соли диссоциируют на комплексный ион и ионы внешней сферы.
соль1 + амфотерный оксид = соль2 + кислотный оксид
соль1 + твердый кислотный оксид = соль2 + кислотный оксид
соль + основный оксид ≠
Карбонат калия также взаимодействует с оксидом алюминия с образованием алюмината калия и углекислого газа:
3. Соли взаимодействуют с кислотами. Закономерности взаимодействия кислот с солями уже рассмотрены в данной статье в разделе «Получение солей».
4. Растворимые соли взаимодействуют с щелочами. Реакция возможна, только если образуется газ, осадок, вода или слабый электролит, поэтому с щелочами взаимодействуют, как правило, соли тяжелых металлов или соли аммония.
Растворимая соль + щелочь = соль2 + основание
Хлорид аммония взаимодействует с гидроксидом натрия:
Кислые соли взаимодействуют с щелочами с образованием средних солей.
Кислая соль + щелочь = средняя соль + вода
5. Растворимые соли взаимодействуют с солями. Реакция возможна, только если обе соли растворимые, и в результате реакции образуется осадок.
Растворимая соль1 + растворимая соль2 = соль3 + соль4
Растворимая соль + нерастворимая соль ≠
Некоторые кислые соли взаимодействуют с кислыми солями более слабых кислот. При этом более сильные кислоты вытесняют более слабые:
Кислая соль1 + кислая соль2 = соль3 + кислота
Некоторые кислые соли могут реагировать со своими средними солями.
6. C оли взаимодействуют с металлами. Более активные металлы (расположенные левее в ряду активности металлов) вытесняют из солей менее активные.
CuSO4 + Fe = FeSO4 + Cu
А вот серебро вытеснить медь не сможет:
CuSO4 + Ag ≠
Обратите внимание! Если реакция протекает в растворе, то добавляемый металл не должен реагировать с водой в растворе. Если мы добавляем в раствор соли щелочной или щелочноземельный металл, то этот металл будет реагировать преимущественно с водой, а с солью будет реагировать незначительно.
2H2O + 2Na = 2NaOH + H2
Образующийся гидроксид натрия, конечно, будет реагировать с хлоридом цинка:
ZnCl2 + 2NaOH = 2NaCl + Zn(OH)2
Но сам-то натрий с хлоридом цинка, таким образом, взаимодействовать напрямую не будет!
ZnCl2(р-р) + Na ≠
А вот в расплаве эта реакция при определенных условиях уже может протекать, так как в расплаве никакой воды нет.
ZnCl2(р-в) + 2Na = 2NaCl + Zn
И еще один нюанс. Чтобы получить расплав, соль необходимо нагреть. Но многие соли при нагревании разлагаются. И реагировать с металлом, естественно, при этом не могут. Таким образом, реагировать с металлами в расплаве могут только те соли, которые не разлагаются при нагревании. А разлагаются при нагревании почти все нитраты, нерастворимые карбонаты и некоторые другие соли.
Образующийся оксид меди, конечно, будет реагировать с железом:
CuO + Fe = FeO + Cu
Но сам-то нитрат меди, получается, с железом реагировать напрямую не будет!
При добавлении меди (Cu) в раствор соли менее активного металла – серебра (AgNO3) произойдет химическая реакция:
2AgNO3 + Cu = Cu(NO3)2 + 2Ag
При добавлении железа (Fe) в раствор соли меди (CuSO4) на железном гвозде появился розовый налет металлической меди:
CuSO4 + Fe = FeSO4 + Cu
При добавлении цинка в раствор нитрата свинца (II) на цинке образуется слой металлического свинца:
7. Некоторые соли при нагревании разлагаются .
Соли, в составе которых есть сильные окислители, разлагаются с окислительно-восстановительной реакцией. К таким солям относятся:
Некоторые соли разлагаются без изменения степени окисления элементов. К ним относятся: