Что такое специфичность фермента и чем она обусловлена
Специфичность действия ферментов
Специфичность действия ферментов
Ферменты обладают более высокой специфичностью действия по сравнению с неорганическими катализаторами. Различают специфичность по отношению к типу химической реакции, катализируемой ферментом, и специфичность по отношению к субстрату. Эти два вида специфичности характерны для каждого фермента.
Специфичность по отношению к субстрату – это предпочтительность фермента к субстрату определенной структуры в сравнении с другими субстратами.
Различают 4 вида субстратной специфичности ферментов:
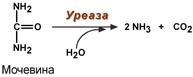
1. Абсолютная специфичность – способность фермента катализировать превращение только одного субстрата. Например – глюкокиназа фосфорилирует только глюкозу, аргиназа расщепляет только аргинин, уреаза – мочевину.
2. Относительная специфичность – фермент катализирует превращение нескольких субстратов, имеющих один тип связи. Например – липаза расщепляет сложноэфирную связь в триацилглицеролах.
3. Относительная групповая специфичность – фермент катализирует превращение нескольких субстратов, имеющих один тип связи, но требуется наличие определенных функциональных групп, входящих в состав субстратов. Например, все протеолитические ферменты расщепляют пептидную связь, но пепсин – образованную аминогруппами ароматических аминокислот, химотрипсин – образованную карбоксильными группами этих же аминокислот, трипсин – пептидную связь, образованную карбоксильной группой лизина, аргинина.
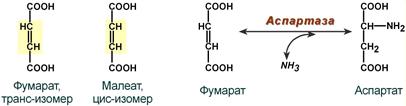
4. Стереохимическая специфичность – фермент катализирует превращение только одного стереоизомера. Например, бактериальная аспартатдекарбоксилаза катализирует декарбоксилирование только L-аспартата и не действует на D-аспарагиновую кислоту.
Специфичность по отношению к реакции
Каждый фермент катализирует одну реакцию или группу реакций одного типа. Часто одно и то же химическое соединение выступает как субстрат для разных ферментов, причем каждый из них катализирует специфическую для него реакцию, приводящую к образованию разных продуктов. Специфичность по типу реакции лежит в основе единой классификации ферментов.
Данный текст является ознакомительным фрагментом.
Продолжение на ЛитРес
Читайте также
МЕСТО ДЕЙСТВИЯ — АФРИКА
МЕСТО ДЕЙСТВИЯ — АФРИКА Заглянем в 1924 год и выясним, что так внимательно рассматривает профессор Раймонд Дарт, стоя возле только что распакованных ящиков, которые привезли его ученики из известкового карьера Таунг, что в Бечуаналенде. В руках у профессора из
Микробы — продуценты ферментов
Микробы — продуценты ферментов Мы уже знаем, что ферменты — это биологические катализаторы, то есть вещества, способствующие осуществлению многих химических реакций, которые-происходят в живой клетке и необходимы для получения питательных веществ и построения ее
Механизм действия нервной системы
Механизм действия нервной системы Теперь, вероятно, следует присмотреться к механизму действия этой сложной структуры, начав с простого примера. Если направить в глаза яркий свет, зрачок человека сужается. Эта реакция зависит от целой серии событий, которые начинаются в
Глава 3. Ферменты. Механизм действия ферментов
Глава 3. Ферменты. Механизм действия ферментов Ферментами или энзимами называют специфические белки, входящие в состав всех клеток и тканей живых организмов и выполняющие роль биологических катализаторов.Общие свойства ферментов и неорганических катализаторов:1. Не
Структура молекулы ферментов
Структура молекулы ферментов По строению ферменты могут быть простыми и сложными белками. Фермент, являющийся сложным белком называют холоферментом. Белковая часть фермента называется апоферментом, небелковая часть – кофактором. Различают два типа кофакторов:1.
Механизм действия ферментов
Глава 4. Регуляция активности ферментов. Медицинская энзимология
Глава 4. Регуляция активности ферментов. Медицинская энзимология Способы регуляции активности ферментов:1. Изменение количества ферментов.2. Изменение каталитической эффективности фермента.3. Изменение условий протекания реакции.Регуляция количества
Применение ферментов в медицине
Применение ферментов в медицине Ферментные препараты широко используют в медицине. Ферменты в медицинской практике находят применение в качестве диагностических (энзимодиагностика) и терапевтических (энзимотерапия) средств. Кроме того, ферменты используют в качестве
Глава 13. Особенности действия гормонов
Глава 13. Особенности действия гормонов Гормоны гипоталамуса ЦНС оказывает регулирующее действие на эндокринную систему через гипоталамус. В клетках нейронов гипоталамуса синтезируются пептидные гормоны двух типов. Одни через систему гипоталамо-гипофизарных сосудов
Диапазон действия экологических факторов
Диапазон действия экологических факторов Все живые организмы способны воспринимать только определенный диапазон интенсивности воздействий любого экологического фактора, что определяется нормой реакции генотипа. Этот диапазон выработался в процессе
6.4. Возрастающая специфичность морфического резонанса в процессе морфогенеза
6.4. Возрастающая специфичность морфического резонанса в процессе морфогенеза Энергетический резонанс не является процессом типа «все или ничего»: система резонирует в ответ на диапазон частот, более или менее близких к ее естественной частоте, хотя максимальный отклик
Как наши действия рассказывают нам о мире
Как наши действия рассказывают нам о мире Для мозга между восприятием и действиями существует тесная связь. Наше тело служит нам, чтобы познавать окружающий мир. Мы взаимодействуем с окружающим миром посредством своего тела и смотрим, что из этого выйдет. Этой
Программа действия
Программа действия Выбор или создание программы действия непосредственно предшествует двигательному акту. В подавляющем большинстве случаев ни человек, ни животные не разрабатывают программу действия, а используют ту, которая уже применялась ранее при схожей
2.2. Общая характеристика пищеварительных ферментов
2.2. Общая характеристика пищеварительных ферментов Обращает на себя внимание принципиальное сходство, а иногда и поразительное совпадение ферментных систем, реализующих пищеварение у различных организмов. Поэтому те характеристики, которые будут представлены ниже,
Изменение активности некоторых Ферментов крови и печени крыс при экспериментальном голодании А. А. ПОКРОВСКИЙ, Г. К. ПЯТНИЦКАЯ (Москва)
Изменение активности некоторых Ферментов крови и печени крыс при экспериментальном голодании А. А. ПОКРОВСКИЙ, Г. К. ПЯТНИЦКАЯ (Москва) Проблема влияния голодания на разные показатели обменных процессов в организме животных и человека продолжает привлекать внимание
Влияние голодания на активность ферментов пентозофосфатного пути в печени и мозге крыс Ю. Л. ЗАХАРЬИН (Москва)
Влияние голодания на активность ферментов пентозофосфатного пути в печени и мозге крыс Ю. Л. ЗАХАРЬИН (Москва) В последние годы в клинике часто применяется с лечебными целями, в частности, для лечения психических заболеваний, полное голодание. Не вызывает сомнения, что
Когда желудку и кишечнику не хватает ферментов
Основным инструментом пищеварения являются ферменты, именно они выполняют всю основную работу. Логично, что при их недостатке процесс пищеварения нарушается, и организм начинает нам сообщать о проблемах, сигнализируя различными симптомами. Такие привычные всем симптомы как изжога, тяжесть в животе, боль, метеоризм, диарея или запор – являются прямым указанием на проблемы с пищеварением.
Ферменты поджелудочной железы – виды и функции
Пора узнать, что представляют собой ферменты, и как они влияют на пищеварение. Ферменты поджелудочной железы – это белковые комплексы или катализаторы, основной задачей которых является расщепление питательных веществ на простые, легкоусвояемые соединения. Таким образом, организм легко усваивает все необходимые элементы и витамины.
Какие ферменты вырабатывает поджелудочная железа и какие у них функции?
Особо интересно то, что организм может регулировать выработку тех или иных ферментов в зависимости от характера потребляемой пищи. То есть, если вы потребляете много хлебобулочных изделий, то упор в выработке будет сделан на амилазе, если потребляется жирная пища, то поджелудочная железа отправит в кишечник больше липазы.
Кажется, что работа полностью налажена, и сбоев быть не может. Но сбои случаются и достаточно часто: слишком тонкий механизм работы, который легко нарушить. Даже большой приём пищи с преобладанием жиров может сломать систему, и поджелудочная железа не сможет обеспечить нужное количество ферментов.
Появление проблем с пищеварением
Мы выяснили, что проблемы с пищеварением могут возникать из-за недостатка ферментов. Существует два основных механизма, при которых организму не хватает ферментов поджелудочной железы. В первом варианте проблема с выработкой ферментов кроется в самой поджелудочной железе, т.е. сам орган функционирует неправильно.
Во втором варианте нарушаются условия, при которых ферменты могут правильно работать. Подобное возможно в результате изменения кислотности среды кишечника, например, при воспалении или при изменении стандартной температуры окружения (36-37° С). Воспалительный процесс в кишечнике может возникать при различных состояниях: кишечные инфекции, аллергические реакции (пищевая аллергия, атопический дерматит).
Основные признаки нехватки ферментов поджелудочной железы
Выявить недостаток ферментов достаточно просто. Ключевыми симптомами являются тяжесть после еды, чувство распирания в животе и дискомфорт в животе. Нередко эти симптомы сопровождаются вздутием, урчанием, метеоризмом, диареей. Чаще всего такие симптомы могут возникать в рядовых ситуациях: при употреблении тяжелой, жирной пищи или при переедании, когда удержаться от множества вкусных блюд попросту не удалось. В этом случае не стоит бояться неполадок с поджелудочной железой или других заболеваний ЖКТ. Поджелудочная железа просто не справляется с большим объемом работы, и ей может потребоваться помощь.
Если нехватка ферментов и проблемы с пищеварением сохраняются длительное время, то это не остается незаметным для организма. Симптомы могут усугубляться и носить уже не эпизодический, а регулярный характер. Постоянная диарея дает старт авитаминозу, могут развиваться: белково-энергетическая недостаточность и обезвоживание во всем организме. Может наблюдаться значительное снижение массы тела. Помимо этого при тяжелых стадиях могут наблюдаться следующие симптомы недостатка ферментов поджелудочной железы 8 :
Поддержание пищеварения и лечение ферментной недостаточности
При проблемах с пищеварением могут помочь ферментные препараты (чаще они называются препаратами для улучшения пищеварения), основная задача которых компенсировать нехватку собственных ферментов в организме. Не зря такая терапия называется «ферментозаместительная». Критически важно, чтобы ферментный препарат максимально точно «имитировал» физиологический процесс.
На сегодняшний момент существуют различные препараты для улучшения пищеварения. Как же ориентироваться в многообразии средств и сделать правильный выбор?
Эффективный ферментный препарат должен соответствовать следующим критериям 5,6 :
Ферменты избирательны в своем действии
Специфичность, т.е. высокая избирательность действия ферментов, основана на комплементарности структуры субстрата и активного центра фермента.
1. Стереоспецифичность – катализ только одного из стереоизомеров, например:
Стереоспецифичность аспартазы к транс-изомеру субстрата
2. Абсолютная специфичность – фермент производит катализ только одного вещества. Например, каталаза разрушает перекись водорода, аргиназа расщепляет только аргинин, уреаза расщепляет только мочевину, глюкокиназа фосфорилирует только D-глюкозу.
Реакция расщепления мочевины
3. Групповая специфичность – катализ субстратов с общими структурными особенностями, т.е. при наличии определенной связи или химической группы, например:
4. Относительная групповая специфичность – превращение субстратов с некоторыми общими признаками. Например, цитохром Р450 окисляет только гидрофобные вещества, которых насчитывается около 7000.
Механизмы специфичности
В общем виде все сводится к комплементарному взаимодействию фермента и субстрата. При этом функциональные группы субстрата взаимодействуют с соответствующими им функциональными группами фермента. Наличие субстратной специфичности объясняют две гипотезы:
1. Теория Фишера (модель «жесткой матрицы», «ключ-замок») – активный центр фермента строго соответствует конфигурации субстрата и не изменяется при его присоединении. Эта модель хорошо объясняет абсолютную специфичность, но не групповую.
Схематичное представление теории Фишера
2. Теория Кошланда (модель «индуцированного соответствия», «рука-перчатка») – подразумевает гибкость активного центра. Присоединение субстрата к якорному участку фермента вызывает изменение конфигурации каталитического центра таким образом, чтобы его форма соответствовала форме субстрата.
Ферменты: их строение, функции и регуляция. Ингибиторы ферментов
В нашем организме протекает множество химических реакций. Но тут я вас, наверное, не удивил. Хотя здесь можно найти кое-что удивительное! Если мы проводим реакцию в лаборатории и нам не очень хочется долго ждать, то мы можем её ускорить. И тут нет ничего проще — повысим температуру или давление, а можем добавить катализатор. И всё — мы быстренько получим продукты реакции и пойдём отдыхать. Очень удобно.
Но наш организм не может повышать температуру или давление — он очень ценит постоянство своей внутренней среды! Такой эгоист конечно. Остается только одно средство — добавить катализатор. Очень хорошее средство, но почти все катализаторы работают, когда повышают температуру и/или давление. Ну ладно-ладно, немного вспомнили химас и хватит. Наш организм нашёл катализатор, который не зависит от повышения температуры и давления — он, наоборот, зависит от их постоянства. И это….
Ферменты — это биологические катализаторы белковой природы. Они имеют третичную или четвертичную структуру. То есть фермент — это просто белок, который катализирует химическую реакцию (тут я лукавлю, есть небелковые ферменты, но о них говорят очень редко — так что забейте!). И вроде все круто, но вам разве не интересно, а как он блин это делает. Как можно ускорить химическую реакцию в стабильных условиях среды. Думаю, что интересно — давайте глянем по-быстрому, но для этого нужно кое-что вспомнить.
Энергия активации
Помните что-то такое? Да-да, где-то блин проходили, давайте вспоминать. Начнем с простого — есть экзо- и эндотермические реакции. Первые протекают спонтанно и выделяют энергию, а вторые не могут протекать спонтанно — им нужна энергия для протекания реакции.
В каждой реакции есть реагенты и продукты, но тут я уже перегибаю палку — вы и так это знаете. Так вот, у реагентов своё значение свободной энергии, а у продуктов своё. Чем меньше свободная энергия, тем стабильнее молекула. Давайте отметим это на небольшом графике. Мы видим, что между значениями свободной энергии есть разница и она отрицательная. Это говорит о том, что реакция экзотермическая — во время неё происходит выделение этой разницы энергий.
Будем разбирать всё на примере экзотермических реакций. И она будет вот такой: A-B + C = A-C + B. Хоть реакция экзотермическая и выделяет энергию, но ей нужно немного энергии для её запуска. Зачем? Для того, чтобы достигнуть переходного состояния. В переходном состоянии у молекул максимальная свободная энергия, и они начинают реагировать друг с другом. Когда приложим достаточно энергии, то дальше реакция пойдёт самостоятельно. Отметим это на графике.
Так вот, добиться энергии активации очень легко. Нужно просто повысить температуру или давление — это увеличит шанс взаимодействия наших реагентов, но организму это не подходит! Нужно действовать хитрее… И наш организм действительно очень хитер — он не пытается дойти до энергии активации, а снижает её. И на нашем графике можно отметить и это.
Очень простой и умный способ. Но нужно же разобраться с тем, как он это делает. Давайте-ка посмотрим.
Как фермент снижает энергию активации
Из прошлой статьи мы помним, что белки взаимодействуют с лигандами в определенных точках — активных центрах (либо аллостерических, но пока нас интересуют только первые). Фермент — это белок, а это значит что у него есть активный центр и лиганд для него. Только у лиганда здесь другое название — субстрат. Субстратов может быть несколько (обычно два) — оба они присоединяются к активному центру, но об этом ниже. Нам пока что удобнее все разобрать на одном.
Субстрат подходит к активному центру фермента как ключ к замку — комплементарность. Это первая теория взаимодействия фермента и субстрата, но есть и другая. Эта теория не отрицает того, что субстрат и фермент комплементарны друг другу, но не до такой степени как в «ключе-замке». Вот в чем её суть: при присоединении субстрата к активному центру происходят конформационные изменения в молекуле. Помним, что основные связи, которые стабилизируют белковую молекулу — слабые! Они могут разрушаться, но при этом тут же образуются новые — это и есть конформационные изменения молекулы.
Так вот, после присоединения субстрата меняется конформация активного центра. Он превращается в кармашек, который прячет своё сокровище от окружающей среды. У этих изменений есть своё название — индуцированное соответствие. И это усовершенствованная теория о ключе и замке. В этом кармашке создаётся микроокружение, благодаря которому реакция идёт быстрее. Уравнение этой реакции можно записать так: E + S = ES (E-enzyme; S-substrate).
Мы разобрали три вещи из-за чего снижается энергия активации, но давайте я выделю их получше:
Это только один механизм катализа — есть еще три других. Они тоже снижают энергию активации, но нам пока трудно будет с ними разобраться, да и они есть не у всех ферментов. Здесь мы разобрали вещи, которые характерны для любого фермента. Об остальных механизмах снижения энергии активации будем говорить ниже.
Ещё нам нужно посмотреть, как проходит реакция фермента с субстратом. Проще всего сделать это на примере. Возьмём реакцию: S1 + S2= P ( субстрат 1 + субстрат 2 = продукт) — так она протекает без фермента. Если мы добавим фермент, то реакция будет другой:
Столько этапов! Кажется, что первая реакция была намного проще. Так и есть, вот только в энергетическом плане на первую реакцию пойдёт больше энергии. Но реакция с ферментом затрачивает меньше энергии из-за того, что он ведёт реакцию по-другому пути. Здесь образуется множество переходных продуктов, если говорить честно, то это абсолютно другая реакция. Так что фермент проводит другую реакцию, но в ней образуются конечные продукты, которые и были нужны. Гений…
Если посмотреть ещё разок на график, то можно сделать пару выводов:
У ферментов просто огромная скорость работы! Один фермент может перегнать милльйон субстратов за секунду. Так что это убийственные трудяги, а мы будем дальше ныть про прокрастинацию…
Давайте чуть ближе взглянем на активный центр
Строение активного центра
Мы уже сказали о том, что активный центр комплементарен субстрату. Но если посмотреть на активный центр, то можно увидеть кое-что интересненькое. У большинства ферментов в активном центре находятся два участка: первый — это участок связывания; а второй — каталитический участок. Думаю, что тут даже объяснять ничего не нужно, но можно рассказать про специфичность двух этих участков.
Специфичность участка связывания:
Специфичность каталитического участка:
Субстрат может быть общим для нескольких ферментов. Но! Фермент направляет реакцию только по одному пути. Это значит, что фермент не может катализировать разные типы реакций. Если он занимается гидролизом, то он не может производить окислительно-восстановительные реакции. Когда дойдём до классов ферментов, то вы все поймёте.
Аллостерический центр
И ещё одно: у некоторых ферментов есть и другой центр — аллостерический. Такой центр есть у белков с четвертичной структурой — они состоят из нескольких субъединиц. Аллостерический центр располагается на одной субъединице, а активный на другой. Но иногда на одной субъединице могут быть оба центра. Аллостерический центр служит для присоединения другого субстрата (очень редко у него одинаковый субстрат с активным центром). Этот субстрат может активировать фермент или ингибировать его функцию, но об этом позднее.
Простетические группы
Давайте заканчивать со строением. Помните, что некоторые белки сложные и у них есть простетическая группа? Если нет, то простетическая группа — это небелковая часть, которая связана с белком ковалентной связью. Так вот в каталитическом участке фермента есть такие группы. Простетические группы есть почти во всех ферментах (очень редко их не бывает). Они даже получили своё название — кофакторы. Кофакторами могут быть металлы и органические молекулы (коферменты) — это витамины и их производные, убихинон и всё в таком духе.
У нас часто называют кофакторами только металлы, а коферментами только органические молекулы. Я так и привык их называть — так что дальше буду писать так, как привык. Я предупредил! Простетические группы важны для ферментов — без них они не могут функционировать. Вот вам примеры того, что делают простетические группы. Но подробнее будем разбирать коферменты в витаминах, а кофакторы — как дойдем до металлов.
Видали сколько функций? Сразу становится ясно, что фермент редко работает в одиночку — у него всегда есть суппорт в виде простетической группы. И ещё одно! Что если кофактор/кофермент не связан ковалентной связью с активным центром фермента? Можно ли назвать его коферментом/кофактором? Нет, нельзя. В таком случае — это второй субстрат фермента. Про витамины, которые могут быть вторыми субстратами поговорим ниже.
Этапы взаимодействия фермента и субстрата
Ну связался фермент с субстратом, а дальше то что? А вот это мы сейчас и посмотрим, выделив этапы взаимодействия. Первый этап — субстрат сближается с активным центром, происходит его ориентация в пространстве. Всё это для того, чтобы расположить субстрат рядом со своими функциональными группами. Второй этап — взаимодействие фермента и субстрата с формированием фермент-субстратного комплекса (здесь же индуцированное соответствие). На этом этапе фермент начинает взаимодействовать с субстратом — образует связь или связи с ним.Третий этап — образование продуктов: здесь уже произошла химическая реакция, но продукты ещё связаны с ферментом, хотя он теряет к ним соответствие (нестабильный комплекс фермента с продуктами). Четвёртый этап — освобождение фермента от продуктов реакции и восстановление его начальной структуры. Можно посмотреть все эти этапы на картинке.
Если присмотреться к картинкам, то можно увидеть — фермент меняет свою структуру во-время реакции. Это и есть индуцированное соответствие, которое основано на конформационных изменениях.
Взаимодействие фермента с несколькими субстратами
Пока мы здесь — давайте посмотрим на то, как фермент взаимодействует с несколькими субстратами. Здесь два механизма, которые завязаны на последовательности взаимодействия субстратов с активным центром:
1) Последовательный механизм. Реакция будет протекать только тогда, когда к активному центру присоединятся оба субстрата. Но в какой последовательности? Ой, а тут нужно поделить ещё на два варианта.
А) Упорядоченный механизм. При этом механизме важно в какой последовательности присоединятся субстраты к активному центру! Очень важно, если она будет другой, то реакция не пойдет. Можно привести в пример лактатдегидрогеназу — она катализирует обратимую реакцию превращения пирувата в лактат. Сначала присоединяется NADH, а только потом пируват. Если мы присоединим сначала пируват, то фермент работать не будет. Продукты отсоединяются тоже последовательно: сначала второй, а потом первый.
NADH здесь — это кофермент или второй субстрат? Да, второй субстрат — он ведь не связан ковалентно с активным центром фермента, а спокойно вылетает из него.
Б) Случайный механизм. Тут неважно в какой последовательности присоединятся оба субстрата, реакция пойдет все равно. Главное, чтобы оба были на своём месте. Последовательность отсоединения продуктов? Забейте — здесь все идёт рандомно. Пример фермента с таким механизмом — креатинфосфокиназа.
2) Механизм пинг-понг. Здесь ферменту не нужно присоединять сразу же оба субстрата. Ему больше нравится присоединять сначала первый, а только потом второй. Вот в чём дело: фермент присоединяет первый субстрат и катализирует реакцию до образования продукта: но при этом в нём возникают изменения. Например, фермент присоединяет аминогруппу к активному центру, а потом присоединяет второй субстрат и отдаёт ему эту аминогруппу. Получается, что в конце фермент остаётся в неизменной форме. Так работают аминотрансферазы. Помните какой кофермент занимается переносом аминогруппы? Ага, пиридоксальфосфат, респект!
Делаем один очень важный вывод — ферменты не изменяются во-время химических реакций. Хотя нет — не так. Фермент может изменяться, но в конце реакции он в такой же форме, как и до вступления в неё.
Структура фермента до и после реакции — одинаковая!
Механизмы катализа
Мы их бросили в самом начале, но пришло время вернуться к ним. Основных механизмов катализа — четыре, но очень редко они действуют изолированно. Чаще всего фермент комбинирует несколько видов катализа.
Один из них мы уже разобрали — катализ близости и ориентации. Напоминаю, что в него входят: создание микроокружения для субстрата, расположение функциональных групп фермента максимально близко к субстрату/субстратам и деформация молекулы. И да, такой катализ работает во всех ферментах!
Кислотно-основной катализ
Нам будет очень удобно разобрать этот вид катализа и следующий на одном ферменте — химотрипсине. Химотрипсин занимается гидролизом пептидной связи белков в тонком кишечнике, а синтезируется он поджелудочной железой. Наибольшее сродство химотрипсина к пептидным связям между ароматическими радикалами (фенилаланин, тирозин).
По названию понятно, что здесь всё завязано на кислотах и основаниях — а если точнее, то на протоне водорода. И что же может сделать этот жалкий протон водорода? Многое, но давайте сначала посмотрим что он делает в химотрипсине. У химотрипсина, как и у всех ферментов, есть активный центр. В нём есть две аминокислоты — гистидин и серин.
У азота в гистидине есть неподелённая электронная пара, а у кислорода такая большая электроотрицательность, что он оттягивает единственный электрон водорода на себя. Из-за этого азот может поделиться своей парой электронов и отщепить протон водорода. При этом возрастает способность кислорода вступать в реакции. Оно и понятно — вы посмотрите сколько у него электронов.
Кислотно-основной катализ не только увеличивает реакционную способность атомов. Перенос протона может использоваться для стабилизации молекул во-время реакции — убирать их отрицательный или положительный заряд. А это очень важно в переходном состоянии, что вносит свой вклад в снижение энергии активации.
Ковалентный катализ
Я взял полипептид, где две аминокислоты рядом — ароматические (ведь у химотрипсина сродство к связям между ними). Высокоактивный кислород атакует связь между атомом углерода и азотом — это приводит к её разрушению. Образуется новая ковалентная связь между атомом кислорода и углерода. Мы разделили наш полипептид на два! Только вот одна часть осталась у химотрипсина. Давайте добавим воды и уберём её — наш фермент снова в неизменной форме.
Видите? Катализы работают совместно! В химотрипсине их целых три: сначала ориентация субстрата и его сближение, а потом кислотно-основной и ковалентные катализы.
Катализ ионами металлов
Мы уже говорили о металлах в кофакторах — здесь всё тоже самое, но давайте приведём пару примеров. Вот стабилизация магнием молекулы АТФ, что облегчает её присоединение к активному центру фермента. Легче присоединение — меньше энергия активации. АТФ (аденозинтрифосфат) — это основная макроэргическая молекула или батарейка на которой работает наш организм. Чего только ради неё не делается.
А вот цинк участвует в образовании протона водорода и гидроксид иона, которые потом будут использоваться в ферментативной реакции. Этот процесс называется электрофильной атакой. Но не будем останавливаться на этом подробнее.
Классы ферментов
Систематическое включает слишком много всего и нам будет неудобно им пользоваться, поэтому остановимся на рабочем. Рабочее название, как правило, включает в себя: субстрат, класс фермента и окончание(-аза). Если мы разберёмся с классами ферментов, то сразу будем себе представлять какую реакцию они катализируют. А если ещё и знаем субстрат, то можем спокойно написать эту реакцию. Вот что нам это даст. Хотя иногда бывают ферменты с другими названиями, которые «устоялись». Типо трипсина, пепсина и химотрипсина — по этим названиям ничего не скажешь, но их не слишком много.
И нам повезло, потому что такую классификацию уже сделали! Она включает шесть классов ферментов, но они делятся на подклассы, а те ещё на подподклассы. Так далеко мы не полезем — достаточно классов, а кое-где добавим подклассы. Поехали!
1. Оксидоредуктазы
Если видите оксидоредуктазы, то сразу думайте об окислительно-восстановительных реакциях. Почти всегда будет два субстрата, либо субстрат + кофермент — электроны и/или протоны водорода будут прыгать с одной молекулы на другую. Но если посмотреть на названия ферментов, то субстрат-оксидоредуктаза встречается очень редко. Здесь придётся поговорить о подклассах оксидоредуктаз:
Вторая реакция очень примечательная — в ней есть неизвестный нам кофермент тетрагидробиоптерин, но о нём поговорим как-нибудь в другой раз. Вообще хотел не про это сказать — эта реакция основа патогенеза одного заболевания. И зовут эту бяку фенилкетонурия, но и о ней не сегодня!
2. Трансферазы
Занимаются транспортом функциональных групп с одной молекулы на другую — опять два субстрата! Мы разобрали как работают трансферазы, когда говорили о механизме пинг-понг. Это был пример аминотрансферазы, но есть и другие. Для нас важны киназы — это фосфотрансферазы, которые переносят фосфатную группу из молекулы АТФ на субстрат.
3. Гидролазы
Ну, они занимаются гидролизом 🙂 Рвут ковалентную связь и присоединяют к ней воду — так что здесь только один субстрат. Так работает трипсин, химотрипсин и пепсин. Подкласс гидролаз — эстераза (чуть выше мы видели ацетилхолинэстеразу). У этих ферментов есть своя особенность — иногда их называют не субстрат-гидролаза, а просто субстрат-аза (липаза).
4. Лиазы
Работают с одним субстратом — отщепляют от него какую-нибудь группу (CO2, NH2 или H2O), но в отличие от трансфераз никуда её не переносят. Ещё лиазы могут присоединять H2O по двойной связи. Название у них немного другое: субстрат-отщепляемая группа. Так при отрыве аминогруппы фермент будет называться: субстрат-дезаминаза; а при отрыве карбоксильной группы: субстрат-декарбоксилаза. Если же присоединяем воду, то субстрат-гидратаза.
5. Изомеразы
Перемещают функциональные группы или двойные связи в пределах одной молекулы — делают изомеры. Тоже работают с одним субстратом. Если перемещают функциональную группу, то название у них субстрат-мутаза, а в остальных случаях субстрат-изомераза.
6. Лигазы
Второе название звучит более логично — синтетазы. Они катализируют образование связей между двумя субстратами — синтезируют сложные молекулы через образование ковалентной связи. Для синтеза всегда нужна энергия АТФ или другого макроэнергетического субстрата. Тут опять небольшие неполадки с названиями: если используем энергию АТФ, то фермент называется продукт-синтетаза; но если используем другой макроэрг, то продукт-синтаза. Лигазы — это единственное исключение из правила — их название включает продукт!
Кинетика химических реакций
Основная задача фермента — это ускорение химических реакций. Мы видели, что он неплохо с этим справляется и может катализировать миллионы субстратов в секунду. Но можно увеличить или уменьшить эту скорость? Да, можно. Здесь мы и поговорим о том, как меняется скорость фермента в разных условиях.
1. При избытке субстрата
Мы сделаем вот что — возьмём склянку с ферментом. Его там стабильное количество — у нас в организме ведь определенное количество фермента? Конечно, и это мы типа моделируем ситуацию. Так вот, начнём добавлять в эту склянку субстрат нашего фермента. Что будет вначале? Пока субстрата мало, то ему трудно найти активные центры — ведь фермент огромный, а субстраты маханькие. Продолжаем добавлять субстрат и видим что? Правильно — скорость растёт. Чем больше мы добавляем субстрата, тем больше шанс того, что он наткнётся на активный центр. Скорость постепенно растёт всё больше и больше.
Но у нас всё-таки ограниченное количество фермента. Поэтому мы дойдём до такой точки, где увеличение количества субстрата уже не повлияет на скорость реакции. Всё из-за того, что мы заняли все активные центры фермента! Это будет нашей максимальной скоростью.
Максимальная скорость — это хорошо, но есть одна проблема: мы не можем с помощью неё определить сродство фермента к субстрату. Если упростить — как быстро активный центр фермента находит субстрат. Это может быть очень быстро, а может медленно. И максимальная скорость не даёт нам понимания этого — ведь при избытке субстрата мы всегда добьёмся максимальной скорости, но его может потребоваться очень много. В некоторых ситуациях (о них чуть ниже) — нужно знать сродство фермента к субстрату.
Константа Михаэлиса-Ментена
Для определения сродства активного центра к ферменту существует константа Михаэлиса-Ментена. У неё довольно простое определение — это концентрация субстрата, при которой достигается половина максимальной скорости. Давайте посмотрим на наш график и отметим половину максимальной скорости.
До этого мы работали со стабильной концентрацией фермента, но что если мы её уменьшим в два раза? Скорее всего и скорость реакции уменьшится примерно в два раза, но что будет с константой Михаэлиса-Ментена? А вот сейчас и глянем.
Получается, что константа Михаэлиса-Ментена постоянна для фермента и не зависит от его концентрации.
Теперь нам нужно взять какой-нибудь другой фермент, но у него должен быть такой же субстрат.
Отличается от нашего прошлого фермента? Да, этот фермент дольше достигал максимальной концентрации — ему потребовалось для этого больше субстрата. А значит и константа Михаэлиса-Ментена в данном случае больше! Чем больше субстрата нужно для достижения максимальной скорости, тем больше константа. Понятное дело, что это работает и наоборот: чем меньше субстрата нужно для достижения максимальной скорости, тем меньше константа. Ну и делаем вывод:
Чем больше константа Михаэлиса-Ментена, тем меньше сродство фермента к субстрату. А чем меньше константа, тем больше сродство.
Поэтому, если мы знаем значение константы Михаэлиса-Ментена, то знаем сродство фермента к субстрату. При этом нам пофигу на концентрацию субстрата — она всегда будет стабильной. Ну или почти всегда, интрига! С этой интригой разберёмся позже. Что-то я вас совсем «завтраками» закормил — все позже, да ниже. Но извиняйте — статья огромная и всё разобрать сразу невозможно.
Помните ещё, что мы говорили об изменениях скорости реакции в разных условиях? Ну и хорошо, продолжаем.
2. При изменении pH
Тут можно задать вопрос: почему одному ферменту хорошо работать при pH = 2, а другой вообще не проявляет активности? Отвечаю: ферменты состоят из аминокислотной последовательности — их активность зависит от того, какие аминокислоты в них входят. Помните про изоэлектрическую точку? Если нет, то можете почитать, но суть такая — аминокислоты меняют свои заряды при изменении pH. Такое изменение pH может привести к денатурации белка: ведь при изменении зарядов аминокислот разрушаются слабые связи.
Так что напоминаю — ферменты работают в стабильных условиях среды. Для каждого фермента эти условия индивидуальны и определяются первичной структурой белка.
3. При изменении температуры
Здесь всё неоднозначно. При повышении температуры скорость реакции возрастает и достигает максимума. Для нашего организма такой максимум около 41 градуса, а при повышении до 42 градусов фермент начинает денатурировать, и скорость реакции снижается.
Бойтесь болеть — все ферменты денатурируют!
Ингибиторы ферментов
Ингибиторы — это вещества, которые замедляют скорость ферментов. Давайте немного раскроем то, что я сейчас написал. До этого мы разбирали скорость не одного фермента, а какого-то их количества (концентрации). Если часть этих ферментов выключить из реакции, то её скорость снизится. Ингибиторы в глобальной картинке — замедляют скорость реакции; а если присмотреться поближе, то они полностью блокируют действие некоторых ферментов. Но ведь остаются и рабочие! Поэтому ингибиторы — это вещества, которые снижают скорость реакции через выключение части ферментов. Если заблокировать все ферменты, то скорость реакции будет равна нулю, но такое случается очень редко.
Отличие от денатурации — нет нарушения третичной и четвертичной структуры фермента.
Ингибиторы можно разделить на обратимые и необратимые. Вторыми займёмся чуть позже, а пока что про обратимые.
Обратимые ингибиторы
Обратимые ингибиторы связываются с ферментом непрочными связями и не изменяют его функциональные группы. Такое ингибирование временное! Ингибитор может связываться с активным центром, аллостерическим центром и даже фермент-субстратным комплексом. Поэтому можно выделить 3 механизма.
Конкурентное ингибирование
Ингибитор может быть очень похож на субстрат, а может просто иметь такие же функциональные группы. Раз они похожи, то конкурируют за присоединение к активному центру (отсюда и название). Хоть они и похожи, но ингибитору чего-то всегда не хватает (например, функциональных групп). Поэтому после присоединения ингибитора он не может превратиться в другое вещество (продукт) — фермент с ним связывается, а что делать не знает. Из-за этого фермент больше не катализирует образование продукта из субстрата, поэтому скорость реакции снижается.
Ингибитор и субстрат конкурируют за активный центр, но нам легко будет обойти ингибитор. Мы просто начнём повышать концентрацию субстрата — он начнёт вытеснять ингибитор из активных центров фермента. Да и давайте прикинем: у нас будет очень много субстрата — это значит, что он будет чаще попадаться активным центрам. Ноль шансов для ингибитора…
Пример конкурентного ингибитора может быть малонат. Он похож на субстрат сукцинатдегидрогеназы. Догадайтесь какой? Легенды, да — это сукцинат. При этой реакции образуется фумарат — похож на сукцинат, но между 2 и 3 углеродом будет двойная связь, рисовать не буду. У малоната же негде образовать двойную связь, так что фермент работает в «холостую».
Сделаем график с максимальной скоростью и константой Михаэлиса-Ментена. Видите? При добавлении конкурентного ингибитора увеличивается константа — снижается сродство фермента к субстрату. Но мы всё еще можем добиться максимальной скорости, увеличивая концентрацию субстрата. Конкурентное ингибирование — просто добавь субстрат!
Поэтому, если мы знаем константу Михаэлиса-Ментена для данного фермента, то может сказать: «Вот блин константа увеличилась — значит тут ингибитор. »
Неконкурентное ингибирование
Неконкурентный ингибитор не похож на субстрат, поэтому он не может присоединиться к активному центру фермента. Но может присоединиться в другом месте, например, аллостерическом центре. На нём то мы и остановимся. Хотя неконкурентные ингибиторы могут присоединяться не только к аллостерическому центру, но и другим местам молекулы.
Вспоминаем, что аллостерический центр есть у ферментов с четвертичной структурой. При присоединении неконкурентного ингибитора в аллостерический центр происходят конформационные изменения в молекуле. К чему могут привести эти изменения? Ну, они могут привести изменению активного центра — субстрат не сможет к нему присоединиться.
Есть и другой тип изменений — субстраты смогут присоединиться к активным центрам, но реакция просто не пойдет.
Примеры посмотрим в регуляции, а график в следующем пункте.
Бесконкурентое ингибирование
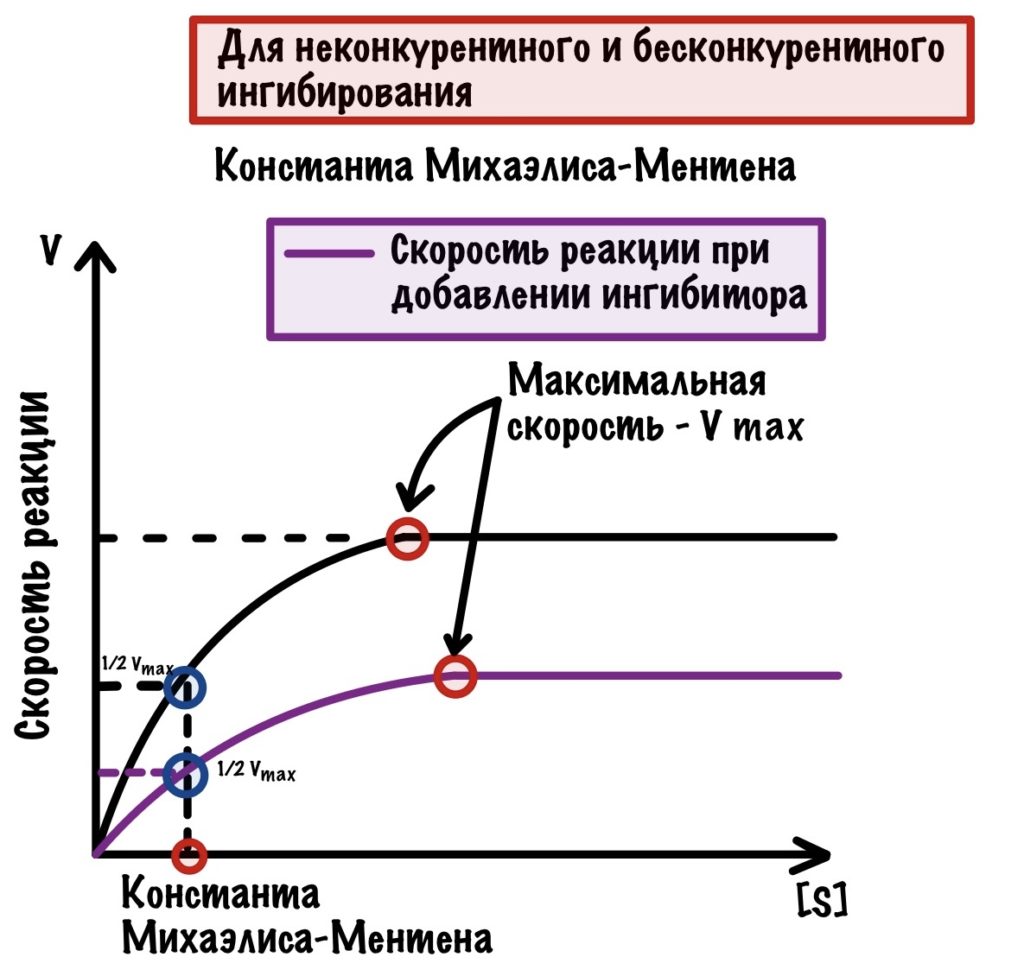
Очень похоже на прошлое, но с оговорками. Здесь ингибитор контактирует с фермент-субстратным комплексом. Суть такая: при образовании фермент-субстратного комплекса происходят конформационные изменения в молекуле. Это приводит к тому, что появляется небольшой кармашек — он находится рядом с фермент-субстратным комплексом. К этому кармашку и присоединяется ингибитор — фермент перестает выполнять свои функции.
Если ингибиторы неконкурентные или бесконкурентые, то мы не можем увеличить скорость химической реакции, добавляя субстрат. Субстрат никак не влияет на скорость, так как ингибиторы находятся не в активном центре! Если посмотреть на график, то можно увидеть пару интересных вещей.
Максимальная скорость снижена, а константа Михаэлиса-Ментена такой же. Вот как можно это объяснить: ингибиторы связались не со всеми ферментами, поэтому какая-то часть продолжает выполнять свои функции. Но все-таки ферментов меньше, поэтому они не могут достигнуть максимальной скорости, которая была раньше. Константа же остаётся такой же, потому что у оставшихся ферментов такое же сродство к субстрату, как и раньше.
Ещё раз скажу, что обратимое ингибирование непостоянно. Если подождать, то эти ингибиторы сами отлетят от фермента — произойдёт восстановление его функций, поэтому оно и называется обратимым.
Необратимое ингибирование
Необратимые ингибиторы чаще всего связываются с ферментом при помощи ковалентных связей, но иногда и нековалентных. Это приводит к тому, что фермент перестает выполнять свою функцию. Но такое ингибирование необратимо! Может ждать стотысяч миллион лет, но ингибитор останется связан с ферментом. Так что мы можем позабыть о функциях фермента навсегда, если с ним связался необратимый ингибитор. Хотя для некоторых ферментов бывают реактиваторы, так что это я загнул. Ну да ладно, давайте посмотрим какими они бывают.
Ингибиторы функциональных групп
Аналоги субстратов
Ингибитор снова похож на субстрат — это чем-то напоминает конкурентное ингибирование. Но не совсем — здесь фермент навсегда теряет свою функцию (сколько раз я ещё это повторю?). Когда будем говорить о катаболизме глюкозы, то там есть одна молекула — дигидроацетонфосфат. Эта молекула под действием триозофосфатизомеразы, превращается в глицеральдегид-3-фосфат. Так вот есть ингибитор этого фермента — бромдигидроацетонфосфат. Он очень похож на дигидроацетонфосфат. После того, как присоединился бромдигидроацетонфосфат фермент теряет свою функцию — у него не получается отцепиться от него. Знаю, что не очень запоминающийся пример….
Суицидальное ингибирование
Опять ингибитор очень похож на субстрат, но механизм ингибирования другой. Ингибитор присоединяется к активному центру фермента и начинается реакция. Тут даже образуется продукт/продукты, но вот проблемка — этот продукт не отпускает активный центр фермента!
Есть ещё один легендарный препарат, который является суицидальным ингибитором — это пенициллин. Так что две легенды действуют по схожему механизму.
Держите сводную табличку!
Регуляция активности ферментов
Огроменный плюс ферментов — это способность к регуляции. Согласитесь было бы не очень, если они работали постоянно. Сколько бы у нас накопилось всего ненужного! И тут опять нужно остановочка — разбираемся с тем, как протекает метаболизм в нашей тушке.
Итак, ферменты катализируют только одну реакцию, правильно? Но очень редко случается такое, что образовался продукт и всё — конец! Чаще всё происходит немного сложнее: продукт — это субстрат для следующего фермента. А продукт того фермента — субстрат до следующего и так далее. Вся последовательность превращений — это метаболический путь.
И вы конечно же знаете про эти пути:
Эти пути должны быть разделены, потому что если соединить их, то получится неразбериха — ведь в этих процессах могут быть одинаковые субстраты. Клетка их и разделяет — помним про компарментализацию? Если не помним, то это разделение клетки на отсеки. Клетка делает даже больше: в цитоплазме обычно идёт анаболизм, а в митохондриях катаболизм. Это не стопроцентное утверждение, когда будете разбирать углеводы, то поймёте. Но суть такая — разделяй и властвуй!
Возвращаемся к регуляции. Организм очень хитёр — вы уже это поняли? Контролировать каждый фермент в метаболическом пути — запарное дело, поэтому он делает умнее. Организм контролирует ключевые ферменты — те, которые стоят первыми в метаболическом пути. Либо те, которые стоят на развилках в метаболических путях. Ну а теперь к видам регуляции.
Аллостерическая регуляция
Этот вид мы уже разобрали, когда говорили о неконкурентном ингибировании. Но повторение — мать ученья! Тем более мы кое-что добавим к тому, что уже знаем (хех). Аллостерические ферменты почти всегда имеют четвертичную структуру — на одной субъединице расположен активный центр, а на другой — аллостерический. У аллостерического центра есть свой собственный субстрат. При его присоединении в ферменте происходят конформационные изменения — активный центр может закрываться или, наоборот, открываться (про такое ещё не говорили). Если он закрывается, то это отрицательная регуляция. А если открывается, то положительная. Это очень частый вид регуляции в метаболических путях и очень удобный. Аллостерическими регуляторами могут быть продукты реакции — при их избытке они присоединяются к аллостерическому центру и останавливают действие фермента — это отрицательная обратная связь. Даже страшно сказать сколько ещё раз мы с ней встретимся, она просто вездесуща! Более редкая — положительная обратная связь, когда конечные продукты фермента активируют первый фермент. Даже в голову никакого примера не приходит.
А вот принцип разделения катаболизма и анаболизма: избыток АТФ блокирует регуляторные ферменты катаболизма, но активирует ферменты анаболизма. Раз есть что-то лишнее, то нужно это запасти! Избыток АДФ же, наоборот, активирует ферменты катаболизма, но блокирует ферменты анаболизма. АДФ можно назвать положительным регулятором для ферментов катаболизма, а АТФ положительным регулятором для ферментов анаболизма. Ну и очень редко при избытке субстрата он может присоединяться аллостерическому центру некоторых ферментов.
Об аллостерической регуляции подробнее будем говорить позже — нужно добраться до углеводного и жирового обмена. А пока хватит этих основных принципов.
Ассоциация/диссоциация субъединиц
Опять четвертичная структура! Лучший пример — протеинкиназа А. Она состоит из четырёх субъединиц — две регуляторные и две каталитические. При присоединении цАМФ к регуляторным субъединицам происходит распад четвертичной структуры — протеинкиназа становится активной. Что делают киназы? Правильно — фосфорилируют всё, что попадётся им на пути!
цАМФ — это вторичный посредник некоторых гормонов, в основном катаболических — глюкагона и адреналина. Если снизить концентрацию цАМФ (гормоны перестали действовать), то регуляторные субъединицы находят своих каталитических братьев и собираются в четвертичную структуру. Всё — протеинкиназа становится неактивной.
Фосфорилирование/дефосфорилирование
Есть ферменты, которые действуют только в фосфорилированном состоянии. Для этого нужна протеинкиназа! Вот такая вот взаимосвязь двух типов регуляции. Другие ферменты, наоборот, активны в дефосфорилированном состоянии. Так что тут все зависит от метаболического пути.
Такие ферменты тесно связаны с гормонами — они вызывают быстрое фосфорилирование/дефосфорилирование в зависимости от потребностей организма. Фосфорилированием занимается протеинкиназа, а дефосфорилированием — фосфопротеинфосфатаза То есть гормоны активируют или инактивируют ферменты. Чаще всего они активируют один путь и инактивируют другой — активация катаболизма, но ингибирование анаболизма. Ну и наоборот.
Все эти виды регуляции были обратимые, но есть ещё один — необратимый.
Ограниченный протеолиз
Разберём на примере химотрипсина. Сегодня столько раз про него говорили, но вот ещё кое-что — это фермент, который вырабатывает поджелудочная железа, он вызывает гидролиз пептидных связей в тонком кишечнике. И можно подумать, а почему он не переваривает поджелудочную железу? А вот — он вырабатывается в неактивной форме в виде химотрипсиногена, а такой фермент неактивен. Но при попадании в двенадцатиперстную кишку происходит его частичный протеолиз трипсином — он убирает несколько аминокислот от химотрипсиногена. Из-за этого формируется активный центр фермента и он начинает гидролизировать пептидные связи — становится активным. У таких ферментов есть своё название — проферменты, к ним относится не только химотрипсин, но и трипсин и пепсин (-гены). А ну еще по такому же принципу происходит активация факторов свертывания крови, но только не в кишке)
И последнее — эти виды регуляции были быстрые и не влияли на концентрацию фермента. Мы изменяли активность фермента через его модификацию, но есть ещё один вид регуляции.
«Медленная регуляция»
Всего пару слов и заканчиваем! Можно пойти другим путём — через увеличение концентрации ферментов. Ведь фермент — это белок, а значит его синтез связан с ДНК. Можно вызывать экспрессию генов, которые кодируют фермент и увеличить его концентрацию (просто увеличим его количество). Но для этого нужно подействовать на ДНК — это могут сделать некоторые гормоны. Почему эта регуляция медленная? Потому что нужно время для того, чтобы синтезировать новые ферменты. Обычно это занимает около суток, но может и меньше.
Хочешь задать вопрос, похвалить или наговорить гадостей? Тогда залетай в телегу. Там ты сможешь предложить новый формат или разбор темы. А если серьёзно, то эти статьи пишутся для вас, поэтому мне важна обратная связь.