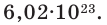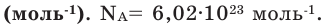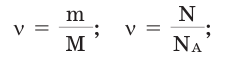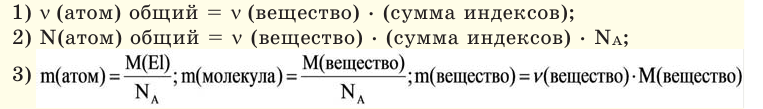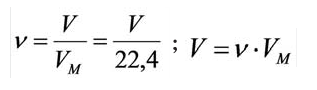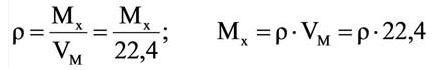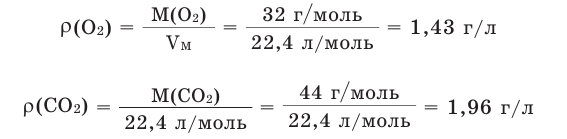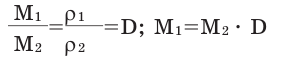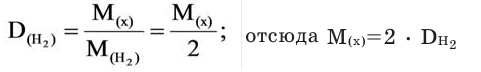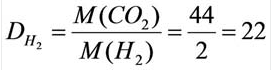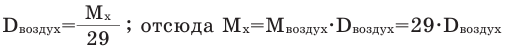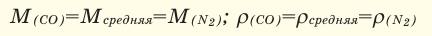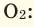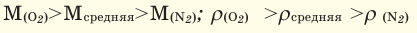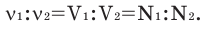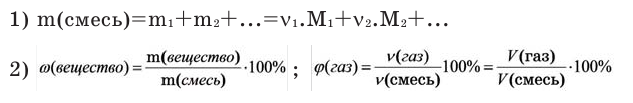Что такое средняя молярная масса
Что такое средняя молярная масса
РАЗДЕЛ И. ОБЩАЯ ХИМИЯ
Примеры решения типовых задач
V. Определение средней молярной массы смеси газов
Формулы и понятия, которые используются:
Задача 23. Вычислите молярну массу смеси, в которой объемные доли метана и бутана соответственно составляют 85 и 15%.
Задача 24. Определите плотность газовой смеси с азотом, в которой объемные доли карбон(И V ) оксида, сульфур(И V ) оксида и карбон(II) оксида соответственно составляют 35,25 и 40 %.
1. Вычислим молярну массу смеси (М(С O 2 ) = 44 г/моль, M ( SO 2 ) = 64 г/моль, М(СО) = 28 г/моль):
2. Вычислим относительную плотность смеси с азотом:
Ответ: DN2 (смеси) = 1,52.
Задача 25. Плотность смеси ацетилена и бутену за гелием равна 11. Определите объемную долю ацетилена в смеси.
1. По формуле 
2. Предположим, что мы имеем 1 моль смеси. В ней содержится х моль С2Н2, тогда в соответствии
3. Запишем выражение для вычисления средней молярной массы газовой смеси:
Подставим все известные данные: М(С2Н2) = 26 г/моль, М(С4Н8) = 56 г/моль:
4. Следовательно, 1 моль смеси содержит 0,4 моль С2Н2. Вычислим мольну долю χ(С2Н2):
Для газов φ(Х) = χ(Х). Следовательно, φ(С2Н4) = 40 %.
Содержание:
Количество вещества:
В чём разница между понятиями «масса» и «количество»
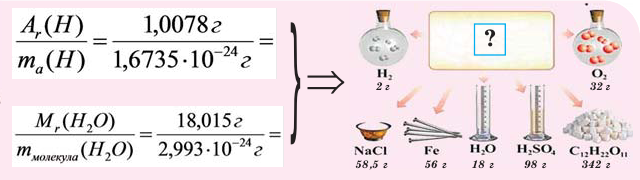
Если мы будем производить подобные расчеты, соответствующие этому заданию, для простых веществ, образованных различными элементами, то всякий раз получим одно и то же число —
Например, в 1 моле водородного газа содержится 

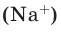

Количество частиц, содержащихся в 1 моле химических веществ ( 
Количество вещества можно вычислить по следующей формуле:
Молярная масса
Молярной массой называют массу 1 моля вещества, выраженного в граммах. Молярная масса обозначается
буквой М, единицей измерения является г/моль.
При выражении молярной массы вещества в граммах, она численно бывает равна его относительной молекулярной массе (если состоит из молекул). Для сравнения запишем (таблица 1):
Как видно из вышесказанного, понятие молярная масса применяется как к химическим элементам, так и к простым и сложным веществам с молекулярным и немолекулярным строением.
На основе количества вещества (моль) можно производить следующие вычисления. Если известно мольное количество вещества:
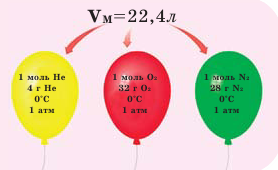
Закон Авогадро и молярный объём газов
Обратите внимание на рисунки. Почему, несмотря на разные массы газов, они занимают одинаковый объём?
В начале XIX века итальянский ученый Авогадро, проведя наблюдения над свойствами газов в различных условиях и проанализировав открытые прежде законы о газах (Бойля-Мариотта, Гей-Люссака и др.) в 1811 году сформулировал новый закон о газах. Закон Авогадро звучит следующим образом: в равных объемах различных газов при одинаковых условиях (одинаковых температуре и давлении) содержится одинаковое число молекул.
Итальянский ученый. В 1811 году им был открыт закон о газах, который впоследствии был назван его именем.
Мы уже знаем, что 1 моль любого вещества содержит 
Было вычислено, что при нормальных условиях объем 1 моля любого газа или смеси газов составляет примерно 22,4 л. Объем 1 моля газа при нормальных условиях (н.у.) называют молярным объемом данного газа, выраженным знаком 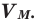
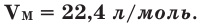
Здесь 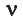
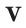
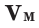
Нормальные условия означают: температура 0°С, 1 атм давления 1атм — 101,3 кПа
Для вычисления плотности какого-либо газа X в нормальных условиях (н.у.), следует его молярную массу разделить на молярный объем:
Например, вычислим плотности кислорода и углекислого газа при нормальных условиях:
Плотность твёрдых и жидких веществ при н.у. вычисляется по формуле 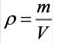
Для того, чтобы определить, масса какого из газов с одинаковыми объемами и при одинаковых условиях бывает тяжелее, пользуются понятием относительной плотности. Отношение плотностей различных газов при одинаковых условиях равно отношению их молярных масс. Относительная плотность обозначается буквой D и не имеет единицы измерения. Формула относительной плотности следующая:
В таком случае, относительная плотность углекислого газа по водороду вычисляется следующим образом:
Так как средняя молярная масса воздуха, состоящего из смеси газов, примерно равна 29 г/моль, то формула его относительной плотности следующая:
Способы вычисления средней молярной массы газовой смеси
Здесь: 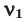
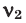
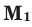
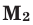

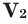
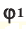
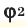
Среднюю молярную массу 1 моля смеси из двух различных газов можно вычислить по следующей формуле: 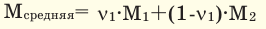
При смешивании газов с одинаковыми молярными массами, которые при одинаковом давлении не вступают друг с другом в реакцию, плотность газовой смеси (при н.у.), а также их средняя молярная масса остаются неизменными. Например, при смешивании 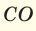
При смешивании газов с различными молярными массами, при одинаковом давлении, средняя молярная масса (при н.у.) и плотность полученной газовой смеси приобретают значение между молярными массами и плотностями смешиваемых газов. Например, при смешивании 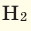
При добавлении газа с большей молярной массой в тот или иной газ при постоянном давлении плотность газовой смеси увеличивается, а при добавлении газа с меньшей молярной массой — уменьшается.
Закон объемных отношений
В химических реакциях соотношение объемов, вступающих в реакцию, и полученных газов равно соотношению их коэффициентов. Например:
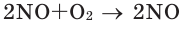
Численное соотношение объемов, молей и молекул газов равно друг другу.
Можно производить следующие вычисления по смесям:
3) Массовое соотношение двух газов:
При копировании любых материалов с сайта evkova.org обязательна активная ссылка на сайт www.evkova.org
Сайт создан коллективом преподавателей на некоммерческой основе для дополнительного образования молодежи
Сайт пишется, поддерживается и управляется коллективом преподавателей
Whatsapp и логотип whatsapp являются товарными знаками корпорации WhatsApp LLC.
Cайт носит информационный характер и ни при каких условиях не является публичной офертой, которая определяется положениями статьи 437 Гражданского кодекса РФ. Анна Евкова не оказывает никаких услуг.
Молярная масса
Моля́рная ма́сса вещества — масса одного моля вещества. Для отдельных химических элементов молярной массой является масса одного моля отдельных атомов этого элемента. В этом случае молярная масса элемента, выраженная в г/моль, численно совпадает с массой атома элемента, выраженной в а.е.м. (атомная единица массы). Однако надо чётко представлять разницу между молярной массой и молекулярной массой, понимая, что они равны лишь численно и отличаются по размерности. [1]
Молярные массы сложных молекул можно определить, суммируя молярные массы входящих в них элементов.
Например, молярная масса воды (H2O) есть MH2O = 2 MH +MO = 2·1+16 = 18 (г/моль).
Стоит отметить, что, например, молярная масса кислорода как элемента = 16 (г/моль), а в газообразном состоянии (O2) = 32 (г/моль).
Молярная масса некоторых веществ
| Вещество | г/моль |
|---|---|
| Азот | 28 |
| Аргон | 40 |
| Водород | 2 |
| Водяные пары | 18 |
| Гелий | 4 |
| Воздух | 29 |
| Кислород | 32 |
| Литий | 6 |
| Неон | 20 |
| Серебро | 108 |
| Молибден | 96 |
| Углекислый газ | 44 |
Примечания
Полезное
Смотреть что такое «Молярная масса» в других словарях:
молярная масса — molio masė statusas T sritis fizika atitikmenys: angl. molar mass vok. molare Masse, f; Molmasse, f rus. мольная масса, f; молярная масса, f pranc. masse molaire, f … Fizikos terminų žodynas
молярная масса — molio masė statusas T sritis Standartizacija ir metrologija apibrėžtis Medžiagos dalelių, kurių skaičius lygus Avogadro konstantai, masė, t. y. masė m, padalyta iš medžiagos kiekio n: M = m/n. atitikmenys: angl. molar mass vok. molare Masse, f;… … Penkiakalbis aiškinamasis metrologijos terminų žodynas
молярная масса — molinė masė statusas T sritis chemija apibrėžtis Vieno medžiagos molio masė. atitikmenys: angl. molar mass rus. молярная масса … Chemijos terminų aiškinamasis žodynas
молярная масса — molio masė statusas T sritis Energetika apibrėžtis Medžiagos dalelių, kurių skaičius lygus Avogadro konstantai, masė, t. y. medžiagos masė, padalyta iš medžiagos kiekio. atitikmenys: angl. molar mass vok. molare Masse, f; Molmasse, f rus.… … Aiškinamasis šiluminės ir branduolinės technikos terminų žodynas
МОЛЯРНАЯ МАССА — физ. величина, равная отношению массы к кол ву в ва. Единица М. м. (в СИ) кг/моль. М = m/n, где М М. м. в кг/моль, m масса в ва в кг, п кол во в ва в молях. Числовое значение М. м., выраж. в кг/моль, равно относит. молекулярной массе, делённой на … Большой энциклопедический политехнический словарь
Молярная масса эквивалента — Величина Мэквх, численно равная произведению молярной массы вещества х на фактор эквивалентности и рассчитываемая по формуле Мэквх = Мх × fэквх, где Мх молярная масса вещества х, г; fэквх фактор эквивалентности. Примечание. Величина Мэквх… … Словарь-справочник терминов нормативно-технической документации
Молярная концентрация эквивалента — Величина Сэквх, численно равная частному от деления массовой концентрации вещества х на молярную массу его эквивалента и рассчитываемая по формуле где Стх массовая концентрация вещества х, г; Мэквх молярная масса эквивалента вещества х, г.… … Словарь-справочник терминов нормативно-технической документации
МОЛЯРНАЯ MАCCA — физ. величина, равная отношению массы газа (или др. тела) к количеству вещества, которое в нём содержится; обозначается буквой Μ; М = m/n. где т масса вещества, n количество вещества. Числовое значение М в тысячу раз меньше относительной… … Большая политехническая энциклопедия
Молярная концентрация — Концентрация величина, характеризующая количественный состав раствора. Согласно правилам ИЮПАК, концентрацией растворённого вещества (не раствора) называют отношение количества растворённого вещества или его массы к объёму раствора (моль/л, г/л) … Википедия
Для химических элементов без изолированных молекул, таких как углерод и металлы, молярная масса вычисляется делением вместо этого на количество молей атомов. Так, например, молярная масса железа составляет около 55,845 г / моль.
СОДЕРЖАНИЕ
Молярные массы элементов
Умножение на константу молярной массы гарантирует, что расчет является размерно правильным: стандартные относительные атомные массы являются безразмерными величинами (т.е. чистыми числами), тогда как молярные массы выражаются в единицах (в данном случае граммах на моль).
Молярные массы соединений
Здесь M
р относительная молярная масса, также называемая формулой веса. Для нормальных образцов с Земли с типичным изотопным составом стандартный атомный вес или обычный атомный вес может использоваться в качестве приближения к относительной атомной массе образца. Примеры:
= Средняя молярная масса смесей
Среднюю молярную массу смесей можно рассчитать из мольных долей компонентов и их молярных масс : M ¯ <\ displaystyle <\ bar 

Также его можно рассчитать из массовых долей компонентов: ш я <\ displaystyle w_ >
Например, средняя молярная масса сухого воздуха составляет 28,97 г / моль.
Связанные количества
Молекулярная масса
Использование синтеза ДНК
Термин « формульная масса» (FW) имеет особое значение при использовании в контексте синтеза ДНК: в то время как отдельное фосфорамидитное азотистое основание, добавляемое к ДНК-полимеру, имеет защитные группы и указана его молекулярная масса, включая эти группы, количество молекулярной массы который в конечном итоге добавляется этим азотистым основанием к полимеру ДНК, называется массой формулы азотистого основания (т. е. молекулярной массой этого азотистого основания в полимере ДНК, за вычетом защитных групп).
Точность и неопределенность
Точность атомных масс и, следовательно, молярных масс ограничена знанием изотопного распределения элемента. Если требуется более точное значение молярной массы, необходимо определить изотопное распределение рассматриваемого образца, которое может отличаться от стандартного распределения, используемого для расчета стандартной атомной массы. Изотопные распределения различных элементов в образце не обязательно независимы друг от друга: например, образец, который был подвергнут дистилляции, будет обогащен более легкими изотопами всех присутствующих элементов. Это усложняет расчет стандартной неопределенности молярной массы.
Полезным условием для нормальной лабораторной работы является указание молярных масс с точностью до двух десятичных знаков для всех расчетов. Это более точно, чем обычно требуется, но позволяет избежать ошибок округления во время вычислений. Когда молярная масса превышает 1000 г / моль, редко бывает целесообразно использовать более одного десятичного знака. Эти условные обозначения соблюдаются при составлении большинства табличных значений молярных масс.
Измерение
Молярные массы почти никогда не измеряются напрямую. Они могут быть рассчитаны на основе стандартных атомных масс и часто перечислены в химических каталогах и в паспортах безопасности (SDS). Молярные массы обычно варьируются от:
Плотность пара
Объединение этих двух уравнений дает выражение для молярной массы через плотность пара для условий известного давления и температуры :
Депрессия точки замерзания
Повышение температуры кипения
Молярная масса
Для химических элементов без изолированных молекул, таких как углерод и металлы, молярная масса вычисляется путем деления на количество молей атомов. Так, например, молярная масса железа составляет около 55,845 г / моль.
Содержание
Молярные массы элементов [ править ]
Умножение на константу молярной массы гарантирует, что расчет является размерно правильным: стандартные относительные атомные массы являются безразмерными величинами (то есть чистыми числами), тогда как молярные массы выражаются в единицах (в данном случае граммах / моль).
Молярные массы соединений [ править ]
Здесь M
р относительная молярная масса, также называемая формулой веса. Для нормальных образцов с Земли с типичным изотопным составом стандартный атомный вес или условный атомный вес может использоваться в качестве приближения к относительной атомной массе образца. Примеры:
Средняя молярная масса смесей [ править ]
Среднюю молярную массу смесей можно рассчитать из мольных долей компонентов и их молярных масс : M ¯ <\ displaystyle <\ bar 

Также его можно рассчитать из массовых долей компонентов: ш я <\ displaystyle w_ >
Например, средняя молярная масса сухого воздуха составляет 28,97 г / моль. [7]
Связанные количества [ править ]
Молекулярная масса [ править ]
Использование синтеза ДНК [ править ]
Термин « формульная масса» (FW) имеет особое значение при использовании в контексте синтеза ДНК: в то время как отдельное фосфорамидитное азотистое основание, добавляемое к ДНК-полимеру, имеет защитные группы и указана его молекулярная масса, включая эти группы, количество молекулярной массы который в конечном итоге добавляется этим азотистым основанием к полимеру ДНК, называется массой формулы азотистого основания (т. е. молекулярной массой этого азотистого основания в полимере ДНК, минус защитные группы).
Точность и неопределенности [ править ]
Точность атомных масс и, следовательно, молярных масс ограничена знанием изотопного распределения элемента. Если требуется более точное значение молярной массы, необходимо определить изотопное распределение исследуемой пробы, которое может отличаться от стандартного распределения, используемого для расчета стандартной атомной массы. Изотопные распределения различных элементов в образце не обязательно независимы друг от друга: например, образец, который был дистиллирован, будет обогащен более легкими изотопами всех присутствующих элементов. Это усложняет расчет стандартной неопределенности молярной массы.
Полезным условием для нормальной лабораторной работы является указание молярных масс с точностью до двух десятичных знаков для всех расчетов. Это более точно, чем обычно требуется, но позволяет избежать ошибок округления во время вычислений. Когда молярная масса превышает 1000 г / моль, редко бывает целесообразно использовать более одного десятичного знака. Эти условные обозначения соблюдаются при составлении большинства табличных значений молярных масс. [14] [15]
Измерение [ править ]
Молярные массы почти никогда не измеряются напрямую. Они могут быть рассчитаны на основе стандартных атомных масс и часто перечислены в химических каталогах и в паспортах безопасности (SDS). Молярные массы обычно варьируются от: