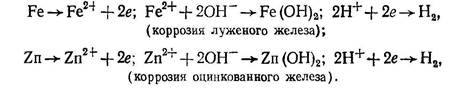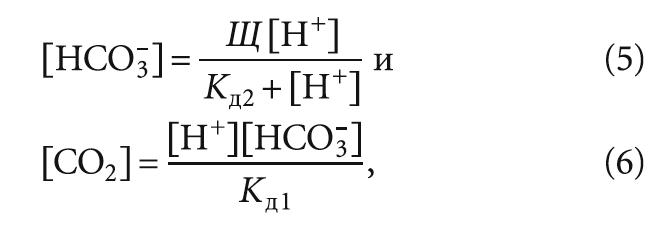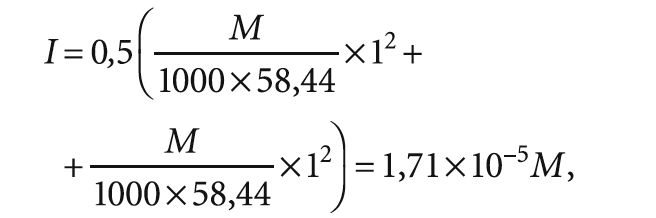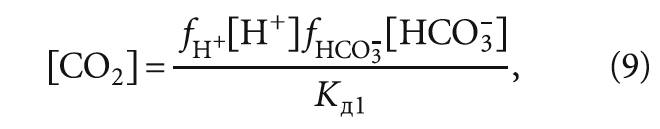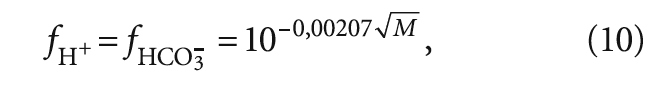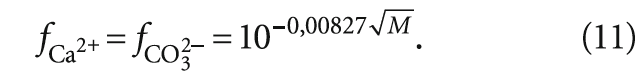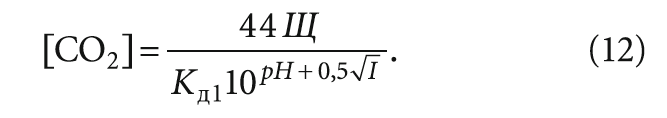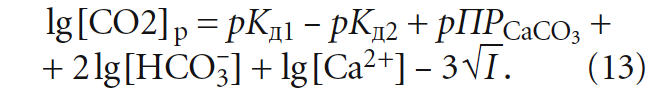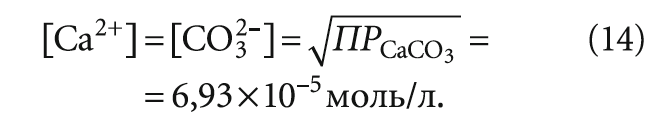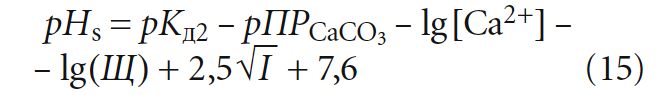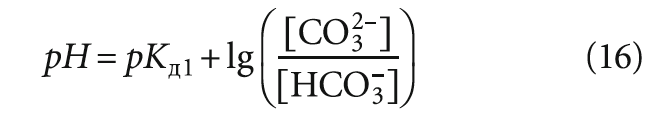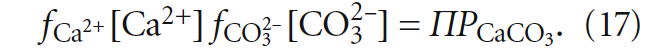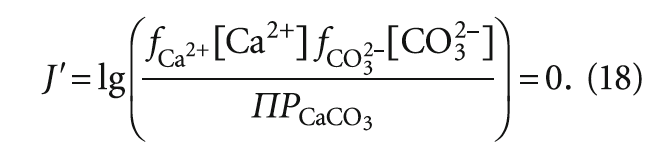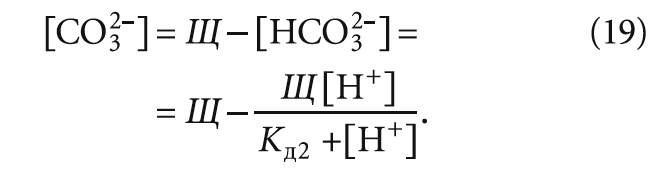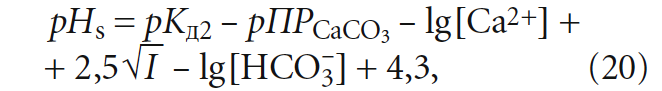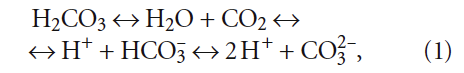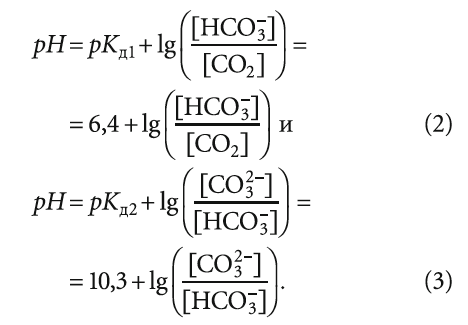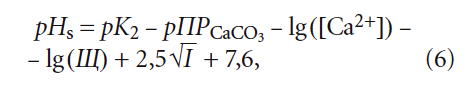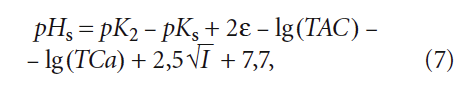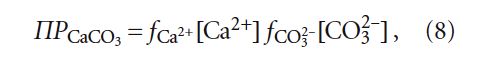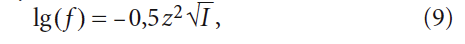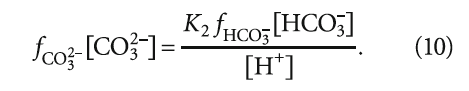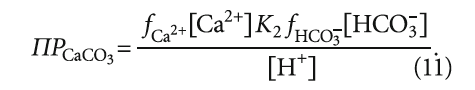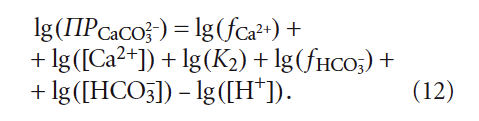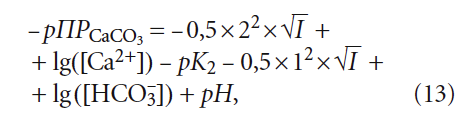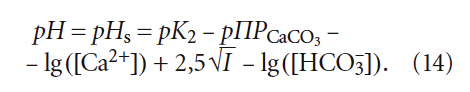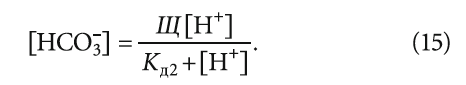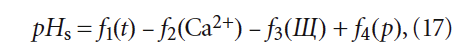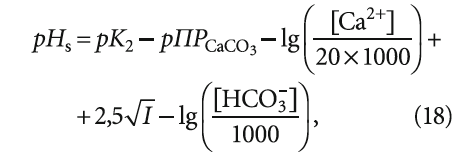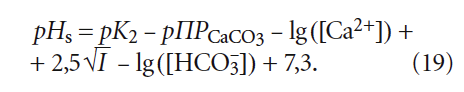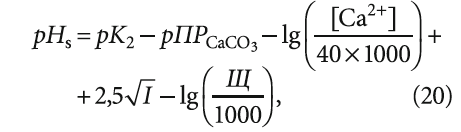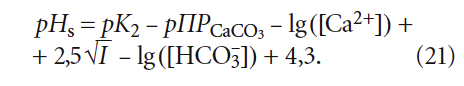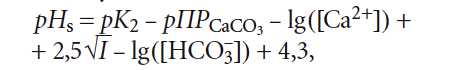Что такое стабильность воды
Стабильная вода. Дать объяснение стабильности, от чего зависит этот показатель?



Стабильной называется вода, не способная к выделению отложений карбоната кальция и не являющаяся агрессивной. В стабильной воде фактическая концентрация СО2 соответствует равновесной концентрации СО2. Это обстоятельство описывается уравнением кинетического равновесия всех форм угольной кислоты:
Что называется коагуляцией воды? От каких примесей избавляются при помощи этой операции?
Коагуляция – это процесс укрупнения коллоидных частиц в крупные агрегаты (флоккулы) и их осаждение под действием сил тяжести. Также называется осветление, процесс производится в осветлителе. При помощи этой операции избавляются от коллоидно-дисперсных примесей (размер от 1 до 100 нм), к ним относятся некоторые глины, кремнекислые соединения (SiO2*nH2O, FeO(OH), AlO(OH) ) и т.д.
Стабильность воды
Виды и причины зарастания труб и оборудования.
При эксплуатации водопроводных труб и оборудования в ряде случаев на их стенках образуются различного рода отложения. В результате этого снижается их пропускная способность. Это связано, как правило, со свойствами транспортируемой по ним воды. Встречаются отложения сплошные, равномерно уменьшающие живое сечение трубы, и бугристые, возникающие в виде отдельных выступов на стенках труб и оборудования.
По видам и причинам, вызывающим отложения, их разделяют на донные, сплошные, бугристые отложения и биологические обрастания.
Донные отложения возникают в нижней части труб вбольшинстве случаев при транспортировке неочищенной воды, содержащей грубую взвесь. Они характерны для труб, по которым вода движется с небольшими скоростями. Донные отложения может вызвать гидроксид железа (III), который в периоды малого расхода воды отлагается в трубах, уплотняется и цементируется.
Сплошные отложения образуются при транспорте воды, пересыщенной карбонатом кальция (с положительным индексом насыщения). В этом случае отложения состоят в основном из карбоната кальция и прочно прикреплены к стенкам труб и оборудования; грубодисперсные взвеси цементируются карбонатом кальция. Отложения располагаются эксцентрично с утолщением в донной части трубы.
Коррозия труб и оборудования может вызываться разнообразными агрессивными средами, к которым относятся воздух, топочные газы, сернистые соединения, реагенты, употребляемые для обработки воды, продукты их разложения и др.
Агрессивное действие воды при очистке объясняется нарушением в ней карбонатного равновесия, поскольку при добавлении в воду 1 мг сульфата алюминия или хлорида железа (III) выделяется около 0,8 мг оксида углерода(IV) за счет разложения гидрокарбонатов. Вода при этом становится нестабильной, т. е. способной растворять защитные пленки на внутренней поверхности трубопроводов в результате появления в ней агрессивной угольной кислоты. При оголении поверхности трубопроводов усиливается электрохимическая коррозия, которой благоприятствует присутствие растворенного в воде кислорода и сероводорода. Вода обогащается продуктами коррозии, ухудшающими ее качественные показатели.
Из металлов больше всего разрушается железо, коррозия которого в зависимости от покрытия протекает следующим образом:
Для предохранения металлов от коррозии их покрывают коррозионно-стойкими металлами (цинком, оловом, никелем и др.), в воду добавляют ингибиторы (например, соли фосфорной кислоты), жидкое стекло, сильные окислители (хромат натрия, гексаметафосфат натрия), применяют протекторную защиту, наносят на их поверхности краски, эмали и другие защитные материалы.
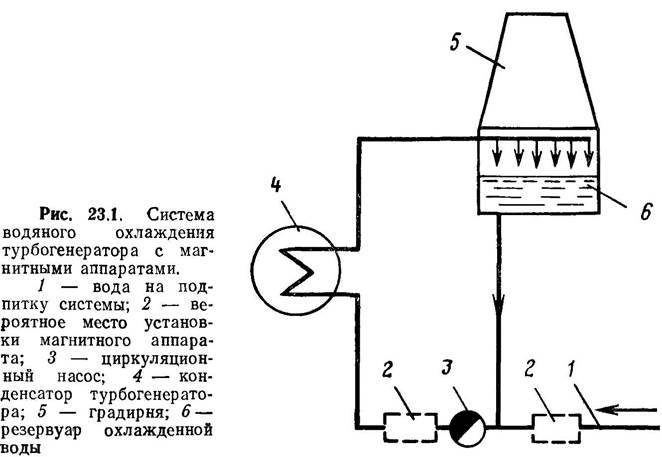
Для борьбы с коррозией труб рекомендуется магнитная обработка воды. Предполагают, что под действием магнитного поля растворенный в воде кислород активируется и образует с железом ферромагнитные оксиды, предохраняющие поверхность металла от агрессивных сред. Концентрация кислорода в воде при этом уменьшается.
Применяют магнитные установки чаще всего в системах оборотного водоснабжения. На рис.1 показана схема циркуляционной системы водяного охлаждения турбогенератора с Установкой магнитного аппарата.
Стабильность воды является одним из основных показателей ее качества. Обесцвеченную и осветленную на очистных сооружениях воду нельзя считать удовлетворительной по качеству, если она, проходя по трубам, приобретает окраску или образует осадок.
Нарушение стабильности воды может быть вызвано наличием растворенной угольной кислоты, сероводорода или кислорода, низким значением рН, пересыщенностью угольной кислоты или кислорода, пересыщенностью ее карбонатом кальция или гидроксидом магния, повышенной концентрацией сульфатов либо хлоридов.
Согласно ГОСТу 3313—86, стабильной считается вода, которая не выделяет и не растворяет осадка карбоната кальция. Это свойство воды характеризуется показателем стабильности. ГОСТ дает два метода его определения: основной и вспомогательный. По первому методу показатель стабильности находят из выражения
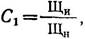
где Щи — исходная фактическая щелочность воды в естественном состоянии, мг-экв/л; Щн — щелочность воды после смешивания (насыщения) ее с карбонатом кальция, мг-экв/л.
При взбалтывании воды, содержащей агрессивную углекислоту, с карбонатом кальция последний растворяется, переходя в гидрокарбонат кальция, в результате чего щелочность и рН воды повышаются. Если же вода пересыщена карбонатом кальция, то он отлагается на зернах введенного в воду перед началом взбалтывания карбоната кальция; рН и щелочность воды при этом понижаются.
По второму методу показатель стабильности находят из выражения

где рНи — значение рН в исходной воде; рНн — значение рН воды, насыщенной карбонатом кальция.
Нам важно ваше мнение! Был ли полезен опубликованный материал? Да | Нет
Что означает понятие «стабильная вода»?
В общем случае стабильной называют воду, не вызывающую коррозии металлических и бетонных поверхностей и не выделяющую на эти поверхности осадков карбоната кальция. Определяется стабильность как разность между водородным показателем рН раствора и его равновесным значением рНS (индекс Ланжелье): если водородный показатель оказывается меньше равновесного, вода становится коррозионно-активной, если больше равновесного – выпадают в осадок карбонаты кальция и магния. В природных водах стабильность воды определяется соотношением между диоксидом углерода, щелочностью и карбонатной жесткостью воды, температурой, давлением углекислого газа в окружающем воздухе. При этом процессы установления равновесия протекают самопроизвольно и сопровождаются либо выпадением в осадок карбонатов, либо их растворением.
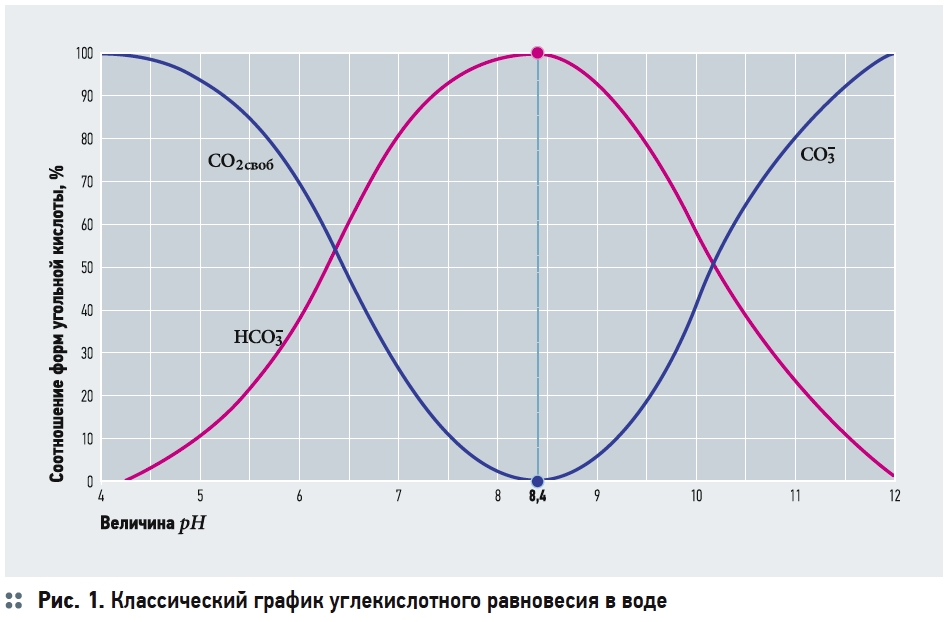
Соотношение между диоксидом углерода, гидрокарбонатными и карбонатными ионами (производные угольной кислоты) в значительной мере определяется величиной рН. При рН ниже 4.5 из всех компонентов карбонатного равновесия в воде присутствует только диоксид углерода CO2, при рН=8,3 практически вся угольная кислота присутствует в виде гидрокарбонатных ионов, а при рН 12 в воде находятся только карбонатные ионы. При использовании воды в коммунальном хозяйстве, в промышленности чрезвычайно важно учитывать фактор стабильности. Для поддержания стабильности воды регулируют водородный показатель, щелочность или карбонатную жесткость. Если вода оказывается коррозионно-активной (например, при обессоливании, умягчении), то перед подачей в линию потребления ее следует обогатить карбонатами кальция или провести подщелачивание; если, напротив, вода склонна к выделению карбонатных осадков, требуется их удаление или подкисление воды. Для стабилизационной обработки воды используются такие физические методы, как магнитная и радиочастотная обработка воды, препятствующая выпадению солей жесткости на поверхностях теплообменников, внутренних поверхностях трубопроводов. Химическая обработка заключается во введении с помощью дозаторов специальных реагентов на основе фосфатных соединений, препятствующих осаждению на нагретых поверхностях солей жесткости за счет их связывания, коррекции pH дозацией кислот или пропусканием воды через гранулированные материалы типа доломита (Corosex, Calcite, жженый доломит), дозацией различных комплексонов на основе производных фосфоновой кислоты, ингибирующих процессы кристаллизации карбонатов солей жесткости и коррозии углеродистых сталей. Для получения заданных параметров и концентраций примесей воды применяют кондиционирование воды. Кондиционирование воды осуществляется комплексом оборудования очистки воды, ее стабилизации и дозирования необходимых веществ, например, кислот для уменьшения щелочности, фтора, йода, минеральных солей (например, коррекция содержания кальция при производстве пива).
О некоторых особенностях расчёта индекса стабильности воды Ланжелье
Концентрация углекислого газа в воде имеет лишь косвенное отношение к её стабильности. Оценка индекса стабильности воды Ланжелье при детальном рассмотрении сводится к сравнению результата перемножения концентраций ионов кальция и карбонат-ионов (с учётом ионной силы раствора) со значением произведения растворимости карбоната кальция. Более или менее точный расчёт рН и щёлочности, соответствующих полному насыщению воды карбонатом кальция, при нынешнем уровне развития науки о химии воды невозможен.
Так как непосредственно СО2 в формулу произведения растворимости СаСО3 не входит, то и формально не влияет на стабильность воды. При этом в литературе (например, в [1]) можно встретить следующее уравнение между различными формами угольной кислоты:
2 НСО3 – ↔ СО3 2– + СО2 + Н2О. (1)
Согласно устоявшемуся мнению, для поддержания в растворе определённой концентрации гидрокарбонатных ионов требуется соответствующее этой концентрации количество угольной кислоты — это количество и называется «равновесной углекислотой».
Если количество находящегося в растворе углекислого газа превышает равновесное, то избыток СО2 способен вступать в реакцию с твёрдым карбонатом кальция и вызывать его растворение:
СаСО3 + СО2 + Н2О ↔ Са(НСО3)2. (2)
Воду, содержащую свободную углекислоту в концентрации, превышающей равновесную, называют «агрессивной».
Возможны также условия, когда содержание в воде свободной углекислоты совпадает с равновесной — в этом случае вода считается стабильной.
В [2] отмечается, что часть свободной углекислоты, находящейся в равновесии с бикарбонатами (то есть гидрокарбонатами), имеет название «равновесной» и не вступает в химические реакции.
СО3 2– можно рассматривать «равновесный» и «избыточный» — когда начинается активное образование СаСО3 и его выпадение в осадок. Также не вполне понятно, с какими веществами в природных водах углекислый газ вообще может вступать в химические реакции (помимо участия в углекислотном равновесии).
Только такая запись позволяет понять, как стабильность воды зависит от щёлочности и рН.
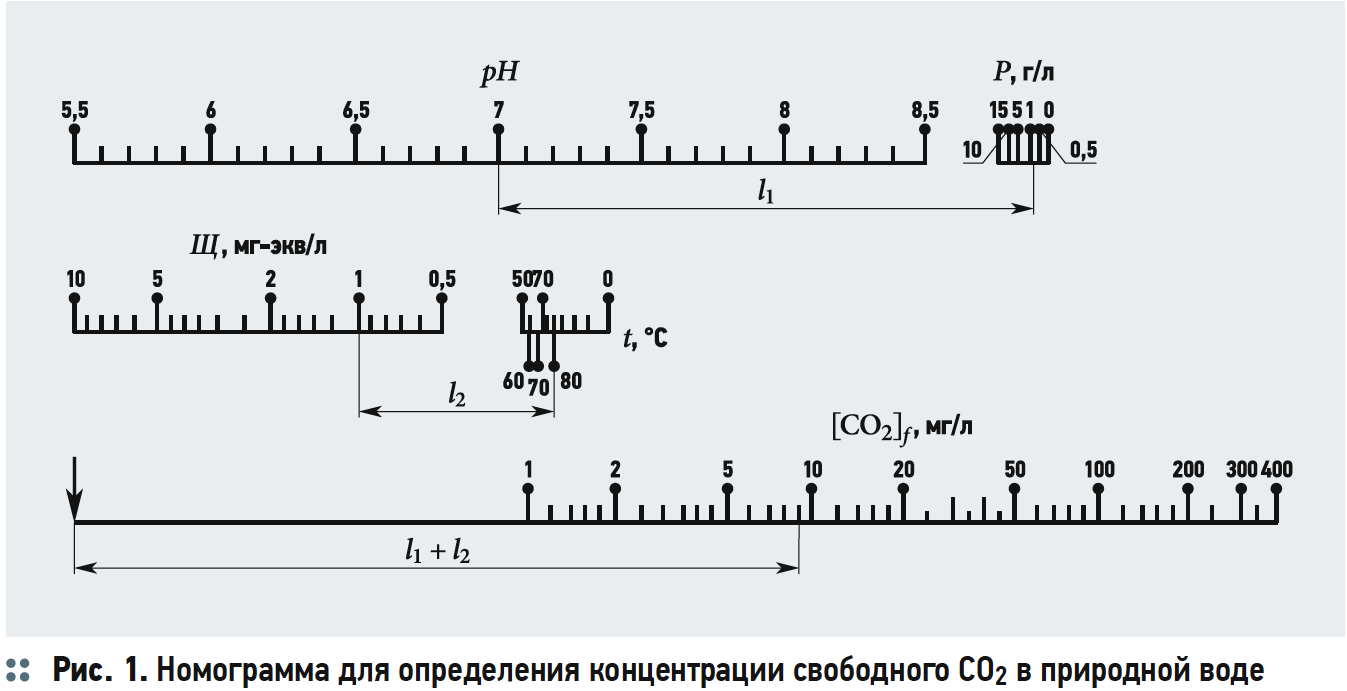
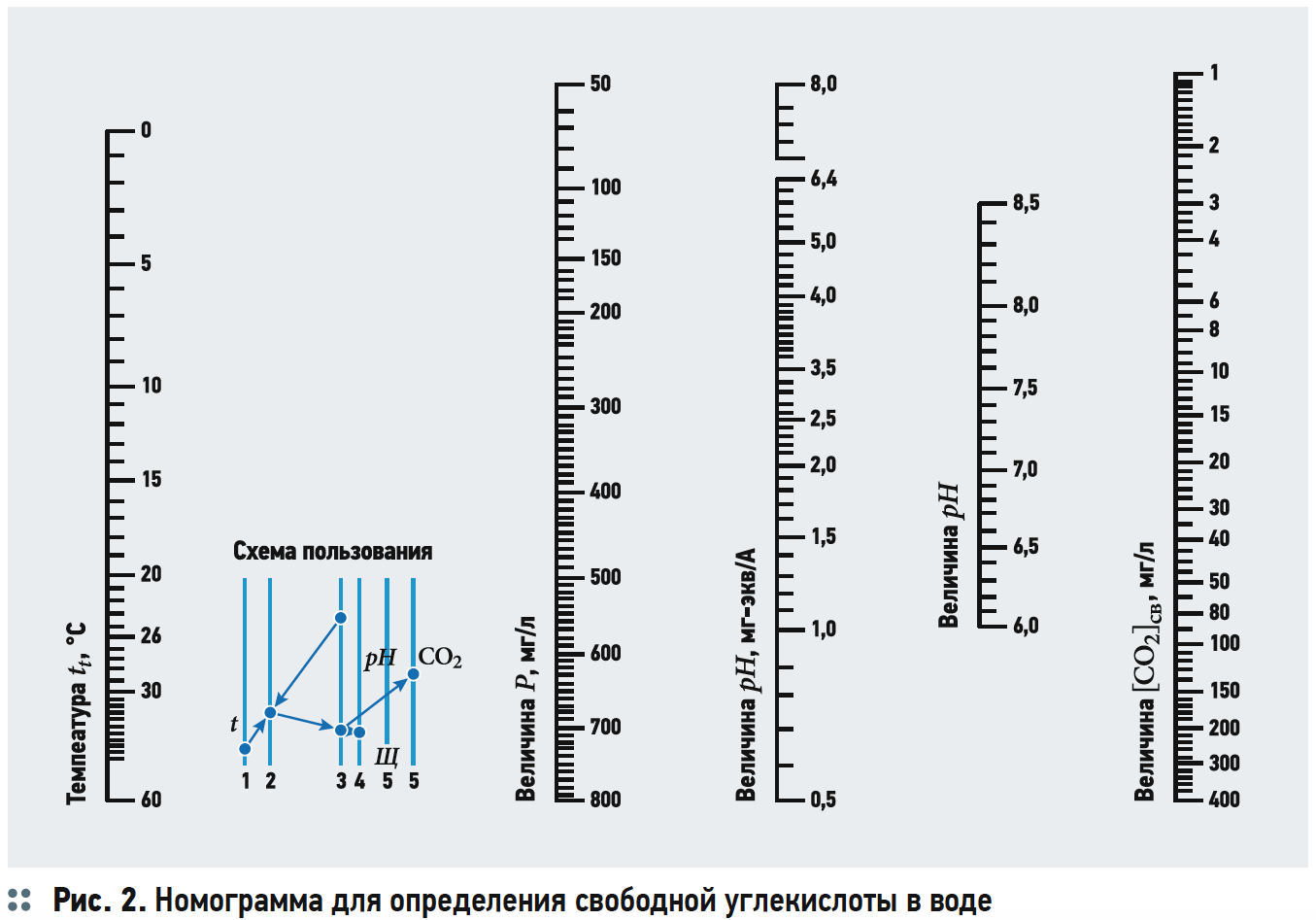
Содержание свободной двуокиси углерода обычно определяется по номограммам (рис. 1 из [3]). Как видно из рис. 1, концентрацию [CO2] определяют в зависимости от щёлочности Щ, рН воды, температуры и общего солесодержания.
Рассчитать содержание углекислого газа в воде [CO2] можно и с помощью формул, основанных на теории буферных растворов Хендерсона-Хассельбаха (подробнее см. в работе [4]).
В частности, концентрацию [CO2] можно оценить исходя из зависимостей:
Кд2 = 5,6 × 10 –11 при 25 °C (надо отметить, что в справочниках по неорганической химии приводятся и иные значения Кд1 и Кд2); [H + ] — концентрация ионов водорода, моль/л.
где z — заряд иона; I — ионная сила раствора, рассчитываемая по формуле:
где ci — молярные концентрации ионов, моль/л; zi — заряды ионов.
Для упрощения расчётов введено допущение, что вся минерализация (сухой остаток) представлена в виде хлорида натрия NaCl. Тогда при молярной массе NaCl, равной 58,44 г/моль:
где М — минерализация воды, мг/л.
С учётом минерализации воды формула (6) примет вид:
где [CO2]f — концентрация углекислого газа с учётом коэффициентов активности иона fH + и fHCO3 – ; fH + и fHCO3 – — коэффициенты активности ионов водорода и гидрокарбонат-ионов.
коэффициенты активности, соответственно, fCa 2+ и fCO3 2– :
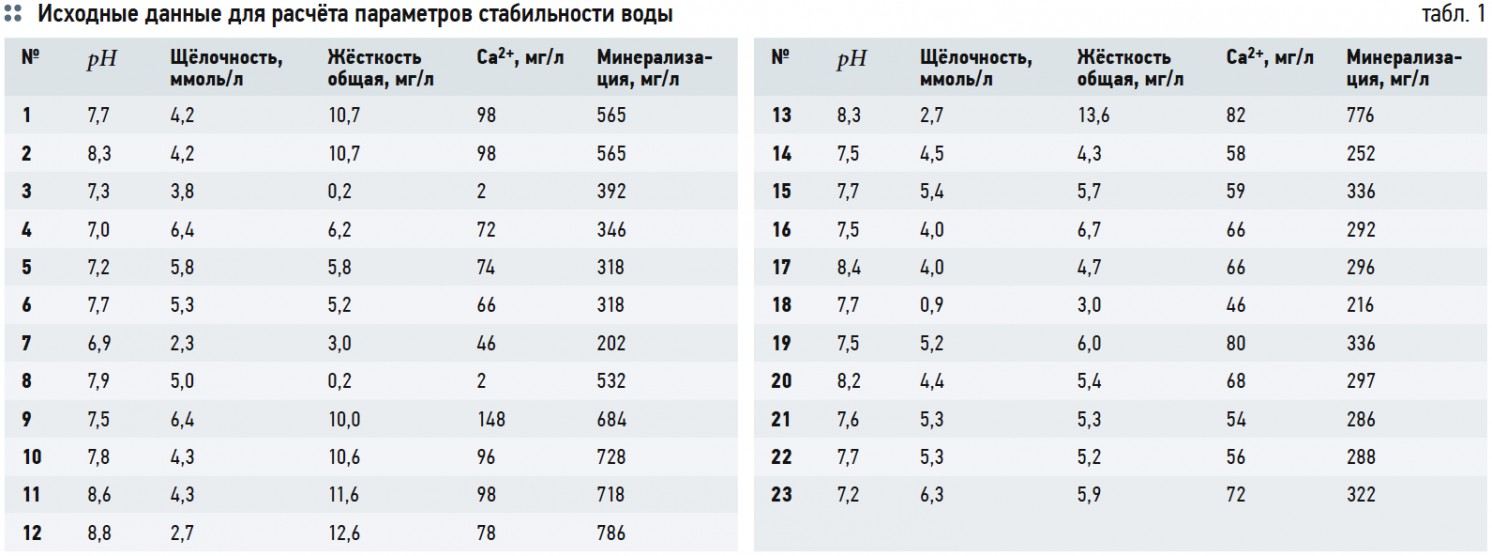
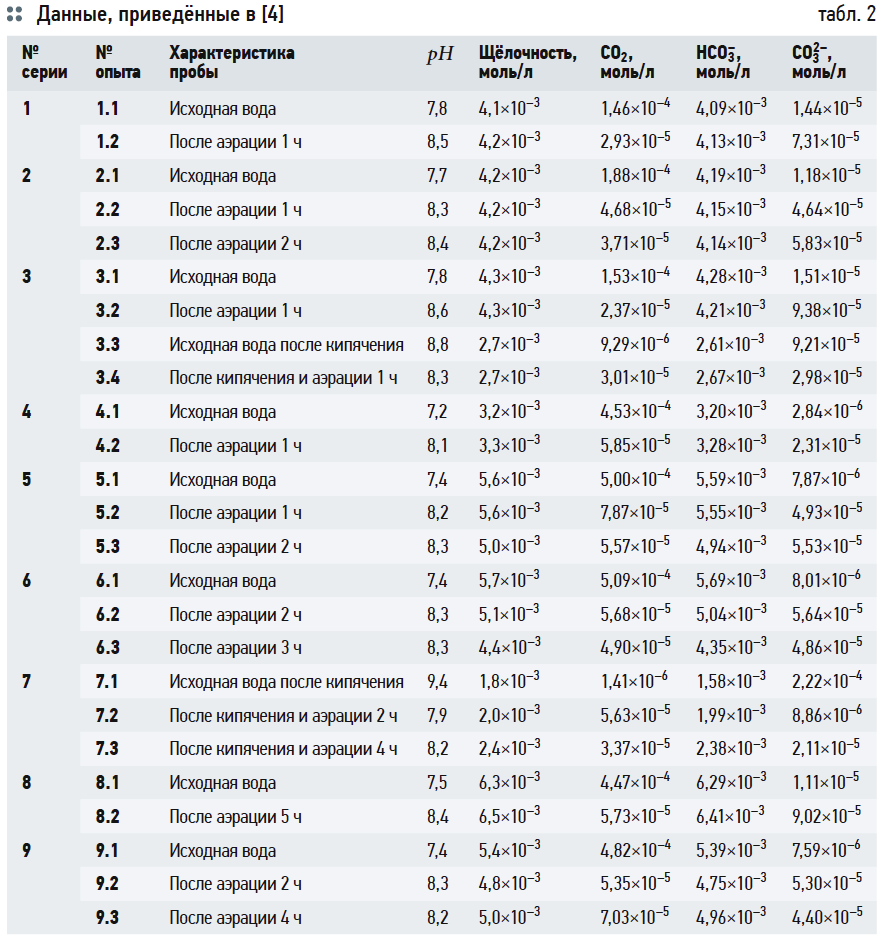
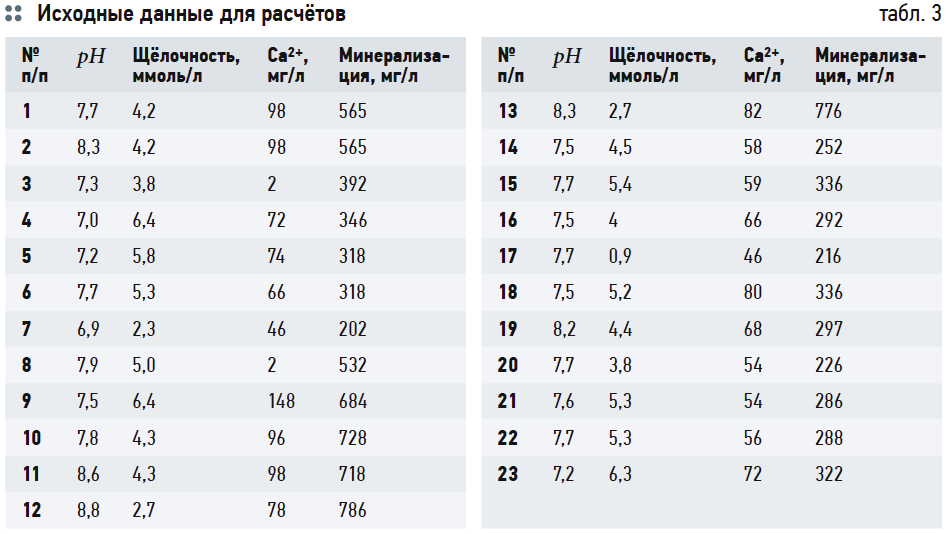
В табл. 1 представлены необходимые исходные данные для дальнейших расчётов (анализы воды из подземных источников — водозаборных скважин Московской области).
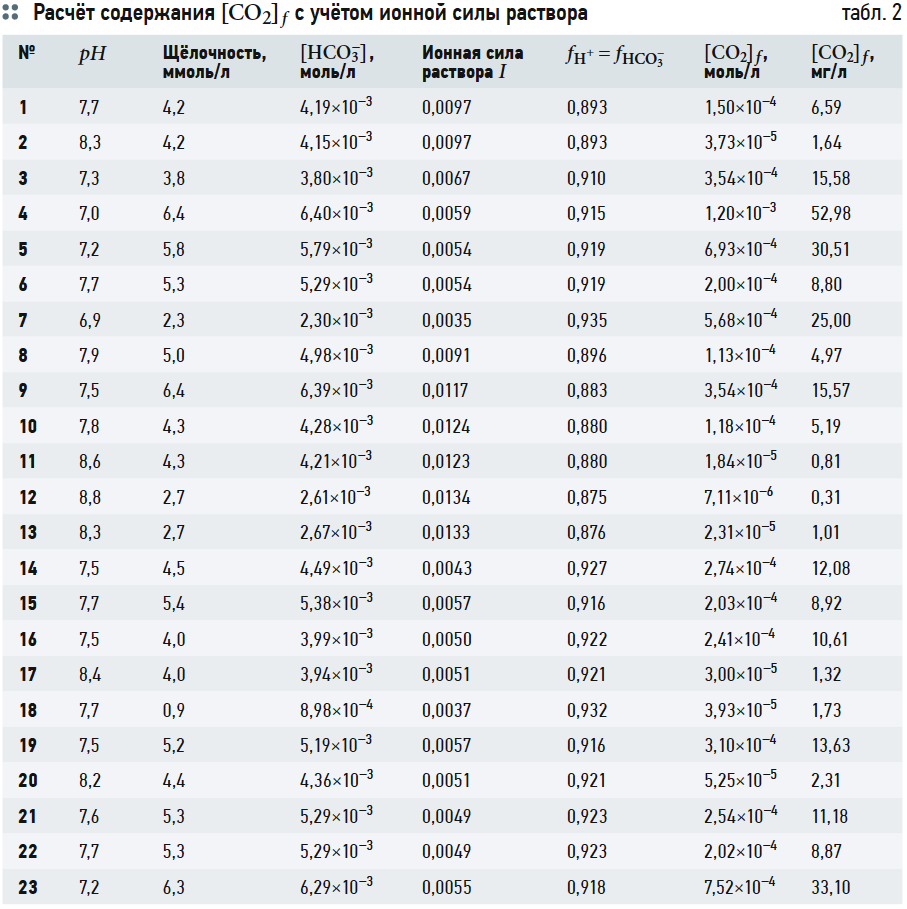
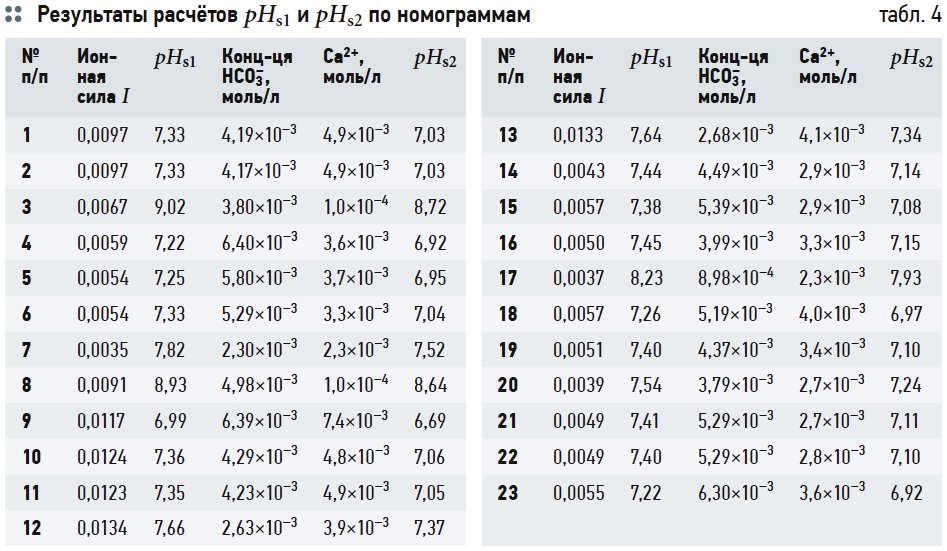
В табл. 2 представлены результаты расчётов концентрации ионов [HCO3 – ], ионной силы раствора I, коэффициентов активности ионов fH + и fHCO3 – и концентрации [CO2]f .
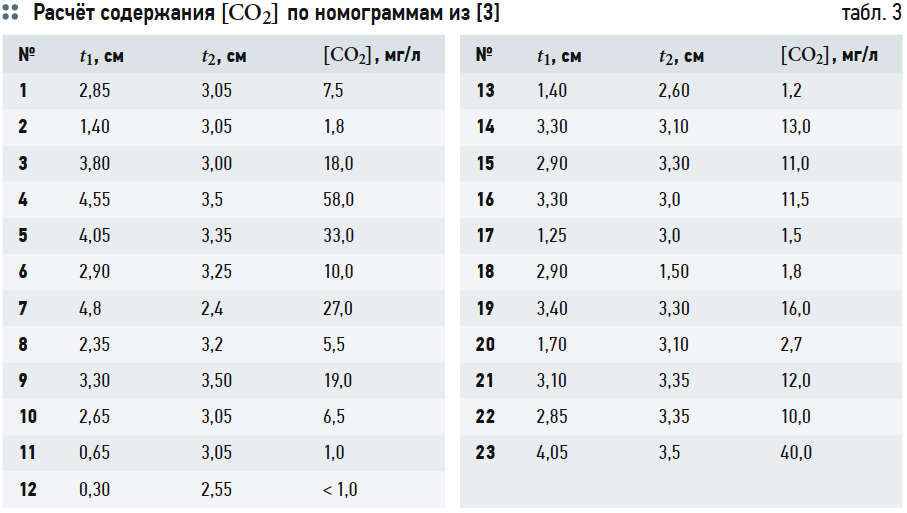
Расчёты концентрации [CO2] согласно номограммам на рис. 1 из [3] представлены в табл. 3.
Хотя графические построения и вычисления по номограммам обладают известной субъективностью, но нетрудно заметить, что концентрации [CO2] («свободной углекислоты») в табл. 3 превышают аналогичные значения в табл. 2. Это несоответствие, как уже отмечалось, возникает из-за отождествления показателя щёлочности Щ и содержания гидрокарбонат-ионов [HCO3 – ], хотя на самом деле [HCO3 – ] всегда меньше Щ, пусть и на ничтожную величину.
Содержание свободной углекислоты (правильнее — растворённого углекислого газа) в мг/л определяют также по формуле (см. в [6]):
При внимательном рассмотрении формула (12) аналогична формуле (9) за исключением опять же использования щёлочности Щ вместо содержания гидрокарбонат-ионов [HCO3 – ].
Содержание равновесной углекислоты [CO2]p с учётом ионной силы раствора I, согласно [6], вычисляется по формуле:
Учитывая, что [HCO3 – ] в рамках общепринятого подхода с трудом поддаётся расчёту, содержание [CO2]р в [6] предлагается оценивать с помощью не слишком наглядных номограмм (рис. 2 из [6]), хотя для этого существуют простые и удобные формулы (5) и (6). Авторы в [6] отмечают, что щёлочность Щ действительно равна сумме концентраций [HCO3 – ] и [CO3 2– ], но при этом опять же выделяют некую «гидратную щёлочность» [OH – ].
Данная методика основана на определении разности щёлочности исходной воды и щёлочности после добавления в эту воду порошка мрамора (который имеет в своей основе CaCO3) с последующей выдержкой в течение шести часов или пяти суток в зависимости от способа проведения анализа. Затем эта разность пересчитывается на содержание углекислоты (растворенного углекислого газа).
Таким образом, анализ на агрессивную углекислоту носит скорее косвенный характер, так как фактически в ходе эксперимента стараются достичь образования насыщенного раствора карбоната кальция. В этом случае при избытке осадка карбоната кальция образуется насыщенный раствор, в котором произведение концентраций [Ca2+] и [CO3 2– ] (с учётом коэффициентов активности) равно произведению растворимости ПРCaCO3 при данной температуре.
Следовательно, при определении индекса Ланжелье для насыщенной карбонатом кальция воды содержание карбонат-ионов [CO3 2– ] следовало бы всегда принимать равным 6,93 × 10 –5 моль/л, уточнив его только с учётом температуры и минерализации воды. Однако такое допущение представляется не вполне правомерным по двум причинам:
— во-первых, в подавляющем большинстве случаев в природных водах концентрации [Ca 2+ ] и [CO3 2– ] сильно различаются, и трудно предположить, что при добавлении твёрдого карбоната кальция они будут увеличиваться в одинаковой степени;
— во-вторых, выпадение осадка начинается, когда произведение концентраций [Ca 2+ ] × [CO3 2– ] достигнет ПРCaCO3 вне зависимости от соотношения [Ca 2+ ] и [CO3 2– ].
Во всяком случае, вопрос о предельных равновесных концентрациях при экспериментальном насыщении воды карбонатом кальция можно рассматривать отдельно и более подробно с точки зрения неорганической химии. Но даже если принять величину [Ca 2+ ] = [CO3 2– ] = 6,93 × 10–5 моль/л, то это в целом не помогает при расчёте Щs — щёлочности при предельном насыщении воды карбонатом кальция, необходимой для определения индекса Ланжелье.
Строго говоря, любое воздействие на данную систему, будь то снижение [CO2] при аэрации, добавление кислот, щелочей, вызывающих изменение [Н + ], гидролиз коагулянтов, обработка воды ионным обменом и другие технологические приёмы водоподготовки изменяют состояние углекислотного равновесия, которое влияет на химические свойства обрабатываемой воды. Эти изменения можно рассматривать на качественном уровне, но провести точную оценку, как изменится рН или щёлочность, при современном уровне развития теории буферных растворов, невозможно.
Таким образом, в известной формуле для расчёта «рН равновесного насыщения воды карбонатом кальция»:
(хотя в [5] было показано, что более правильно использовать в ней коэффициент 7,3 вместо 7,6) значение щёлочности Щ (точнее — [HCO3 – ]) должно соответствовать состоянию равновесного насыщения, то есть Щs, оценить которое не представляется возможным.
С другой стороны, использование индекса стабильности Ланжелье J наглядно на качественном уровне показывает изменение состояния водного раствора при его насыщении карбонатом кальция.
Предположим, по результатам анализов и расчётов J´ = рН – рНs = 7,5 – 7,05 = +0,45, что указывает на склонность воды к выделению CaCO3. Это означает, что при насыщении воды карбонатом кальция некое количество карбонат-ионов CO3 2– вступит в реакцию с Ca 2+ с образованием осадка. Снижение концентрации [CO3 2– ] в свою очередь приведёт к изменению концентрации [НCO3 – ] (понижению или повышению — вопрос дискуссионный), но менее значительному, чем [CO3 2–], за счёт буферных свойств раствора.
Тогда, согласно уравнению
рН воды действительно снизится. Можно аналогичным образом описать и обратную ситуацию, когда J 2+ ] × [CO3 2– ] (с учётом коэффициентов активности) со значением ПРCaCO3. Для стабильной воды будет верным равенство:
Тогда при значении J´ 0 — склонной к выделению карбоната кальция.
Значение [CO3 2– ] [моль/л] можно оценить, исходя из уравнения углекислотного равновесия в воде (см. [4]):
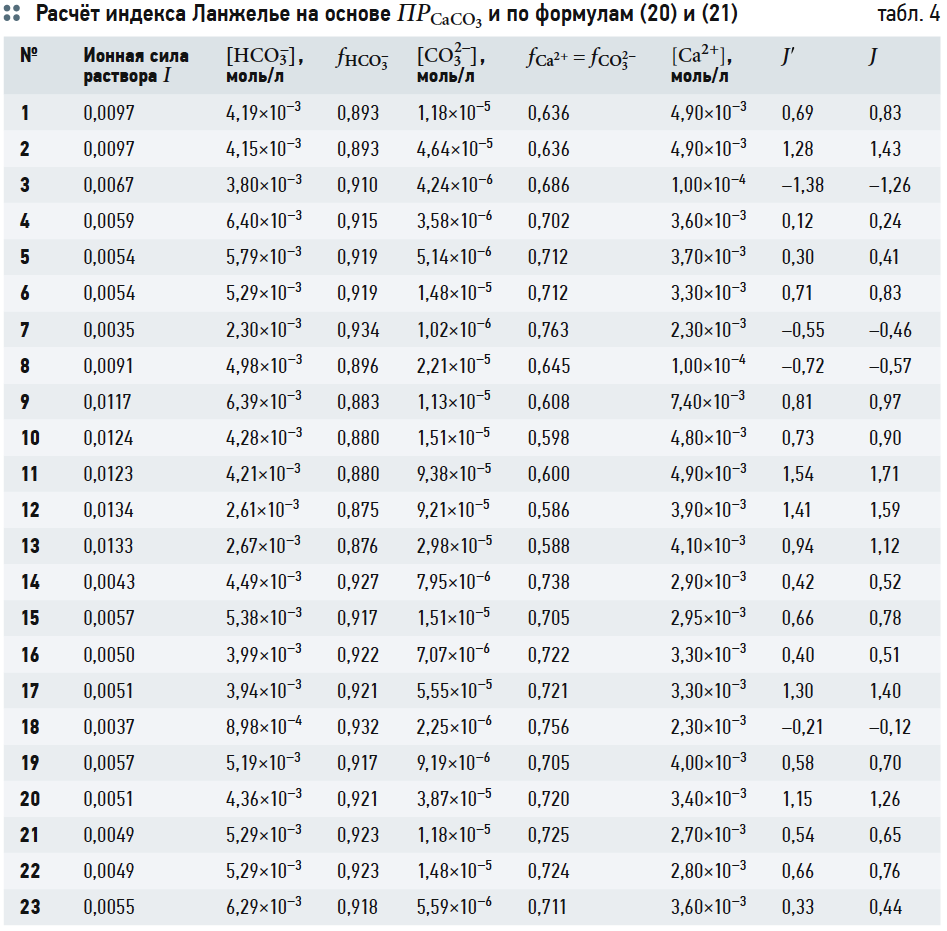
Расчётные величины согласно выражениям (11), (18), (19) сведены в табл. 4. В табл. 4 также представлены значения индекса Ланжелье, вычисленные по формуле из [5]:
где [Ca2+] подставляется в мг/л, [HCO3 –] — моль/л, отсюда J = рН – рНs. (21)
С другой стороны, незначительная разница между J и J´ приводит к следующему выводу: расчёт индекса Ланжелье J заключается не в сравнении исходных значений рН или щёлочности со значениями рНs и Щs, соответствующими состоянию полного насыщения воды карбонатом кальция, а в сравнении результата умножения концентраций [Ca 2+ ] и [CO3 2– ] (конечно, с учётом ионной силы раствора) с произведением растворимости ПРCaCO3.
Действительные значения рНs и Щs при нынешнем уровне развития химической науки расчёту не поддаются.
Выводы
1. Расчёты содержания растворенного углекислого газа («углекислоты») имеют лишь косвенное значение при определении индекса стабильности воды, так как агрессивность воды по отношению к бетону или склонность к выделению карбоната кальция определяются только концентрациями [Ca 2+ ], [CO3 2– ] и произведением растворимости ПРCaCO3, зависящим от температуры.
2. Влияние ионного состава воды на её стабильность оценивается через показатель ионной силы раствора I.
3. Показано, что при расчёте индекса стабильности Ланжелье сравниваются не исходные значения рН или щёлочности со значениями рНs или щёлочности Щs, соответствующие предельному насыщению этой воды карбонатом кальция, а произведение концентраций [Ca 2+ ] и [CO3 2– ] со значением ПРCaCO3 с учётом температуры и солесодержания.
4. Прогноз изменения концентраций всех составляющих углекислотного буферного раствора — [CO2], [HCO3 – ], [CO3 2– ], а также рН воды — при каком-либо воздействии на систему при нынешнем уровне знаний о свойствах воды невозможен; одной из задач химической науки является совершенствование теории буферных растворов, которое позволило бы проводить подобные расчёты, что явилось бы технологическим прорывом в водоподготовке.
О возможности умягчения, деминерализации и изменения стабильности воды в процессе обезжелезивания
В процессе безреагентного обезжелезивания с помощью аэрации и фильтрования возможно изменение жёсткости и солесодержания воды. Изменение этих показателей, по всей вероятности, происходит не вследствие ионной сорбции Ca2+ и Mg2+, а в результате изменения индекса стабильности воды, которое можно рассматривать с точки зрения теории буферных растворов.
Другой автор — ведущий инженертехнолог ООО «НПЦ ПромВодОчистка» А. А. Бударагин [2] — в своей рецензии на представленную статью выразил сомнение в возможности умягчения и деминерализации в процессе обезжелезивания, указав, что «достаточно проблематично понять, в результате чего соли жёсткости частично выпадают в осадок».
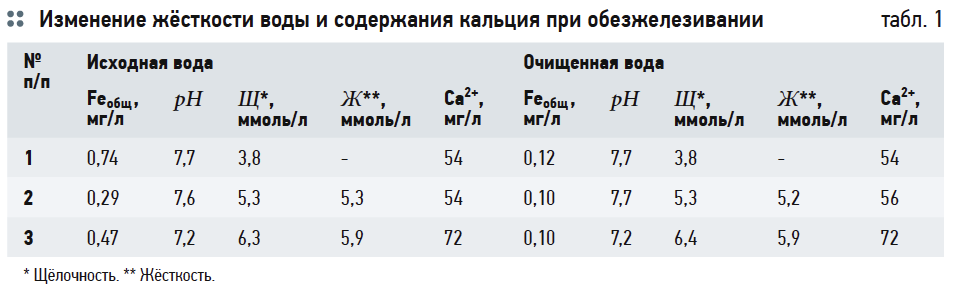
Наблюдения за изменением жёсткости воды и содержанием кальция при обезжелезивании, проведённые нами на станциях водоподготовки в Павлово-Посадском и Дмитровском районах Московской области, скорее подтверждают выводы второго автора (табл. 1).
В ходе работы станций водоподготовки, как видно из табл. 1, определялось не только непосредственно содержание общего железа, но и жёсткость воды, содержание кальция, рН воды, щёлочность, а также иные показатели, не указанные в табл. 1. Рассмотрение большего количества показателей качества воды, чем просто необходимо для решения данной технологической задачи, представляется весьма уместным, так как оно может дать более полную картину происходящего процесса. Ведь, несмотря на общепризнанное мнение, что вода представляет собой целостную систему, на практике преобладает подход, когда при исследованиях обращают внимание только на непосредственно интересующие параметры.
Как видно из данных табл. 1, заметного снижения жёсткости и концентрации кальция Ca 2+ не отмечено. Почти не изменились значения рН и щёлочности. Во всех случаях обезжелезивание проводилось с помощью глубокой аэрации воды компрессорами с последующим фильтрованием на напорных фильтрах, загруженных алюмосиликатным сорбентом «АС». Скорость фильтрации во всех случаях поддерживалась 18–20 м/ч. Следует также иметь в виду, что методика измерения концентрации Ca 2+ в условиях обычных городских лабораторий (даже официально аттестованных) не отличается высокой точностью, и вполне возможна погрешность в несколько миллиграмм на литр как в одну, так и в другую стороны.
Для описания этого процесса разработаны различные изотермы сорбции: Генри, Ленгмюра, Фрейндлиха, БЭТ. Однако даже для молекулярной сорбции, происходящей в динамических условиях при фильтрации в зернистой пористой среде, до сих пор не получено адекватных формул, которые можно было бы использовать в инженерных расчётах.
Многочисленные же дифференциальные уравнения и эмпирические формулы, предлагавшиеся разными исследователями для описания фильтрации через слой зернистой загрузки, на практике оказываются непригодными для практического применения. Поэтому процесс ионной сорбции катионов жёсткости изначально исключим из рассмотрения. С другой стороны, известно, что процессы химического умягчения связаны с образованием малорастворимых соединений — CaCO3 и Mg(OH)2, которые затем выделяются из обрабатываемой воды отстаиванием и(или) фильтрованием. Процесс обезжелезивания чаще всего связан с аэрацией исходной воды — упрощённой или глубокой, что предполагает газообмен между атмосферой и водой, которая всегда содержит растворённые газы. Как было подробно рассмотрено в [3, 4], аэрация значительно влияет на углекислотное равновесие в воде, что, в свою очередь, влияет на значение рН. Напомним, что в общем виде все составляющие углекислотного буферного раствора связаны уравнением следующего вида:
а выражение для рН, согласно теории буферных растворов Хендерсона-Хассельбаха, выглядит как:
Справедливости ради нужно сказать, что продолжительность аэрации при промышленном обезжелезивании очень небольшая — максимум всего несколько минут, что, конечно, несопоставимо с лабораторными опытами по многочасовой глубокой аэрации воды с помощью микрокомпрессора. Что, в свою очередь, не отрицает возможности изменения углекислотного равновесия при промышленном обезжелезивании воды на конкретном водоисточнике, на что и указывал Д. Ф. Янченко.
Таким образом, снижение жёсткости при обезжелезивании можно напрямую связать с изменением углекислотного равновесия и вытекающей отсюда возможностью выпадения CaCO3. Данное явление в водоподготовке обычно описывают показателем стабильности воды, выраженном в индексе Ланжелье (известны и другие индексы стабильности воды, но наиболее распространённым у нас является именно индекс Ланжелье). В целом, под стабильностью воды понимают состояние, когда вода не склонна ни к выделению карбоната кальция, ни к его растворению, что приводит к ускоренному разрушению бетонных конструкций. Индекс Ланжелье определяется как разность рН исходной воды и рНs (значение водородного показателя при полном насыщении данной воды карбонатом кальция):
Если получившееся значение J меньше 0, вода считается агрессивной. Наоборот, при J > 0 вода считается склонной к осадкообразованию карбоната кальция. Воды с J от –0,2 до +0,2 считаются относительно стабильными. Далее, чем больше по модулю значение J, тем более вода приобретает агрессивные свойства либо, наоборот, становится склонной к выделению карбоната кальция.
Индекс Ланжелье может быть выражен и с помощью щёлочности:
Здесь, как и в формуле (4), Щs соответствует щёлочности воды после её насыщения CaCO3. Независимо от способа выражения индекса стабильности, отклонение его от равновесия часто объясняют наличием агрессивной углекислоты, низким значением рН, высоким содержанием солей жёсткости и т.п. Отставив из рассмотрения коррозию в агрессивной водной среде металлических элементов и деталей, следует задаться вопросом о корректности некоторых формул и определений, используемых при описании стабильности воды.
Рассмотрим данный вопрос подробнее. рНs может быть рассчитан как по формулам, так и по номограммам, приводимым в специализированной литературой. Одна из часто используемых формул (например, в [5]) для расчёта pHs выглядит таким образом:
где К2 — константа равновесия второй ступени диссоциации угольной кислоты (HCO3 – = H + + CO3 2– ), К2 = 5,6 × 10 –11 при 25 °C (в работе [4] она записывалась как Кд2); ПРCaCO3 — произведение растворимости (произведение концентраций ионов малорастворимого электролита в его насыщенном растворе) карбоната кальция CaCO3; Са 2+ — содержание кальция в воде, мг/л; Щ — общая щёлочность воды, мг-экв/л; I — ионная сила раствора, которая оценивает интенсивность электрического поля, создаваемого ионами в растворе.
Сразу отметим, что под показателем Щ понимается только «общая щёлочность». Показатель так называемой «гидратной щёлочности», как было показано в [3], практически не имеет смысла.
В [6] уравнение (6) записано несколько иначе:
где ε — коэффициент, учитывающий солесодержание; ТАС — общая щёлочность; ТСа — содержание кальция.
Сложное, на первый взгляд, уравнение (6) в действительности происходит из уравнения произведения растворимости воды:
где fCa 2+ и fCO3 2– — коэффициенты активности ионов Са 2+ и CO3 2– ; [CO3 2– ] — концентрация карбонат-ионов, моль/л.
Коэффициент активность ионов (величина, характеризующая взаимодействие ионов в сильно разбавленном растворе электролита) определяется по формуле Дебая-Хюккеля:
Уравнение (8) можно преобразовать, выразив fCO3 2– [CO3 2– ] через концентрации гидрокарбонат-ионов [HCO3 – ] (с учётом коэффициента активности fНСO3 – ) и ионов водорода [H + ] (активность ионов водорода принимается равной единице), то есть имеет место:
Тогда уравнение (8) преобразуется в следующий вид:
Прологарифмировав обе части выражения (11), получим:
В научно-технической практике часто применяют такую замену: – lg(Х) = рХ, где Х — концентрация какого-либо иона, константа и т.п. Тогда (12) с учетом (9) запишется так:
Сразу отметим различие выражений (6) и (14): в одном случае для расчёта рНs фигурирует щёлочность воды Щ, в другом — концентрация гидрокарбонатионов [HCO3 – ]. Это немаловажное различие, так как щёлочность воды определяется не только содержанием гидрокарбонат-ионов [HCO3 – ], но и карбонат-ионов [CO3 2– ]. Среди специалистов по водоподготовке давно укоренилось представление, что общая щёлочность при рН 2– ] в этом случае можно пренебречь), но одновременно накладывает ограничения на использование уравнения (6) только в пределах определённых значений рН, что, конечно, является его недостатком.
Отождествление щёлочности и гидрокарбонатов приводит к путанице при определении показателей качества воды даже в аналитических лабораториях. Например, в ряде лабораторий предлагаются услуги по определению отдельно щёлочности и отдельно гидрокарбонатов, причём анализ на гидрокарбонаты может стоить 200–300 руб. и даже больше (по расценкам начала 2017 года).
В протоколах испытаний воды для хозяйственно-питьевого водоснабжения можно найти такие данные (взяты из документов, размещённых в Интернете):
Из представленных данных видно, что во всех случаях содержание гидрокарбонатов равно щёлочности, умноженной на их эквивалентную массу — 61 г/моль или, точнее, 61 мг/ммоль. Выполнить такой простой расчёт способен мало-мальски грамотный человек и без проведения химического анализа. При этом содержание гидрокарбонатов всегда меньше щёлочности, пусть и на ничтожную величину. Концентрации [HCO3 – ] и [CO3 2– ] при известных рН и щёлочности воды нужно искать по известным формулам углекислотного равновесия, которые подробно рассмотрены в [4], в частности:
При этом сам заказ анализа на гидрокарбонаты представляется излишним.
На обе формулы — (6) и (14) — накладываются ограничения, связанные с показателем ионной силы раствора I. Это связано с несовершенством теории сильно разбавленных сильных электролитов Дебая-Хюккеля, которая не учитывает молекулярной структуры растворителя, размеров ионов и расстояния между ними. Обычно считают, что она применима для концентраций растворов не более 0,015 моль/л. Ионная сила раствора определяется по формуле:
где ci — молярные концентрации ионов, моль/л; zi — заряды ионов.
Для расчётов по формуле (16) необходимо знать полный ионный состав воды, что часто бывает затруднительно, поэтому можно ввести допущение, представив всю минерализацию (сухой остаток) в виде NaCl. Так как молярная масса NaCl составляет примерно 58,5 г/моль, то молярная концентрация 0,015 моль/л соответствует минерализации приблизительно 878 мг/л — условно примем, что расчёты по (6) и (14) могут быть корректными только для пресных вод (до солесодержания 1 г/л).
Рассчитаем для примера ионную силу раствора (исходной природной воды) с сухим остатком 500 мг/л. 500 мг/л соответствует 0,0085 моль/л NaCl. Тогда ионная сила такого раствора составит:
I = 0,5 × (0,0085 × 1 2 + 0,0085 × 1 2 ) = 0,0085.
Другим способом определения рНs, позволяющим проводить расчёты для широкого диапазона минерализаций, является использование специальных номограмм, приведённых в соответствующей литературе по водоподготовке, например, в [5] (рис. 2), а также в [7] (рис. 3).
Согласно номограммам на рис. 2, значение рНs определяется по формуле:
где f1(t), f2(Ca 2+ ), f3(Щ) и f4(p) — функции температуры воды, содержания кальция, щёлочности и солесодержания (минерализации), соответственно.
Интересно, что выражение (17) в некоторых популярных изданиях по водоподготовке, а также в сети Интернет, иногда записывается с ошибками.
По номограммам на рис. 3 рНs оценивается с помощью простейших геометрических построений. Разумеется, точность расчётов по номограммам уступает точности расчёта по математическим формулам, так как при этом всегда присутствует определённая субъективность.
Оценим значения рНs и индекса Ланжелье J по выражениям (6), (14) и номограммам на рис. 2 и 3. Условно обозначим их рНs1, J1; рНs2, J2; рНs3, J3 и рНs4, J4, соответственно. Исходные данные для расчётов взяты из анализов исходной воды из подземных источников (скважин) Московской области, аэрированной и кипячёной воды. Большая часть исходных данных соответствует приведённым в [4] с добавлением необходимых показателей, которые не были рассмотрены в указанной статье. Эти данные были дополнены результатами более поздних исследований. Все они сведены в табл. 3.
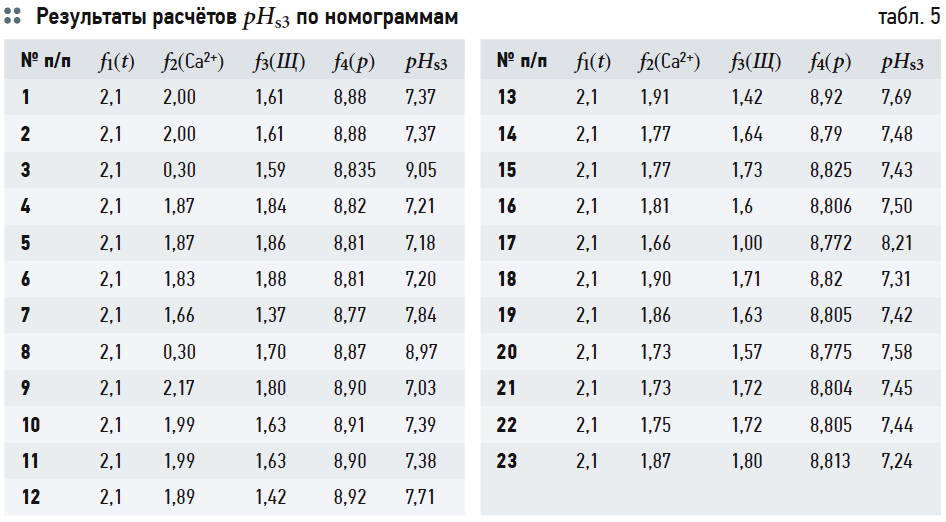
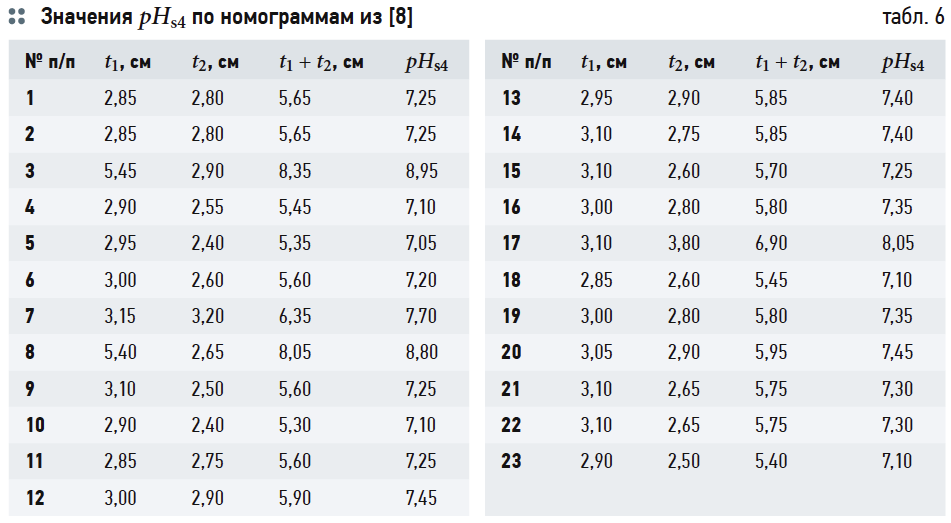
В табл. 4 приведены результаты расчётов значений рНs1 (согласно выражению (6)), рНs2 (согласно выражению (14)) и связанных с ними параметров ионной силы раствора I и содержания гидрокарбонат-ионов [HCO3 – ]. Результаты расчётов рНs3 по номограммам на рис. 2 и по формуле (17) приведены в табл. 5. В табл. 6 показаны значения рНs4, найденные согласно номограммам из [8] (t1, t2, t1 + t2 — результаты геометрических построений, сделанные вручную).
Следует повторить, что все данные в табл. 5 и 6 основаны на графических построениях, которые, разумеется, в той или иной степени субъективны.
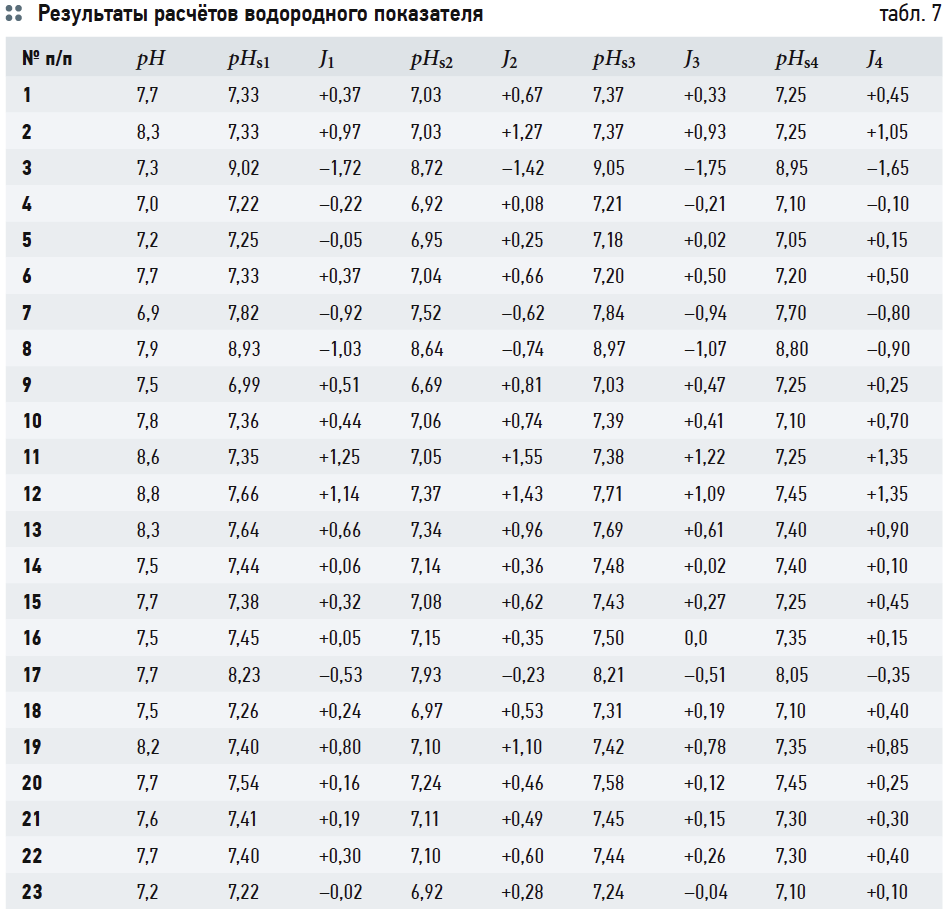
В табл. 7 сведены результаты расчётов водородного показателя при полном насыщении карбонатом кальция CaCO3 по всем использованным формулам и номограммам и значения индексов Ланжелье J1, …, J4. Во втором столбце указаны измеренные значения рН воды.
Данные табл. 7 показывают, что значения J1 и J2 (вычисленные на основе формулы (6) и номограмм на рис. 2) отличаются очень мало. Наоборот, значения J3, рассчитанные на основе (14), почти во всех случаях превышают J1 на 0,3. Это довольно существенное различие: в одном случае одну и ту же воду можно считать стабильной, в другом случае она определяется как склонная к выделению карбоната кальция. Значения J4 занимают своего рода промежуточное положение между J1 и J2, но в основном ближе к J1.
Разницу между J1 и J3, очевидно, следует объяснять размерностями величин, используемых в данных выражениях.
Так, если в (14) концентрации [Ca 2+ ] и [HCO3 – ] выразить не в [моль/л], а в [мг/л] и [мг-экв/л] ([ммоль/л]), соответственно, то эта формула приобретёт вид:
где 20 — эквивалентная масса кальция [г/моль], получаемая делением молярной массы (М = 40 г/моль) на валентность z = 2.
Коэффициент 7,6 в выражении (6), вероятно, был получен из следующей записи этой формулы:
где Щ — щёлочность в [мг-экв/л] (или [ммоль/л]); Са 2+ — содержание в воде кальция в [мг/л]; 40 — молярная масса кальция, г/моль.
Однако, по мнению автора, более правильным в данном случае является использование не молярной, а эквивалентной массы, так как расчёты ведутся для веществ, находящихся в ионной форме.
Учитывая, что обычно концентрация кальция измеряется в [мг/л], а содержание гидрокарбонатов из уравнения (15) получается в [моль/л] (для этого щёлочность Щ также следует подставлять в [моль/л]), то окончательно выражение (14) можно записать в виде:
Следует отметить, что выражение (14) применимо для всех значений рН, так как [HCO3 – ] определяется исходя из уравнения константы диссоциации (химического равновесия) угольной кислоты, основанном на фундаментальном законе действующих масс.
Выводы
1. Умягчение воды (как попутный процесс при её обезжелезивании с помощью аэрации и фильтрования) возможно только при определённом сочетании показателей качества воды. При этом оно не может рассматриваться как технологически значимый метод снижения жёсткости.
2. Не представлено никаких обоснованных данных, указывающих на протекание процесса умягчения при обезжелезивании за счёт явления ионной сорбции. Более вероятной причиной умягчения воды в данном случае следует считать изменение показателя стабильности воды вследствие интенсивной аэрации.
3. Анализ воды на гидрокарбонаты, предлагаемый рядом лабораторий в качестве платной услуги, представляется бессмысленным, так как концентрацию [HCO3 – ] можно легко вычислить согласно известному выражению (15).
4. Расчётные формулы и номограммы для определения рНs и индекса стабильности Ланжелье J, по мнению автора, нуждаются в уточнении. Более адекватным выражением для расчёта рНs представляется следующее:
в котором [Ca 2+ ] имеет размерность [мг/л], [HCO3 – ] — [моль/л].