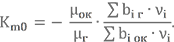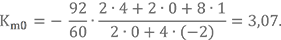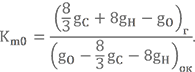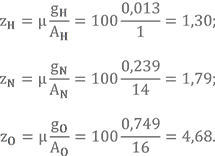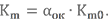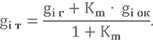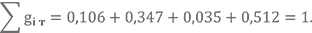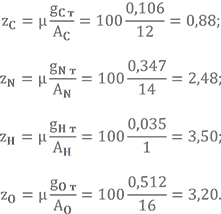Что такое стехиометрическое соотношение компонентов
Беседы о ракетных двигателях
Просто о том, что кажется сложным
Урок 02. Определение параметров топлива (ч.1)

В сегодняшнем уроке мы узнаем, как определить стехиометрическое соотношение компонентов и записать условную химическую формулу топлива.
Во-первых, давайте вспомним, что же это такое – стехиометрическое соотношение компонентов топлива. Оказывается, топливо может гореть по-разному. Причем не нужно воспринимать это горение как обычное горение дров в камине, где в качестве окислителя выступает кислород воздуха. Горение топлива в камере ракетного двигателя – это, в первую очередь, химическая реакция окисления с выделением тепла. А протекание химических реакций существенно зависит от того, сколько вещества вступает в реакцию. Если взять 1 кг какого-нибудь горючего и заставить его взаимодействовать с очень большим количеством окислителя, то после того, как этот 1 кг горючего закончится, химическая реакция горения прекратится, потому что окислителю просто нечего будет окислять.
Вопрос на засыпку.
На защите курсового проекта у студента спрашивают: что произойдёт с горючим, впрыскиваемым через пояс завесного охлаждения перед критическим сечением камеры? Распространённый ответ: оно сгорит. Это неверно. Ему не с чем там гореть. Весь окислитель уже прореагировал в камере сгорания. Горючее испарится, может разложиться, но сгореть не может.
Значит, для каждой топливной пары существует вполне определённое соотношение между количеством окислителя и горючего, при котором они взаимодействуют друг с другом без остатка. Именно такое соотношение называют стехиометрическим.
Количество компонента можно задать объёмом или массой. При расчёте топлив больше распространено массовое соотношение компонентов Km (индекс m как раз и указывает на это). Для обозначения стехиометрического соотношения добавляют индекс 0, т.е. – Km0. Каждая топливная пара имеет вполне определённое Km0. Его можно найти в справочной литературе. Однако в учебно-познавательных целях давайте рассмотрим, как его можно вычислить.
Значение Km0 зависит от валентности, которую могут проявлять химические элементы в теоретической форме уравнения химической реакции
Возьмём топливную пару НДМГ + АТ и вычислим для неё Km0. Молекулярную массу НДМГ и АТ мы уже считали:
μ(C2N2H8) = 12·2 + 14·2 + 1·8 = 60 а.е.м.
μ(N2O4) = 14·2 + 16·4 = 92 а.е.м.
Количество атомов и валентности элементов известны. Подставляем в формулу
Но это наиболее общая формула. Она годится для любых веществ, но неудобна, если компонент представляет собой смесь. Придётся дополнительно определять его условную химическую формулу чтобы узнать bi.
Для определения Km0 при сгорании углеводородных топлив в учебнике Штехера, например, предлагается использовать более практичную формулу (для веществ, содержащих только C, H, N, O)
Найдём стехиометрическое соотношение компонентов для той же топливной пары НДМГ + АТ, но по другой формуле.
Массовые доли элементов в НДМГ были найдены в прошлом уроке gC = 0,400, gN = 0,467, gH = 0,133.
Для азотного тетраоксида gN = 0,304, gO = 0,696 (предлагаю Вам посчитать их самостоятельно).
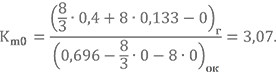
Вроде бы сошлось. 🙂
Если Вам всё же больше нравится первый вариант, то компонент нужно представить в виде условной химической формулы. При этом задаться условной молекулярной массой смеси (например, μ = 100 а.е.м.).
Количество атомов в формуле можно определить так:
Определим условную химическую формулу АК-20, рассмотренного в прошлом уроке.
Массовые доли gH = 0,013, gN = 0,239, gO = 0,749.
Получить условную химическую формулу топлива можно тем же способом.
Для определения массовых долей компонентов в топливе в целом нужно знать действительное соотношение компонентов Km. Прежде чем его вычислить, скажем несколько слов о такой величине, как коэффициент избытка окислителя αок.
Несмотря на то, что казалось бы сжигать компоненты при стехиометрии наиболее выгодно, по ряду причин реальные ЖРД обычно работают с некоторым избытком горючего (рассказ о причинах займёт довольно много времени, возможно этому вопросу будет посвящена отдельная статья в Базе знаний). Для различия между стехиометрическим и действительным соотношением компонентов топлива и вводится αок.
Зависимость крайне проста
Коэффициент может принимать любые положительные значения. Если αок = 1, Km = Km0, при αок 1 – избыток окислителя.
Узнать наперед какое значение αок лучше выбрать, очень сложно. Поэтому им либо задаются из диапазона рекомендуемых значений, либо проводят серию тепловых расчетов при разных αок, а затем выбирают оптимальное, например, из условия максимума скорости истечения продуктов сгорания на срезе сопла.
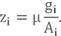
Зная значение коэффициента избытка окислителя, можно определить массовый состав топлива:
Определим массовый состав топливной пары НДМГ + АТ при αок = 0,91 и запишем её условную химическую формулу.
Значение Km0 получено в примерах выше. Массовые доли химических элементов в компонентах тоже уже известны.
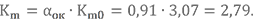
Количество атомов в условной химической формуле
На этом всё. Надеюсь, урок был полезным. В следующий раз поговорим об энтальпии топлива и плотности смесей.
Стехиометрические соотношения
Для каждого вещества реакции существуют следующие количества вещества:
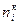
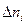
Так как количество вещества не может быть отрицательно, то для исходных веществ
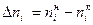
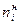
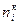
Для продуктов реакции 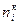
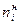

Стехиометрические соотношения – соотношения между количествами, массами или объемами (для газов) реагирующих веществ или продуктов реакции, рассчитанные на основе уравнения реакции. В основе расчетов по уравнениям реакций лежит основной закон стехиометрии: отношение количеств реагирующих или образовавшихся веществ (в молях) равно отношению соответствующих коэффициентов в уравнении реакции (стехиометрических коэффициентов).
Пример:
Для реакции алюмотермии, описываемой уравнением:
количества прореагировавших веществ и продуктов реакции относятся как

В общем случае для реакции вида
где маленькие буквы обозначают коэффициенты, а большие – химические вещества, количества реагирующих веществ связаны соотношением:

Любые два члена этого соотношения, связанные равенством, образуют пропорцию химической реакции: например, 

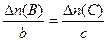

Если для реакции известна масса образовавшегося или прореагировавшего вещества реакции, то можно найти его количество по формуле 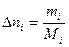
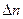
Если даны массы нескольких реагентов, то расчет масс остальных веществ ведут по тому из веществ, которое находится в недостатке, т. е. полностью расходуется в реакции. Количества веществ, которые точно соответствуют уравнению реакции без избытка или недостатка, называют стехиометрическими количествами.
Таким образом, в задачах, связанных со стехиометрическими расчетами, основным действием является нахождение опорного вещества и расчет его количества, которое вступило или образовалось в результате реакции.
Расчет количества индивидуального твердого
вещества
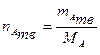
где 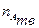
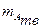
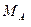
Расчет количества природного минерала
или смеси твердых веществ
Пусть дан природный минерал пирит, основной компонент которого FeS2. Кроме него в состав пирита входят примеси. Содержание основного компонента или примесей указывается в массовых процентах, например, 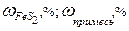
Если известно содержание основного компонента, то

Если известно содержание примесей, то
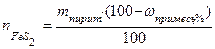
где 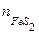

Аналогично рассчитывается количество компонента в смеси твердых веществ, если известно его содержание в массовых долях.
Стехиометрическое соотношение
Смотреть что такое «Стехиометрическое соотношение» в других словарях:
стехиометрическое соотношение — stechiometrinis santykis statusas T sritis chemija apibrėžtis Ekvivalentiški reaguojančiųjų medžiagų kiekiai. atitikmenys: angl. stoichiometric ratio; stoichiometric relationship rus. стехиометрическое отношение; стехиометрическое соотношение … Chemijos terminų aiškinamasis žodynas
нормированное или нормализованное стехиометрическое соотношение — — [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN normalized stoichiometric ratio … Справочник технического переводчика
теоретическое стехиометрическое соотношение — Избыток воздуха, теоретически необходимый для полного сгорания топлива, соответствующий богатому срыву [А.С.Гольдберг. Англо русский энергетический словарь. 2006 г.] Тематики энергетика в целом EN theoretical stoichiometric ratioLo … Справочник технического переводчика
стехиометрическое отношение — stechiometrinis santykis statusas T sritis chemija apibrėžtis Ekvivalentiški reaguojančiųjų medžiagų kiekiai. atitikmenys: angl. stoichiometric ratio; stoichiometric relationship rus. стехиометрическое отношение; стехиометрическое соотношение … Chemijos terminų aiškinamasis žodynas
Соотношение стехиометрическое — [stoichiometric ratio] численное соотношение между количествами реагирующих веществ, отвечающих законам стехиометрии. Соотношение стехиометрическое выражается целыми числами для подавляющего большинства твердых химических соединений. Однако среди … Энциклопедический словарь по металлургии
Маргарита Дергачева — Маргарита Борисовнв Дергачева, доктор химических наук, профессор. Институт органического катализа и электрохимии им. Д. В. Сокольского, г. Алматы. Казахстанско Британский Технический Университет, г. Алматы. Получение соединений CuInSe2… … Википедия
Химическое уравнение — Химическим уравнением (уравнением химической реакции) называют условную запись химической реакции с помощью химических формул, числовых коэффициентов и математических символов. Уравнение химической реакции даёт качественную и количественную… … Википедия
stechiometrinis santykis — statusas T sritis chemija apibrėžtis Ekvivalentiški reaguojančiųjų medžiagų kiekiai. atitikmenys: angl. stoichiometric ratio; stoichiometric relationship rus. стехиометрическое отношение; стехиометрическое соотношение … Chemijos terminų aiškinamasis žodynas
stoichiometric ratio — stechiometrinis santykis statusas T sritis chemija apibrėžtis Ekvivalentiški reaguojančiųjų medžiagų kiekiai. atitikmenys: angl. stoichiometric ratio; stoichiometric relationship rus. стехиометрическое отношение; стехиометрическое соотношение … Chemijos terminų aiškinamasis žodynas
stoichiometric relationship — stechiometrinis santykis statusas T sritis chemija apibrėžtis Ekvivalentiški reaguojančiųjų medžiagų kiekiai. atitikmenys: angl. stoichiometric ratio; stoichiometric relationship rus. стехиометрическое отношение; стехиометрическое соотношение … Chemijos terminų aiškinamasis žodynas
Стехиометрия
Из Википедии — свободной энциклопедии
Понятие стехиометрии относят как к химическим соединениям, так и к химическим реакциям. Соотношения, в которых, согласно законам стехиометрии, вступают в реакцию вещества, называют стехиометрическими, так же называют соответствующие этим законам соединения. В стехиометрических соединениях химические элементы присутствуют в строго определённых соотношениях (соединения постоянного стехиометрического состава, они же дальтониды). Примером стехиометрических соединений могут служить вода Н2О, сахароза С12Н22О11 и практически все другие органические, а также множество неорганических соединений.
Термин «стехиометрия» ввёл И. Рихтер в книге «Начала стехиометрии, или Искусство измерения химических элементов» (J. B. Richter. Anfangsgründe der Stöchyometrie oder Meßkunst chymischer Elemente. Erster, Zweyter und Dritter Theil. Breßlau und Hirschberg, 1792-93), обобщивший результаты своих определений масс кислот и оснований при образовании солей.
В основе стехиометрии лежат законы сохранения массы, эквивалентов, закон Авогадро, Гей-Люссака, закон постоянства состава, закон кратных отношений. Открытие законов стехиометрии, строго говоря, положило начало химии как точной науки. Правила стехиометрии лежат в основе всех расчётов, связанных с химическими уравнениями реакций и применяются в аналитической и препаративной химии, химической технологии и металлургии.
Законы стехиометрии используют в расчётах, связанных с формулами веществ и нахождением теоретически возможного выхода продуктов реакции. Рассмотрим реакцию горения термитной смеси:
Сколько граммов алюминия нам необходимо для завершения реакции с 85,0 граммами оксида железа (III)?
( 85.0 g F e 2 O 3 1 ) ( 1 m o l F e 2 O 3 160 g F e 2 O 3 ) ( 2 m o l A l 1 m o l F e 2 O 3 ) ( 27 g A l 1 m o l A l ) = 28.7 g A l <\displaystyle \mathrm <\left(<\frac <85.0\ g\ Fe_<2>O_<3>><1>>\right)\left(<\frac <1\ mol\ Fe_<2>O_<3>><160\ g\ Fe_<2>O_<3>>>\right)\left(<\frac <2\ mol\ Al><1\ mol\ Fe_<2>O_<3>>>\right)\left(<\frac <27\ g\ Al><1\ mol\ Al>>\right)=28.7\ g\ Al> >
Таким образом, для проведения реакции с 85,0 граммами оксида железа (III), необходимо 28,7 грамма алюминия.
Стехиометрия
Резюме
Принцип
Во время химической реакции мы наблюдаем модификацию присутствующих веществ: одни вещества потребляются, они называются « реагентами », другие вещества образуются, это « продукты ».
В микроскопическом масштабе химическая реакция представляет собой модификацию связей между атомами путем смещения электронов: одни связи разрываются, другие образуются, но сами атомы сохраняются. Это называется сохранением материи, которое приводит к двум законам:
Стехиометрические соотношения между количествами израсходованных реагентов и образующимися продуктами прямо следуют из законов сохранения. Они определяются из уравнения баланса реакции.
Исторические аспекты
Напишите сбалансированное уравнение реакции
Когда кто-то пишет уравнение баланса химической реакции, он должен соблюдать правила сохранения материи.
Стехиометрическое число
Определение
Характеристики
Отрицательные стехиометрические числа
При компактном написании химических уравнений для упрощения термодинамических расчетов принято принимать условное обозначение Σ i ν i B i = 0:
Замечания
Смесь, пропорции и стехиометрические условия
Когда количества всех реагентов пропорциональны их стехиометрическим числам в начале реакции, мы говорим, что:
эти три выражения имеют строго одно и то же значение.
В этих условиях, если реакция завершится, все реагенты будут полностью израсходованы.
Если реагенты изначально не вводятся в стехиометрических пропорциях и реакция завершилась:
Определите количество израсходованных реагентов или образовавшихся продуктов.
Какими бы ни были начальные условия, количества израсходованных реагентов и образовавшихся продуктов пропорциональны стехиометрическим числам уравнения химической реакции.
Рассмотрим уравнение-баланс горения метана:
Таким же образом можно определить количество образовавшейся воды (H 2 O, стехиометрическое число: 2). Поскольку при сжигании одного моля метана образуется два моля воды, количество произведенных молей воды всегда будет вдвое больше, чем количество израсходованных молей метана.
Можно использовать пропорции с любыми реагентами или продуктами в уравнении для расчета количества произведенных или потребленных молей.
Этот метод также эффективен между реагентами (когда один из реагентов является ограничивающим реагентом), а также между продуктами.
Пропорции в химической формуле
Общие соединения
Нестехиометрические соединения
В некоторых соединениях стехиометрия элементов не полная. Наиболее классическим случаем является оксид железа FeO, формула которого фактически представляет собой Fe 1-x O. Это отсутствие полной стехиометрии происходит из-за того, что этот оксид железа содержит значительную долю железа (III) среди железа (II ), и что для соблюдения электронейтральности оксида требуется меньше ионов железа, чем ионов оксида.