Что такое стриктура кишечника
Что такое стриктура кишечника
Характеристика стриктур кишечника:
• Локализация/место возникновения: проксимальная/средняя/дистальная треть тонкой кишки, толстая кишка.
• Сопутствующие симптомы: тошнота, рвота, боль в животе и мышечный спазм, вздутие живота, водянистые выделения при высокой илеостоме, кровотечение, изменение привычной функции кишечника, понос, инфекции мочевых путей? Дегидратация, нестабильность гемодинамических показателей, сепсис?
• Развитие симптомов: бессимптомное течение, острое, преходящее/рецидивирующее, хроническое.
• Диагностика: эндоскопия, рентгенологические исследования, интраоперационные данные.
• Выраженность: отсутствие функциональных влияний, причины умеренных/выраженных/тяжелых симптомов (частичная обструкция тонкой/толстой кишки, полная обструкция тонкой/толстой кишки).
• Основные системные причины: болезнь Крона, злокачественные новообразования, предшествующие хирургические вмешательства.
• Вероятность серьезного заболевания (проблема ответственности): от средней до высокой.
Дифференциальный диагноз причин кишечных стриктур:
1. Мальформации:
— атрезия
— стриктура анастомоза
2. Сосудистые заболевания:
— мезентериальная ишемия (заболевания периферических сосудов, эмболия, васкулит)
— тромбоз воротной вены
— лучевое поражение с формированием стриктуры
3. Воспалительные заболевания:
— спайки брюшины
— Болезнь Крона
— дивертикулит/аппендицит с образованием воспалительных спаек петель тонкой кишки
— панкреатит (сочетание воспалительного процесса и ишемии в средней ободочной артерии)
4. Опухоли:
— канцероматоз брюшины (различные первичные опухоли)
— десмоид
— лимфома, мезенхимальные опухоли
— эндометриоз
— первичный рак тонкой кишки: редко
5. Дегенеративные заболевания/функциональные нарушения:
— (послеоперационная) непроходимость кишечника
— закручивание тонкой кишки вокруг тонкокишечного сегмента, несущего илеостому
— заворот кишечника
— инвагинация
— ущемление фекалитов в тонкой кишке у пациентов с муковисцедозом
— желчнокаменная непроходимость кишечника
6. Травматические/посттравматические изменения:
— тупая травма живота
— синдром повышенного давления в брюшной полости (посттравматические, послеожоговые изменения и т.д.)
— забрюшинные/спинальные патологические изменения (гематома, перелом и т.д.)
Причины стриктур тонкой кишки:
1. Болезнь Крона.
2. Спайки.
3. Рак тонкой кишки (первичный, канцероматоз).
Причины стриктур толстой кишки:
1. Рак.
2. Дивертикулит.
3. Болезнь Крона.
4. Ишемия.
Какое обследование необходимо при стриктуре кишки?
• Анамнез: перенесенные операции на органах брюшной полости, опухоли и т.д.
• Клинические исследования: общее состояние пациента, вздутие живота (может отсутствовать при очень высокой обструкции), наличие/отсутствие (тимпанит) перистальтических шумов, очаговая/диффузная болезненность при пальпации, перитонеальные симптомы, стул в прямой кишке.
• Методы лучевой диагностики:
— Обзорная рентгенография органов брюшной полости и грудной клетки: обструкция тонкой/толстой кишки, свободной воздух, уровни воздуха/ жидкости, расширение желудка, расширение тонкой кишки (>2,5см) с циркулярными складками, наличие воздуха в дистальных отделах толстой кишки, раздутые петли кишки, кальцификаты, пневмобилия.
— Обзорная КТ (если возможно, с пероральным и внутривенным контрастированием): расширение тонкой кишки, экзофитные образования слизистой, пневматоз кишечника, пневмобилия, газ в воротной вене, подозрение на отключенную петлю кишки, опухолевую обструкцию и т.д.
— Контрастные исследования с заполнением всей толстой кишки:
а) барием, при хронической частичной обструкции тонкой кишки,
б) гастрографином или смесью 50/50 гастрографина и бария при острой частичной обструкции тонкой кишки.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
— Вернуться в оглавление раздела «Хирургия»
Другие виды закрытия просвета кишечника (K56.4)
Версия: Справочник заболеваний MedElement
Общая информация
Краткое описание
Примечание
В данную подрубрику включены следующие клинические понятия:
— закрытие просвета кишечника кишечным камнем;
— копростаз.
Автоматизация клиники: быстро и недорого!
— Подключено 300 клиник из 4 стран
Автоматизация клиники: быстро и недорого!
Мне интересно! Свяжитесь со мной
Классификация
Энтеролиты. Условно подразделяются на истинные и ложные (см. раздел «Этиология и патогенез»)
Копростаз. Приемлемая классификация отсутствует. Один из вариантов классификации по этиологическому признаку приводится ниже.
Этиология и патогенез
Энтеролиты
1. Истинные энтеролиты. Встречаются очень редко и представляют собой конкременты кала и желчных кислот, которые по мере попадания в дистальный отдел тонкого кишечника импрегнируются осаждаемыми солями кальция. Камни могут состоять почти исключительно из одного карбоната магния; могут содержать 80% карбоната и других солей кальция; «жирно-восковые массы», образующиеся вероятно от чрезмерного употребления очень жирной пищи, содержащей тугоплавкие жиры животного происхождения, или же вследствие недостаточного переваривания жиров.
Истинные энтеролиты формируются в основном в области врожденных аномалий и приобретенных дефектов тонкого кишечника.
2. Ложные энтеролиты формируются вокруг фрагментов непереваренной пищи (косточек, семян, безоаров) в любом отделе кишечника.
Продвигаясь по кишечнику и фиксируясь в тощей кишке или в илеоцекальном отделе кишечника, энтеролиты способны вызвать полную или частичную непроходимость.
Каловая непроходимость
Копростаз возникает вследствие образования в толстой (чаще всего в прямой или сигмовидной) кишке твердых неподвижных фрагментов кала, перекрывающих просвет кишечника и вызывающих клинику кишечной непроходимости.
Наиболее частые причины:
— заболевания центральной и периферической нервной системы;
— длительный бесконтрольный прием лекарственных препаратов (холинолитики, антипсихотические препараты, наркотики, антидиарейные);
— дегидратация и нарушения питания;
— врожденные аномалии кишечника;
— заболевания кишечника.
(См. также раздел «Классификация»).
Эпидемиология
Возраст: преимущественно пожилой
Признак распространенности: Редко
Соотношение полов(м/ж): 0.9
1. Истинные энтеролиты, вызывающие кишечную непроходимость, являются редким явлением. Считается, что заболеванию подвержены пожилые люди со сниженной моторикой желудочно-кишечного тракта и высоким риском дивертикулярной болезни. Тем не менее, случаи кишечной непроходимости, обусловленной каловыми камнями, были описаны и у детей.
Что такое стриктура кишечника
Enter the password to open this PDF file:
Полный текст статьи:
ЭНДОСКОПИЧЕСКОЕ ЛЕЧЕНИЕ РУБЦОВЫХ СТРИКТУР МЕЖКИШЕЧНЫХ АНАСТОМОЗОВ
Веселов В.В., Ачкасов С.И., Ваганов Ю.Е.,
Скридлевский С.Н., Меркулова Е.С., Мтвралашвили Д.А.
ФГБУ «ГНЦК колопроктологии им. А.Н.Рыжих» Минздрава России, г. Москва (директор – профессор, д.м.н. Ю.А. Шелыгин
Рубцовые стриктуры межкишечных анастомозов являются одним из осложнений, которые возникают как в ближайшем, так и в отдаленном послеоперационном периодах.
ЦЕЛЬ ИССЛЕДОВАНИЯ. Оценить возможности эндоскопического лечения стриктур межкишечных анастомозов.
МАТЕРИАЛЫ И МЕТОДЫ. В исследование было включено 26 больных. Полная облитерация просвета анастомоза наблюдалась у 6 больных, стриктура диаметром 25 мм – у 10 пациентов и 69 мм – у 10 больных. Протяженность стриктуры менее 5 мм была выявлена у 18 больных, у 4 больных – 69 мм и у 4 больных – более 10 мм. У 15 больных была выполнена электродеструкция и аппаратное бужирование, у 7 – электродеструкция и механическое бужирование и у 4 – электродеструкция, аппаратное и механическое бужирование.
РЕЗУЛЬТАТЫ. После проведения электродеструкции и механического бужирования у 5 пациентов коррекция стриктуры была достигнута за один этап бужирования, у 2х – в несколько этапов. В результате электродеструкции стриктуры с аппаратным бужированием ширина просвета в зоне анастомоза в 6 случаях была восстановлена за 1 этап, а в 9 – после многоэтапного лечения. В случае применения электродеструкции с аппаратным и механическим бужированием (4 пациента) манипуляция была многоэтапной. Результат лечения считали отличным у 6 пациентов (ширина просвета более 20 мм), хорошим – у 11 пациентов (1520 мм) и удовлетворительным – у 9 пациентов (1014 мм).
ЗАКЛЮЧЕНИЕ. Эндоскопические методы являются эффективными при лечении стриктур в зоне межкишечных анастомозов.
[Ключевые слова: cтриктура в зоне анастомоза, электродеструкция, механическое бужирование, аппаратное бужирование]
ENDOSCOPIC TREATMENT OF CORROSIVE STRICTURES OF INTESTINAL ANASTOMOSIS
Veselov V.V., Achkasov S.I., Vaganov Y.E., Skridlevsky S.N., Merkulova E.S., Mtvralashvili D.A.
Strictures of intestinal anastomosis are the complications, which appear both in the short and late postoperative periods. THE AIM OF THE STUDY. To evaluate the possibility of endoscopic treatment of strictures of intestinal anastomosis.
MATERIALS AND METHODS. 26 patients were included in the study. Complete obliteration of the lumen of the anastomosis was found in 6 patients, strictures with diameter of 25 mm in 10 patients, and of 69 mm – in 10 patients. The length of the stricture of less than 5 mm were found in 18 patients, 69 mm in 4 patients and more than 10 mm – in 4 patients. In 15 patients electric destruction and instrumental bougienage was performed, in 7 – electric destruction and mechanical bougienage, and in 4 – electric destruction, instrumental and mechanical bougienage. RESULTS. After the electric destruction and the mechanical bougienage in 5 patients the correction of the stricture was achieved in 1 step, in 2 – after several manipulations. After the electric destruction and instrumental bougienage, the correction was achieved in 6 patients in 1 step, and in 9 patients – after a multistage treatment. In the case of electric destruction, instrumental and mechanical bougienage (4 patients) manipulation was multistage in all cases. The result of the treatment was considered excellent in 6 patients (width of anastomose is more than 20 mm), good – in 11 patients (1520 mm), and satisfactory – in 9 patients (1014 mm).
CONCLUSION. Endoscopic methods are effective in the treatment of strictures of intestinal anastomosis.
Что такое стриктура кишечника
Адрес для переписки: Ваганов Юрий Евгеньевич, ФГБУ ГНЦ колопроктологии Минздрава России, ул. Саляма Адиля, д. 2, Москва, 123423, тел. 89262241233, email: info@gnck.ru
Рубцовые стриктуры межкишечных анастомозов являются одним из осложнений, которые возникают как в ближайшем, так и в отдаленном послеоперационном периодах. Наиболее часто такие стриктуры развиваются в сроки от 2 до 3 месяцев после резекции кишки [1,4,13]. Частота этого осложнения существенно возрастает при наложении аппаратных анастомозов с использованием циркулярного скрепочного шва, особенно в сочета
нии с формированием превентивной колоили илеостомы. Это обусловлено избыточным разрастанием соединительной ткани в местах локализации металлических скрепок и состоянием длительного функционального покоя зоны соустья [4,13]. Для восстановления пассажа кишечного содержимого по толстой кишке необходимо расширить ее просвет в зоне сужения, что может быть выполнено с помощью эндоскопической техники.
Выделяют следующие виды эндоскопической коррекции рубцовых стриктур анастомозов:
• эндоскопическое аппаратное бужирование;
• лазерная деструкция и электродеструкция;
Бужирование эндоскопом редко применяется в качестве самостоятельного способа лечения. Чаще всего используется как дополнительная методика после частичного рассечения стриктуры. Это обусловлено узостью просвета, не пропускающего даже эндоскоп самого малого диаметра, низкой эластичностью кольца анастомоза, опасностью грубых разрывов, а также отсутствием набора эндоскопов различного диаметра.
Для электродеструкции стриктур используются диатермические петли, игольчатые электроды или диатермические ножи. Достоинствами методики являются: возможность регулирования силы тока, проведения рассечения в режиме резания и коагуляции, малая продолжительность сеанса деструкции [3,10].
Имеются сообщения о положительном опыте применения высокоэнергетического излучения неодимового лазера при лечении доброкачественных стриктур толстой кишки. Однако, данная методика не нашла широкого применения. При лазерном воздействии, как и при диатермокоагуляции, вследствие коагуляционного повреждения ткани имеется опасность возникновения перфорации. Глубокая проникающая способность и быстрота воздействия на ткани, а, следовательно, высокий риск возможных осложнений, регламентируют применение данной методики [1,7].
Методика стентирования, в основном, применяется для лечения кишечной непроходимости, вызванной злокачественным опухолевым процессом. Однако, имеются данные о применении её и при доброкачественных стриктурах. Используются саморасширяющиеся металлические стенты. Их установка происходит либо по проводнику параллельно эндоскопу при локализации стриктуры в дистальных отделах толстой кишки или через биопсийный канал под рентгенологическим контролем или без него [9,14]. Такие недостатки, как частая миграция стентов и их высокая стоимость, не позволяют использовать этот метод как рутинный.
Баллонная дилатация – один из методов коррекции стриктур анастомозов, применяющийся во многих клиниках. В настоящее время используют баллоны, устанавливаемые по проводнику под контролем рентгеновского исследования, проводимые через канал эндоскопа под контролем зрения и сочетающие в себе принципы баллонов первого и второго типов (баллоны для дилатации билиарных стриктур).
Для установки дилатационного баллона используется методика, разработанная Seldinger. Сначала в область стриктуры устанавливается гибкий проводник, по которому телескопически вводится баллонный дилататор. Баллон раздувается рентгеноконтрастной жидкостью (или водой), что позволяет легко дозировать степень воздействия на стриктуру. В отличие от эндоскопического бужирования, при баллонной дилатации, слизистая кишки не повреждается, и увеличение просвета происходит за счет расширения подслизистого и мышечного слоев.
Предназначенные для проведения через эндоскоп баллоны можно установить двумя способами. Если есть возможность провести аппарат за стриктуру, что бывает относительно редко, то после ее преодоления баллон полностью выводится из канала и затем аппарат извлекается вместе с баллоном до достижения его правильного расположения в стриктуре. При непреодолимости стриктуры аппаратом предпринимается попытка «канюляции» баллонном области стеноза. Об успешной дилатации судят по возможности движения баллона в раздутом состоянии вперед и назад через стриктуру [10].
Положительными сторонами этого метода являются возможность визуального контроля за ходом дилатации, дозированная подача воздуха или жидкости в баллон и простота методики. Использование прозрачных материалов в производстве баллонов позволяет осуществлять визуальный контроль за зоной его воздействия. Вместе с тем, не всегда можно использовать баллонную дилатацию как самостоятельный метод вследствие невозможности проведения дилататора проксмальнее уровня стриктуры анастомоза, если диаметр ее менее 0,4 см. При расширении плотных протяженных стриктур баллонная дилатация мало эффективна, так как рубцовые сращения вокруг анастомоза не позволяют полностью расправить баллон и достигнуть максимально возможного диаметра. На баллоне формируется «талия», поэтому степень расширения стриктуры значительно меньше, чем можно было ожидать. Чаще баллонная дилатация используется в комбинации с предварительным эндоскопическим рассечением рубцового кольца анастомоза диатермическим ножом или петлей до диаметра, позволяющего провести через анастомоз дилататор. Такая комбинация использования методов позволяет значительно повысить эффективность реканализации и снизить вероятность осложнений [2,5,6]. К сожалению, одним из лимитирующих моментов широкого использования баллонных дилататоров является их высокая стоимость.
Таким образом, для ликвидации стриктур межкишечных анастомозов и восстановления пассажа по толстой кишке, используются различные эндоскопические методики. Но даже с использованием самого дорогостоящего инструментария не всегда удается избежать осложнений и добиться успеха в лечении.
МАТЕРИАЛЫ И МЕТОДЫ
В отделении эндоскопической хирургии ФГБУ«ГНЦ колопроктологии» Минздрава России за период с 2007 по 2013 гг. у 26 больных (12 женщин и 14 мужчин, в возрасте от 34 до 81 года) была выполнена эндоскопическая коррекция стриктур межкишечных анастомозов. По поводу рака толстой кишки были оперированы 23 больных, осложненного дивертикулеза – 2 и болезни Крона – 1.
По характеру и локализации анастомозов больные распределились следующим образом:
• колоректальный анастомоз – 24 больных;
• илеотрансверзоанастомоз – 1 больной;
• илеоилеоанастомоз – 1 больной.
Следует отметить, что колоректальные анастомозы находились в диапазоне от 7 до 18 см от ануса. В 4х случаях анастомозы были сформированы ручным способом. В 22 наблюдениях – аппаратным. Кроме того, у 20 больных операции сопровождались наложением превентивной стомы: у 10 – илеостомы и у 10 – трансверзостомы.
Помимо эндоскопического исследования с биопсией из области стриктуры проводилось рентгенологическое исследование (проктография или ирригоскопия), УЗИ, КТ, определялся уровень опухолевых маркеров.
Данные комплексного предоперационного обследования позволили диагностировать полную облитерацию просвета анастомоза у 6 больных; диаметр стриктуры размерами от 0,2 до 0,5 см выявлен у 10 пациентов, а от 0,6 до 0,9 см – у 10 больных.
Клиническая картина нарушения кишечной проходимости проявлялась лишь у 6 из 26 пациентов, у которых не была сформирована стома.
Протяженность стриктуры, в основном, была не более 5 мм (18 больных), у 4 больных – 69 мм и в 4х случаях протяженность стриктуры составляла 10 мм и более.
Целью нашего исследования явилось изучение возможности лечения стриктур межкишечных анастомозов с помощью рутинного эндоскопического оборудования, а именно:
• эндоскопов различного диаметра;
• эндоскопических шаровых электродов;
Нами применялась комбинированная коррекция стриктур анастомозов:
• электродеструкция и аппаратное бужирование (15 больных);
• электродеструкция и механическое бужирование (7 больных);
• электродеструкция, аппаратное и механическое бужирование (4 больных).
Эндоскопическая коррекция стриктуры анастомоза начиналась с электродеструкции его центральной части. При полной облитерации просвета кишки шаровым электродом производилась электрокоагуляция рубцовой ткани в центральной зоне конвергенции мелких складок. Причем, если не удавалось контролировать процесс коагуляции колоноскопом, проведенным через стому, мы коагулировали область стриктуры до полного ее рассечения, так как даже в этом случае, через 12 дня, вследствие коагуляционного некроза, образовывался раневой канал диаметром 0,20,3 см. Он подлежал дальнейшей циркулярной коагуляции с расширением просвета кишки в зоне анастомоза до 0,40,5 см. Аналогично выполнялось расширение анастомоза с имеющимся остаточным просветом. Далее, в зависимости от локализации зоны межкишечного анастомоза, выбирался способ бужирования.
Эндоскопическое (аппаратное) бужирование выполнялось последовательной сменой аппаратов с увеличением их диаметра от 6 мм до 18 мм: педиатрический гастроскоп (6 мм) – диагностический гастроскоп (8 мм) – педиатрический колоноскоп (11 мм) – диагностический колоноскоп (13 мм) – операционный колоноскоп (15 мм) – операционный сигмоскоп (18 мм).
При низких колоректальных анастомозах использовалось, преимущественно, механическое бужирование металлическими бужами под контролем колоноскопа, проведенного либо параллельно с ними, либо через стому. Эндоскопический контроль был необходим для безопасного бужирования, особенно, при проведении первого бужа, так как анастомоз часто располагался в зоне деформации или изгиба кишки.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
При электродеструкции стриктуры с аппаратным бужированием для достижения необходимой ширины просвета кишки в зоне анастомоза в 6 случаях достаточно было одного этапа лечения, а в 9 других случаях понадобилось от 2 до 5 этапов вмешательства.
При комбинации электрокоагуляции и механического бужирования в 5 случаях коррекция стриктуры была достигнута за один этап бужирования, в 2х – в несколько этапов – 5 и 7, соответственно. В одном случае, при комбинации эндоскопического пособия и механического бужирования произошла перфорация стенки кишки в зоне сигморектального анастомоза (на 9 см от анального канала), которая потребовала оперативного вмешательства в объеме ушивания перфоративного отверстия.
Наряду с электродеструкцией стриктуры в 4 наблюдениях для достижения лечебного эффекта проводилось как аппаратное, так и механическое ее бужирование. Во всех случаях манипуляция проводилась многоэтапно.
Непосредственный результат лечения считали отличным у 6 пациентов, когда ширина просвета анастомоза превышала 20 мм. Хороший результат отмечен у 11 пациентов – при диаметре анастомоза 1520 мм, у 9 пациентов зарегистрирован удовлетворительный результат лечения – ширина просвета составила 1014 мм. У 17 из 20 больных со стомами после проведения бужирования произведено закрытие стомы с восстановлением пассажа по толстой кишке. В 2 наблюдениях после закрытия стомы была выявлена повторная стриктура анастомоза с последующим успешным рассечением. Одному пациенту стому не закрывали по медицинским показаниям.
Контрольные эндоскопические исследования в первые 13 месяца после бужирования были выполнены 24 больным, из них у 21 ширина просвета кишки в зоне анастомоза составляла 1525 мм. При дальнейших контрольных исследованиях у 19 из 21 пациента с диаметром просвета анастомоза 1525 мм в сроки от 6 месяцев до 3 лет ширина анастомоза оставалось неизменной. Двум пациентам контроль не проводился изза малого срока после произведенной электродеструкции.
Рисунок 2. Электродеструкция стриктур анастомозов шаровым электродом: 21 Полная облитерация анастомоза, коагуляция в зоне конвергенции складок; 22 Электрокоагуляция стриктуры при остаточном просвете 0,2 см;
23 Второй этап рассечения стриктуры и расширение просвета кишки до 0,7 см
У 3х из 9 пациентов с удовлетворительным результатом лечения, осмотренных через месяц после бужирования, выявлен рестеноз анастомоза с шириной просвета не более 34 мм. Двоим больным произведены сеансы повторного аппаратного и механического бужирования с расширением просвета анастомоза до 1617 мм. Одного из них это привело к излечению, у другого после очередного бужирования вновь выявлен рестеноз, и выполнена ререзекция толстой кишки с зоной анастомоза. Третьему пациенту с выраженным сужением просвета кишки в зоне сигморектального анастомоза с существующей трансверзостомой проведение повторного бужирования сочли нецелесообразным изза выявленного канцероматоза.
Пациенту, который не явился на контрольный осмотр, через 6 месяцев после успешного бужирования стриктуры и ликвидации трансверзостомы, по месту жительства была выполнена экстрен
ная операция по поводу кишечной непроходимости с повторным формированием колостомы. При госпитализации в ГНЦ колопроктологии выявлен рецидив опухоли в области анастомоза, по поводу чего была произведена ререзекции левых отделов толстой кишки с формированием трансверзоректального анастомоза.
У другого, наблюдавшегося нерегулярно пациента, при первом осмотре через 1 год после ликвидации стриктуры, выявлено сужение просвета кишки до 3 мм. Проводилось повторное эндоскопическое и механическое бужирование с удовлетворительным результатом. При контрольном обследовании через 2 месяца развился рестеноз анастомоза до 5 мм в диаметре. В связи с неэффективностью бужирования выполнено оперативное вмешательство в объеме резекция сигморектального анастомоза с формированием нового колоректального анастомоза.
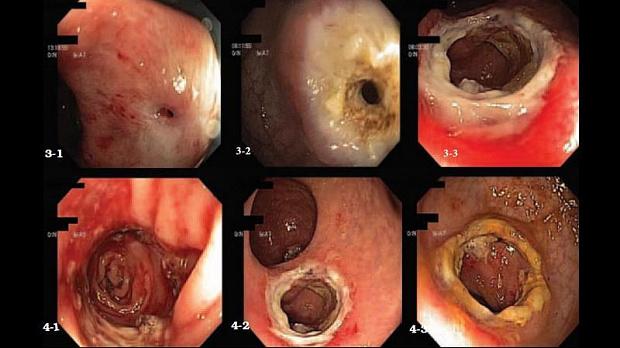
Рисунок 3. Этапы рассечения стриктур анастомозов:
31 Стриктура колоректального анастомоза с остаточным просветом менее 0,3 см; 32 Первый этап электрокоагуляции рубцовой ткани в зоне анастомоза;
33 Второй этап циркулярной коагуляции с расширением просвета кишки в зоне анастомоза до 1,3 см
Рисунок 4. Вид стриктур после рассечения:
41 Рассеченная стриктура сигмосигмоидного анастомоза;
42 Рассеченная стриктура сигморектального анастомоза конец в бок;
43 Рассеченная стриктура сигморектального анастомоза конец в конец
Таким образом, из 26 пациентов, которым проводилась эндоскопическая коррекция по поводу стриктур межкишечных анастомозов, у 20 пациентов результаты расценены как удовлетворительные после первого курса бужирования и у одного – после второго курса лечения. У 5 пациентов результаты эндоскопического лечения рубцовых стриктур межкишечных анастомозов признаны неудовлетворительными.
Следует отметить, что у всех 5 пациентов с неудовлетворительными результатами эндоскопического лечения протяженность рубцовых стриктур составляла от 12 до 20 мм. У пациентов с удовлетворительными результатами лечения протяженность стриктур составляла: в 1 случае – 9 мм, в четырех – 56 мм и в шестнадцати – 24 мм.
Небольшой материал не позволяет дать статистически достоверных результатов, но проследить некоторые тенденции возможно. На основании проведенного исследования мы пришли к заключению, что эндоскопическое лечение является эффективным методом борьбы со стриктурами межкишечных анастомозов, а применение сразу нескольких эндоскопических методик позволяет получить стойкий, положительный результат. Эндоскопическое бужирование может являться альтернативой хирургического лечения стриктур межкишечных анастомозов, однако успех эндоскопического лечения рубцовых сужений анастомозов зависит от их протяженности. Так, например, при стриктурах более 12 мм результаты эндоскопических рассечений не удовлетворительны.