Что такое водородная химическая связь
Водородная связь
Межмолекулярные взаимодействия
Ориентационные силы притяжения возникают между полярными молекулами (диполь-диполь взаимодействие). Эти силы возникают между полярными молекулами. Индукционные взаимодействия — это взаимодействие между полярной молекулой и неполярной. Неполярная молекула поляризуется из-за действия полярной, что и порождает дополнительное электростатическое притяжение.
Особый вид межмолекулярного взаимодействия — водородные связи.
Водородные связи — это межмолекулярные (или внутримолекулярные) химические связи, возникающие между молекулами, в которых есть сильно полярные ковалентные связи — H-F, H-O или H-N. Если в молекуле есть такие связи, то между молекулами будут возникать дополнительные силы притяжения.
Механизм образования водородной связи частично электростатический, а частично — донорно–акцепторный. При этом донором электронной пары выступают атом сильно электроотрицательного элемента (F, O, N), а акцептором — атомы водорода, соединенные с этими атомами. Для водородной связи характерны направленность в пространстве и насыщаемость.
Водородные связи возникают между следующими веществами:
Водородная связь оказывает влияние на физические и химические свойства веществ. Так, дополнительное притяжение между молекулами затрудняет кипение веществ. У веществ с водородными связями наблюдается аномальное повышение тепературы кипения.
Водородная связь.
Водородная связь – связь между положительно заряженным атомом водорода одной молекулы и отрицательно заряженным атомом другой молекулы.
Механизм возникновения водородной связи – частично электростатический и частично донорно-акцепторный.
Характерной чертой водородной связи является расстояние между атомом водорода и другим атомом, её образующим. Оно должно быть меньше, чем сумма радиусов этих атомов.
Водородная связь подразделяется:
1. Межмолекулярная водородная связь образуется между молекулами веществ, в состав которых входят водород и сильно электроотрицательный элемент – фтор, кислород, азот, хлор, сера. Сильно смещенная общая электронная пара от водорода к атому отрицательно заряженного элемента, при этом положительный заряд водорода сконцентрирован в малом объеме, приводит взаимодействие протона с неподеленной электронной парой другого атома или иона, обобществляя её.
Водородную связь обозначают точками, указывая, что она намного слабее ковалентной связи (примерно в 15-20 раз).
Межмолекулярная водородная связь: две молекулы воды и две молекулы уксусной кислоты с образованием циклической структуры
2. Внутримолекулярная водородная связь присутствует в многоатомных спиртах, углеводах, белках и других органических веществах.
Молекула салициловой кислоты.
Вещества с водородной связь имеют молекулярные кристаллические решетки, в узлах которой находятся молекулы.
Примеры: вода в виде льда, йод, хлор, бром, «сухой лёд» (твердый диоксид углерода), твёрдый аммиак, а также твёрдые органические вещества (метан, бензол, фенол, нафталин, белки и т.д.).
Физические свойства веществ с водородной связью.
Водородная связь обеспечивает низкомолекулярным веществам способность быть при обычных условиях в жидком агрегатном состоянии (этанол, метанол, вода) или сжижающимися газами (аммиак, фтороводород).
Более высокая температура кипения воды (100 о С) по сравнению с водородными соединениями элементов подгруппы кислорода (Н2S, Н2Sе, Н2Те), так как затрачивается дополнительная энергия на разрушение водородных связей.
Также при плавлении воды её плотность возрастает. Это объясняется тем, что в структуре льда каждый атом кислорода связан через атомы водорода с четырьмя другими атомами кислорода других молекул воды. В результате образуется рыхлая «ажурная» структура.
Водородная связь
Водородная связь весьма распространена и играет важную роль в биологических объектах. Рассмотрим ее образование подробнее.
Образование водородной связи
При возникновении подходящих условий водородная связь возникает самопроизвольно.
Какие же условия приводят к возникновению водородной связи?
Можно предположить, что в любом ряду веществ с молекулами одинаковой формы и полярности температуры плавления и кипения должны повышаться прямо пропорционально возрастанию молекулярной массы, однако существуют некоторые несоответствия.
На следующем рисунке приведены кривые зависимости температуры кипения гидридов элементов 6 группы от молекулярной массы.
Так, для гидридов элементов 6 группы наблюдается последовательное увеличение температур кипения и плавления с увеличением молекулярной массы (номера периода), но из этой закономерности выпадает вода.
В 5 группе аномально высокие температуры кипения и плавления наблюдаются у аммиака NH3, а в 7 группе – у HF, по сравнению с гидридами элементов соответствующих групп.
Почему вода, аммиак и фтороводород имеют аномально высокие температуры кипения и плавления?
Это связано с присутствием в воде, аммиаке и фтороводороде водородных связей.
Водородная связь — это внутри- или межмолекулярная связь, которая образуется с соединениях между атомами водорода и атомами, имеющими большую электроотрицательность (N, O, F).
Механизм образования водородной связи, вследствие электростатического притяжения атомов — электростатический. Но частично он также носит донорно–акцепторный характер.
Образуемые соединения имеют большую полярность, возникает диполь. Атом водорода находится на положительном конце диполя. Этот диполь может взаимодействовать с неподеленной электронной парой кислорода (и азота, и фтора), который принадлежит другой или этой же молекуле. Таким образом, донором электронной пары являются атомы F, O или N, а акцептором — атомы водорода.
Графически, на рисунках, водородная связь обозначается тремя точками:
Виды водородной связи
Характеристика водородной связи
Водородная связь характеризуется
N-H···Y ˂ O-H···Y ˂ F-H···Y
Т.е., связь тем прочнее, чем меньше размер атома с неподеленными парами — N, O, F и больше его электроотрицательность. Среди них более прочную водородную связь образует тот, неподеленная электронная пара которого менее сильно притягивается к своему ядру.
Водородная химическая связь

Всего получено оценок: 1021.
Всего получено оценок: 1021.
Между атомами водорода и атомом элемента, обладающим высокой электроотрицательностью, возникает особый тип связи – водородная химическая связь. Она может образовываться не только внутри молекулы, но и между соседними молекулами.
Общее описание
Электроотрицательность – способность атома удерживать валентные электроны на внешнем энергетическом уровне или количественная характеристика, показывающая, с какой силой притягиваются электроны к ядру атома. Наиболее электроотрицательными элементами являются фтор, азот и кислород.

Сильное электростатическое взаимодействие между атомом водорода и электроотрицательными атомами обуславливается небольшими размерами атома водорода и силой притяжения атомов элементов. В результате возникает частный случай ковалентной полярной связи. Примерами водородной химической связи являются:
Наличие водородной связи обуславливает физические и химические свойства вещества. В частности определяет температуру плавления, кипения, растворимость, кислотность.
Особенностью связи является её невысокая прочность и распространённость, особенно в органических веществах.
Водородная связь бывают двух типов:
Способ образования связи в обоих типах одинаковый. Разница только в том, что с помощью межмолекулярной водородной связи образуются цепочка молекул, а при внутримолекулярной связи водород «сцепляется» с атомами внутри молекулы.
Например, молекула воды образована одним атомом кислорода и двумя атомами водорода. За счёт высокой электроотрицательности кислород, на внешнем энергетическом уровне которого шесть электронов, притягивает единственные электроны двух атомов водорода. Две пары электронов кислорода остаются свободными. При этом у водорода освобождается орбиталь. Другая аналогичная молекула может присоединиться в месте свободных электронных пар атома кислорода, заполнив освободившуюся орбиталь водорода. Возникает межмолекулярная водородная связь.

Аналогичным образом соединяются молекулы плавиковой кислоты и аммиака. Однако связь между азотом и водородом будет слабее, чем между водородом и кислородом. Также молекулы плавиковой кислоты сильнее притягиваются друг к другу, чем молекулы воды. Это объясняется величиной электроотрицательности.
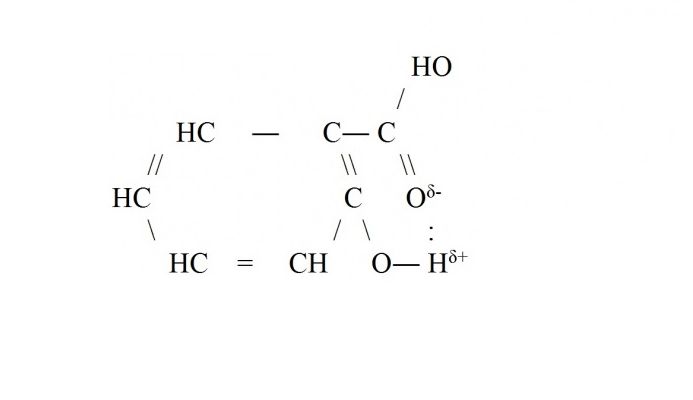
Водородные связи графически изображаются точками.
Что мы узнали?
Между атомами водорода и атомами неметаллов возникает водородная связь, основанная на электростатическом взаимодействии атомов. Это частный случай ковалентной полярной связи, характеризующийся взаимодействием водорода и атомов с высокой электроотрицательностью. Связь бывает двух типов: межмолекулярная, возникающая между молекулами вещества, и внутримолекулярная, возникающая между водородом и атомом другого элемента в одной молекуле. Водородная связь присуща неорганическим и органическим веществам.
Химические связи
Различают несколько типов химических связей: ковалентная, ионная, металлическая, водородная.
Ковалентная связь возникает между двумя атомами по обменному механизму (обобществление пары электронов) или донорно-акцепторному механизму (электронов донора и свободной орбитали акцептора).
Ковалентной связью соединены атомы в молекулах простых веществ (Cl2, Br2, O2), органических веществ (C2H2), а также, в общем случае, между атомами неметалла и другого неметалла (NH3, H2O, HBr).
Существует донорно-акцепторный механизм образования ковалентной связи, при котором один атом выступает в качестве донора неподеленной электронной пары. Другой атом не тратит свои электроны, а только лишь предоставляет орбиталь (ячейку) для этой электронной пары.
Ионная связь
В наиболее частом случае ионная связь образуется между типичным металлом и типичным неметаллом. Примеры:
Большой подсказкой служит таблица растворимости, ведь все соли имеют ионные связи: CaSO4, Na3PO4. Даже ион аммония не исключение, между катионом аммония и различными анионами образуются ионные связи, например в соединениях: NH4I, NH4NO3, (NH4)2SO4.
Часто в химии встречаются несколько связей внутри одной молекулы. Рассмотрим, например, фосфат аммония, обозначив тип каждой связи внутри этой молекулы.
Металлическая связь
«Облако» электронов в металлах способно приходить в движение под различным воздействием. Именно оно является причиной электропроводности металлов.
Водородная связь
Водородные связи возникают между атомом водорода и другим более электроотрицательным атомом (O, S, N, C).
Отчасти за счет водородных связей наблюдается то самое исключение, связанное с усилением кислотных свойств в ряду галогеноводородных кислот: HF → HCl → HBr → HI. Фтор является самым ЭО-ым элементов, сильно притягивает к себе атом водорода другой молекулы, что снижает способность кислоты отщеплять водород и снижает ее силу.
© Беллевич Юрий Сергеевич 2018-2021
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.












