Что такое наследственный анамнез
Что такое наследственный анамнез
Сбор семейного анамнеза является важным элементом оценки риска развития онкологических и сердечно-сосудистых заболеваний (ССЗ). У пациентов с отягощенной наследственностью риски обычно выше в 2 раза, а в отдельных случаях и в 4 раза, поэтому у них особенно важно принимать меры по предотвращению заболевания.
Несмотря на то, что генетическая диагностика и определение рисков в последнее время стали более распространенными, отягощенный семейный анамнез до сих пор остается основным методом оценки наследственности в рекомендациях по диагностике и лечению большинства заболеваний.
Анамнез не только указывает на риск заболевания, но и в ряде случаев помогает выбрать оптимальную стратегию наблюдения за пациентом: например, скрининг аневризмы брюшного отдела аорты рекомендуется начинать в 50 лет, если у пациента есть родственник с этим заболеванием.
К сожалению, врачу зачастую не удается качественно собрать семейный анамнез из-за того, что многие пациенты не знают подробности здоровья своих родственников, а информация, которой они владеют, обычно неточна. Кроме того, во время амбулаторного приема врачам не хватает времени для сбора анамнеза. Все это приводит к тому, что исследовательские группы по всему миру разрабатывают решения для получения надежной и точной оценки риска и помогают врачам и пациентам принимать меры на основе собранных данных.
Согласно данным, опубликованным в журнале «Lancet» 5 августа, разработана новая программная платформа для оценки риска развития хронических заболеваний, использующая в числе прочего данные о семейном анамнезе. Программное обеспечение позволяет соединять платформу с электронными медицинскими картами и оказывать поддержку принятия клинических решений врача. Систематический обзор исследований, включавших первичные осмотры 1124 пациентов, показал, что у 66% пациентов высокого риска программа точнее определила риск, чем это было бы сделано ранее, а у 23% ранее анамнез вообще не был бы собран.
Сбор и анализ информации, а также стратификация риска могут выполняться с использованием различных программных платформ. Ранее опыт использования программной платформы показал, что 1184 первичных пациентов заполняли данные о своем семейном анамнезе в среднем 27 минут.
Учитывая такую длительность работы с анкетой, предполагается, что вносить данные пациенты должны без участия врачей. Сообщается, что подобные программы могут стать важным компонентом управления здравоохранением.
Текст подготовил: к.м.н. Круглый Л.Б.
Что такое наследственный анамнез
Более столетия тому назад британский врач-ученый Арчибальд Гаррод применил законы наследственности Менделя к наследованию болезней человека и ввел термин «врожденные ошибки метаболизма», создав тем самым раздел биохимической генетики. Тем не менее Гаррод имел в виду больше, чем необычные биохимические изменения у больных с аутосомно-рецессивными нарушениями метаболизма.
Показав свою научную и клиническую проницательность, он предложил значительно более широкое понятие химической индивидуальности, отличающей каждого из нас по состоянию здоровья и предрасположенности к различным болезням вследствие индивидуальных генетических характеристик. И в самом деле, в 1902 г. он писал: «. факторы, определяющие нашу склонность и устойчивостъ к болезням, унаследованы в нашей химической структуре, и даже в молекулярных группах, пришедших из хромосом».
Теперь, более чем 100 лет спустя, в эру геномики человека, у нас есть средства, чтобы оценить важные индивидуальные локусы генотипа и охарактеризовать генетические признаки каждого человека в виде уникальной «химической индивидуальности». Когда станут известны генетические варианты, важные для поддержки здоровья и предотвращения или лечения болезней у каждого человека, и когда это знание будут использовать при принятии важных клинических решений как обычную часть медицинской помощи, мы войдем в эру персонализированной генетической медицины, одну из основных целей проекта «Геном человека».
Тем не менее персонализированная генетическая медицина — только один компонент в широком значении единой службы медицинской помощи больным, когда врачи должны также учитывать индивидуальную историю развития, влияние факторов окружающей среды и общественный опыт при проведении диагностики, консультирования, профилактики и лечения.
Врачи издавна практикуют одну из форм персонализированной генетической медицины, когда собирают семейный анамнез и используют его в клинической практике. Семейный анамнез имеет большое значение в работе с моногенными заболеваниями. Применение известных правил менделирующего наследования позволяет генетикам давать точные оценки риска болезни у родственников больных. Семейная история также важна, когда генетик оценивает риск для комплексных болезней.
Поскольку у родственников имеются общие гены, семейный анамнез дает клиницисту информацию о влиянии на здоровье индивидуальных генетических признаков, что позволяет использовать медицинскую историю родственников как показатель генетической предрасположенности. Кроме того, члены семьи часто имеют общие факторы влияния окружающей среды, например диету и поведение, и, таким образом, родственники могут предоставить информацию как об общих генах, так и общих факторах окружающей среды, способных взаимодействовать, вызывая болезни с многофакторным наследованием.
Наличие родственников первой степени родства с типичной болезнью взрослого возраста, например ИБС, раком молочной железы, опухолями кишечника или простаты, сахарным диабетом II типа, остеопорозом или бронхиальной астмой, — повышает индивидуальный риск для этой болезни приблизительно в 2-3 раза относительно общей популяции.
Чем больше у человека родственников первой степени с многофакторным заболеванием и чем раньше проявляется болезнь у членов семьи, тем больший генетический груз предрасположенности и влияния окружающей среды, вероятно, присутствует в семье пациента, приводя его в группу высокого риска по болезни на основе семейного анамнеза. Например, мужчина с тремя родственниками мужского пола первой степени родства с опухолью простаты имеет в 11 раз более высокий относительный риск развития болезни, чем человек без семейной истории.
Семейный анамнез при оценке риска
I. Высокий риск наследственных болезней:
• Раннее начало болезни у родственников первой степени родства.
• Раннее начало болезни у родственников второй степени (только при ИБС).
• Два пораженных родственника первой степени.
• Один родственник первой степени с поздним или неизвестным началом болезни и больной второй степени родства с ранним началом болезни того же происхождения.
• Два родственника второй степени родства по материнский или отцовской линии, по крайней мере, один с ранним началом болезни.
• Три или более больных родственников по матери или отцу.
• Присутствие семейного анамнеза «умеренного риска» в обеих сторонах родословной.
II. Умеренный риск наследственных болезней:
• Один родственник первой степени родства с поздним или неизвестным началом болезни.
• Два родственника второй степени по одной линии с поздним или неизвестным началом болезни.
III. Средний риск наследственных болезней:
• Отсутствие больных среди родственников.
• Только один больной второй степени родства с одной или обеих сторон родословной.
• Отсутствие семейного анамнеза.
• Приемный ребенок с неизвестным семейным анамнезом
Определение на основе семейного анамнеза того, что человек имеет повышенный риск какого-либо заболевания, может влиять на оказание индивидуальной медицинской помощи. Например, два человека с ГВТ: один с семейной историей необъяснимого ГВТ в относительно молодом возрасте (до 50 лет) и второй без семейной истории любой патологии свертывающей системы, получат разные рекомендации относительно обследования на фактор V Лейдена или мутацию протромбина 20210G>A и противосвертывающей терапии.
Аналогично наличие в семейном анамнезе опухоли толстого кишечника служит основанием для проведения скрининга на опухоли кишечника с применением более сложных методов обследования в возрасте 40 лет, на 10 лет раньше, чем для общей популяции. Дело в том, что совокупная встречаемость болезни у лиц в 40 лет с положительным семейным анамнезом равна риску для 50-летнего человека без такого анамнеза. Увеличение риска будет еще более заметным, если болезнь имеется у двух или более родственников.
Семейный анамнез, к сожалению, сравнительно мало учитывают в клинической медицине. В одном исследовании оказалось, что участковые врачи обсуждают семейную историю только с половиной новых пациентов, и менее чем с четвертью повторных. Только у одного пациента из девяти, наблюдаемых врачами в этом исследовании, в медицинской карте имелась диаграмма родословной.
В другом исследовании, выполненном для проверки состояния медицинской помощи, выяснилось, что наличие у пациента одного или более родственников первой степени родства с болезнью и, следовательно, повышенного риска одного из частых заболеваний взрослого возраста, наследуемого как многофакторный признак, было пропущено почти у двух третей пациентов. Имеет смысл повторить замечание, высказанное выдающимся педиатром и генетиком Бартоном Чайлдсом, приведенное в главе 1: «отсутствие хорошего семейного анамнеза — это плохая медицина».
Конечно, за исключением монозиготных близнецов, никто не обладает всеми одинаковыми генами со своими родственниками. Следовательно, семейный анамнез — лишь косвенное средство оценки вклада индивидуальной комбинации генетических факторов, производимого в развитие болезни. Семейный анамнез так же нечувствителен, как показатель предрасположенности, поскольку он зависит от явной болезни, действительно имеющейся у родственников конкретного пациента.
Будущее принадлежит исследованиям, проводимым независимо от семейной отягощенности, в рамках популяционного скрининга по выявлению вариантов, важных для нормы и патологии, и использованию полученной информации для оценки риска с целью улучшения медицинской помощи конкретному пациенту и его семье. Для применения этой информации необходимо, чтобы генетические факторы были эффективными маркерами фактического риска у конкретного пациента, а сама информация полезна для оказания медицинской помощи.
Редактор: Искандер Милевски. Дата обновления публикации: 18.3.2021
Риск носительства заболеваний по родству
Разговор о риске носительства заболеваний по родству следует начать с таких понятий, как гены и хромосомы. Клетки человеческого тела содержат в себе гены, расположенные в нитевидных структурах, называемых хромосомами. В большинстве клеток организма содержится 46 хромосом, из которых ребенок получает 23 от матери и 23 от отца. Они состоят из вещества под названием ДНК.
Изменения в генах и хромосомах приводят к наследственным болезням. У человека могут присутствовать такие мутации, но ввиду наличия двух копий хромосом (полученных от родителей) нормальная копия компенсирует влияние мутированной. Носительство в данном контексте представляет собой ситуацию, когда имеется одна измененная копия в паре хромосом. Это не влияет на здоровье человека, но может отразиться на его потомстве.
Как реализуется риск носительства заболеваний по родству?
Причиной рождения больных детей могут быть:
Способы выяснения риска носительства заболеваний по родству
Вероятность оказаться носителем хромосомной перестройки или генетической патологии повышена у людей с отягощенным семейным анамнезом, а также у родителей детей с подобными наследственными патологиями. Кроме того, существуют болезни, которые характерны для определенной этнической группы или народности.
Для определения риска носительства заболеваний по родству необходимо обратиться к врачу-генетику. На приеме специалист задает вопросы, касающиеся наследственных патологий в семье. Если для исследования имеются основания, врач дает направление на генетический анализ.
Образец крови или слюны направляется в лабораторию, где для оценки риска носительства заболеваний по родству определяется наличие/отсутствие мутации в определенном гене или хромосоме.
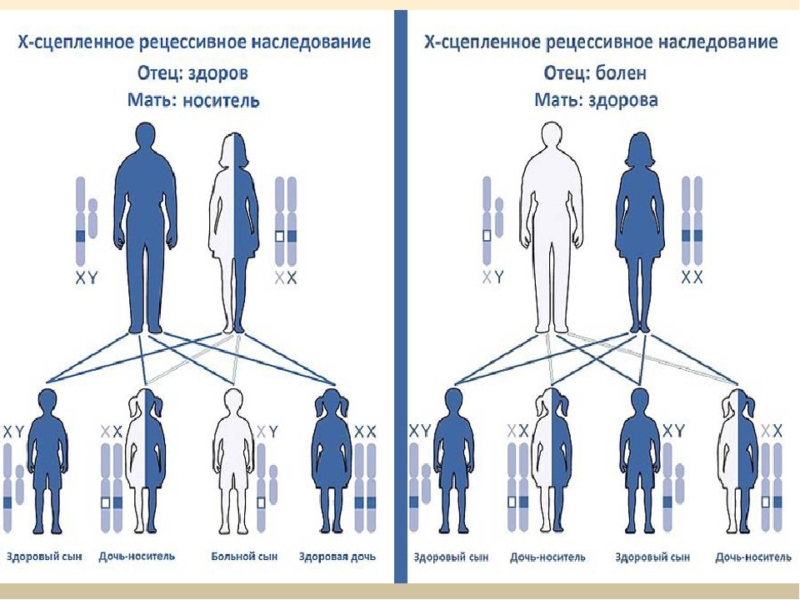
Рождение детей с аутосомно-рецессивной патологией вероятно в том случае, когда оба родителя имеют мутацию в одном и том же гене. При риске носительства заболеваний по родству с X-сцепленным характером вероятно рождение больных сыновей у матери-носительницы, у отца-носителя дочери будут носительницами такой мутации. Женщины редко болеют X-сцепленными болезнями.
Результаты тестирования на риск носительства заболеваний по родству могут оказаться неопределенными. Это может быть связано с присутствием резидального риска (например, для такой болезни, как муковисцидоз), а также с обнаружением мутации, эффект которой неясен.
Что делать, если существует риск носительства заболеваний по родству?
Нужно понимать, что каждый человек является носителем множества генных и хромосомных изменений, но они не обязательно отражаются на его здоровье. Подтверждение того, что женщина или мужчина являются носителем мутации, влияет на принятие решения о рождении детей.
Если оба партнера являются носителями рецессивной патологии либо женщина несет в себе X-сцепленную патологию, то существует несколько вариантов. Выяснить, унаследовал ли ребенок от такого союза генетическую мутацию и будет ли он болеть, позволяет пренатальная диагностика.
Заранее узнать, реализовался ли риск носительства заболеваний по родству, помогает такой метод, как предимплантационная генетическая диагностика. Её проводят в рамках протокола экстракорпорального оплодотворения.
Пройти исследование на риск носительства заболеваний по родству можно в медико-генетическом центре «Геномед».
анамнез наследственный
Смотреть что такое «анамнез наследственный» в других словарях:
Анамнез — (греч. anamnesis – воспоминание). Совокупность сведений о больном, развитии у него болезни, окружающей среде, получаемых путем расспроса самого больного (субъективный А.) и окружающих его лиц (объективный А.). Различают А. психиатрический… … Толковый словарь психиатрических терминов
Нефри́ты — (nephritis, единственное число; греч. nephros почка + itis) термин, объединяющий разные по происхождению воспалительные (иммуновоспалительные) двусторонние диффузные поражения почек. В зависимости от преимущественной локализации воспаления в… … Медицинская энциклопедия
Лимфаденопатия — МКБ 10 I88.88., L04.04., R59.159.1 МКБ 9 … Википедия
Список эпизодов телесериала «Доктор Хаус» — Основная статья: Доктор Хаус … Википедия
ГИПОТРОФИЯ — мед. Гипотрофия тип дистрофии, хроническое нарушение питания и трофики тканей, характеризующееся относительным снижением массы тела ребёнка по отношению к его длине, нарушающее правильное развитие и функции отдельных органов и систем. По времени… … Справочник по болезням
АСТМА БРОНХИАЛЬНАЯ — АСТМА БРОНХИАЛЬНАЯ, припадки удушья, преимущественно, экспираторного типа, обычно внезапно начинающиеся и большей частью внезапно прекращающиеся, не связанные с заболеваниями сердечнососудистой (сердечная астма) или выделительной (уремическая… … Большая медицинская энциклопедия
Лёгкие — I Легкие (pulmones) парный орган, расположенный в грудной полости, осуществляющий газообмен между вдыхаемым воздухом и кровью. Основной функцией Л. является дыхательная (см. Дыхание). Необходимыми компонентами для ее реализации служат вентиляция… … Медицинская энциклопедия
СЕРДЦЕ — СЕРДЦЕ. Содержание: I. Сравнительная анатомия. 162 II. Анатомия и гистология. 167 III. Сравнительная физиология. 183 IV. Физиология. 188 V. Патофизиология. 207 VІ. Физиология, пат.… … Большая медицинская энциклопедия
Бронхиальная астма — Различные ингаляторы, используемые при бронхиальной астме … Википедия
Причины и диагностика спинальной мышечной атрофии (СМА)
Отмирание моторных нейронов приводит к прогрессивному развитию слабости мышц, их атрофии, и в итоге, обездвиживанию пациента. Спинальная мышечная атрофия делится на несколько типов, в зависимости от того, насколько серьезны симптомы и в каком возрасте они начались:
Частота и тип наследования СМА
Спинальная мышечная атрофия встречается у 1 из 6000 — 10 000, с частотой носительства 1 из 38 человек. Больной ребенок рождается, при наличии двух мутаций, со стороны матери и со стороны отца. Родители, являющиеся носителями мутации в гене SMN1, не имеют клинических симптомов. Спинальная мышечная атрофия наследуется по аутосомно-рецессивному типу:
Есть и другие гены (например ATP7A и др.), поломки в которых приводят к развитию СМА. Поэтому возможны и другие типы наследования (доминантный/X-сцепленный) и, соответственно, другие риски.
Причина заболевания и патогенез СМА
Тяжесть течения болезни модифицируется вторым геном SMN2. Он очень похож на ген SMN1, но отличается последовательностью нуклеотидов в 7 и 8 экзонах. Ген SMN2 не способен продуцировать функциональный белок SMN в достаточном количестве, однако количество копий SMN2, а также последовательность этих копий влияют на фенотип. Поэтому важно получить информацию о количестве копий генов SMN1и SMN2, не только у пациента с признаками СМА, но и у пар, планирующих беременность.
Скрининг новорожденных на СМА
Хотя скрининг новорожденных еще не является стандартной практикой, время имеет решающее значение. Более ранняя диагностика СМА может помочь улучшить исходы для детей с атрофией дыхательных и скелетных мышц.