Что такое неметаллы в химии 8 класс
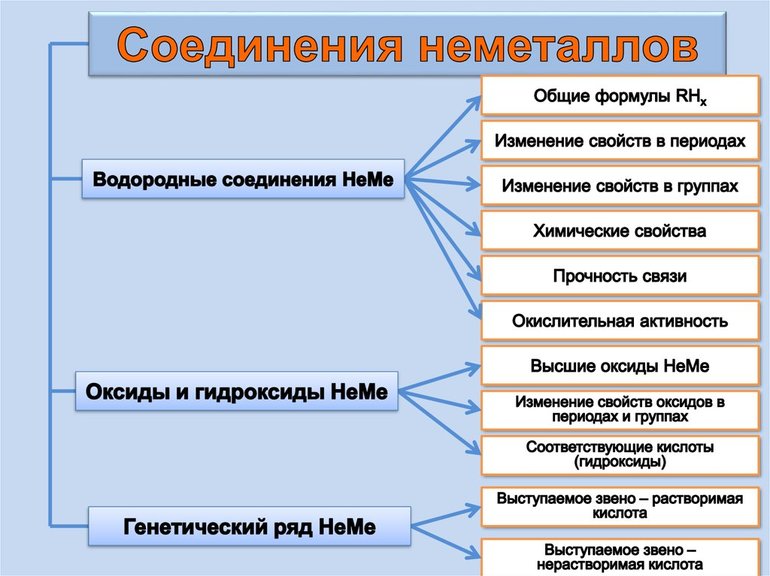
Неметаллы. Физические и химические свойства
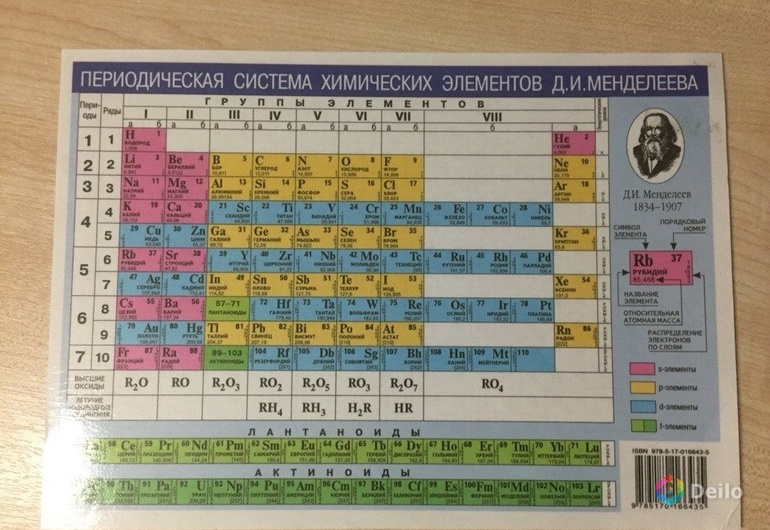
Положение неметаллов в периодической системе
Как же определить, относится вещество к металлам или к неметаллам?
Если внимательно посмотреть на Периодическую систему Д.И. Менделеева (подробно с классификацией элементов знакомимся в параграфе 42 учебника по химии для 8 класса под редакцией Еремина В.В.) и провести условную диагональ от водорода через бор до астата и неоткрытого пока элемента № 118, таблица неметаллов займет правый верхний угол.
Каждый горизонтальный период таблицы заканчивается элементом с завершенным внешним энергетическим уровнем. Эта группа элементов носит название благородные газы и имеет особые свойства, с которыми можно познакомиться в параграфе 18 учебника «Химия» для 8 класса под редакцией Еремина В.В.
При рассмотрении электронного строения неметаллов можно заметить, что энергетические уровни атома заполнены электронами больше чем на 50% (исключение – бор), и у элементов, расположенных в таблице справа налево количество электронов на внешнем уровне увеличивается. Поэтому в химических реакциях эта группа веществ может быть как акцептором электронов с окислительными свойствами, так и донором электронов с восстановительными свойствами.
Вещества, образующие диагональ бор-кремний-германий-мышьяк-теллур, являются уникальными, и в зависимости от реакции и реагента могут проявлять как металлические, так и неметаллические свойства. Их называют металлоиды. В химических реакциях они проявляют преимущественно восстановительные свойства.
Физические свойства неметаллов. Аллотропия
Если смотреть на металлы, то невооруженным глазом можно заметить общие свойства — металлический блеск, твердое агрегатное состояние (исключение — жидкая ртуть), тепло- и электропроводность.
С неметаллами все намного сложнее. Они могут иметь молекулярное и немолекулярное строение. Благодаря различиям в строении, простые вещества неметаллы существуют в трех агрегатных состояниях:
Большинство из неметаллических веществ плохо проводят электричество и тепло.
Исключением является графит — разновидность углерода.
Аллотропия — уникальная способность неметаллического элемента образовывать несколько простых веществ. В естественной среде существуют аллотропные модификации элементов, которые отличаются физическими и химическими свойствами. К ним относятся озон и кислород, графит и алмаз. Подробнее о физических свойствах неметаллов вы можете узнать в учебнике «Химия. 9 класс».
Химические свойства неметаллов
Как мы разобрали выше, группа неметаллов довольно полиморфна и в зависимости от типа реакций, в которых они участвуют, могут проявлять и окислительные, и восстановительные свойства. Фтор — исключение в этом ряду. Он всегда окислитель.
В ряду F,O,N,CL,Br,I,S,C,Se,P,As,Si,H окислительные свойства уменьшаются. Восстановительные свойства кислород может проявлять только в отношении фтора.
В этом типе реакций проявляются окислительные свойства и неметаллы принимают электроны с образованием отрицательно заряженных частиц.
Практически все неметаллы реагируют с водородом. Лишь благородные газы составляют исключение для реакций данного типа. Продуктом реакции являются летучие водородные соединения:
P + 5O2 = 2P2O5
4. Взаимодействие с водой и кислотами для неметаллов не характерно.
История открытия неметаллов
Медная посуда, железные орудия труда, золотые украшения — издавна человек замечал, что у всех этих веществ есть определенные общие свойства:
В противовес металлам были и другие вещества, не обладающие металлическими свойствами, и названные соответственно неметаллами. Практически до конца XVII века ученым-алхимикам было известно всего лишь два вещества-неметалла — углерод и сера.
В 1669 году Бранд в поисках «философского камня» открыл белый фосфор. И за короткий период с 1748 по 1798 годы было открыто около 15 новых металлов и 5 неметаллов.
В настоящее время открыто 22 неметаллических элемента.
Онлайн-конференция
«Современная профориентация педагогов
и родителей, перспективы рынка труда
и особенности личности подростка»
Свидетельство и скидка на обучение каждому участнику
Виктор Владимирович Жарких, учитель химии
Образовательная. Ознакомить учащихся с положением неметаллов в периодической системе химических элементов. Сформировать общее представление у учащихся о неметаллах. Указать особенности строения атомов неметаллов, углубить знания о металлической связи. Проследить взаимосвязь между строением неметаллов и их физическими свойствами.
Воспитательная. Реализация ВПС и МПС. Продолжить расширение политехнического кругозора учащихся на основе знаний о физических свойствах неметаллов, об использовании неметаллов в различных отраслях хозяйства.
Развивающая. Продолжить развитие умений учащихся самостоятельно пополнять и систематизировать свои знания, пользоваться приёмами сравнения и обобщения, делать выводы.
Тип урока. Комбинированный.
Оборудование. Коллекция «Неметаллы».
Таблица «Периодическая система химических элементов Д. И. Менделеева».
I . Организационный момент.
II . Проверка домашнего задания.
1. Какие вещества принято считать металлами?
2. Укажите расположение металлов в ПСХЭ Д. И. Менделеева.
3. Каковы особенности строения и свойств атомов металлов?
4. Поясните сущность металлической связи.
5. Назовите наиболее характерные физические свойства металлов. Как эти свойства можно обосновать в соответствии с представлениями о строении атомов металлов и металлической связи?
# работа по карточкам.
III . Изучение нового материала.
1. Неметаллы – это химические элементы, которые образуют в свободном виде простые вещества, не обладающие физическими свойствами металлов.
2. Положение неметаллов в ПСХЭ.
1) химические элементы неметаллы в основном расположены в правой верхней части таблицы ПСХЭ Д. И. Менделеева.
2) неметаллы в большей степени присутствуют в малых периодах.
3. Особенности строения атомов неметаллов.
1) на внешнем электронном слое атома содержится значительное число электронов, обычно от 4 до 7. (Исключение H – 1 ē, B – 3 ē).
3) атомы неметаллов обладают меньшим радиусом по сравнению с атомами металлов.
4) химическая связь ковалентная неполярная;
5) внешние валентные электроны довольно хорошо удерживаются ядром атома, вследствие этого неметаллы обладают высокой степенью электроотрицательности и при химических реакциях обычно проявляют окислительные свойства.
4. Характерные физические свойства неметаллов.
1) вещества молекулярного строения:
2) вещества атомного строения:
5. Аллотропия – это способность атомов одного и того же химического элемента образовывать несколько простых веществ.
Аллотропные видоизменения (модификации) – это простые вещества образованные атомами одного и того же химического элемента.
IV . Закрепление знаний полученных на уроке.
1. Какие вещества принято считать неметаллами?
2. Укажите расположение неметаллов в ПСХЭ Д. И. Менделеева.
3. Каковы особенности строения и свойств атомов неметаллов?
4. Поясните сущность ковалентной связи.
5. Назовите наиболее характерные физические свойства неметаллов. Как эти свойства можно обосновать в соответствии с представлениями о строении атомов неметаллов и ковалентной связи?
6. Что такое аллотропия? Приведите примеры аллотропных видоизменений химических элементов неметаллов.
Неметаллы
Общая характеристика неметаллов
Неметаллы в периодической системе расположены справа от диагонали «бор – астат». Это элементы главных подгрупп III, IV, V, VI, VII, VIII групп. К неметаллам относятся: бор, углерод, кремний, азот, фосфор, мышьяк, кислород, сера, селен, теллур, водород, фтор, хлор, бром, йод, астат, а также благородные газы: гелий, неон, криптон, ксенон, радон.
Среди неметаллов два элемента – водород и гелий – относятся к s-семейству, все остальные принадлежат к р-семейству.
На внешнем электронном слое у атомов неметаллов находится различное число электронов: у атома водорода – один электрон (1s 1 ), у атомов гелия – два электрона (1s 2 ), у атома бора – три электрона (2s 2 2p 1 ). Однако атомы большинства неметаллов, в отличие от атомов металлов, на внешнем электронном слое имеют большое число электронов – от 4 до 8; их электронные конфигурации изменяются от ns 2 np 2 у атомов элементов главной подгруппы IV группы до ns 2 np 6 у атомов инертных газов.
Физические свойства
Элементы – неметаллы образуют простые вещества, которые при обычных условиях существуют в разных агрегатных состояниях:
Газы: гелий, неон, криптон, ксенон, радон, водород, кислород, азот, фтор, хлор.
Жидкость: бром
Твердые вещества: йод, углерод, кремний, фосфор, и др.
7 элементов-неметаллов образуют простые вещества, существующие в виде двухатомных молекул Э2 (H2, O2, N2, F2, Cl2, Br2, I2).

Кристаллические решетки металлов и твердых веществ-неметаллов отличаются между собой. Атомы металлов образуют плотно упакованную кристаллическую структуру, в которой между атомами существуют ковалентные связи. В кристаллической решетке неметаллов, как правило, нет свободных электронов. В связи с этим твердые вещества-неметаллы в отличие от металлов плохо проводят тепло и электрический ток, не обладают пластичностью.
Химические свойства
Неметаллы как окислители
В этой реакции сера – окислитель, а фосфор – восстановитель, так как ЭО фосфора меньше ЭО серы.
На разной окислительной активности основана способность одних неметаллов вытеснять другие из растворов их солей. Например, бром, как более сильный окислитель, вытесняет йод в свободном виде из раствора йодида калия:
Неметаллы как восстановители
Стоит отметить, что неметаллы (кроме фтора) могут проявлять и восстановительные свойства. При этом электроны атомов неметаллов смещаются к атомам элементов- окислителей. В образующихся соединениях атомы неметаллов имеют положительные степени окисления. Высшая положительная степень окисления неметалла обычно равна номеру группы.
— взаимодействие с кислотами-окислителями:
— взаимодействие с солями-окислителями:
Наиболее сильные восстановительные свойства имеют неметаллы углерод и водород:
Таким образом, практически все неметаллы могут выступать как в роли окислителей, так и в роли восстановителей. Это зависит от того, с каким веществом взаимодействует неметалл.
Реакции самоокисления – самовосстановления
Существуют и такие реакции, в которых один и тот же неметалл является одновременно и окислителем, и восстановителем. Это реакции самоокисления – самовосстановления (диспропорционирования). Например:
Скачать:
Скачать бесплатно реферат на тему: «Неметаллы» Неметаллы.docx (403 Загрузки)
Скачать рефераты по другим темам можно здесь
Характеристики и физические свойства
Хотя химических элементов-неметаллов всего 16, они являются настоящими кирпичиками жизни, из них состоят все органические соединения. Ученые выяснили, что земная кора на 76% состоит из кремния и кислорода, а водород является самым распространенным веществом во Вселенной, из него состоят все объекты космоса, а также наше светило.
В растительном и животном мирах неметаллы составляют больше 96% от общей массы и 96,7% от массы человека. Это органогенные элементы, формирующие молекулы белков, жиров, углеводов и нуклеиновых кислот. Безусловно, без этих простых веществ привычное существование было бы невозможным.
Основная масса металлов, кроме золота и меди, не обладает цветом, только металлическим блеском. Неметаллы ярко и разнообразно окрашены:
Значительное влияние на физические свойства неметаллов оказывают их молекулярное строение и вид кристаллической решетки. Кремний, как и алмаз с атомным кристаллическим строением решетки, обладает большой прочностью и высокой температурой плавления и кипения. Соединения с молекулярной решеткой (йод, сера и фосфор) начинают плавиться и кипеть при довольно низких температурах.
Простые вещества-неметаллы можно разделить на три вида агрегатных состояний: газы, жидкости и твердые вещества. Однако эта классификация будет верной только при стандартных параметрах окружающей среды, при крайне низких или высоких температурах состояние веществ может меняться.
Самую большую группу составляют газообразные неметаллы: кислород, азот, водород, белый фосфор, озон. Они обладают высокой сжимаемостью и расширяемостью, легко смешиваются между собой и заполняют весь объем сосуда. Кислород является сильным окислителем, необходимым для развития жизни на планете, а легко воспламеняющийся белый фосфор быстро образует активные токсичные соединения, поэтому смертельно опасен.
К жидким неметаллам можно отнести только бром — тяжелую темно-бурую вязкую жидкость, обладающую резким и неприятным запахом. Несмотря на то что в природе бром является смертельным ядом, даже его пары вызывают сильное раздражение слизистой и кожных покровов, он присутствует в организме человека, предохраняя от гормональных сбоев.
К твердым веществам относят бор, красный и черный фосфор, мышьяк, кремний, серу, йод и все стабильные аллотропные модификации углерода. В обычном состоянии они являются веществами с прочной атомной кристаллической решеткой, обладают высокой твердостью, но при этом хрупкие, легко слоятся и ломаются.
Интересным примером разных свойств одного и того же неметалла станет сравнение двух разновидностей углерода — алмаза и графита. Утверждение о твердости алмаза имеет научное обоснование — расположение атомов в кристаллической решетке этих веществ настолько различно, что алмаз разрушить практически невозможно, а графит легко ломается и крошится.
Место в периодической системе
Элементы, расположенные возле воображаемой диагонали, обладают двойственным характером и считаются полуметаллами (металлоидами). Список неметаллов в таблице Менделеева зависит от их положения в системе и количества электронов на внешнем слое:
Отдельно находятся водород и гелий, расположенные в левом и правом верхнем углу таблицы. Это объясняется уникальностью атома водорода, имеющего всего 1 электрон на внешнем слое. Причем водород может одинаково хорошо проявлять свойства как восстановителя, отдавая его, так и окислителя, принимая дополнительный электрон.
Химические особенности
Для большинства элементов этой группы характерна способность вступать в быстрые окислительно-восстановительные реакции, это обеспечивают особенности строения атомов неметаллов. Их атомы содержат большое количество электронов (4−8) на внешнем электронном уровне и способны принимать дополнительные для его устойчивой конфигурации. Благодаря этому образуются отрицательно заряженные ионы, увеличивающие заряд ядра, атом сжимается, а его радиус уменьшается.
Эти процессы ослабляют восстановительные свойства неметаллов, а окислительная способность и электроотрицательность увеличиваются. Некоторые, например, бром, являются окислителем для большинства металлов, но при этом выступают восстановителем для более сильных неметаллов.
Проявляемые химические свойства неметаллов, их активность, возможные степени окисления и характер получаемых соединений могут варьироваться в зависимости от их места в периодической системе и текущего агрегатного состояния.
Взаимодействие с другими веществами
Каждый неметалл обладает специфическими свойствами, характерными только для него, которые подробно рассматриваются при изучении неорганической химии. Общими свойствами является способность реагировать с металлами, водородом и кислородом.
При взаимодействии с металлами большинство неметаллов выступают окислителями и в образующихся бинарных соединениях проявляют отрицательную степень окисления:
Неметаллы могут вступать в реакции между собой, при этом более электроотрицательный элемент будет играть роль окислителя, а менее отрицательный станет восстановителем.
Получение и применение
Некоторые элементы встречаются в природе в свободном виде, поэтому их можно выделить из смесей или очистить физическим методом. Фтор, хлор, бром и йод встречаются только в виде соединений, поэтому нужные вещества получают методом химических реакций:
В земных условиях водород встречается только в связанном состоянии в виде водородных соединений, поэтому для его выделения используют различные химические методы, в основном паровую конверсию метана или природного газа.
Учитывая разнообразные свойства неметаллов, они находят применение в большинстве отраслей нашей жизни: медицине, пиротехнике, сельском хозяйстве, пищевой промышленности и для подготовки высоких температур. Для дезинфекции воды используют хлор и озон, медицина невозможна без йода и активированного угля (углерод), жидкий азот применяют в косметологии, а сера помогает бороться с болезнями растений.
«Неметаллы – простые вещества». 8-й класс
Разделы: Химия
Класс: 8
Девиз занятия:
«Единственный путь, ведущий к знанию, – это деятельность»
(Б. Шоу)
Цель занятия: уяснить физические свойства и применение неметаллов.
Задачи:
Оборудование: таблицы, черный ящик, пробирки, презентация, компьютер, проектор, дополнительная литература, зачётные листы.
Вещества: коллекция « Неметаллы», активированный уголь, подкрашенная вода.
Тип урока: изучение нового материала.
Методы и приёмы обучения: урок построен в соответствии с педтехнологией развития критического мышления. Приёмы: «денотатный граф», «кластер», диктант «Верные и неверные утверждения», «синквейн», «Попс-формула», «Озвучить изображения». «Чёрный ящик».Методы: объяснительно-иллюстративный, частично-поисковый, исследовательский.
Ход занятия
I. Стадия вызов
Познание начинается с удивления.
Приём «Чёрный ящик». Может ли исчезнуть вода из пробирки за 1 секунду? Каким образом? Ответ находится в черном ящике. Ответить поможет загадка:
Из меня состоит все живое:
Я – графит, антрацит и алмаз,
Я на улице, в школе и в поле,
Я в деревьях и в каждом из вас.
Демонстрация объекта – активированный уголь, опыта адсорбции углем воды.
(Отметки заносите в зачётный лист).
Самопроверка по коду: 1 – 109, 2 – 87, 3 – 22, 4 – олово, 5 – металлы – в нижнем левом углу, неметаллы – в верхнем правом углу.
II. Стадия осмысления
Какую мы поставим цель? Что должны знать и уметь?
Прием «Денотатный граф». Изучение общей характеристики неметаллов: физических свойств, строение атома, положения по периодической системе.
Химические элементы неметаллы образуют простые вещества, при обычных условиях имеют 3 агрегатных состояния, различных цветов.
Свойства простых веществ – неметаллов определяются ковалентной связью и двумя типами кристаллических решёток: молекулярной (газы), атомной (алмаз, графит). Знакомство с понятием: аллотропия. Способность атомов одного химического элемента образовывать несколько простых веществ называют аллотропией, а эти простые вещества – аллотропными видоизменениями или модификациями.
Лабораторная работа «Изучение физических свойств неметаллов».
Работа с коллекцией « Неметаллы», составление кластера.
Самостоятельная работа по изучению материала «Применение неметаллов»:
1 группа работает с дополнительной литературой. 2 группа находит информацию в Интернете. 3 группа составляет кластер, используя материал учебника. Представление информации группами.
Первичное закрепление.
На слайде применение неметаллов по физическим свойствам: воздушные шары, карандаш, бриллианты, угольные электроды, стеклорез.
Какой неметалл является лесом? (бор)
Я – газ, простое вещество, двузначен номер мой,
А слог мой первый – божество,
Река – вот слог второй (радон)
Какой химический элемент состоит из двух животных? (мышьяк)
Каким элементом богата морская капуста – ламинария? (йод).
Какой элемент образует и очень твёрдое, и очень мягкое вещество? (углерод)
Недостаток какого элемента в организме человека приводит к кариесу? (фтор)
III. Стадия рефлексия
Выполните тест, проверь себя по коду.
Аллотропная модификация кислорода.
1) азот;
2) графит;
3) озон.
Назвать жидкий неметалл?
1) сера;
2) углерод;
3) бром.
Тип связи в молекуле водорода?
1) металлическая;
2) ионная;
3) ковалентная.
Назвать твердый неметалл?
1) водород;
2) углерод;
3) кислород.
Код: 1 – 3, 2 – 3, 3 – 3, 4 – 2.
Игра-задание «Металлы и неметаллы»
Выбери справа доски с символами металлов и они встанут на место.
В этом заборе 4 доски закреплены ненадежно. На них написаны символы неметаллов. Найди их. Не ошибайся. Твои ошибки увидят все.
| Са, Al, Cl, Sn, Fe, Si, As, Ni, Br, Ba |
Написать синквейн со словом «Углерод».
Что мы сегодня узнали?
Оцените свою работу на уроке. Подсчитайте общее количество баллов и поставьте отметку в зачётный лист.
Задание: написать вывод урока по образцу, закончив предложения:
Ученики зачитывают свои выводы.
Домашнее задание: § 14, упр. 1, 2, стр.78, творческое задание: написать мини сочинение «Озоновые дыры», «Неоновая реклама».
Игра светофор. Поднимите бумажную полоску: зелёная – мне работалось легко, интересно; желтая – при работе затруднялся, красная – было не интересно.