Что такое оригинальные и генерические лс
Оригинальные и генерические лекарственные препараты
Лекарственные средства
Провизор должен учитывать не только фармакологические свойства препарата, но и его стоимость. Поэтому провизор должен иметь четкое представление о характерных особенностях оригинальных (брендовых) и генерических препаратов.
В отличие от патента на активное вещество, собственность на оригинальную торговое название сохраняется и по окончании срока действия патента на активное вещество. Даже законодательством многих государств разрешается хранить торговую марку при замене вспомогательных веществ и даже активных веществ в комбинированных препаратах.
Генерические лекарства
Между генерическими и оригинальными лекарствами нет противоречия. Широкое использование генерических эквивалентов приводит к экономии средств, которые затем можно использовать на более дорогие оригинальные лекарства там, где это действительно нужно.
Почему генерические эквиваленты дешевле, чем оригинальные лекарства? Оригинальные лекарства находятся в монопольном позиции, когда охраняемых патентом, а потому имеют возможность удержания высоких цен. Для генерических эквивалентов при разработке не надо снова повторять все доклинические и клинические испытания, но можно ссылаться на существующие клинические данные оригинального препарата. Поэтому разработка препарата намного дешевле.
Эффективность генериков
Регистрация лекарственного средства осуществляется ГФЦ МЗ Украины. В течение процедуры регистрации, согласно Приказу МЗ Украины от 26.08.2005 г.. № 426 «Об утверждении Порядка проведения экспертизы регистрационных материалов на лекарственные средства, которые подаются на государственную регистрацию (перерегистрацию), а также экспертизы материалов о внесении изменений в регистрационные материалы на протяжении действия регистрационного удостоверения», контролируются качество, безопасность и эффективность лекарственного средства. Регистрационное удостоверение на лекарственное средство выдается сроком на 5 лет. В течение действия регистрационного удостоверения производитель несет ответственность за безопасность и качество препарата. Одним из условий по перерегистрации лекарственного средства в Украине является предоставление регулярно обновляемого отчета по безопасности лекарственного средства во время действия регистрационного удостоверения.
Поскольку в мире коренным образом изменилась роль фармацевта в системе здравоохранения, основной целью его профессиональной деятельности становится не столько увеличение ассортимента и качества лекарственных препаратов на рынке, сколько повышение эффективности и безопасности медикаментозной терапии конкретного больного. Для осуществления этой цели Международная фармацевтическая федерация (МФФ) обязывает всех практикующих фармацевтов обеспечить каждому больному надлежащее качество фармацевтической опеки.
Генерики и оригинальные препараты: взгляд практического врача
*Пятилетний импакт фактор РИНЦ за 2020 г.
Читайте в новом номере
Всемирная Организация Здравоохранения (ВОЗ) в 2004 г. приняла резолюцию, провозгласившую радикальное увеличение безопасности лечения приоритетной задачей ВОЗ [1]. В этой резолюции особый акцент сделан на право больного знать все о своем заболевании, методах его лечения и на необходимости получения информированного согласия больного на лечение. В связи с этим следует учитывать, что информированное согласие предполагает заведомое разъяснение пациенту различий между «аналогами» лекарственных средств (ЛС). Однако только 60% врачей обнаруживают знакомство с такой постановкой вопроса [2].
Литература
1. Мешковский А.П. Место дженериков в лекарственном обеспечении. Фарматека. 2003; 3: 103–4.
2. Белоусов Ю.Б. Дженерики – мифы и реалии. Remedium. 2003;7–8: 4–9.
3. Иванов С. Выступление на встрече с членами Общественной палаты. Заседание, посвященное промышленности и инновациям. МГТУ имени Баумана. 2007; 18.05.
4. Панюшин Р. Оригинальные и дженериковые препараты: единство или борьба противопо¬ложностей? Фарм. вестник. 2003; 16: 23–25.
5. ЕМЕА, The rules governing medicinal products in the European Union Investigation of Bioavailability and Bioequivalence.1998; 3C: 231–244.
6. FDA, Electronic Orange Book. Approved Drug Products with Therapeutic Equivalence Evaluations, 23th Edition, 2003.
7. Материалы семинара «Совершенствование процесса регистрации и контроль качества лекарственных средств». Казахст. //Фармацевтический вестник. 16.10.2005.
8. Верткин А.Л., О.Б.Талибов О.Б. Генерики и эквивалентность – что стоит за терминами. Неотложная терапия. 2004; 1–2: 16–17.
9. Чумак В. Т. Оборот лекарственных средств в Украине. Проблемы и перспективы. Материалы І Международной конференции «Клинические испытания лекарственных средств в Украине». Киев, 2006, ноябрь.
10. Nightingale CH. A survey of the Quility of Generic Clarithromydn Product from 13 Countries. Clin Drug Invest 2000; 19: 293–05.
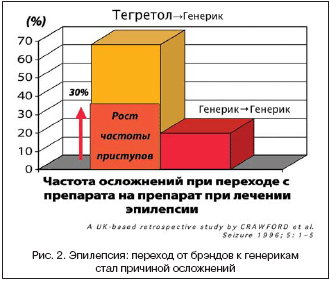
11. A UK–based retrospective study by CRAWFORD et al Seizure. 1996; 5: 1–5.
12. Насонова В.А. Особенности применения различных форм диклофенака натрия при болезнях мягких тканей плечевого пояса и боли в нижней части спины. Consilium medicum. 2006; 2 (8): 45–48.
13. Недогода С.В., Марченко И.В., Чаляби Т.А. Сравнительная антигипертензивная эффективность генериков ангиотензинпревращающего фермента эналаприла (ренитека, энапа, эднита, инворила, энваса и энама) и стоимость лечения у больных гипертонической болезнью. Артериальная гипертония. 2000; 1: 52–5.
14. Сущук Е.А. Симпозиум «Исследования по биоэквивалентности препаратов как основа для рационального использования генериков». Конгресс «Человек и лекарство», 3 апреля 2006 г.
15. The rules governing medicinal products in the European Union. Investigation of Bioavailability and Bioequivalence.1998; 3C: 231–244.
16. Марцевич С.Ю., Кутишенко Н.П., Дмитриева Н.А., Белолипецкая В.Г. Выбор лекарственного препарата в кардиологии: на что должен ориентироваться практический врач? Кардиоваскул. тер. и профилактика. 2004; 4: 77–82.
17. Гарматина Ю. Реклама против закона. //АиФ–Здоровье. 2004; 11, март: 2.
18. Рабочее совещание ВОЗ: Политика в области информации о ЛС в странах Европы и в Новых Независимых Государствах. Хиллеред. 1996; 27.03–2.04
Генерические и оригинальные лекарственные средства (особенности терминологии)
Современный фармацевтический рынок. Основные понятия и термины.
Современный мировой фармацевтический рынок – это рынок, насыщенный генерическими лекарственными средствами, т.к. около 80% лекарственных средств (от общего количества наименований), производимых и находящихся в розничной и оптовой реализации, приходится на генерические (воспроизведенные) лекарственные средства.
Генерическое лекарственное средство (родовой препарат) – это лекарственное средство, которое содержит одно и то же фармакологически активное вещество (фармацевтическую субстанцию) в одинаковой дозе и той же лекарственной форме, что и оригинальное лекарственное средство, является эквивалентным оригинальному средству по качеству, эффективности и профилю безопасности и производится без лицензии компании, владеющей оригинальным лекарственным средством, и реализуется после истечения срока действия патента или других эксклюзивных прав на производство и реализацию оригинала.
Оригинальное (исходное) лекарственное средство – это лекарственное средство, которое отличается от всех ранее зарегистрированных лекарственных средств фармакологически активным веществом (фармацевтической субстанцией) или комбинацией таких веществ.
Таким образом, присутствие на рынке генерических средств обусловлено, прежде всего, истечением сроков патентной защиты на производство оригинальных средств. Срок патентной защиты лекарственного средства, как правило, составляет не более 20 лет.
В настоящее время генерические лекарственные средства могут быть реализованы как под международными непатентованными наименованиями, так и под новыми торговыми названиями. Допускается присутствие на фармацевтическом рынке страны генерических средств в разных лекарственных формах и\или дозах, отличных от оригинальных средств.
Немаловажным аспектом остаются финансовые затраты на фармацевтическую разработку и производство лекарственных средств. При этом для создания и выведения на фармацевтический рынок оригинального лекарственного средства необходимо затратить от 2 до 10 – 15 млн. долларов в течение 10 – 15 лет. Безусловно, значительные расходы денежных средств и длительное исследование могут себе позволить только крупные фармацевтические компании. Что касается средних и мелких фармацевтических заводов, то для них остается возможность использовать уже «готовые» разработки и приспосабливать их для конкретных условий производства.
Существует также понятие инновационного лекарственного средства, которое имеет некоторые преимущества по сравнению с оригинальным лекарственным средством (например, модификация высвобождения действующего компонента во времени).
На фармацевтическом рынке различных стран присутствуют также супергенерики, которые по сравнению с оригинальными лекарственными средствами имеют большую биодоступность, но содержат в своем составе один и тот же фармакологически активный компонент.
В зависимости от уровня доказательности эквивалентности (соответствия) генерика оригиналу выделяют два больших класса генерических лекарственных средств:
1) класс А: генерическое средство терапевтически эквивалентно оригинальному, т.е. по результатам клинических испытаний показана их полная идентичность по эффективности и профилю безопасности, фармакокинетические параметры могут отличаться не более, чем на 5%. В данном случае генерик полностью может заменить оригинал при медицинском применении.
2) класс В: генерическое средство биоэквивалентно оригинальному, т.е. клинические испытания эффективности и безопасности не назначались, была изучена фармакокинетика генерика в сравнении с оригиналом на людях (биологическая эквивалентность). Совпадение фармакокинетических профилей допускается в диапазоне от 80% до 125%. Генерик класса В не может являться автоматической заменой оригинальному средству.
Следует отметить, что ряд генериков вообще не проходит клинических и/или биоэквивалентных испытаний.
Такие средства называют фармацевтически эквивалентными, они содержат в своем составе равное количество фармакологически активного вещества (отличия не более, чем на 5%) и произведены в соответствие со стандартами GMP.
В итоге, к реализации государственными органами допущены лекарственные средства, имеющие различный уровень доказательства эффективности, безопасности и качества. При этом многие производители лекарственных средств не информируют специалистов и население о характере этого уровня. В результате возникают проблемы при выборе лекарственного средства для лечения, диагностики или профилактики заболеваний; замене оригинала генериком и подборе того или иного генерика среди множества средств, представленных в ассортименте аптек. Значение в данной ситуации для многих граждан приобретает цена, а не данные о терапевтической эффективности и безопасности. Поэтому остается открытым вопрос о предоставлении фармацевтическими компаниями более полной информации о генерических средствах в плане изучениях их эквивалентности оригинальным средствам и возможности замены при медицинском применении.
Можете ли привести пример замены оригинального препарата на генерик, с указанным (отличным от оригинального) кодом терапевтической эквивалентности.
По-моему рядовому специалисту, даже зная эти незначительные отличия трудно подобрать оптимальную дозу генерического препарата (если разница в 10-15 %). Или существует какая-либо «формула» пересчета дозы при назначении нового препарата? Ведь в нашей стране, как правило, просто заменяют один препарат на генерик, учитывая лишь идентичность дозировки.
В данном случае (когда речь идет о генериках класса А) в клинических исследованиях показана полная идентичность профиля безопасности и терапевтической эффективности, несмотря не небольшие фармакокинетические отличия (не более 5%). Оригинальное (брэндовое) лекарственное средство можно автоматически (т.е. без учета какого-либо пересчета) заменить генериком. Доза в случае замены ключевой роли не играет, играют другие вспомогательные вещества, технология производства и прочее. При выборе генерика нужно скорее руководствоваться соображениями максимального приближения его получения к оригиналу.
Добавлю еще один момент, в случае диапазона дозы играет роль широта плато максимального эффекта, которая в различных лекарственных средствах различна.
Спасибо, с генериками класса А понятно, а можете ли привести пример рассчета дозы при замене оригинального препарата на генерик класса В (ренитек и энам, бетасерк и верист и т.д.)? Т.е. приемлимо ли это или категорически недопустимо, учитывая разброс дозы для достижения терапевтического эффекта(натолкнулась на эту информацию в сети)?
Проблема кроется в фармацевтической эквивалентности, когда не были проведены ни клинические, ни биоэквивалентные исследования. В данном случае, никто не знает даже профиля концентрации во времени.
Генерики и оригинальные препараты: взгляд фармаколога
На фармацевтическом рынке существуют две основные группы лекарственных средств — оригинальные препараты и генерики (препараты-копии). Их соотношение на рынках разных стран неодинаково, однако в Украине генерический эшелон имеет несомненный перевес. Представить в этом разрезе картину современного украинского рынка помогут данные аналитической системы исследования рынка «PharmXplorer»/«Фармстандарт» компании «Proxima Research» о розничных продажах лекарственных средств (Sale out) за 5 мес 2014 г. (таблица).
| Таблица | Удельный вес препаратов различного рыночного статуса в аптечных продажах за 5 мес 2014 г. («PharmXplorer»/«Фармстандарт») |
| Рыночный статус препаратов | Доля на рынке, % | |
| в натуральном выражении | в денежном выражении | |
| Иммунобиологические | 1 | 3 |
| Оригинальные | 6 | 19 |
| Генерические | 44 | 38 |
| Традиционные | 49 | 40 |
Врачам и пациентам хорошо известно, что генерики дешевле оригинальных препаратов. Но в чем еще заключаются различия между этими препаратами? Для принятия обоснованного решения о замене оригинального лекарственного средства на генерик в каждом конкретном случае врач должен четко представлять, что такое генерик и чем он отличается от оригинального препарата. Рассмотрим этот вопрос на примере глимепирида — перорального антигипергликемического препарата из группы производных сульфонилмочевины третьего поколения. По сравнению с другими производными сульфонилмочевины глимепирид имеет целый ряд преимуществ: быстрое и полное всасывание, возможность использования один раз в сутки, щадящее влияние на β-клетки поджелудочной железы, низкий риск развития гипогликемии, менее выраженное увеличение массы тела.
В Государственном формуляре лекарственных средств Украины за 2014 г. глимеперид представлен оригинальным препаратом Амарил ® («Санофи-Авентис») и 40 генериками (9 препаратов отечественного производства и 31 — зарубежного) [1], что делает выбор оптимального лекарственного средства для каждого конкретного пациента довольно непростой проблемой.
Оригинальный (инновационный) препарат (originalis — первичный, innovative — обновленный) — это лекарственный препарат, который создан на основе новой, впервые синтезированной или полученной из природного сырья субстанции, прошел полный курс доклинических и клинических исследований эффективности и безопасности и защищен патентом на определенный срок [2]. В странах ЕС этот срок составляет 10–15 лет, в России и Украине — 20 лет.
На доклиническом этапе создания оригинального лекарственного средства его фармакологическая активность (по отношению к глимепериду — сахароснижающее действие) и безвредность (последствия для организма однократного и ежедневного приема в течение 1 года, вероятность онкогенного, мутагенного, эмбриотоксического, аллергизирующего действия и др.) углубленно изучается на нескольких видах животных [3]. Затем оригинальный препарат проходит три последовательных фазы клинических исследований на людях. Первая — на здоровых добровольцах (10–20 человек), вторая — на пациентах с соответствующим заболеванием (50–150 пациентов с нетяжелой формой заболевания без сопутствующей патологии), третья — 250–300 больных с различными вариантами течения соответствующего заболевания. Только после успешного прохождения III фазы клинических исследований оригинальный препарат может претендовать на получение разрешения для применения в широкой медицинской практике (разрешение на маркетинг или регистрационное свидетельство).
С этого момента начинается IV фаза исследований — постмаркетинговая. Изучаются особенности применения препарата у пациентов разного пола, возраста, в разнообразных клинических ситуациях. При этом по инициативе производителя особое внимание обращается на активное выявление, сбор и анализ информации о побочном действии лекарственного средства [4]. Эта фаза чрезвычайно важна, так как согласно законам статистики для выявления серьезных побочных явлений, выявляемых с частотой 1:10 000 (что считается относительно частым), исследование необходимо провести не менее чем на 30 тыс. больных. Регистрация же препарата проводится после клинических исследований на меньшем числе пациентов. В реальной жизни новое лекарственное средство принимают больные с сопутствующими заболеваниями, требующими применения других лекарств. При этом возраст больных, взаимодействие препаратов между собой и с пищевыми продуктами могут существенно влиять на эффективность и переносимость препарата. Все эти факторы вносят коррективы в схемы назначения оригинального лекарственного средства, разработанные при проведении I–III фаз клинических исследований.
Генерик (дженерик, генерический препарат, многоисточниковый препарат; англ. Generic) — непатентованный лекарственный препарат, являющийся воспроизведением оригинального препарата, на активный фармацевтический ингредиент (АФИ) которого истек срок патентной защиты [2]. Он может выпускаться любой фармацевтической компанией как под международным непатентованным наименованием, так и коммерческим (торговым) названием.
Термин «генерик» возник в 70-е годы XX в., когда считалось, что препараты-аналоги надо называть родовым (генерическим) именем, в отличие от оригинального лекарственного средства, которое продавалось под специальным торговым названием. Это правило облегчало распознавание оригинального препарата среди множества его копий.
В настоящее время большинство генериков имеют собственное торговое название, что не позволяет отличать их от оригинала. Например, оригинальный препарат глимепирида называется Амарил («Санофи-Авентис»), а генерики, которые теоретически должны называться родовым (генерическим) именем глимепирид, имеют самые разнообразные торговые названия. «Генерическое» имя (международное непатентованное наименование) на украинском фармацевтическом рынке носят только два препарата — производства украинской и индийской фармацевтических компаний.
Согласно существующим требованиям проведение доклинических и клинических исследований для выведения генерика на рынок не требуется. Необходимым условием для признания тождественности генерика оригиналу является доказанная фармацевтическая, биологическая и терапевтическая эквивалентность этих препаратов [5].
Фармацевтическая эквивалентность предполагает, что оригинальное и воспроизведенное лекарственные средства содержат одно и то же АФИ в одинаковом количестве и в одинаковой лекарственной форме, а вспомогательные компоненты (наполнители, красители, особенности покрытия) и технология производства генериков и оригинальных препаратов могут быть совершенно различными [6]. При этом допускается, что содержание АФИ может отличаться в пределах ±5% (в случае глимепирида Фармакопея США разрешает колебания содержания АФИ в таблетках в пределах ±10%) [7].
Большое значение для эквивалентности препаратов имеет явление оптической изомерии. Большинство фармакологически активных веществ существуют в виде нескольких оптических изомеров с одинаковым составом атомов, однако с их различным расположением в пространстве, так что эти изомеры невозможно совместить между собой.
Так, глимепирид существует в виде цис- и транс-формы (в цис-изомерах заместители находятся по одну сторону от плоскости двойной связи, в транс-изомерах — по разные). Гипогликемическим действием обладает транс-форма, а цис-форма является высокотоксичной примесью [8]. По различным технологиям синтеза получают смеси с различным соотношением цис- и транс-изомеров. Определение изомерного состава субстанции на сегодня не выдвигается как требование при регистрации препаратов и эта информация не приводится в инструкциях на лекарственное средство. Однако особенности пространственного строения неизбежно влияют на фармакологическую активность препарата, ведь взаимодействие АФИ с мишенями (рецепторами, ферментами, ионными каналами и т.п.) определяется именно соответствием пространственной структуры АФИ и мишени. Для анализа качества фармацевтического сырья разработаны методики определения стереоизомеров глимеперида, однако в практической деятельности их применяют крайне редко [9, 10, 11].
В процессе создания лекарств не менее значимо, чем оптическая изомерия, явление полиморфизма кристаллов. Полиморфизм — это способность веществ существовать в разных кристаллических структурах. Классический пример полиморфизма — углерод, который имеет две всем известные полиморфные модификации: кубическую (алмаз) и гексагональную (графит). Явление полиморфизма известно и для высокомолекулярных соединений. В результате реакции с хлоридом цинка осажденный инсулин превращается в труднорастворимый комплекс, который в зависимости от рН может быть аморфным или кристаллическим. Так, аморфный цинк-инсулин действует быстро и недолго, кристаллический — всасывается значительно медленнее. Соответственно, оптимальное соотношение в лекарственной форме обоих полиморфных модификаций инсулина обеспечивает сбалансированную концентрацию инсулина в крови пациентов.
На сегодня явление полиморфизма показано для более чем 80% активных фармацевтических ингредиентов, в том числе, для глимепирида [12]. Каждая из известных модификациий является устойчивой и образуется при соответствующих термодинамических условиях в процессе фармацевтического производства действующей субстанции, а в дальнейшем — в процессе производства таблетированной лекарственной формы.
Как уже было сказано выше, существующими требованиями к регистрации лекарственных препаратов допускаются различия между оригинальными и генерическими лекарственными средствами в составе вспомогательных веществ. В то же время фармацевтам хорошо известно, что состав и качество вспомогательных веществ не безразлично для клинической эффективности и безопасности препарата, особенно с учетом того факта, что именно вспомогательные вещества составляют основную массу таблетки. Так, в препаратах глимеперида вспомогательные вещества составляют более 90% массы таблетки [8]. Они влияют на скорость и степень высвобождения АФИ из таблетки, соответственно повышая или снижая его концентрацию в крови, органах и тканях. Вспомогательные вещества также могут изменять время, в течение которого АФИ удерживается в тканях, оказывая пролонгированный эффект, существенно влиять на стабильность препарата при хранении. Например, в состав оригинального глимепирида входит карбоксиметилкрахмал, а в состав ряда генериков — обычный крахмал. Карбоксиметилирование придает крахмалу особые свойства — способность образовывать устойчивые вязкие клейстеры, стабилизировать водные многокомпонентные системы, образовывать легко растворимые в холодной воде пленки, что важно при технологическом процессе производства таблеток и их стабильности при последующем хранении [13, 14]. В экспериментальных исследованиях по разработке пролонгированной лекарственной формы глимеперида показано, что в зависимости от состава матрикса таблетки (синтетические или природные полимеры) степень высвобождения АФИ изменяется на 30% [15].
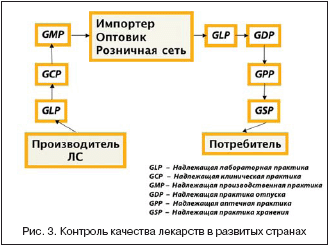
Скорость и степень высвобождения АФИ существенно зависит также от технологии процесса прессования таблеточной массы (превращения «лекарственного теста» в таблетку). Соответствие технологии производства генериков международным стандартам качества подтверждается сертификатом GMP (Good Manufacturing Practice — надлежащая производственная практика). Сертификат GMP означает, что продукция произведена в строгом соответствии с требуемым химическим составом, в условиях, не допускающих попадания посторонних веществ, а также должным образом упакована, что гарантирует сохранение всех свойств на протяжении срока годности [16].
Таким образом, фармацевтическая эквивалентность сама по себе не гарантирует одинакового по силе и длительности фармакологического действия оригинального и генерического препарата и обязательно должна подтверждаться биологической эквивалентностью.
Биологическая эквивалентность предусматривает, что фармацевтически эквивалентные препараты имеют сравнимую биодоступностъ — скорость и степень всасывания действующего вещества в системный кровоток. Биоэквивалентность устанавливается в экспериментальных исследованиях с участием ограниченного количества здоровых добровольцев. При этом, по регламенту ВОЗ и ЕС, допускается различие в показателях биодоступности оригинального препарата и его генерика в пределах ±20% (соответственно, разница между отдельными препаратами может достигать 40%) [19, 20].
Для глимепирида биоэквивалентными считаются препараты, имеющие разницу с оригиналом в интервале 80–125% [21, 22]. Для заболеваний, при которых развитие обострения представляет особую опасность для дальнейшего прогноза, а также в случае необходимости особо точного дозирования эта разница весьма существенна. Кроме того, как уже было сказано, биоэквивалентность изучают при однократном введении препаратов небольшому количеству здоровых лиц, особенности всасывания и распределения лекарственных средств у которых могут иметь различия с больными, особенно при наличии у последних сопутствующей патологии. Именно поэтому наличие биоэквивалентности с высокой степенью вероятности позволяет предполагать (но не гарантирует), что оригинальный и генерический препарат имеют терапевтическую эквивалентность — равную клиническую эффективность и безопасность. Следует также отметить, что до настоящего времени только часть многочисленных генериков глимеперида прошли исследование биоэквивалентности, для других изучение биоэквивалентности только планируется [23]. Что касается терапевтической эквивалентности, то такие исследования во всем мире проводят крайне редко, поэтому, к сожалению, сомнения врачей, равно как и пациентов, в идентичности оригинальных препаратов и генериков в ряде случаев не лишены оснований [24].
Чтобы облегчить врачу выбор препарата, в США существует ежегодно издаваемая «Оранжевая книга», в которой генерическим препаратам, подтвердившим терапевтическую эквивалентность оригиналу, присваивается код А, а препаратам, которые по разным причинам в данный момент нельзя считать терапевтически эквивалентными соответствующим препаратам сравнения, — код В [25]. В Украине подобные нормативные документы пока отсутствуют, что делает адекватный выбор препаратов для взаимозамены проблематичным.
Сегодня в нашей стране накоплен достаточный опыт в области сравнения оригинальных и генерических препаратов. Выявлены как терапевтически эквивалентные оригинальным препаратам генерики, так и генерические препараты, уступающие оригинальным по переносимости или клинической эффективности. В ближайшие годы рынок генерических лекарственных средств будет развиваться, поскольку более дешевые генерики дают возможность доступа к новым высокоэффективным препаратам широких слоев населения с ограниченными экономическими возможностями. Задача врача — в каждом конкретном случае выбрать для пациента оптимальный (с клинических и экономических позиций) препарат среди многочисленных аналогов, содержащих одно и то же действующее вещество.