Что такое посткардиотомный синдром
Посткардиотомный синдром
Посткардиотомный синдром — это осложнение, наступающее после хирургического вмешательства на сердце со вскрытием околосердечной сумки и проявляющееся повышением температуры, сухим или выпотным перикардитом, плевритом, лейкоцитозом и ускорением РОЭ.
Патогенез посткардиотомного синдрома недостаточно ясен. Высказываются различные предположения. Посткардиотомный синдром после митральной комиссуротомии рассматривают как обострение ревматизма. Как на причину посткардиотомного синдрома указывают на асептическое воспаление, возникающее от раздражения перикарда и плевры кровью из операционной раны. Посткардиотомный синдром рассматривается также как проявление аутосенсибилизации, происходящей в результате повреждения тканей сердца при операции. Как сама операция, так и послеоперационный период могут благоприятствовать развитию повышенной чувствительности организма, так как в результате хирургического вмешательства накапливается денатурированный белок, что ведет к проявлениям аллергической реакции вследствие аутосенсибилизации организма.
Морфологической основой синдрома у большинства больных является фибринозный перикардит (см.).
Клиническая картина посткардиотомного синдрома характеризуется внезапным повышением температуры, чаще всего на второй или третьей неделе после операции. Температура может повышаться до 38—39°, но часто носит затяжной субфебрильный характер. Наиболее постоянны интенсивные боли в грудной клетке, чаще слева. Иногда отмечается лишь ощущение тяжести в области сердца. У ряда больных наблюдаются загрудинные боли с отдачей в левую половину грудной клетки, левую руку. В более редких случаях боли распространяются по всей поверхности грудной клетки. Загрудинные боли могут сопровождаться выраженной одышкой. Реже бывают кашель и кровохарканье. При обследовании устанавливают сухой, реже выпотной перикардит; может обнаруживаться плеврит, чаще левосторонний.
Пневмония относится к более редким проявлениям посткардиотомного синдрома. При выпотном перикардите или плеврите при пункции обычно получают серозно-геморрагическую жидкость, как правило, стерильную. На ЭКГ могут быть зарегистрированы изменения, типичные для поражения перикарда, а также различные нарушения ритма, воспринимаемые больными в виде сердцебиения и перебоев в области сердца.
Некоторые авторы относят к симптомам посткардиотомного синдрома явления правожелудочковой недостаточности в виде значительного увеличения печени, асцита, отеков нижних конечностей. Более вероятно, что подобного рода осложнения связаны с гемодинамическими нарушениями в послеоперационном периоде. Определяется выраженный нейтрофильный лейкоцитоз, ускоренная РОЭ, реже гипохромная анемия.
Несмотря на склонность к рецидивам, посткардиотомный синдром протекает обычно доброкачественно; продолжительность его колеблется от 1 недели до 1—2 месяцев.
Диагноз посткардиотомного синдрома может представлять известные трудности. Посткардиотомный синдром следует дифференцировать от тромбоэмболических послеоперационных осложнений, активации ревматизма.
Лечение посткардиотомного синдрома проводится антибиотиками, салицилатами, глюкокортикоидами и симптоматическими средствами.
Посткардиотомический синдром
Рубрика МКБ-10: I97.0
После хирургического и эндоваскулярного лечения ИБС в послеоперационном периоде у больных сохраняются явления дезадаптации сердечнососудистой, дыхательной и регуляторных систем организма. Они наиболее выражены в ранние сроки лечения и проявляются кардиалгиями, нарушением биоэлектрической активности сердца и аритмиями, снижением сократительной способности миокарда, коронарного, миокардиального и аэробного резервов организма, развитием воспалительных и рубцовых изменений в органах и тканях грудной клетки.
Физическая реабилитация проводится в два этапа: стационарный и постстационарный. Последний включает период выздоровления (реабилитационный центр и поликлиника) и период восстановления под наблюдением поликлинического врача или врача специализированного лечебно-профилактического учреждения.
Задачи физической реабилитации на стационарном этапе лечения.
• Улучшение психического статуса пациента.
• Улучшение эндотелиальной функции сосудов системного артериального кровотока и локального сосудистого русла в зоне стеноза.
• Активизация коллатерального кровообращения.
• Профилактика и лечение послеоперационных осложнений (ателектазов легких, гипостатических пневмоний, бронхоспастического компонента при наличии аутоиммунного посткардиотомного синдрома, нарушений моторной функции органов пищеварения).
• Профилактика развития спаечного процесса в грудной клетке.
• Устранение мышечного дисбаланса.
Большое значение в лечении кардиохирургических больных имеет предоперационная подготовка. В этот период пациентов обучают тем физическим упражнениям, которые необходимы для выполнения задач послеоперационного периода. В первую очередь, это дыхательные упражнения с удлиненным выдохом без напряжения мышц. Пациенты должны быть обучены сознательному управлению дыханием.
Сознательно управляемое локализованное дыхание способствует увеличению вентиляции в одном легком или его части. При выполнении этих упражнений во время выдоха слегка сдавливают грудную клетку пациента в области, где должна быть увеличена вентиляция, а во время вдоха давление на грудную клетку постепенно уменьшают. Пациент вынужден, преодолевая сопротивление, больше напрягать мышцы именно там, где оказывают давление. В результате в этой области увеличивается движение ребер и возрастает вентиляция.
Различают двухстороннее и одностороннее; правостороннее и левостороннее нижне- и верхнегрудное; двустороннее и правостороннее средне-грудное; заднегрудное дыхание.
• При обучении пациента нижнегрудному дыханию инструктор помещает руки на нижнебоковые отделы грудной клетки в исходном положении пациента лежа, сидя, стоя. Давление оказывается с обеих сторон (двустороннее) или с одной (одностороннее). Одностороннее нижнегрудное дыхание можно выполнять лежа на спине, сидя, стоя или лежа на валике, на противоположном боку. Давление оказывают на нижнебоковую поверхность грудной клетки во фронтальной плоскости с одной стороны.
• Верхнегрудное дыхание выполняют в исходном положении стоя, сидя, лежа на спине. Руки инструктора помещаются в подключичные области и оказывают давление в дорзальном направлении с обеих или с одной стороны.
• Заднегрудное дыхание выполняется в исходном положении сидя с максимально кифозированной спиной («поза кучера») или лежа на спине. Руки инструктора помещены на нижне-средние отделы грудной клетки сзади и оказывают давление вентрально. Программа физической реабилитации кардиохирургических больных после оперативного лечения включает в себя: лечебную гимнастику, дозированную ходьбу, тренировки на велоэргометре, тредмиле.
Лечебную гимнастику необходимо начинать в реанимационном отделении с сознательно управляемого дыхания и движений в дистальных и средних суставах конечностей. Через 48-72 ч при отсутствии противопоказаний пациента переводят в кардиохирургическое отделение, где интенсивность лечебной гимнастики постепенно увеличивают. После проведения велоэр-гометрической пробы (не ранее 2 нед после операции, например аортоко-ронарного шунтирования) или 6-минутного теста появляется возможность достаточно точного дозирования физических нагрузок.
Постстационарный этап лечения оперированных больных
Период выздоровления проводится в условиях реабилитационного центра и поликлиники. Цель: повышение толерантности к физическим нагрузкам, устранение миофасциальных изменений и повышение работоспособности до уровня, позволяющего пациенту вернуться к профессиональной деятельности или к такой работе, на которую он способен. Этот период включает в себя не только комплексную кардиологическую реабилитацию, но и обязательную вторичную профилактику.
После реваскуляризирующих операций необходимо продолжить на данном этапе лечения (в реабилитационном центре и поликлинике) физические тренировки. В этот период программа физической реабилитации включает: лечебную гимнастику в зале и бассейне, с использованием тренажеров и без них, дозированную ходьбу, дозированные подвижные игры.
Реваскуляризация миокарда после проведенного хирургического лечения может быть полной и неполной. В последнем случае, а также при развитии дисфункции шунтов, феномена «noreflow», спазма шунтов, послеоперационного инфаркта миокарда у больных может сохраняться коронарная недостаточность. Оценку коронарной недостаточности проводят по данным нагрузочных тестов.
Период восстановления. После обязательного курса реабилитации больным рекомендуются постоянные занятия физкультурой с соответствующим объемом физической активности в зависимости от функционального класса ИБС. Цели длительных тренировок: восстановление и тренировка сердечно-сосудистой системы за счет включения механизмов компенсации кардиальных и экстракардиальных факторов кровообращения, повышение толерантности к физическим нагрузкам, а также вторичная профилактика ИБС.
Что такое посткардиотомный синдром
ФЦССХ Минздравсоцразвития России, Пенза
ФЦССХ Минздравсоцразвития России, Пенза
Постперикардиотомный синдром: клинико-лабораторная диагностика, лечение (обзор литературы)
Журнал: Кардиология и сердечно-сосудистая хирургия. 2012;5(1): 42-46
Игольникова Л. Н., Никулина Е. Г. Постперикардиотомный синдром: клинико-лабораторная диагностика, лечение (обзор литературы). Кардиология и сердечно-сосудистая хирургия. 2012;5(1):42-46.
Igol’nikova L N, Nikulina E G. Postpericardiotomy Syndrome: clinical & laboratory diagnostics and treatment. Review. Kardiologiya i Serdechno-Sosudistaya Khirurgiya. 2012;5(1):42-46.
ФЦССХ Минздравсоцразвития России, Пенза
ФЦССХ Минздравсоцразвития России, Пенза
ФЦССХ Минздравсоцразвития России, Пенза
В последние годы резко возрос объем кардиохирургических операций. Так, в Российской Федерации лишь за 2009 г. число больных, перенесших хирургическую реваскуляризацию миокарда, по сравнению с 2008 г. увеличилось на 20,6%, а сочетанных операций — на 34,9% [1]. Наиболее частым послеоперационным осложнением является постперикардиотомный синдром (ПКТС), развивающийся в рамках неспецифической системной воспалительной реакции организма (SIRS) после кардиохирургического вмешательства. По данным различных клиник [26, 33], частота развития ПКТС после операции на открытом сердце колеблется от 16 до 68%, причем гемодинамически значимый выпот в полости перикарда формируется только в 0,8—6% случаев. Рецидивирующее течение ПКТС наблюдается в 2% случаев [34].
Впервые клинические проявления ПКТС описаны L. Soloff и соавт. [31] в 1953 г. у пациента, перенесшего открытую митральную комиссуротомию. В последующем отмечено развитие подобной симптоматики после коррекции врожденных пороков сердца, а также других типов хирургического вмешательства на открытом сердце. В настоящее время описаны случаи развития SIRS с формированием выпота в плевральной и/или перикардиальной полости после эндоваскулярных манипуляций: коронарной ангиопластики, радиочастотной катетерной абляции и имплантации электрокардиостимулирующих устройств [2].
Клиническая картина
Согласно рекомендациям Европейского общества кардиологов, ПКТС относится к аутоиммунному процессу 2-го типа [22]. Клинические проявления ПКТС неспецифичны и диагноз, как правило, устанавливается после исключения клинических состояний со сходной симптоматикой. При небольшом объеме выпота течение ПКТС может быть бессимптомным.
Диагностические клинические критерии для ПКТС: 1) повышение температуры тела в течение первых 7 дней после операции без признаков общего или локального воспалительного процесса; 2) плевральная боль в грудной клетке; 3) шум трения; 4) плевральный выпот; 5) появление признаков увеличения перикардиального выпота. Диагноз может быть выставлен при наличии не менее двух перечисленных признаков. При своевременной диагностике и лечении прогноз ПКТС благоприятный. Однако возможно рецидивирующее течение, а также развитие таких осложнений, как тампонада сердца и ранняя окклюзия шунтов с клиникой нестабильной стенокардии [18, 19].
Факторы риска
Частота развития ПКТС у больных ишемической болезнью сердца зависит от тяжести исходного клинического состояния пациента, выраженного в виде расчетного показателя риска интраоперационной летальности (EuroSCORE), а также от объема хирургического вмешательства, определяемого количеством сформированных анастомозов или проведением сочетанных операций [4]. Считается, что использование маммарного кондуита повышает риск развития ПКТС после коронарного шунтирования [34]. Не только хирургическое вмешательство у больных с острым коронарным синдромом, но и указание в анамнезе на перенесенный в течение последних 6 мес острый инфаркт миокарда, увеличивают риск развития ПКТС [15]. У пациентов, перенесших реконструктивные операции на клапанном аппарате сердца, ПКТС чаще выявлялся при инфекционном эндокардите и хронической ревматической болезни сердца. При этом степень активности воспалительного процесса принципиально не влияет на частоту развития ПКТС [6]. Проведение операции по экстренным показаниям также сопряжено с риском развития ПКТС. Продолжительность экстракорпорального кровообращения и длительное пережатие аорты в ходе операции, ассоциирующиеся с SIRS, также могут повышать риск появления ПКТС [15]. Высокая легочная гипертензия в послеоперационном периоде — один из факторов риска формирования выпота в перикардиальной и/или плевральной полостях. Гипергликемия в первые дни после операции, наличие сопутствующего аутоиммунного заболевания также ассоциируются с более частым развитием ПКТС. Использование пероральных антикоагулянтов в послеоперационном периоде в 86% случаев приводит к формированию различной степени выраженности перикардиального выпота в ранние сроки после операции и в 65% — в более поздние сроки [33, 34]. Гемотрансфузия может выступать в качестве самостоятельного фактора риска развития ПКТС [4].
Патогенез
Несмотря на почти полувековую историю изучения ПКТС, механизмы его развития до сих пор не до конца ясны и в настоящее время существует две теории патогенеза ПКТС.
В соответствии с первой теорией ПКТС развивается в рамках SIRS в ответ на любое кардиохирургическое вмешательство, но в большей степени выражен при операциях, проводимых в условиях искусственного кровообращения (ИК) [15].
Пусковыми факторами в реализации SIRS являются хирургическая травма, контакт крови с оксигенатором и аппаратом ИК, ишемическое и реперфузионное повреждение кардиомиоцитов, а также действие эндотоксинов, уровень которых повышается во время ИК за счет транслокации бактериальной микрофлоры кишечника [29, 35].
При этом SIRS чаще наблюдается у пациентов после хирургической коррекции клапанной патологии сердца воспалительной природы, а также при проведении механической реваскуляризации миокарда в экстренном порядке. У больных этой категории выявлено увеличение продолжительности дренирования послеоперационной раны, что, вероятно, обусловлено повышением объема раневого отделяемого на фоне нарушения гемостаза и активации местных воспалительных реакций [5].
Доказано, что у больных с SIRS чаще развиваются в послеоперационном периоде инфекционные осложнения. Под влиянием повреждающих факторов происходят активация иммунокомпетентных клеток, а также выброс медиаторов воспаления в системный кровоток, что приводит к активации как системных, так и местных воспалительных реакций. Лизированные сгустки крови в плевральной и перикардиальной полостях служат дополнительным фактором, поддерживающим местные воспалительные реакции. Наряду с этим поступление в системный кровоток провоспалительных цито- и хемокинов усиливает сосудистую проницаемость и способствует развитию экссудативного процесса [12].
Активное развитие в последние годы получила иммунная теория формирования ПКТС, в пользу которой свидетельствуют наличие латентного периода в клинических проявлениях заболевания, быстрый ответ на иммуносупрессивную терапию (глюкокортикостероиды (ГКС) и нестероидные противовоспалительные препараты (НПВП), а также тенденция к рецидиву [5, 10, 11, 31]. Аутоиммунные механизмы развития ПКТС осуществляются за счет формирования антимиокардиальных (антисарколемных и антифибриллярных) антител [10, 31]. В ответ на антигенную стимуляцию происходит активация иммунокомпетентных эндотелиальных клеток. Активное участие в развитии ПКТС могут принимать тучные клетки. Предсердный натрийуретический пептид (ANP), секретируемый в процессе дегрануляции тучных клеток, наряду с другими факторами может участвовать в формировании выпота в полости перикарда [10].
Противоречивыми остаются представления о роли вирусной инфекции в развитии ПКТС [11, 24, 36]. Существует гипотеза о реактивации вирусной инфекции (аденовирус, цитомегаловирус, вирус Коксаки В тип 1—6) после кардиохирургического вмешательства, согласно данным M. Eagle и соавт. [11]. Однако в исследованиях I. De Scheerder и S. Webber [10, 36] частота выявления антител к кардиотропным вирусам у пациентов с ПКТС и без клинических проявлений данного синдрома не различалась.
Диагностика
Отсутствие специфических клинических критериев диагностики ПКТС повышает ценность дополнительных методов обследования. Инструментальная диагностика включает рентгенологическое исследование органов грудной клетки; электрокардиографию; эхокардиографию с целью выявления выпота в полости перикарда или плевры. Стандартом в диагностике является эхокардиография.
Лабораторная диагностика ПКТС строится на трех основных лабораторных тестах: определения неспецифических маркеров воспаления; оценке титра антимиокардиальных антител и циркулирующих иммунных комплексов; анализа характера выпотной жидкости.
Воспаление, возникающее после какой-либо формы тканевого повреждения, сопровождается продукцией биологически активных веществ, определение которых может свидетельствовать о наличии воспаления и отражать степень его тяжести. В ряде случаев определение некоторых белков острой фазы или провоспалительных цитокинов может свидетельствовать о природе воспалительного процесса или его осложнениях, хотя чаще всего они не являются специфичными [12]. Для ПКТС характерны повышение содержания интерлейкина-6, С-реактивного белка и фибриногена в сыворотке крови, а также гиперэозинофилия [8, 37].
Традиционно прокальцитонин считается маркером бактериальной инфекции. Наряду с этим данный показатель отражает тяжесть SIRS после операции на открытом сердце. Существует мнение, что концентрация прокальцитонина в сыворотке крови хирургических пациентов повышается вследствие роста уровня провоспалительных цитокинов, в первую очередь, фактора некроза опухолей и интерлейкина-6 [2, 25, 32]. В динамике прокальцитонин коррелирует с клиническими критериями SIRS, а также с уровнем неспецифических маркеров воспаления в сыворотке крови [3, 21, 27]. Концентрация прокальцитонина повышается достаточно быстро: через 2—3 ч после массивной антигенной стимуляции или генерализации инфекционного процесса. Период его полувыведения составляет около 24 ч. Лишь высокочувствительный метод определения концентрации прокальцитонина (KRYPTOR) позволяет оценивать уровень прокальцитонина в диапазоне 0,02—5000 нг/мл и используется для диагностики очаговой инфекции, аутоиммунных заболеваний, а также для динамической оценки SIRS. Повышение уровня прокальцитонина более 2 нг/мл свидетельствует о бактериальной инфекции с системными проявлениями, в то время как более низкая концентрация данного маркера в послеоперационном периоде может отражать неспецифический воспалительный процесс [3]. Таким образом, отсутствие нормализации уровня прокальцитонина на 5-е сутки после операции может быть признаком развития ПКТС и предиктором инфекционно-воспалительных осложнений.
Продемонстрировано диагностическое значение повышения титра антимиокардиальных антител (антител к актину и миозину) у пациентов с ПКТС, перенесших коронарное шунтирование [10, 24]. По мнению авторов [27], выраженность клинических проявлений ПКТС тесно коррелировала с соотношением антимиокардиальных антител в выпотной жидкости и сыворотке крови, которое оценивалось в до- и послеоперационном периодах.
Ранее используемая оценка уровня холестерина, билирубина, глюкозы в выпотной жидкости имеет низкую диагностическую значимость [9, 14, 20, 38]. Стандартным подходом к оценке экссудативного характера выпота являются критерии R. Light: содержание белка в жидкости >0 г/л; соотношение общего белка в выпотной жидкости и в сыворотке крови >0,5; лактатдегидрогеназа в выпотной жидкости >300 ед/л; соотношение лактатдегидрогеназы в выпотной жидкости и в сыворотке крови >0,6. Эти критерии имеют высокую чувствительность (98%), диагностическую эффективность (94%), но низкую специфичность (72%) [20, 21]. B. Roth и соавт. предложили использовать относительные биохимические показатели в верификации экссудативного выпота: соотношение альбуминов плевральной жидкости и сыворотки крови >0,5; градиент альбуминов сыворотки крови и плевральной жидкости
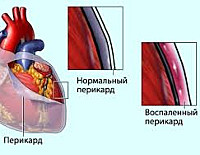
Постперикардиотомный синдром
Постперикардиотомный синдром – воспалительное заболевание перикарда аутоиммунного генеза, развивающееся как осложнение хирургических вмешательств на открытом сердце. Его основные симптомы – лихорадочная реакция и боли в грудной клетке, возникающие через неделю или позже после операции. При диагностике учитываются лабораторные признаки воспалительного процесса, данные рентгенографии грудной клетки, ЭКГ, УЗИ и МРТ сердца. Для лечения патологии используются нестероидные противовоспалительные средства (НПВС) или кортикостероиды. Развитие осложнений заболевания нередко требует дополнительного кардиохирургического вмешательства.
Общие сведения
Причины ППТС
Причина формирования постперикардиотомного синдрома – аутоиммунная реакция, возникающая после кардиохирургических операций. Она является следствием врожденных или приобретенных изменений клеточного иммунитета. После повреждения перикардиальных листков организм начинает вырабатывать антитела, взаимодействующие с тканями сердца. Это ведет к развитию аллергической реакции по типу гиперчувствительности замедленного типа и аутоиммунному воспалению.
Развитие синдрома описано после коррекции врожденных и приобретенных пороков сердца, имплантации электрокардиостимулятора, стентирования коронарных артерий, аортокоронарного шунтирования, перикардиальной пункции, радиочастотной аблации, тупой травмы грудной клетки, операций по поводу заболеваний аорты. Фактором риска ПТТС является инфицирование вирусом Коксаки В, цитомегаловирусом, аденовирусом.
Патогенез
Повреждение тканей перикарда вызывает образование антител к мембране клеток (антисарколемных), мышечным волокнам (антифибриллярных) и к клеточным ядрам. Реакция между собственными тканями и аутоантителами сопровождается привлечением к очагу патологии иммунных клеток-макрофагов, эозинофилов, нейтрофильных лейкоцитов. Начинается воспалительная реакция, сопровождающаяся выбросом медиаторов воспаления, лизосомальных ферментов, активных форм кислорода, разрушающих клетки сердечной сумки.
Еще один фактор развития ППТС – системная реакция организма на операционную травму. Она сопровождается эндотоксемией, повреждением клеток миокарда, повышением концентрации гистамина, серотонина, кининов, эйкозаноидов, цитокинов, компонентов комплемента. Это приводит к кислородному голоданию тканей, повышению сосудистой проницаемости, развитию интоксикации, что усиливает местный воспалительный процесс.
Вследствие повышения сосудистой проницаемости в очаге воспаления между двумя перикардиальными листками появляется жидкость, богатая фибрином. Этот белок образует отложения на стенках околосердечной сумки. Кроме того, подобная реакция начинается в плевральной полости. Трение листков перикарда и плевры вызывает появление важного признака, сопровождающего постперикардиотомный синдром, – боли в груди.
Симптомы постперикардиотомного синдрома
Заболевание развивается через 1–6 недель после перенесенной операции. У пациента повышается температура тела до 38-40°C. Продолжительность лихорадочного периода составляет до 3-х недель. Больных беспокоит тупая боль в левой половине грудной клетки. Она не связана с физической активностью, но может усиливаться во время глубокого дыхания, а также в положении лежа. Ухудшается аппетит, появляется слабость, раздражительность. Иногда пациентов беспокоит одышка в состоянии покоя, при незначительной нагрузке, а также ноющие суставные боли.
Когда объем выпота увеличивается, болевой синдром становится менее интенсивным. Образовавшийся экссудат сдавливает сердце, поэтому появляется учащенное сердцебиение, усиливается одышка, набухают шейные вены. Могут присоединяться отеки, постоянная тяжесть в подреберье справа, вызванная увеличением печени. Кроме того, ППТС вызывает затруднения глотания, постоянный сухой кашель, осиплость голоса, тошноту, приступы икоты. У детей признаком тяжелого течения синдрома служит рвота.
Осложнения
Постперикардиотомный синдром сопровождается накоплением выпота внутри перикардиальной полости. Если медицинская помощь оказана несвоевременно, это может привести к развитию опасного для жизни осложнения – тампонады сердца. Сдавление органа вызывает ухудшение сократительной способности миокарда и становится причиной острой сердечной недостаточности. Частота возникновения такого осложнения составляет 10%. Если объем перикардиального выпота мал, сгущение экссудата и образование наслоений фибрина могут спровоцировать появление констриктивного («сдавливающего») перикардита. Данное осложнение развивается у 5% больных ППТС и также сопровождается тяжелой сердечной недостаточностью.
Диагностика
При физикальном обследовании пациента определяется шум трения перикарда и плевры, отеки, увеличение печени. Может обнаруживаться парадоксальный пульс, который сопровождается снижением систолического АД на 10 мм рт. ст. и более, одновременным уменьшением пульсового наполнения на лучевой артерии во время вдоха. Лабораторная диагностика ППТС включает следующие исследования:
Для диагностики ПТТС наиболее информативны визуализирующие методики. Они дают возможность оценить количество выпота, его локализацию, угрозу тампонады, состояние легочной ткани. Основные способы инструментальной диагностики заболевания включают:
Диагностические критерии патологии предложены Американской Кардиологической Ассоциацией. Постперикардиотомный синдром предполагается, если у больного имеются по крайней мере два из перечисленных признаков: лихорадка; боль, вызванная перикардитом или плевритом; шумы трения перикарда или плевры; увеличение количества жидкости в сердечной сумке; экссудативный перикардит, сопровождающийся повышением количества С-реактивного протеина в крови. Дифференциальная диагностика осуществляется с констриктивным перикардитом, застойной сердечной недостаточностью, инфекционным эндокардитом и перикардитом, миокардитом вирусной или иной этиологии.
Лечение посткардиотомного синдрома
Пациенты с ПТТС обычно наблюдаются у кардиолога амбулаторно. Показанием к госпитализации в отделение кардиологии или торакальной хирургии является нарастание объема плеврального выпота, угроза тампонады сердца. Во время лихорадочного периода и сохраняющихся электрокардиографических изменений необходим постельный режим. Специальных диетических ограничений нет, рекомендуется полноценное богатое витаминами питание. Лечение назначается с учетом выраженности и скорости развития клинических проявлений, тяжести заболевания, общего состояния пациента. Преимущественно используется медикаментозная терапия, в некоторых случаях показано хирургическое вмешательство:
Прогноз и профилактика
Несмотря на высокую частоту развития синдрома, в большинстве случаев прогноз благоприятный. Под влиянием лечения проявления воспалительной реакции постепенно исчезают. Развитие тяжелых осложнений наблюдается у 15% пациентов. Постперикардиотомный синдром рецидивирует у 2% прооперированных, иногда через несколько лет после вмешательства. Для профилактики ПТТС необходимо соблюдение техники кардиохирургических операций: использование прерывистого шва для закрытия перикарда, послеоперационное дренирование его полости, предотвращение попадания крови в сердечную сумку. Есть данные об эффективности у взрослых пациентов послеоперационного назначения колхицина, однако они требуют дальнейшего подтверждения.