Что такое реакция ионного обмена в химии
Реакции ионного обмена
Содержание:
Что есть реакция ионного обмена? Определение
Химическое взаимодействие ионов в электролитах называется реакцией ионного обмена (РИО).
Сущность РИО заключается в связывании ионов.
Напоминание. Электролиты – это водные растворы кислот, солей или оснований, в которых эти вещества распадаются (диссоциируют) на свободные заряженные ионы.
Необходимое условие РИО. Правило Бертолле
Главное условие необратимого протекания ионнообменной реакции между электролитами – образование осадка, газообразного вещества или малодиссоциирующего соединения (слабого электролита, в т.ч. воды).
Данное утверждение носит название правила Бертолле. Этот французский химик сформулировал его в 1803 г.
Следует помнить, что это правило справедливо при взаимодействии ненасыщенных растворов.
Особенности РИО. Суть необратимого процесса
Более реально состояние реагентов в растворе демонстрирует запись в виде заряженных ионов:
Эти уравнения получили названия:
(2) – полное ионное уравнение,
(1) – молекулярное уравнение реакции.
Вывод: уравнение в ионной форме отражает сущность процесса, показывает за счёт чего возможно его протекание.
Знать: в обратимых РИО не бывает сокращенной ионной формы уравнения.
Правила (алгоритм) составления уравнений ионно-обменных реакций
В обычных химических уравнениях разложение молекул на ионы не учитывается. Чтобы отразить сущность взаимодействия электролитических растворов, пользуются ионными уравнениями, которые составляются по определённым правилам.
Примеры РИО с выделением газа и выпадением осадка
Применение РИО
Во многих отраслях индустрии, сельском хозяйстве, в решении проблем экологии используются реакции ионного обмена. Несколько примеров применения РИО.
В заключении интересный факт: домашние хозяйки, сами того не зная, используют правило Бертолле, когда применяют реакцию ионного обмена между столовым уксусом и пищевой содой. Выделяющийся при этом газ способствует «поднятию» теста.
Примечание важное для сдачи ЕГЭ по химии
Чтобы реакции ионного обмена протекали, необходимо, чтобы выполнялись не только условия: образование осадка, газа или воды, но и вещества –реагенты должны быть растворимыми.
Вывод:
Реакции ионного обмена
Реакции ионного обмена – это реакции между сложными веществами в растворах, в результате которых реагирующие вещества обмениваются своими составными частями. Так как в этих реакциях происходит обмен ионами – они называются ионными.
| Правило Бертолле: Реакции обмена в растворах электролитов протекают до конца (возможны) только тогда, когда в результате реакции образуется либо твердое малорастворимое вещество (осадок), либо газ, либо вода или любой другой слабый электролит. |
| Например, нитрат серебра взаимодействует с бромидом калия |
AgNО3 + КВr = АgВr↓ + КNО3
Правила составления уравнений реакций ионного обмена
1. Записываем молекулярное уравнение реакции, не забывая расставить коэффициенты:
3KOH +FeCl3 = Fe(OH)3 + 3KCl
2. С помощью таблицы растворимости определяем растворимость каждого вещества. Подчеркнем вещества, которые мы не будем представлять в виде ионов.
р р н р
3KOH + FeCl3 = Fe(OH)3 + 3KCl
3. Составляем полное ионное уравнение. Сильные электролиты записываем в виде ионов, а слабые электролиты, малорастворимые вещества и газообразные вещества записываем в виде молекул.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
4. Находим одинаковые ионы (они не приняли участия в реакции в левой и правой частях уравнения реакции) и сокращаем их слева и справа.
3K + + 3OH — + Fe 3+ + 3Cl — = Fe(OH)3 + 3K + + 3Cl —
5. Составляем итоговое сокращенное ионное уравнение (выписываем формулы ионов или веществ, которые приняли участие в реакции).
Fe 3+ + 3OH — = Fe(OH)3
На ионы мы не разбиваем:
| Например, взаимодействие сульфида цинка и серной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ. Сульфид цинка нерастворим.
ZnS + H2SO4 = ZnSO4 + H2S
Реакция протекает до конца, т.к. выделяется газ сероводород, который является слабым электролитом. Полное ионно-молекулярное уравнение:
ZnS + 2H + + SO4 2 — = Zn 2+ + SO4 2 — + H2S
Сокращаем ионы, которые не изменились в процессе реакции – в данном случае это только сульфат-ионы, получаем сокращенное ионное уравнение:
ZnS + 2H + = Zn 2+ + H2S
| Например, взаимодействие гидрокарбоната натрия и гидроксида натрия |
Составляем уравнение реакции и проверяем растворимость всех веществ:
NaHCO3 + NaOH = Na2CO3 + H2O
Кислые анионы слабых кислот являются слабыми электролитами и на ионы не разбиваются:
Na + + НСО3 — + Na + + ОН — = 2Na + + CO3 2- + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
НСО3 — + ОН — = CO3 2- + H2O
| Например, взаимодействие тетрагидроксоалюмината натрия и соляной кислоты |
Составляем уравнение реакции и проверяем растворимость всех веществ:
Na[Al(OH)4] + 4HCl = NaCl + AlCl3 + H2O
Комплексные ионы являются слабыми электролитами и на ионы не разбиваются:
Na + + [Al(OH)4] — + 4H + + 4Cl — = Na + + Cl — + Al 3+ + 3Cl — + H2O
Сокращаем одинаковые ионы, получаем сокращенное ионное уравнение:
[Al(OH)4] — + 4H + = Al 3+ + 4H2O
Что такое реакция ионного обмена в химии
Ключевые слова конспекта: свойства ионов, определение ионов, реакции ионного обмена, ионное уравнение, реакции в растворах электролитов.
Свойства ионов
Число электронов в атоме равно числу протонов. Протоны и нейтроны прочно связаны друг с другом и образуют ядро атома. Ион – атом или часть молекулы, где есть неравное количество электронов и протонов. Если электронов больше, чем протонов, то ион называют отрицательным. Иначе ион называют положительным.
Ионы отличаются от атомов строением и свойствами. Некоторые ионы бесцветны, а другие имеют определенный цвет. Для каждого из ионов характерны специфические химические свойства.
Таблица 1. Определение ионов
Определяемый ион
Результат реакции
* При определении галогенид-ионов с помощью серной кислоты используют твердую соль.
Ионное уравнение
В водных растворах все электролиты в той или иной степени распадаются на ионы и реакции происходят между ионами.
Сущность реакций в растворах электролитов отражается ионным уравнением. В ионном уравнении учитывается то, что сильный электролит в растворе находится в диссоциированном виде. Формулы слабых электролитов и нерастворимых в воде веществ в ионных уравнениях принято записывать в недиссоциированной на ионы форме. Растворимость электролита в воде нельзя считать критерием его силы. Многие нерастворимые в воде соли являются сильными электролитами, однако концентрация ионов в растворе оказывается низкой вследствие низкой растворимости. Именно поэтому в уравнениях их формулы записывают в недиссоциированной форме.
Реакции в растворах электролитов происходят в направлении связывания ионов. Существует несколько форм связывания ионов: образование осадков, выделение газообразных веществ, образование слабых электролитов. Рассмотрим конкретные примеры:
Уравнение в молекулярном виде: Ca(NO3)2 + Na2CO3 = СаСO3↓ + 2NaNO3
Полное ионное уравнение:
Сокращенное ионное уравнение:
а) КОН + НCl = КCl + H2O
К + + OH – + Н + + Cl – = К + + Cl – + H2O
OH – + Н + = H2O
б) HNO2 – азотистая кислота (слабая):
NaNO2 + НCl = NaCl + HNO2
Na + + NO2 + Н + + Cl – = Na + + Cl – + HNO2
NO2 – + Н + = HNO2
Иногда реакции в растворах электролитов осуществляются с участием нерастворимых веществ или слабых электролитов в направлении более полного связывания ионов. Например, мрамор растворяется в соляной кислоте с образованием углекислого газа:
Таблица 2. Уравнения ионных реакций
Реакции ионного обмена
Для ионных реакций выражение «в молекулярном виде», как и сама запись, является условным. При анализе приведенных в Таблице 2 уравнений реакций выясняется, что реакции ионного обмена протекают до конца в следующих случаях:
Если в растворе нет таких ионов, которые могут связываться между собой, реакция обмена не протекает до конца, т. е. является обратимой. При составлении уравнений таких реакций, как и при составлении уравнений диссоциации слабых электролитов, ставится знак обратимости.
Чтобы сделать вывод о протекании реакции ионного обмена до конца, надо использовать данные таблицы растворимости солей, оснований и кислот в воде.
Чтобы составить уравнения всех возможных реакций, в которых участвуют хлорид магния и другие растворимые в воде вещества, рассуждают так:
При составлении уравнений реакций ионного обмена, в которых образуются газообразные вещества, следует учесть, что анионы 
В свете представлений об электролитической диссоциации кислот, оснований и солей общие свойства этих веществ определяются наличием общих ионов, которые входят в их состав
Конспект урока «Реакции ионного обмена. Ионное уравнение». Выберите дальнейшее действие:
Понятие о реакции
Курс органической химии рассматривает взаимодействия между соединениями, которые необходимы для жизнедеятельности человека и животных: белками, жирами, углеводами. Химическими принято называть такие процессы, которые протекают между веществами с получением иных соединений, отличающихся от исходных по свойствам и составу.

Реагентами именуют исходные соединения, а продуктами – конечные соединения.
Движущей силой процесса является природа реагентов, особенности продуктов, концентрация реагирующих компонентов, температура, давление.

Особенности взаимодействий
В переводе с латинского языка «реакция» означает «ответное действие, отпор».
Условия протекания
Среди тех факторов, которые необходимы для химического взаимодействия, выделяют:
Варианты классификации реакций
Сложно все процессы, сопровождающиеся изменением состава и свойств соединений, объединить в одну классификацию.
По возможности протекания процессов в прямом и обратном направлении неорганические и органические процессы делят на две группы.
Необратимо протекает реакция ионного обмена между растворами растворимых соединений в том случае, когда между ними образуется нерастворимый продукт. Это применяется в аналитической химии для качественного определения катионов (анионов) в смеси растворов.
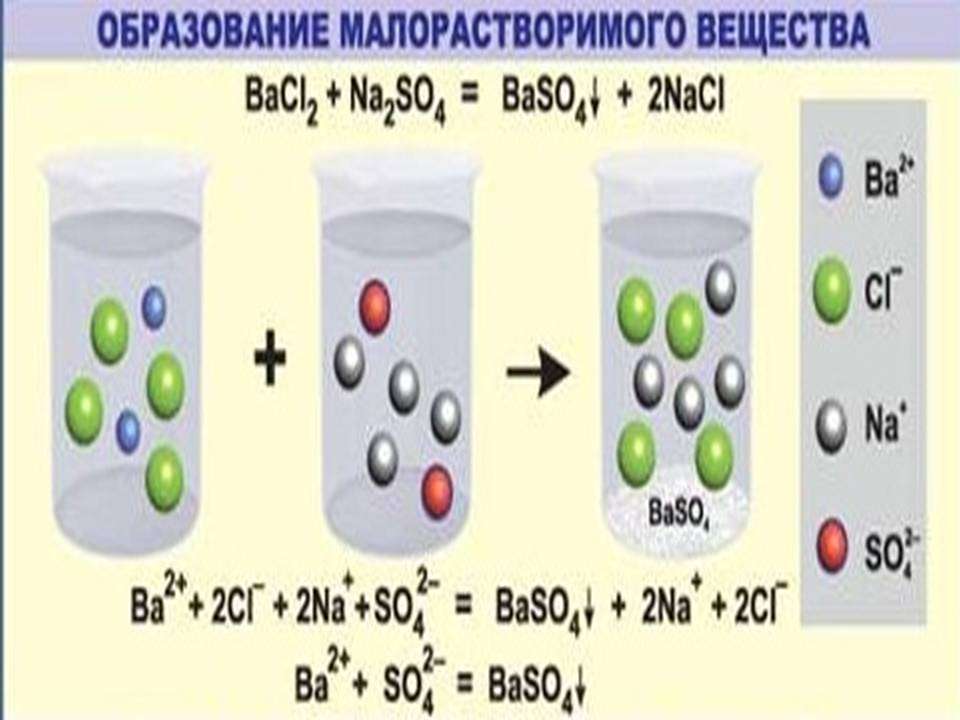
К примеру, для обнаружения катионов бария (Ba2+) используют раствор, содержащий сульфат анион (SO4 2-).
Пример ионных уравнений, сопровождающихся выпадением осадка
Как правильно составить уравнение процессов, характерных для этого случая? Рассмотрим на примере этой реакции ионного обмена сокращенные ионные уравнения. Данный вопрос входит в курс школьной программы, поэтому заслуживает пристального рассмотрения.
Первым этапом является написание процесса в молекулярном виде.
Чтобы понять, действительно ли необратимо протекает реакция ионного обмена между растворами этих веществ, потребуется таблица растворимости кислот, солей, оснований. Одним из продуктов является сульфат бария (средняя соль), которая является нерастворимым соединением. Следовательно, процесс действительно необратим, сопровождается выпадением осадка.
Вторым этапом является запись полного ионного уравнения. Каждое из исходных соединений, продуктов взаимодействия записывается в виде катионов и анионов.
Ba2++ 2Cl-+2Na+ +SO42-=BaSO4+2Na+ + 2Cl-
В левой и правой частях данного уравнения положительные и отрицательные ионы, которые не связаны в осадок, малодиссоциируемое или газообразное соединение. После их сокращения получаем вариант краткого ионного уравнения.
Пример процесса с образованием газа
Когда еще могут протекать реакции ионного обмена? Примеры с решением, предполагающим образование газообразного вещества, приведем для карбоната. Качественным реактивом на анион CO32- является взаимодействие с катионов водорода. Итогом процесса является образование углекислого газа.
Представим взаимодействие в молекулярном и ионном виде.
Продуктами реакции является углекислый газ и вода, которые не распадаются на ионы. Представим взаимодействие в полном ионном виде.
После сокращения ионов, повторяющихся в левой и правой частях, получаем следующий вид данного процесса:
Получение малодиссоциируемого соединения
Какими еще признаками могут сопровождаться реакции ионного обмена? Примеры с решением приведем для классического процесса нейтрализации между раствором щелочи и кислоты.
Взаимодействие раствора соляной кислоты с гидроксидом натрия сопровождается образованием воды (малодиссоциируемого соединения). Проверить полноту протекания процесса можно с помощью индикатора. Если первоначально к щелочи добавить спиртовой раствор фенолфталеина, по мере добавления к нему соляной кислоты окраска будет исчезать (идет нейтрализация).
В молекулярном виде процесс выглядит следующим образом:
Краткое ионное уравнение отражает процесс нейтрализации:
Заключение
В отличие от других разновидностей химических процессов, ионный обмен происходит только между растворами сложных соединений. Также среди обязательных условий, которые связаны с подобными процессами, отметим их необратимость. В тех случаях, когда среди продуктов есть малодиссоциируемое соединение, газообразное вещество, осадок, то можно говорить о полноте протекания процесса.
Если в случае замещения у соединений меняются степени окисления, то в случае ионного обмена валентное состояние атомов не меняется. Такие процессы протекают между сложными веществами: солями, кислотами, основаниями, оксидами.
Частным случаем таких взаимодействий является нейтрализация между щелочью и кислотой. Они подчиняются законам химического равновесия, идут в том направлении, где одно из соединений удаляют из реакционной сферы в летучем, газообразном виде, или как малодиссоциируемое вещество.
Химическая реакция является сложным процессом, который предполагает превращение одних веществ в другие, которые отличаются от исходных по строению, составу. Только при наличии одного из трех признаков, перечисленных выше, можно вести речь о полноте протекания взаимодействия.
Что такое реакция ионного обмена в химии
8. Реакции ионного обмена и условия их осуществления.
Реакция ионного обмена — один из видов химических реакций, характеризующаяся выделением в продукты реакции воды, газа или осадка. Химические реакции в растворах электролитов (кислот, оснований и солей) протекают при участии ионов. Если такие реакции не сопровождаются изменением степеней окисления, они называются реакциями двойного обмена.
Реакцию обмена в растворе принято изображать тремя уравнениями: молекулярным, полным ионным и сокращённым ионным. В ионном уравнении слабые электролиты, газы и малорастворимые вещества изображают молекулярными формулами.
1. При написании ионных уравнений следует обязательно руководствоваться таблицей растворимости кислот, оснований и солей в воде, то есть обязательно проверять растворимость реагентов и продуктов, отмечая это в уравнениях.
2. Следует иметь в виду, что реакции двойного обмена между солями с образованием осадков протекают во всех тех случаях, когда растворимость реагентов выше, чем растворимость одного из продуктов.
3. Для получения малорастворимого вещества всегда надо выбирать хорошо растворимые реагенты и использовать достаточно концентрированные растворы.
Для составления уравнений реакций ионного обмена необходимо помнить следующее:
1. Диссоциации не подвергаются: оксиды, газообразные вещества, вода, нерастворимые в воде соединения
2. Реакция ионного обмена идёт до конца если образуется: газ, осадок, вода











.jpg)
